Avaliação de marcadores de lesão renal em pacientes diabéticos submetidos à hemodiálise em um hospital do norte do estado do Rio Grande do Sul
Avaliação de marcadores de lesão renal em pacientes diabéticos submetidos à hemodiálise em um hospital do norte do estado do Rio Grande do Sul
Paula Borges1
Alexandre Ehrhardt2
11Biomédica. Universidade Luterana do Brasil (ULBRA) – campus Carazinho-RS, Brasil.
2Farmacêutico Bioquímico. Biomédico docente do curso de Biomedicina – Universidade Luterana do Brasil (ULBRA) – campus Carazinho–RS, Brasil.
Instituição: Universidade Luterana do Brasil (ULBRA) – campus Carazinho-RS, Brasil.
Recebido em 18/04/2018
Artigo aprovado em 06/11/2018
DOI: 10.21877/2448-3877.201800696
INTRODUÇÃO
Os rins são órgãos essenciais para a manutenção da homeostase do organismo humano; logo, a diminuição progressiva da função renal irá comprometer o funcionamento de outros órgãos importantes do ser humano. A função renal é avaliada pela filtração glomerular (FG) e sua redução é observada na Doença Renal Crônica (DRC).(1)
A DRC é uma síndrome metabólica de uma posterior injúria renal inicial, por perda lenta, progressiva e irreversível da função glomerular, tubular e endócrina dos rins.(2)
A lesão dos néfrons e a diminuição da filtração glomerular são alterações importantes que acarretam um aumento nas concentrações plasmáticas dos resíduos metabólicos e da manutenção do equilíbrio de líquidos e eletrólitos, os quais precisam ser removidos pela hemodiálise ou diálise peritoneal, que são necessárias até que haja possibilidade de um transplante renal.(3)
Dentre as possíveis alternativas para a substituição da função renal, a hemodiálise (HD), que se caracteriza pela “filtragem” do sangue, é uma das mais importantes. Com o uso de substâncias através de membranas remove os produtos tóxicos do metabolismo. É realizada em períodos de quatro a seis horas por dia, até três vezes por semana. Porém, a HD ainda possui suas limitações uma vez que o “rim artificial” não pode substituir outras funções do rim, como a secreção da eritropoetina, necessária para a produção das hemácias.(3)
Com a redução da função renal, ocorrem alterações progressivas no metabolismo mineral e ósseo da DRC, acometendo alguns níveis séricos de sódio (Na), potássio (K), cálcio (Ca), fósforo (Fos) entre outros e do hormônio da paratireoide (PTH).
Vários são os fatores diagnosticados na fisiopatologia da DRC, mas principalmente a diminuição da excreção renal do Fos cuja consequência são a hiperfosfatemia, a diminuição da produção do calcitriol pelo rim e a hipocalcemia, resultante destes dois processos.(4)
Conforme Cersosimo, o controle dos níveis de glicose (G) plasmática em pacientes diabéticos, que desenvolvem a DRC, é extremamente difícil, pois podem haver períodos de hipoglicemia e hiperglicemia em função dos níveis plasmáticos dos hormônios que contrabalançam a ação da insulina (glucagon, cortisol, hormônio de crescimento e as catecolaminas) estarem elevados, por causa de excreção renal reduzida. Devido à glicose elevada, a secreção pancreática de insulina pode estar também inadequada, ocasionando uma alteração atribuída à depleção de K intracelular nas ilhotas de Langerhans.(5)
O Diabetes mellitus (DM) é uma das doenças mais importantes causadoras da falência renal, podendo danificar os vasos sanguíneos renais, e, com a deficiência da insulina, poderá afetar a absorção de alguns eletrólitos, como, por exemplo, o potássio. O não monitoramento adequado dessa patologia pode acelerar o dano renal, ocasionando a DRC.(3)
O DM é umas das causas da nefropatia diabética que resulta na perda progressiva e irreversível de um grande número de néfrons funcionais, fazendo com que o organismo não consiga manter o equilíbrio metabólico, sendo responsável por aproximadamente 1/3 dos pacientes que iniciam o programa de hemodiálise.(6)
Pacientes com insuficiência renal retêm progressivamente os produtos do metabolismo nitrogenado, como a ureia, perdem a capacidade de diluir e concentrar a urina e tornam-se incapazes de regular o equilíbrio ácido-base ou de manter o balanço de níveis plasmáticos de eletrólitos tais como Na, K, Ca e Fos.(7)
Na hemodiálise ocorrem várias alterações fisiológicas, dentre elas a elevação nos níveis de paratormônio (PTH), uma complicação que acomete 50% dos pacientes. O aumento dos níveis séricos de PTH leva à mobilização óssea de Ca.(8,9)
Com base no contexto apresentado, o objetivo do trabalho foi avaliar os níveis séricos de Na, K, Ca, Fos e PTH, em pacientes diabéticos submetidos à hemodiálise.
MATERIAL E MÉTODOS
Esta pesquisa foi realizada por meio de um estudo transversal descritivo com abordagem retrospectiva quantitativa, de caráter documental, realizado no serviço de Hemodiálise do Hospital São Vicente de Paulo, de Passo Fundo, por meio de avaliação de prontuários de pacientes hemodializados.
Os dados coletados dos prontuários foram idade, sexo, tempo de hemodiálise e resultado dos exames de Na, K, Ca, Fos, PTH e G. As informações foram obtidas respeitando-se todas as normas éticas necessárias.
Foram considerados como critérios de inclusão todos os prontuários de pacientes hemodializados que apresentaram alterações nos níveis glicêmicos no período de janeiro a março de 2017. O intervalo citado foi estipulado em virtude de ser o período de realização dos exames propostos. Foram adotados como critérios de exclusão os prontuários de pacientes que não continham os resultados dos exames propostos para avaliação.
Utilizou-se como instrumento de pesquisa um formulário estruturado contendo as seguintes variáveis: sexo, idade e tempo de realização de hemodiálise. Foi realizada uma análise absoluta avaliando-se os seguintes exames: Na (VR= 135 – 145 mEq/L), K (VR= 3,5 – 5,5 mEq/L), Ca (VR 4,2 a 5,5 mEq/L), Fos (VR= 2,5 – 4,5 mg/dL), PTH (VR= 4,0 – 58 pg/mL) e G (>126 mg/dL) com valores de referência usados no kit do laboratório.
Os métodos usados para as dosagens foram os seguintes: Fos, Ca e G por determinação espectrofotométrica; Na e K dosados por potenciometria; PTH dosado por quimioluminescência em micropartículas (CMIA), estes realizados em dois aparelhos: Architect C8000 e Architect I2001.
Este trabalho foi aprovado pelo Comitê de Ética de Pesquisa em Seres Humanos da Universidade Luterana do Brasil – ULBRA, atendendo a ética estabelecida nas diretrizes e Norma Operacional n. 001/2013 da Resolução n. 466/201 do Conselho Nacional de Saúde, de acordo com as normas que orienta a pesquisa com seres humanos, com protocolo sob o número 67030817.0.0000.5349 e autorizado pela Comissão de Pesquisa e Pós Graduação do Hospital São Vicente de Paulo – Passo Fundo.
RESULTADOS
Dos 81 prontuários de pacientes conferidos no período apresentado pelo estudo, 48 (59,25%) foram selecionados por apresentaram níveis de glicose alterados, sendo todos previamente identificados como portadores de DM tipo 2. Em relação ao gênero, houve um predomínio do sexo masculino, totalizando 32 (66,6%) pacientes, conforme mostra a Tabela 1.
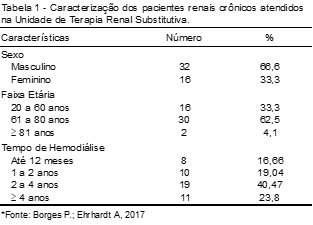
A média de idade obtida foi de 61,3 (± 4,7) anos, variando da faixa etária de 20 a 84, havendo, no estudo, o predomínio da faixa etária de 61 a 80 anos (62,5%). Em relação ao tempo de hemodiálise, o período de dois a quatro anos foi o que apresentou maior percentual (40,47%). Os demais dados referentes à faixa etária e período de hemodiálise estão apresentados na Tabela 1.
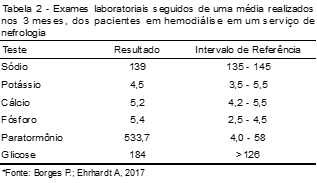
Quanto aos exames laboratoriais, foi feita média dos três meses analisados (janeiro a março de 2017), na qual o Na apresentou um valor médio de 139 mEq/L, o K 4,5 mEq/L, Ca 5,2 mEq/L, Fos 5,4 mg/dL, PTH 533,76 pg/mL e a G 184 mg/dL.
Na, K e Ca encontraram-se normais, enquanto que Fos, PTH e G apresentaram-se fora do valor de referência, conforme visualizados na Tabela 2.
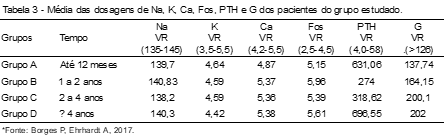
Com o intuito de traçar o nível dos eletrólitos, PTH e G avaliando as alterações laboratoriais apresentadas nos pacientes em estudo, estes foram separados em quatro grupos de acordo com o tempo de programa ao qual pertencem, sendo eles: Grupo A: até 12 meses; Grupo B: 1 a 2 anos; Grupo C: 2 a 4 anos; Grupo D ³ 4 anos. (Tabela 3)
DISCUSSÃO
Destacam-se os achados com predomínio de pacientes do sexo masculino na faixa etária de 60 anos. Esses achados assemelham-se com um estudo realizado em clínicas de hemodiálise em diferentes regiões do Brasil onde se verificou prevalência do sexo masculino (55,4%) e 63,1% tinham 60 anos de idade.(10) Em um estudo realizado no Chile por Guerra et al., foram encontrados também dados semelhantes, com idade média de 58,8 anos, sendo a maioria do sexo masculino (57,9%).(11)
Um estudo realizado por Burmeister et al. cujo objetivo era verificar pacientes diabéticos com DRC em diferentes clínicas de diálise de Porto Alegre, apresentou um total de 1.288 pacientes renais crônicos, nos quais foram identificados 488 diabéticos, tendo uma prevalência de 37,9% com DRC, sendo este percentual um pouco inferior aos achados nesta pesquisa.(12)
Já o Censo Brasileiro de Diálise da Sociedade Brasileira de Nefrologia (SBN), em 2016, encontrou uma prevalência de 41% para DM em HD no país. Como o Censo não apresenta dados por região, os fatores locais devem ser considerados, e qualquer análise comparativa apresenta-se impossibilitada.(13)
A glicose filtrada pelos glomérulos é totalmente reabsorvida na forma ativa pelos túbulos renais, e a excreção urinária da glicose que excede o limiar de reabsorção tubular representa uma função renal cuja finalidade principal é evitar que os níveis plasmáticos de glicose alcancem valores tóxicos. Neste caso, o rim impede que se desenvolva um estado de hiperglicemia extrema com várias complicações, como a hiperosmolaridade e a desidratação intracelular.(5)
A glicose em excesso é transformada para sorbitol por meio da enzima aldose redutase, acumulando-se nos tecidos, túbulos renais e nos glomérulos, e o aumento do sorbitol pode causar lesão tecidual e depletar o meio intracelular de mioinositol, que tem como consequência a elevação do diacilglicerol (DAG). O DAG é o principal mediador celular endógeno da ativação de proteína quinase C a qual tem sido envolvida na patogênese da nefropatia diabética. O controle glicêmico intenso tem sido recomendado na prevenção primária e na diminuição da progressão da microalbuminúria, independentemente da ação benéfica de um estado de hiperglicemia na evolução da nefropatia diabética. A maioria dos autores recomenda o controle glicêmico adequado como estratégia para prevenir ou diminuir as complicações macro e microvasculares do diabetes.(14)
Considerando os resultados do Fos e PTH, foi evidenciado um valor médio acima dos valores de referência considerados como alterados, indicando que há uma redução na excreção dos mesmos.
Nerbass et al. avaliaram o impacto da intervenção e do acompanhamento nutricional sobre o controle do Fos sérico de 46 pacientes hiperfosfatêmicos em hemodiálise durante um período de três meses, os quais apresentaram um valor médio do eletrólito superior a 5,5 mg/dL, corroborando com os dados encontrados neste trabalho.(15)
O Fos tem como função auxiliar na manutenção do pH do corpo, unindo-se com o Ca na regulação de atividades enzimáticas, estimulando rigidez nos ossos e dentes. Sua absorção é proporcional à sua ingestão, e aproximadamente 90% do Fos são excretados via renal, sendo mediados pelo hormônio PTH. Os níveis de fósforo são mantidos por diferentes mecanismos e pela integração de três órgãos que são: intestino delgado, rins e o esqueleto.(16)
Com o aumento nos níveis de Fos e PTH, os rins perdem a capacidade de excretar substâncias tóxicas do nosso organismo, levando a uma hiperfosfatemia e uma estimulação maior da produção de PTH.(17)
O aumento do Fos estimula as paratireoides devido à diminuição de sua excreção, aumentando ainda mais os níveis de PTH, gerando o quadro de hiperparatireoidismo, frequente nos pacientes renais crônicos caracterizados pelo funcionamento excessivo das glândulas paratireoides, e, neste caso, os pacientes são submetidos a uma dieta pobre em fósforo.(18)
Um estudo realizado por Avelar, Pires e Cortes em Santa Maria-RS demonstrou, entre idosos que realizam hemodiálise e já tiveram algum tipo de queda, uma média de PTH de 409,94 pg/mL, e naqueles que nunca tiveram queda a média de PTH foi de 254,94 pg/mL.(19)
A principal função do PTH é prevenir a hipocalcemia, ele age estimulando os osteoclastos a lisar o osso, liberando Ca na circulação. Normalmente, esse processo de homeostase controla a atividade de osteoclastos e osteoblastos, mas o hiperparatireoidismo provoca um desequilíbrio das atividades dessas células, levando ao aumento de degradação óssea. A produção e secreção de PTH pode ser estimulada por hipocalcemia, hiperfosfatemia e deficiência de vitamina D. O termo vitamina D é usado para denominar várias formas, sendo que a forma ativa dessa vitamina é D3 1,25-(OH)2D3 ou calcitriol, que se liga ao receptor de vitamina D (RVD); em situações normais, a vitamina D regula a síntese e liberação de PTH, pois quando a vitamina D3 liga-se aos RVD das paratireoides a produção de PTH é reduzida. Quando ocorre a diminuição da função renal, há um declínio da 1a-hidroxilase renal, responsável pela reação final de hidroxilação na síntese do calcitriol, e a justificativa disso é que os níveis de PTH aumentam e os níveis de vitamina D3 caem.(20)
O hiperparatireoidismo secundário da DRC é considerado uma das mais importantes causas de mortalidade em pacientes com DRC por causar fraturas, deformidades ósseas e decréscimo do tempo de vida desses pacientes.(21)
A característica principal da doença é a hiperplasia das glândulas paratireoides, que leva ao aumento da síntese e secreção do PTH, devido à diminuição da concentração sérica de cálcio, que leva ao decréscimo na síntese de calcitriol e à retenção de fósforo, além da resistência esquelética à ação do PTH. Essa situação atenua a excreção de cálcio na urina e mobiliza o cálcio dos ossos, mantendo as concentrações séricas normais, ou seja, preservando a homeostase deste cátion.(22)
Em nosso estudo, a avaliação nos níveis de vitamina D não foi feita por não apresentar este exame nos meses em que foi realizada a pesquisa.
A retenção de Fos pode também funcionar como inibidor indireto da produção da forma ativa da vitamina D devido à inibição da enzima 1-a-hidroxilase renal, que é responsável pela conversão da vitamina D em sua forma ativa (1,25(OH)2D3). Como consequência da diminuição da vitamina D ativa, ocorre uma redução na absorção intestinal e reabsorção óssea de Ca, favorecendo o desenvolvimento de episódios mais frequentes e sustentados de hipocalcemia.23)
Conforme Sesso et al., os níveis de Ca extracelular são estímulo primário para regulação da secreção do PTH, e o receptor de Ca (CaR) é o seu principal regulador, sendo a sua modulação o mecanismo primário que media os efeitos do Ca sobre a secreção do PTH. Quando o Ca sérico diminui, o CaR é inibido e as vesículas contendo PTH movem-se para a membrana celular e o liberam na circulação. Quando o Ca sérico aumenta, o receptor é ativado e a liberação do PTH é inibida. O Ca regula negativamente a transcrição do gene do PTH por um mecanismo pós-transcripcional que afeta a estabilidade do RNAm do PTH. Então, pode-se afirmar que o Ca pode influenciar, direta ou indiretamente, a secreção e a expressão do gene do PTH e, se o estímulo for prolongado, ocorrer proliferação da célula paratireoideana.(24)
Já nos dados do Ministério da Saúde (2010), na DRC ocorrem mudanças na dinâmica do Ca, causando deficiência de Ca no sangue, caracterizada como hipocalcemia; embora a ingestão seja adequada, o excesso de Fos impede que o Ca seja absorvido, no entanto, para se prevenir a hipocalcemia, é necessário equilibrar os níveis de Ca e fósforo na alimentação.(25)
Os níveis de Ca dentro dos valores de referência observados neste trabalho apresentaram resultados divergentes aos de outros autores estudados, uma vez que os resultados não seguiram o padrão dos pacientes com DRC. Acredita-se que possa estar ocorrendo uma suplementação essencial de cálcio, ou algum outro distúrbio fisiológico que não seja a hipocalcemia, afetando os níveis do PTH
Para Custodio, a suplementação com Ca nos pacientes com DRC deve ser muito cautelosa e apenas nos casos diagnosticados de hipocalcemia, pois em uma população normal ou em pacientes com DRC em tratamento conservador podem demonstrar aumento do risco cardiovascular e da calcificação coronariana associada à suplementação.(4)
Já nos estudos de Dusso, devido à ingestão de alimentos proteicos com fontes de Ca, como leite e derivados, foi observado que houve mais relato de ingestão diária para o leite, e a quantidade de Ca ingerida por estes pacientes supostamente apresenta-se adequada já que mais de 80% dos pacientes apresentaram níveis séricos normais.(26)
Ficou demonstrado no estudo, de acordo com as análises feitas, que as dosagens de K e Na permaneceram dentro do intervalo de normalidade conforme Tabela 2. Estes resultados corroboram com os encontrados por Stringuetta-Belik et al., onde os níveis plasmáticos do K foram semelhantes e não apresentaram alterações em seus valores.(27) Santos, em seu estudo avaliando 35 pacientes renais crônicos com anemia submetidos à hemodiálise, no período de agosto a setembro, identificou um predomínio de normalidade em relação aos valores de K, com resultados na faixa de 3,6 a 5,0 mEq/L.(28)
A absorção do K é realizada pelo sistema digestivo e em seguida distribuída para os tecidos, onde uma pequena parte é absorvida pelas células, no entanto a sua maioria é excretada pelos rins; considera-se que sua concentração plasmática está comumente ligada à função renal.(16) O K é o cátion que predomina no meio intracelular, exercendo funções que são primordiais para o organismo humano, responsável pela regulação de processos metabólicos e a excitação neuromuscular, na qual sua concentração depende de um balanço integrado entre ingestão e absorção e sua eliminação nas fezes e urina.(3)
Os rins têm a função de conservar ou eliminar grandes quantidades de Na, dependendo do conteúdo do mesmo no líquido extracelular e do volume sanguíneo. Parte do Na é também reabsorvida nos túbulos distais e alça de Henle e, sob o controle da aldosterona, é trocada pelo K.(16)
Em um estudo realizado por Moreira et al., cujo objetivo era associar a diabetes e hipertensão na disfunção renal, observou-se que a G ficou na média de 206 mg/dL, o Fos 5,6 mg/dL, ambos apresentando valores elevados; já o K: 5,0 mEq/L e Na: 140 mEq/L apresentaram-se dentro dos valores de referência.(29)
Nota-se, ao analisarmos a Tabela 3, que a média de G aumenta conforme os meses e anos pelo fato de que pacientes portadores de DRC desenvolvem resistência à insulina ocasionando uma hiperglicemia de difícil controle, na qual os níveis plasmáticos de hormônios que compensam a ação da insulina (como cortisol, catecolaminas, glucagon e outros) estão elevados, mesmo que de forma transitória, por causa da diminuição da excreção renal. A afinidade da insulina pelo receptor celular diminui na presença de acidose metabólica, típica destes pacientes, tendo ainda a secreção pancreática de insulina inadequada para o grau de elevação da glicose. Portanto, qualquer alteração no fluxo sanguíneo renal, ritmo de filtração glomerular e na função tubular pode gerar distúrbios na homeostase da glicose, gerando assim elevação da glicemia.(5)
A maioria desses pacientes apresentou DM tipo II, a qual está presente em 90% da população diabética e que pode ocorrer em qualquer faixa etária, mas geralmente são diagnosticados após os 40 anos, confirmando os achados da nossa pesquisa. Alguns mecanismos da DM tipo II podem estar associados à predisposição genética, fatores ambientais e comportamentais, destacando-se a obesidade, dislipidemia, síndrome metabólica e sedentarismo.(30)
CONCLUSÃO
Os resultados encontrados são coerentes com as alterações metabólicas causadas pela nefropatia diabética com exceção dos encontrados de Ca, que se estabeleceram dentro dos valores de referência. É imprescindível que haja a conscientização dos portadores de DM sobre a importância do tratamento adequado para a não evolução da doença renal. Portanto, sugerem-se estudos posteriores mais aprofundados de um acompanhamento que possa contribuir para ampliar os conhecimentos em relação ao perfil da população que é atendida pelos serviços de nefrologia.
Abstract
Chronic Kidney Disease is the gradual loss of renal function, causing a metabolic imbalance leading to an increase in the serum concentration of electrolytes, the main cause of which is Diabetes Mellitus. Considering the presented, the objective of this study was to evaluate serum sodium, potassium, calcium, phosphorus and parathormone levels in diabetic patients submitted to hemodialysis. A descriptive study was carried out with a retrospective documentary approach of patients’ charts from January to March, 2017 at a reference hospital in the northern region of RS. Parathyroid hormone and phosphorus results were found, with mean values of 533 pg / mL and 5.4 mg / dL respectively, and mean values within the reference range of sodium, potassium and calcium. With the exception of calcium values, the other findings are consistent with the metabolic changes caused by diabetic nephropathy. More effective measure for establishing a data transmission chain.
Keywords
Nephropathy; Hyperglycemia; Diabetes Mellitus
REFERÊNCIAS
. Bastos MG, Bregman R, Kirsztajn GM. Doença Renal Crônica: frequente e grave, mas também prevenível e tratável. Universidade Federal de Juiz de Fora, Universidade do Estado do Rio de Janeiro e Universidade Federal de São Paulo. Rev. Assoc. Med. Bras. 2010; 56(2): 248-53.
- Gurgel TC, Cherchiglia ML, Acurcio Fde A, Szuster DA, Gomes IC, Andrade EI. Erythropoietin use by incident hemodialysis patients in the Brazilian Unified National Health System, 2002-2003.Cad Saude Publica. 2012 May;28(5):856-68. [Article in Portuguese]
- Guyton AC, Hall JE. Tratado de Fisiologia Médica. 11ª. ed. Rio de Janeiro: Elsevier; 2006.
- Custódio MR, Canziani ME, Moysés RM, Barreto FC, Neves CL, de Oliveira RB, et al. Clinical protocol and therapeutic guidelines for the treatment of secondary hyperparathyroidism in patients with chronic kidney disease. J Bras Nefrol. 2013;35(4):308-22. [Article in Portuguese]
- Cersosimo E. A importância do rim na manutenção da homeostase da glicose: aspectos teóricos e práticos do controle da glicemia em pacientes diabéticos portadores de insuficiência renal. J Bras Nefrol Volume XXVI – nº 1 – Março de 2004.
- Grzybowski EL, Pedroso D, Sandri YP, Fucks MB. Prevalência de diabetes mellitus em pacientes renais crônicos em um serviço de hemodiálise do RS. Rev Saúde Integrada. 2015; 6(11-12):11-25.
- Zatz R. Fisiopatologia Renal. 2ª ed. São Paulo: Atheneu, 2002.
- Peters BSE, Jorgetti V, Martini L A. influência do hiperparatireoidismo secundário grave no estado nutricional de pacientes com insuficiência renal crônica. Rev. Nutr. [online]. 2006, vol.19, n.1, pp.111-118. http://dx.doi.org/10.1590/S1415-52732006000100012.
- Ruzany F. Controle metabólico do Ca e fósforo na hemodiálise. Medicina On Line Rev virt medicina. 2000.
- Biavo BMMT, Zanno C, Cunha LM, Araujo MLD, Ribeiro MMC, Sachs A, Barros JG. Aspectos nutricionais e epidemiológicos de pacientes com doença renal crônica submetidos a tratamento hemodialítico no Brasil. J Bras Nefrol 2012;34(3):206-215.
- Guerra-Guerrero V, Sanhueza-Alvarado O, Cáceres-Espina M. Quality of life in people with chronic hemodialysis: association with sociodemographic, medical-clinical and laboratory variables. Rev Lat Am Enfermagem. 2012;20(5):838-46. [Article in English, Portuguese, Spanish].
- Burmeister JE, Mosmann CB, Bau R, Rosito GA. Prevalence of diabetes mellitus in chronic renal failure patients under haemodialysis in Porto Alegre, Brazil. J Bras Nefrol. 2012 Jun;34(2):117-21.
- Sociedade Brasileira de Diabetes. Diretrizes da Sociedade Brasileira de Diabetes 2009/3ª ed. Itapevi/SP: A. Araújo Silva Farmacêutica, 2009.
- Lopes F. Atualização em fisiologia e fisiopatologia: Patogênese da nefropatia diabética. J Bras Nefrol. São Paulo 2001 23(2):121-9.
- Nerbass FB, Cuppari L, Avesani CM, Luz HAF. Diminuição do fósforo sérico após intervenção nutricional em pacientes hiperfosfatêmicos em hemodiálise. J Bras Nefrol 2008;30(4):288-93.
- Motta VT. Bioquímica Clínica para laboratório – Princípios e Interpretações. 5. ed. Rio de Janeiro: MedBook, 2009.
- Costa CA, Candido KJ, Doença Renal Crônica Terminal em Hemodiálise: Mudanças de hábitos e doença óssea. Rev Elet Novo Enfoque. 2013; n. 17.196-201.
- Cruz J, Cruz HMM, Kirsztajn GM, Oliveira RB, Barros RT. Atualidades em nefrologia 14ª. São Paulo: Sarvier. 2016. P. 531.
- Avelar J, Pires K, Cortes VF. Influência dos níveis de paratormônio em quedas entre idosos e adultos em hemodiálise. Rev de Enf da UFSM. 2012;125-34.
- Valcarenghi D. Avaliação toxicológica crônica do polímero quitosana ferro (III) solúvel. 2006. 87f. Dissertação – Centro de Educação de Ciências da Saúde, Universidade do Vale do Itajaí, Brasil; 2006.
- Gomes EM, Nunes RC, Lacativa PG, Almeida MH, Franco FM, Leal CT, et al. Ectopic and extranumerary parathyroid glands location in patients with hyperparathyroidism secondary to end stage renal disease. Acta Cir Bras. 2007;22(2):105-9.
- Lorenzo V, Portillo MR, García RP, Andía JBC. De la osteodistrofia renal a las alteraciones del metabolismo óseo y mineral asociado a la enfermedad renal crónica: Evolución de un concepto. Nefrologia. 2007; 27(5):527-33
- Sampaio EA, Lugon JR, Barreto CF. Fisiopatologia do hiperparatireoidismo secundário. J Bras Nefrol. São Paulo 2008 30 (Supl 1):6-10.
- Sesso RC, Lopes AA, Thomé FS, Lugon JR., Martins CT. Brazilian Chronic Dialysis Survey 2016. J Bras Nefrol. 2017;39(3):261-66.
- Brasil, Ministério da Saúde. Portaria SAS/MS nº 225 de 10 de maio de 2010. Aprova o Protocolo Clínico e Diretrizes Terapêuticas – Hiperfosfatemia na Insuficiência Renal Crônica. Diário Oficial da União, 2010.
- Dusso AS, Tokumoto M. Defective renal maintenance of the vitamin D endocrine system impairs vitamin D renoprotection: a downward spiral in kidney disease. Kidney Int. 2011;79(7):715-29.
- Stringuetta BF, Shiraishi FG, Oliveira e Silva VR, Barretti P, Caramori JSCT, Vilas Bôas PJF, et al. Maior nível de atividade física associa-se a melhor função cognitiva em renais crônicos em hemodiálise. J. Bras. Nefrol. [Internet]. 2012 ;34(4): 378-86. Available from: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0101-28002012000400011&lng=en
- Santos BP, Oliveira VA, Soares MC, Schwartz E. Doença renal crônica: relação dos pacientes com a hemodiálise. ABCS Health Sci. 2017;42(1):8-14.
- Moreira HG, Sette JBC, Keiralla LCB, Alves SG, Pimenta E, Sousa MD, Amodeo C. Diabetes mellitus, hipertensão arterial e doença renal crônica: estratégias terapêuticas e suas limitações. Rev Bras Hipertens. 2008;15(2):111-6,
- Sociedade Brasileira de Diabetes. Consenso Brasileiro sobre Diabetes 2002: diagnóstico e classificação do diabetes melito e tratamento do diabetes melito tipo 2. Rio de Janeiro: Diagraphic Editora, 2003.
Correspondência
Paula Borges
Universidade Luterana do Brasil (ULBRA) – campus Carazinho
BR-285, KM 335
99500-000 – Carazinho – RS, Brasil
