Avaliação do perfil de infiltração e relevância do uso de estabilizantes celulares nas amostras de líquido cefalorraquidiano recebidas no Laboratório de Marcadores Celulares do Centro de Hematologia e Hemoterapia de Santa Catarina
Infiltration profile evaluation and relevance of the use of cellular stabilizers in cerebrospinal fluid samples received by Cell Labelling Laboratory in Hematology and Hemotherapy Center of Santa Catarina
Nicoli De Bona Heck1
Mayara Pirolli Coelho1
Gisele Cristina Dametto1
Maria Daniela Holthausen Périco Colombo2
Renata Silva Kalfeltz3
1Bioquímica. Centro de Hematologia e Hemoterapia de Santa Catarina – HEMOSC – Florianópolis-SC, Brasil.
2Médica. Centro de Hematologia e Hemoterapia de Santa Catarina – HEMOSC – Florianópolis-SC, Brasil.
3Bioquímica, Mestre. Centro de Hematologia e Hemoterapia de Santa Catarina – HEMOSC – Florianópolis-SC, Brasil.
1Instituição: UCentro de Hematologia e Hemoterapia de Santa Catarina – HEMOSC – Florianópolis-SC, Brasil.
Recebido em 14/12/2017
Artigo aprovado em 23/08/2018
DOI: 10.21877/2448-3877.201800656
Resumo
Objetivo: O presente estudo pretende analisar o perfil e as condições das amostras de líquido cefalorraquidiano (LCR) recebidas no setor de Marcadores Celulares do Centro de Hematologia e Hemoterapia de Santa Catarina (HEMOSC). Métodos: Os dados foram obtidos retrospectivamente através do sistema HemoSis e dos planos de trabalho contidos no laboratório num intervalo de 12 meses. Resultados: Das 117 amostras avaliadas, observa-se que 54% das provenientes do interior do estado de Santa Catarina são pouco viáveis, enquanto que apenas 9% das amostras da grande Florianópolis apresentaram este problema. No total de amostras avaliadas, quatro laudos foram inconclusivos devido à baixa viabilidade. Em relação ao perfil das amostras, somam-se LCR referentes a 65 pacientes sem predomínio de sexo, majoritariamente em idade adulta e se sobressaem as investigações de Linfoma Não-Hodgkin B e leucemias agudas. Dos pacientes, nove revelaram amostras infiltradas. Entre as neoplasias que acometem o sistema nervoso central, há um predomínio de infiltração por doenças linfoides nas amostras recebidas pelo laboratório. Além disso, a baixa viabilidade celular em algumas amostras pode estar associada a resultados inconclusivos ou de baixa confiabilidade. Conclusão: É preciso adequar as coletas do LCR e inserir o uso dos estabilizantes na rotina para evitar resultados inconclusivos e possíveis recoletas de amostra.
Palavras-chave
Leucemia; Linfoma; Citometria de Fluxo; Líquido cefalorraquidiano
INTRODUÇÃO
A otimização do uso da citometria no diagnóstico e acompanhamento de doenças que acometem o Sistema Nervoso Central (SNC) tem ganhado destaque na prática clínica.(1,2) Por tratar-se de uma abordagem diagnóstica relativamente nova, existem diversas lacunas de conhecimento a serem preenchidas, inclusive em termos de medidas educativas direcionadas aos profissionais envolvidos no processo de acompanhamento do paciente, coleta e envio de amostra, processamento do material e análise dos dados obtidos.
O líquido cefalorraquidiano (LCR) de um indivíduo sadio pode conter até 5 leucócitos/mm3, distribuídos entre uma porcentagem média de 60% de linfócitos e 20% de monócitos. Em menores proporções, granulócitos e células dendríticas também serão vistos. O encontro de outro tipo celular é indicativo de alguma situação atípica.(3,4) Em pacientes com suspeita de metástase de doenças hematológicas para o SNC, o estudo citológico do LCR é muito importante e frequentemente permite a detecção de linfocitose.(5)
O rápido efeito citotóxico do LCR nos leucócitos devido ao aumento do pH extravivo causado pela difusão de CO2 são oncótica) faz com que as células inchem, lisem ou tornem-se irreconhecíveis.(6) Por isso, para exames laboratoriais feitos em LCR sem nenhum tipo de estabilizante celular, as amostras devem ser processadas até uma hora depois da punção para minimizar a deterioração sofrida pelas células.(1,7)
O encontro de células neoplásicas é padrão ouro no diagnóstico de carcinomatose meníngea, contudo, devido à pequena quantidade de células no LCR, a sensibilidade da citologia oncótica é baixa.(8,9) Tendo em vista que a maioria das amostras de LCR são paucicelulares e perdem viabilidade celular muito rapidamente,(1) apesar da alta especificidade da citologia convencional, esta técnica está associada a uma sensibilidade limitada com até 20% a 60% de resultados falso-negativos. Contudo, estudos recentes mostram claramente que a citometria de fluxo pode ser mais sensível do que a citologia convencional para a detecção de células neoplásicas no LCR.(2,10,11)
A citometria de fluxo permite que sejam investigados vários constituintes celulares simultaneamente, e essa característica tem tornado esta a técnica de escolha para análises multiparamétricas de populações celulares.(12)
Neste contexto, o presente estudo pretende analisar o perfil e as condições das amostras de LCR recebidas no setor de Marcadores Celulares do Centro de Hematologia e Hemoterapia de Santa Catarina (HEMOSC) em um intervalo de 12 meses no período de 1º de novembro de 2015 a 1º de novembro de 2016; verificar a distribuição de patologias onco-hematológicas que afetam o SNC em amostras de LCR recebidas no laboratório de Marcadores Celulares; identificar possíveis problemas técnicos e propor melhorias na fase pré-analítica.
Material e Métodos
Estudo descritivo, observacional e retrospectivo. Os dados foram obtidos pelo pesquisador, mediante autorização e orientação da responsável pelo setor de Marcadores Celulares, através do sistema HemoSis – Sistema de Gerenciamento de Hemocentro – e dos planos de trabalhos contidos no laboratório de Marcadores Celulares do HEMOSC. Estes são referentes às amostras de LCR recebidas pelo laboratório no intervalo de 12 meses no período de 1º de novembro de 2015 a 1º de novembro de 2016. Somaram-se 117 amostras e nenhum critério de exclusão foi utilizado. Os dados foram analisados com estatística descritiva e expressos em porcentagem.
Resultados
Foi possível determinar a viabilidade de 96,6% das 117 amostras avaliadas. Destas, 17% (n=19) apresentaram baixa viabilidade celular (menos que 75% de células viáveis). Quando cruzados os dados de procedência e viabilidade celular, observa-se que a maioria (54%) das amostras provenientes do interior do estado de Santa Catarina, e que levam ao menos 24 horas para chegar ao setor de análise, são pouco viáveis, enquanto que apenas 9% das amostras da grande Florianópolis apresentaram este problema. No total de amostras avaliadas, quatro laudos foram inconclusivos devido à baixa viabilidade celular, todas recebidas após um longo tempo da coleta e provenientes do interior do estado. Entre os pacientes com amostras pouco viáveis, cinco tinham diagnóstico prévio de linfoma de Burkitt e não se detectou infiltração neoplásica no LCR em nenhum deles. Um dos pacientes teve nova amostra enviada vinte dias depois, com boa viabilidade celular e infiltração detectada de 98,8%. No que diz respeito ao perfil das amostras, somam-se LCR referentes a 65 pacientes sem predomínio de sexo, majoritariamente em idade adulta (18 a 59 anos) e se sobressaem as investigações de Linfoma Não-Hodgkin B (LNH-B) – 43,1% das suspeitas, e de leucemias agudas – 35,4% das suspeitas (Tabela 1).
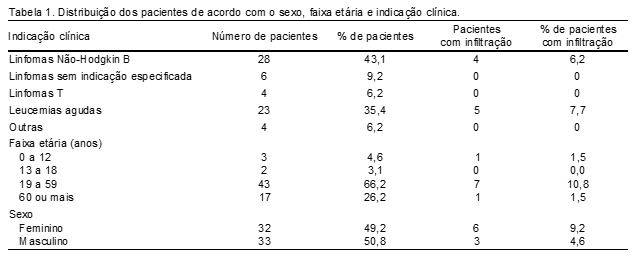
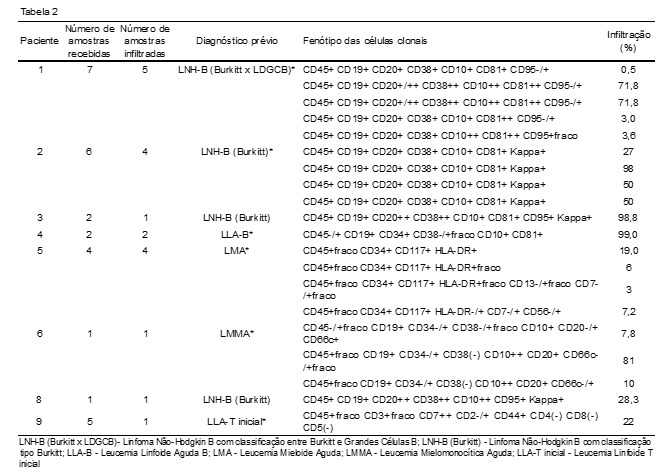
Destes pacientes, nove revelaram, em algum momento, amostras infiltradas: quatro por LNH-B; três por leucemias linfoides agudas; dois por leucemias mieloides (Tabela 2).
Discussão
A imunofenotipagem é extremamente útil, pois permite descrever o imunofenótipo das células detectadas e determinar se há alguma anomalia ou de onde estas são provenientes. Apresentamos amostras infiltradas principalmente por LNH-B, o que, provavelmente, tem relação com a prevalência de pacientes em idade adulta. Especulamos que o delineamento seria diferente se atendêssemos a um número maior de crianças. É conhecido que o SNC é mais comumente infiltrado por linfomas e leucemias linfoides.(13,14) Neste contexto, a citometria de fluxo tem um papel muito relevante, pois permite distinguir entre células linfoides residentes do LCR e células clonais que nem sempre são facilmente diferidas através da avaliação morfológica devido às frequentes atipias linfocitárias. Em todas as amostras em que foram detectados blastos linfoides B, verificamos a expressão de CD34 e/ou CD10. Os linfócitos B eventualmente detectados no LCR não devem expressar CD10 ou CD34, os que apresentam estes antígenos na membrana celular são sempre patogênicos.(15) De modo similar, as síndromes linfoproliferativas crônicas podem ser confirmadas por meio da imunofenotipagem com segurança. Das quatro amostras infiltradas por doenças linfoproliferativas B, três tiveram monoclonalidade identificada através da restrição de cadeia leve de imunoglobulina. A detecção de restrição de cadeia leve de imunoglobulina é suficiente para determinar a clonalidade dos linfócitos avaliados, e o referido parâmetro serve tanto para o diagnóstico quanto para o seguimento de pacientes com infiltração.(16) Nos LNH-B de baixo grau, a infiltração do SNC atinge menos de 5% dos pacientes,(17) porém, quando o LNH-B está associado a alguns fatores de risco, a taxa de infiltração já no diagnóstico aumenta consideravelmente.(13,18-20) (Figura 1). A citometria permite ainda a distinção entre células dendríticas plasmocitoides blásticas ou residentes no LCR. Pudemos evidenciar, com clareza, a presença de células dendríticas em duas amostras de uma mesma paciente devido a infiltrado inflamatório. Apesar de ser uma leucemia rara, quando afeta o SNC tem relevância para o prognóstico do paciente. Ainda que a investigação do SNC não faça parte do protocolo clínico padrão para leucemias de células dendríticas plasmocitoides, 60% dos pacientes com a doença têm o LCR infiltrado ao diagnóstico e sua sobrevida é aumentada significativamente quando recebem tratamento profilático para o SNC.(21) Além disso, de acordo com a experiência do laboratório, alguns tipos celulares são mais susceptíveis à morte celular, incluindo a célula de Burkitt. Na casuística estudada, nos casos em que a viabilidade estava abaixo do ideal, as amostras para investigar a presença desta célula apresentaram resultados inconclusivos ou negativos. O linfoma de Burkitt é um linfoma incomum, porém altamente agressivo, com uma das mais altas taxas de divisão celular conhecidas dentre os tumores humanos.(22) Esta característica exige atenção redobrada às amostras com suspeita de infiltração por linfoma de Burkitt e agilidade na manipulação, pois as células da doença são rapidamente afetadas quando submetidas a situações adversas. Esta demanda da prática clínica e o impacto da fase pré-analítica, principalmente do tempo pós-coleta do material, nos exames realizados em LCR,(23) têm levado ao uso de novas práticas que aprimoram o desempenho das análises feitas por citometria de fluxo. O uso de estabilizantes celulares imediatamente após a coleta é uma solução com claras evidências de eficácia na manutenção da integridade da amostra. Ainda que o TransfixTM tenha se mostrado mais eficiente,(24) o meio de cultura celular RPMI 1640 também é uma excelente opção para manutenção da viabilidade celular. O custo estimado para o uso dos estabilizantes varia de $0.26 a $12.00 por teste dependendo do tipo do produto escolhido para a função,(25) o que viabiliza a implantação independente da disponibilidade financeira do local de coleta ou do centro de análise.
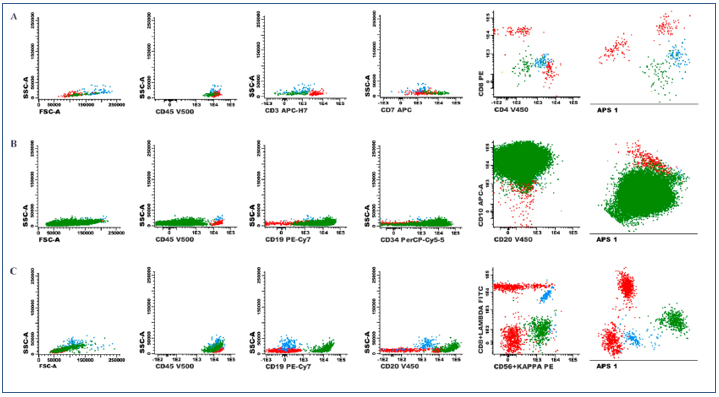 Figura 1. Gráficos de pontos demonstrativos de LCR infiltrados avaliados por citometria de fluxo de 8 cores. Os debris celulares foram excluídos através da avaliação de tamanho celular e expressão de CD45. Em todos os gráficos, as células residentes estão identificadas da seguinte maneira: linfócitos T – pontos vermelhos; monócitos – pontos azuis. As células clonais estão identificadas com pontos verdes. Amostra de LCR infiltrada por blastos de Leucemia Linfoide Aguda T (A), por blastos de Leucemia Linfoide Aguda B (B), por células de Linfoma Não-Hodgkin B (C).
Figura 1. Gráficos de pontos demonstrativos de LCR infiltrados avaliados por citometria de fluxo de 8 cores. Os debris celulares foram excluídos através da avaliação de tamanho celular e expressão de CD45. Em todos os gráficos, as células residentes estão identificadas da seguinte maneira: linfócitos T – pontos vermelhos; monócitos – pontos azuis. As células clonais estão identificadas com pontos verdes. Amostra de LCR infiltrada por blastos de Leucemia Linfoide Aguda T (A), por blastos de Leucemia Linfoide Aguda B (B), por células de Linfoma Não-Hodgkin B (C).
Conclusão
Entre as neoplasias que acometem o SNC, há um predomínio de infiltração por doenças linfoides nas amostras recebidas pelo laboratório. Além disso, a baixa viabilidade celular em algumas amostras pode estar associada à obtenção de resultados inconclusivos ou de baixa confiabilidade. Isto posto, é preciso adequar as coletas do LCR e inserir o uso dos estabilizantes imediatamente após o procedimento para evitar resultados inconclusivos e minimizar a possibilidade de novas coletas de um material tão nobre.
Abstract
Objective: This study aims to evaluate the aspects and profile of CSF samples received by Cell Labelling Laboratory in Hematology and Hemotherapy Center of Santa Catarina. Methods: The data were obtained retrospectively through the HemoSis system and the work plans contained in the laboratory within a 12 months interval. Results: Of 117 samples evaluated, 54% of those from the country side of Santa Catarina estate were poorly viable for analysis, while only 9% of samples from Florianopolis and surrounding area showed the same problem. Of these samples, four reports were inconclusive. Regarding CSF samples profile, the samples were from 65 patients with no predominance of sex, mainly in adult life and for the diagnosis of B cell Non-Hodgkin’s Lymphoma and acute leukemia. Of all patients, nine showed infiltrate samples at some point. Among the neoplasias that affect Central Nervous System, the laboratory received manly samples showing infiltration from lymphoid diseases. In addition, the low cell viability in some samples might be associated to inconclusive and low reliable reports. Conclusion: It is necessary to adjust the CSF harvesting by addition of cellular stabilizers to avoid inconclusive and unreliable reports, and the need of a new harvesting.
Keywords
Leukemia; Lymphoma; Flow cytometry; Cerebrospinal fluid
REFERÊNCIAS
- Kraan J, Gratama JW, Haioun C, Orfao A, Plonquet A, Porwit A, et al. Flow Cytometric Immunophenotyping of Cerebrospinal Fluid. Curr Protoc Cytom. 2008; chapter 6: unit 6 25.
- Subira D, Castañón S, Aceituno E, Hernández J, Jiménez-Garófano C, MD, Jiménez A, et al. Flow cytometric analysis of cerebrospinal fluid samples and its usefulness in routine clinical practice. Am J Clin Pathol. 2002;117:952-8.
- de Graaf MT, de Jongste AH, Kraan J, Boonstra JG, Sillevis Smitt PA, Gratama JW. Flow cytometric characterization of cerebrospinal fluid cells. Cytometry Part B. 2011;80B:271-81.
- de Graaf MT, Smitt PA, Luitwieler RL, van Velzen C, van den Broek PD, Kraan J, et al. Central memory CD4+ T cells dominate the normal cerebrospinal fluid. Cytometry Part B. 2011;80B:43-50.
- Bromberg JE, Breems DA, Kraan J, Bikker G, van der Holt B, Smitt PS, et al. CSF flow cytometry greatly improves diagnostic accuracy in CNS hematologic malignancies. Neurology. 2007;68:1674-9.
- Torzewski M, Lackner KJ, Bohl J, Sommer C. Integrated cytology of cerebrospinal fluid. Berlin: Springer; 2008.
- de Graaf MT, van den Broek PD, Kraan J, Luitwieler RL, van den Bent MJ, Boonstra JG, et al. Addition of serum-containing medium to cerebrospinal fluid preventes cellular loss over time. J Neurol. 2011;258:1507-12.
- Dass J, Dayama A, Mishra PC, Mahapatra M, Seth T, Tyagi S, et al. Higher rate os central nervous system involvement by flow cytometry than morphology in acute lymphoblastic leukemia. Int J Lab Hem. 2017;00:1-6;
9.Levinsen M, Marquat HV, Groth-Pedersen L, Abrahamsson J, Albertsen BK, Andersen MK, et al. Leukemic blasts are present at low levels in spinal fluid in one-third of childhood acute lymphoblastic leukemia cases. Pediatr Blood Cancer. 2016;00:1-8.
- Kovach AE, DeLelys ME, Kelliher AS, Dillon LJ, Hasserjian RP, Ferry JÁ, et al. Diagnostic utility of cerebrospinal fluid flow cytometry in patients with and without prior hematologic malignancy. Am J Hematol. 2014;89:978-984.
- Ranta S, Nilson F, Harila-Saari A, Saft L, Tani E, Soderhall S, et al. Detection of central nervous system involvment in childhood acute lymphoblastic leukemia by cytomorphology and flow cytometry of the cerebrospinal fluid. Pediatr Blood Cancer. 2015;62:951-6.
- Sales MM, Vasconcelos DDM. Citometria de fluxo: Aplicações no laboratório clínico e de pesquisa. Seção I, Capítulo 1 – Citometria de fluxo: princípios metodológicos de funcionamento. São Paulo: Editora Atheneu; 2013.
- Bierman P, Giglio P. Diagnosis and treatment of central nervous system involvement in non-Hodgkin’s lymphoma. Hematol Oncol Clin North Am. 2005;19:597-609.
- Evans AE, Gilbert ES, Zandstra R. The increasing incidence of central nervous system leukemia in children. Cancer. 1970;26: 404-9.
- Subira D, Castañón S, Roman A, Aceituno E, Jiménez-Garófano C, Jiménez A, et al. Flow cytometry and the study of central nervous disease in patients with acute leukaemia. Br J Haematol. 2001; 112:381-4.
- Hegde U, Filie A, Little RF, Janik JE, Grant N, Steinberg SM, et al. High incidence of occult leptomeningeal disease detected by flow cytometry in newly diagnosed aggressive B-cell lymphomasat risk of central nervous system involvement: The role of flow cytometry versus cytology. Blood. 2005;105:496-502.
- Hollender A, Kvaloy S, Nome O, Skovlund E, Lote K, Holte H. Central nervous system involvement following diagnosis of non-Hodgkin’s lymphoma. Ann Oncol. 2002;13:1099-107.
- Bishop PC, Wilson WH, Pearson D, Janik J, Jaffe ES, Elwood PC. CNS involvement in primary mediastinal large B-cell lymphoma. J Clin Oncol. 1999;17:2479-85.
- Feugier P, Virion JM, Tilly H, Haioun C, Marit G, Macro M, et al. Incidence and risk factors for central nervous system occurrence in elderly patients with diffuse large-B-cell lymphoma: Influence of rituximab. Ann Oncol. 2004;15:129-33.
- Ersbøll J, Schultz HB, Thomsen BL, Keiding N, Nissen NI. Meningeal involvement in non-Hodgkin’s lymphoma: symptoms, incidence, risk factors and treatment. Scand J Haematol. 1985;35:487-96.
- Martin-Martin L, Lopez A, Vidriales B, Caballero MD, Rodrigues AS, Ferreira SI, et al. Classification and clinical behavior of blastic plasmacytoid dendritic cell neoplasms according to their maturation-associated immunophenotypic profile. Oncotarget. 2015;6(22):19204-16.
- Hecht JL, Aster JC. Molecular biology of Burkitt’s lymphoma. J Clin Oncol, Boston. 2000;18(21):3707-21.
- Dimas L, Puccioni-Sohler M. Exame do líquido cefalorraquidiano: influência da temperatura, tempo e preparo da amostra na estabilidade analítica. J Bras Patol Med Lab. 2008;44(2):97-106.
- de Jongste AH, Kraan J, van den Broek PD, Brooimans RA, Bromberg JE, van Montfort KA, et al. Use of TransFix™ cerebrospinal fluid storage tubes prevents cellular loss and enhances flow cytometric detection of malignant hematological cells after 18 hours of storage.. Cytometry B Clin Cytom. 2014;86(4):272-9.
- Greig B, Stetler-Stevenson M, Lea J. Stabilization Media Increases Recovery in Paucicellular Cerebrospinal Fluid Specimens Submitted for Flow Cytometry Testing. Cytometry Part B. 2014;86B:135-8.
Correspondência
Renata Silva Kalfeltz
Avenida Professor Othon Gama D’eça, 756 – Centro
88015-240 – Florianópolis – SC, Brasil
