Avaliação dos níveis de sICAM-1 em pacientes com doença falciforme
Assessment of sICAM-1 levels in patients with sickle cell disease
Vanessa Regina Galeazzi1
Paulo Roberto Merisio2
1Estudante. Pontifícia Universidade Católica do Paraná – PUCPR – Campus Toledo – Toledo, PR, Brasil..
2Mestre. Pontifícia Universidade Católica do Paraná – PUCPR – Campus Toledo – Toledo, PR, Brasil.
Instituição: Pontifícia Universidade Católica do Paraná – PUCPR – Campus Toledo – Toledo, PR, Brasil.
Artigo recebido em 10/10/2013
Artigo aprovado em 29/01/2016
Resumo
Objetivo: Este estudo teve como objetivo verificar os níveis séricos de ICAM-1 em crianças com doença falciforme com crise e sem crise clínica, comparando com um grupo controle saudável. Métodos: As dosagens de sICAM-1 foram realizadas através da técnica de enzimaimunoensaio (ELISA). Resultados: As análises demonstraram aumentos significativos de sICAM-1 em pacientes com doença falciforme em relação ao grupo controle. No entanto, não houve diferenças estatísticas nos níveis desta molécula entre os pacientes com a doença, embora tenha se mostrado aumentada na maioria dos pacientes. sICAM-1 também apresentou uma correlação positiva com a contagem de leucócitos, o que possibilita sugerir que o aumento de leucócitos esteja associado à lesão endotelial nestes pacientes. Conclusão: Sugere-se também que sICAM-1 esteja envolvida no processo de ativação endotelial e vasoclusão, e que a maioria dos pacientes com doença falciforme apresente lesão endotelial mesmo sem estar em crise clínica.
Palavras-chave
Anemia falciforme; Elisa; sICAM-1
INTRODUÇÃO
A anemia falciforme é a doença hereditária monogênica de maior ocorrência no Brasil, e com predominância em pessoas afrodescendentes.(1) Nesta doença ocorre uma mutação no cromossomo 11, a qual promove a substituição do aminoácido valina pelo ácido glutâmico na posição 6 da cadeia beta de hemoglobina, modificando sua estrutura molecular e dando origem à hemoglobina S (HbS).(2)
A HbS em condições de hipóxia sofre um processo de polimerização assumindo a forma de foice,(3) trazendo rigidez às hemácias, o que prejudica sua passagem pelos pequenos vasos e capilares. Assim, ocorrem fenômenos de vasoclusão, acarretando infartos com lesões de diversos órgãos e episódios de dor.(4)
A doença de origem africana, descrita pela primeira vez pelo Dr. James Herrick,(5) chegou às Américas pela imigração forçada de negros trazidos como escravos. No Brasil tem predominância entre pardos e negros, mas pode estar presente em brancos.(6) No estado do Paraná, de acordo com estudos realizados por Watanabe,(7) há uma prevalência de 2,2 homozigotos SS a cada 100 mil recém-nascidos vivos e um heterozigoto para cada 66 recém-nascidos vivos. Gonçalves et al.(8) afirmam que a doença falciforme ocorre em um a cada quinhentos nascidos afro-americanos e em um a cada mil a 4 mil nascidos hispano-americanos.
O termo doença falciforme não se refere apenas à anemia falciforme, mas engloba todo um grupo de anemias hemolíticas hereditárias que têm em comum a presença de hemoglobina S no interior da hemácia.(9) A anemia falciforme é assim denominada quando os indivíduos apresentam estado homozigótico para hemoglobina S. O gene S é determinante na alteração estrutural da hemoglobina.(10) O gene da HbS pode formar ainda combinações com outras anormalidades hereditárias, como hemoglobina C, D e beta-talassemia, gerando doença SC, doença SD e doença Sb-talassemia, constituídas no grupo das doenças falciformes. Além disso, quando o indivíduo herda de um dos pais o gene da hemoglobina A (HbA) e do outro o gene da HbS, ele é considerado portador do traço falciforme, não apresentando os sintomas da doença.(6) Contudo, a anemia falciforme destaca-se nesse grupo devido à sua morbidade e alto índice de mortalidade, tendo sido apontada como uma questão de saúde pública.(11)
Para que as moléculas de HbS se agreguem, além da ausência de oxigênio é necessário que estas estejam em um alto nível de concentração dentro da célula.(12) Depois de seguidos episódios de falcização, as células tornam-se desidratadas pela perda de potássio e água.(13) Esse processo eleva os níveis de CHCM favorecendo o aumento de polímeros de HbS. A polimerização é intensificada pela falência da bomba de Ca2+/ATPase, causando alteração na permeabilidade da membrana da hemácia, sendo este o principal fator da irreversibilidade do eritrócito falcizado.(14)
A anemia hemolítica geralmente aparece como um dos primeiros sintomas em pacientes com essa doença, estando diretamente relacionada com o declínio dos níveis de hemoglobina fetal (HbF).(15) A hemólise promove a liberação de hemoglobina no plasma, convertendo o óxido nítrico (NO) em nitrato inativo. A diminuição nas concentrações de NO causa uma alteração na homeostasia vascular, aumentando a ativação de plaquetas e a adesão de moléculas ao endotélio, promovendo vasoconstrição e consequente vasoclusão.(16) Este evento leva o paciente a ter crises de dor, infartos e necrose de órgãos como ossos e articulações, baço, pulmões e outros.(17)
Clinicamente, os pacientes com anemia falciforme não apresentam os sintomas da doença até os 6 meses de vida, pois nessa fase ainda há um alto nível de HbF,(18) que exerce um fator protetor contra a falcização, pois possui maior afinidade pelo oxigênio e não se incorpora ao polímero de HbS.(6,19,20,21)
As manifestações clínicas na doença falciforme podem se apresentar de forma aguda ou crônica.(22) Os fenômenos vasoclusivos acometem principalmente ossos, fígado, pulmões, cérebro, baço e pênis. Em crianças, as dores ósseas costumam ser confundidas com osteomielite aguda e a hipóxia cerebral pode levar a convulsões ou acidente vascular cerebral. Podem ocorrer crises aplásticas muitas vezes causadas por infecção das células eritroides pelo parvovírus B19. Além disso, em crianças com esplenomegalia pode ocorrer crise por sequestro, a qual pode ser convertida por transfusões.(23)
A hipóxia tecidual causada pela vasoclusão na doença falciforme desencadeia fenômenos inflamatórios que variam sua intensidade de acordo com o grau de necrose tecidual. A inflamação gerada promove a liberação de citocinas inflamatórias no local da lesão, promovendo a expressão de moléculas de adesão. Essas moléculas estimulam a quimiotaxia de leucócitos, que liberam peróxido de hidrogênio acentuando a lesão vascular.(24-26) A vasoclusão nesta doença é causada devido à interação que ocorre entre a hemácia falciforme e o endotélio vascular. Assim, quanto maior for essa interação, maior será a gravidade da doença,(27) e esta aderência é diretamente proporcional à densidade da célula. Após a adesão, as células endoteliais tornam-se ativadas(28) e, além de promover alterações no processo de coagulação, desencadeiam fenômenos inflamatórios com a mobilização de granulócitos e monócitos.(12) As células endoteliais também são responsáveis pela liberação de endotelina-1, que aumenta as concentrações plasmáticas de Molécula de Adesão Celular Vascular-1 (VCAM-1) e Molécula de Adesão Intercelular-1 (ICAM-1), e estimula a secreção de citocinas inflamatórias por monócitos.(29)
A ICAM-1 é uma glicoproteína transmembrana utilizada como um indicador da inflamação.(30) Sua expressão é evidente na superfície de células endoteliais,(31) e, em condições normais, essa molécula está presente em baixos níveis, tendo sua expressão estimulada drasticamente após a ativação das células endoteliais por fator de necrose tumoral-a (TNF-a), interleucina-1 (IL-1), interferon-g, endotoxina ou lipopolissacarídeos.(31-34) Quando expressas, as moléculas de adesão apresentam uma superfície adesiva que permite a ligação de leucócitos recrutados durante a resposta inflamatória.(35) Em estudo realizado por Solovey et al.,(36) maiores concentrações de sICAM-1 foram encontradas em pacientes com anemia falciforme quando em comparação a um grupo controle.
Deste modo, sICAM-1 parece estar envolvida nos processos de ativação endotelial e de vasoclusão, porém a existência destes estudos em crianças é pouco comum.(37) Apesar de ser uma molécula estrutural, ICAM-1 pode ser mensurada in vivo por meio de sua forma solúvel (sICAM-1).(38) Devido aos raros estudos relacionados à concentração de sICAM-1 em crianças com doença falciforme, este trabalho tem como objetivo a dosagem sérica dessa molécula nesses pacientes, tanto em crise clínica como na ausência de crise, de modo a comparar os valores obtidos com as dosagens encontradas em pacientes não portadores da doença.
MATERIAL E MÉTODOS
O presente estudo foi realizado buscando a comparação entre as dosagens de sICAM-1 em três populações: pacientes com doença falciforme sem crise clínica, pacientes com doença falciforme com crise clinica e pacientes sem doença falciforme (grupo controle). Todos constituídos por indivíduos de sexo feminino e masculino, com idade entre 0 e 21 anos.
Foram analisadas 45 amostras do soro de pacientes doentes, sendo 17 em crise e 28 sem crise, atendidos no serviço de hematologia pediátrica do Hospital de Clínicas da Universidade Federal do Paraná (UFPR), Curitiba, PR. Nesses grupos incluíram-se os genótipos SS, SC, SD e Sb. O material coletado para pesquisa já realizada anteriormente foi fornecido a este estudo. Simultaneamente, foram disponibilizados os prontuários com as demais informações desses pacientes. O projeto foi aprovado pelo Comitê de Ética em Pesquisa em Seres Humanos do Hospital de Clínicas da UFPR em 20 de maio de 2010.
O grupo controle foi constituído de 17 amostras fornecidas por um Laboratório de Análises Clínicas situado na cidade de Toledo, PR, após assinatura de Termo de Responsabilidade e Sigilo.
As amostras de sangue foram colhidas para realização de exames de rotina. O hemograma dos pacientes foi realizado pelo laboratório e os resultados fornecidos a este estudo.
A determinação das concentrações séricas de ICAM-1 foi realizada no laboratório de Hematologia da Pontifícia Universidade Católica do Paraná (PUCPR) campus Toledo, através da técnica de enzimaimunoensaio (Elisa), seguindo os critérios exigidos na bula do kit da InvitrogenTM e utilizando leitor de Elisa da marca Biotek (modelo ELX800) para leitura das absorbâncias. Foram excluídas as amostras visualmente hemolisadas ou lipêmicas.
As análises estatísticas foram realizadas por meio da Análise da Variância (Anova), com critérios de significância adotados para p < 0,05, seguido do teste de Tukey. Foi utilizado o Coeficiente de Correlação de Pearson para verificar a relação entre variáveis.
RESULTADOS
Os pacientes foram divididos em três grupos: controle, falciforme sem crise e falciforme com crise, os quais apresentaram as seguintes concentrações de sICAM-1: 262,9 ng/mL, 406,8 ng/ mL e 465,7 ng/ mL, respectivamente (p=0,0001). As análises demonstraram aumentos estatisticamente significativos de sICAM-1 em pacientes com doença falciforme, tanto em crise clínica como na ausência de crise, em relação ao grupo controle (Figura1).
Em relação à comparação das concentrações séricas de ICAM-1 com a variável leucócitos, essa molécula apresentou uma correlação positiva fraca quando comparados todos os pacientes (r=0,419) (Figura 2).
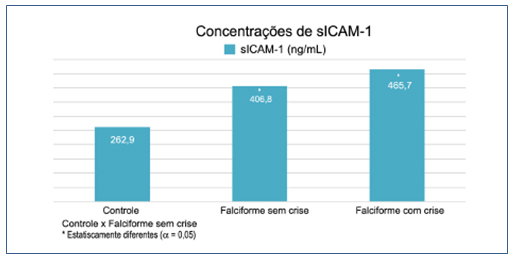 Figura 1. Concentrações de sICAM-1
Figura 1. Concentrações de sICAM-1
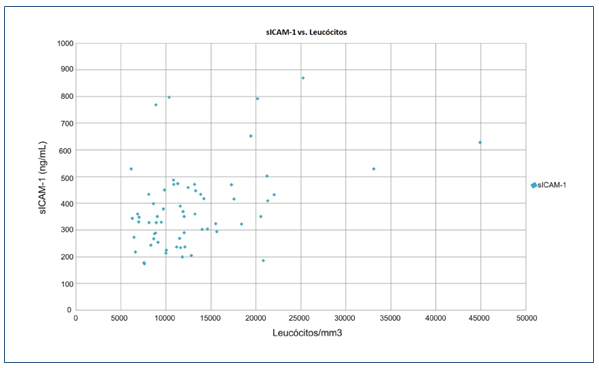
Figura 2. sICAM-1 vs Leucócitos
DISCUSSÃO
Os níveis séricos de ICAM-1 encontrados nos três grupos analisados apresentaram diferença estatisticamente significativa quando comparando o grupo controle àqueles representados pelos pacientes com doença falciforme, tanto estáveis como em crise clínica (Figura 1). No entanto, não houve diferença estatística considerável nos níveis de sICAM-1 na comparação entre os dois grupos com doença falciforme, sugerindo um estado de ativação endotelial em ambos os grupos de pacientes com doença falciforme,(35,39,40) pois as concentrações de sICAM-1 apresentaram-se aumentadas na maioria dos indivíduos.
De acordo com Vichinsky,(41) na anemia falciforme há um aumento na produção de moléculas de adesão ocasionado pela redução da biodisponibilidade de NO. Devido à hemólise que ocorre nesses pacientes, a hemoglobina é liberada no plasma onde degrada o NO promovendo a inibição da vasodilatação(42) e disfunção endotelial,(43) que acarreta aumento na produção de moléculas de adesão(41) contribuindo para o fenômeno vasoclusivo.(44) É provável que isso justifique os níveis elevados de sICAM-1 em pacientes com essa doença, mesmo na ausência de crise vasoclusiva. Apesar de nossos estudos demonstrarem um aumento nos níveis séricos de ICAM-1 em pacientes com doença falciforme, essa molécula não aumentou de forma considerável em pacientes em estado de crise vasoclusiva, possivelmente justificado pelo estado de inflamação crônica existente.(12)
Um estudo realizado em 2009 mostrou que indivíduos hipercolesterolêmicos apresentam maiores níveis de sICAM-1 e, como consequência, maior risco de lesão endotelial.(45) Glowinska et al.,(46) encontraram maiores níveis de sICAM-1 em crianças magras hipertensas. Assim como em nosso trabalho, Benkerrou et al.,(47) Blum et al.(40) e Kanavaki et al.(48) também verificaram níveis séricos de ICAM-1 relativamente maiores em pacientes com doença falciforme quando compararam a um grupo controle representado por indivíduos saudáveis, confirmando um grau de ativação endotelial importante em pacientes com essa doença, mesmo sem crise clínica. Isso provavelmente seja explicado pela adesão de eritrócitos ao endotélio vascular, a qual desencadeia fenômenos inflamatórios.(12)
Outra possível explicação para os níveis elevados de sICAM-1 nos indivíduos doentes é o aumento na produção de moléculas de adesão induzido por citocinas pró-inflamatórias, como TNF-a e interleucina-8 (IL-8), as quais têm sido descritas no plasma de pacientes com anemia falciforme sem crise. Essas alterações podem estar relacionadas ao aumento da expressão de moléculas de adesão no endotélio vascular.(49) Klimiuk et al.(50) afirmam que a produção de sICAM-1 é induzida por citocinas na disfunção endotelial, tendo seu envolvimento no processo inicial da inflamação. As citocinas também estão envolvidas no crescimento e na produção de leucócitos.(51) Assim, sugere-se que os mesmos fatores que aumentam a contagem de leucócitos também podem induzir um aumento nos níveis de sICAM-1.
Diferentemente de estudos já discutidos, Merísio(37) encontrou concentrações menores de sICAM-1 em pacientes em estado de crise vasoclusiva em comparação a pacientes estáveis quando dosou essa molécula em crianças com doença falciforme, sugerindo que possivelmente sICAM-1 apresente sua velocidade de depuração mais rápida na crise vasoclusiva.
Em relação à contagem de leucócitos, essas células demonstraram uma correlação positiva fraca com as concentrações de sICAM-1. Esse resultado indica que o aumento dessas células sanguíneas pode estar diretamente relacionado à elevação nos níveis séricos dessa molécula. Alguns autores afirmam que a leucocitose é considerada fator independente de risco para morte precoce em pacientes com doença falciforme na ausência de crise, além de estar associada a complicações dessa doença, como acidente vascular cerebral e priaprismo.(25,52) Também há indicadores que estabelecem uma correlação entre o grau de leucocitose e a morbidade nesses pacientes.(25,53) Isso provavelmente seja justificado pelo fato da anemia falciforme ser caracterizada pela ocorrência de um estado pró-inflamatório apresentando aumento na contagem de leucócitos.(54)
Ataga et al.(55) verificaram contagens elevadas de leucócitos em pacientes adultos com anemia falciforme sem crise comparando a um grupo controle representado por adultos saudáveis. Concordando com nossos resultados, Benkerrou et al.(47) encontraram maior contagem de leucócitos totais em seu estudo envolvendo crianças africanas com doença falciforme.
Em conclusão, verificou-se que há um aumento significativo nas concentrações séricas da molécula ICAM-1 em crianças com doença falciforme, a qual possivelmente esteja envolvida na ativação endotelial nesses pacientes, mesmo na ausência de crise vasoclusiva. No entanto, em estado de crise, as concentrações dessa molécula não apresentaram um aumento considerável em comparação com o grupo sem crise, sugerindo que sICAM-1 não pode ser considerada um marcador de crise clínica na doença falciforme.
Devido à correlação positiva apresentada com sICAM-1, um aumento na contagem de leucócitos pode também ser sugestivo de lesão endotelial. Entretanto, tornam-se necessários mais estudos em relação às dosagens dessa molécula em portadores de doença falciforme, inclusive em crianças, a fim de buscar melhorias na qualidade de vida desses pacientes.
Abstract
Objective: This study aimed to determine the serum levels of ICAM-1 in children with sickle cell disease with and without clinical crisis, compared with a healthy control group. Methods: Dosages of sICAM-1 were performed by enzyme immunoassay technique (ELISA). Results: The analyzes showed significant increases in sICAM-1 in patients with sickle cell disease in the controlled group, However, there were no statistical differences in the levels of this molecule among patients with the disease, although it has been shown to be elevated in most patients. sICAM-1 also showed a positive correlation with the leukocyte count, which allows to suggest that the increase in leukocytes is associated with endothelial injury in these patients. Conclusion: It is also suggested that sICAM-1 is involved in endothelial activation process vaso-occlusion and that most patients with sickle cell disease present endothelial injury without even being in clinical crisis.
Keywords
Sickle cell disease; Elisa; sICAM-1
REFERÊNCIAS
- Cançado RD, Jesus JA. A doença falciforme no Brasil. Rev. Bras. Hematol. Hemoter. 2007;29(3):203-6.
- Di Nuzzo DVP, Fonseca SF. Anemia falciforme e infecções. J Pediatr. 2004;80(5):347-54.
- Horiuchi K, Ballas SK, Asakura T. The effect of deoxygenation rate on the formation of irreversibly sickled cells. Blood. 1988 Jan;71(1):46-51.
- Bunn HF. Pathogenesis and treatment of sickle cell disease. N Engl J Med. 1997 Sep 11;337(11):762-9.
- Jenkins ME, Scott RB, Baird RL. Studies in sickle cell anemia. XVI. Sudden death during sickle cell anemia crises in young children. J Pediatr. 1960 Jan;56:30-8.
- Brasil. Ministério da Saúde. Secretaria de Políticas de Saúde. Manual de doenças mais importantes, por razões étnicas, na população brasileira afrodescendente. Brasília, 2001. p. 14-35. Disponível em: http://bvsms.saude.gov.br/bvs/publicacoes/doencas_etnicas.pdf.
- Watanabe AM. Prevalência da anemia falciforme no estado do Paraná. 2007. 122 p. Dissertação de Mestrado – Programa de Pós-Graduação em Medicina Interna. Setor de Ciências da Saúde da UFPR. Curitiba.
- Gonçalves MS, Bomfim GC, Maciel E, Cerqueira I, Lyra I, Zanette A, et al. BetaS-haplotypes in sickle cell anemia patients from Salvador, Bahia, Northeastern Brazil. Braz J Med Biol Res. 2003 Oct;36 (10):1283-8.
- Yoong WC, Tuck SM. Menstrual pattern in women with sickle cell anaemia and its association with sickling crises. J Obstet Gynaecol. 2002 Jul;22(4):399-401.
- Okpala I, Thomas V, Westerdale N, Jegede T, Raj K, Daley S, et al. The comprehensiveness care of sickle cell disease. Eur J Haematol. 2002 Mar;68(3):157-62.
- Alvares Filho F, Naoum PC, Moreira HW, Cruz R, Manzato AJ, Domingos CR. Age and racial geographic distribution of S hemoglobin in Brazil. Sangre (Barc). 1995 Apr;40(2):97-10. [Article in Spanish].
- Zago MA, Pinto ACS. Fisiopatologia das doenças falciformes: da mutação genética à insuficiência de múltiplos órgãos. Rev. Bras. Hematol. Hemoter. 2007; 29 (3):207-14.
- Rizzo R, Hviid TV, Govoni M, Padovan M, Rubini M, Melchiorri L, et al. HLA-G genotype and HLA-G expression in systemic lupus erythematosus: HLA-G as a putative susceptibility gene in systemic lupus erythematosus. Tissue Antigens. 2008 Jun;71(6):520-9.
- Powars DR, Chan L, Schroeder WA. The influence of fetal hemoglobin on the clinical expression of sickle cell anemia. Ann N Y Acad Sci. 1989;565:262-78.
- Naoum PC. Hemoglobinopatias e Talassemias. São Paulo, Editora Sarvier, 1997, 171p.
- Kato GJ, Gladwin MT, Steinberg MH. Deconstructing sickle cell disease: reappraisal of the role of hemolysis in the development of clinical subphenotypes. Blood Rev. 2007 Jan;21(1):37-47.
- Zago MA, Falcão RP, Pasquini R. Hematologia. Fundamentos e prática. São Paulo, Editora Atheneu, 2004, 1081p.
- 18 Gómez-Chiari M, Tusell Puigbert J, Ortega Aramburu J. Sickle cell anemia: experience in a center. An Pediatr (Barc). 2003 Feb;58(2):95-9. [Article in Spanish]
- Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Manual de diagnóstico e tratamento de doenças falciformes. ANVISA, Brasília, 2002. p. 13-50. Disponível em: http://bvsms.saude.gov.br/bvs/publicacoes/anvisa/diagnostico.pdf
- Richard RE, Siritanaratkul N, Jonlin E, Skarpidi E, Heimfeld S, Blau CA. Collection of blood stem cells from patients with sickle cell anemia. Blood Cells Mol Dis. 2005 Nov-Dec;35(3):384
- Steinberg MH, Brugnara C. Pathophysiological-based approaches to treatment of sickle cell disease. Annu Rev Med. 2003;54:89-112
- Braga JAP. Medidas gerais no tratamento das doenças falciformes. Rev Bras. Hematol. Hemoter. 2007;29(3):233-8.
- Ramzi C, Vinay K, Stanley RL. Patologia estrutural e funcional. 5ª ed. Rio de Janeiro, Guanabara Koogan, 1996, 455 p.
- Kaul DK, Hebbel RP. Hypoxia/reoxygenation causes inflammatory response in transgenic sickle mice but not in normal mice. J Clin Invest. 2000 Aug;106(3):411-20.
- Okpala I. The intriguing contribuition of white blood cells to sickle cell disease – a red cell disorder. Blood Rev. 2004 Mar;18(1):65-73.
- Redding-Lallinger R, Knoll C. Sickle cell disease-pathophysiology and treatment. Curr Probl Pediatr Adolesc Health Care. 2006 Nov-Dec;36(10):346-76
- Aslan M, Freeman BA. Redox-dependent impairment of vascular function in sickle cell disease. Free Radic Biol Med. 2007 Dec 1;43(11):1469-83.
- Yedgar S, Koshkaryev A, Barshtein G. The red blood cell in vascular occlusion. Pathophysiol Haemost Thromb. 2002 Sep-Dec;32(5-6):263-8.
- McIntyre TM, Prescott SM, Weyrich AS, Zimmerman GA. Cell-cell interactions: leucocyte-endothelial interactions. Curr Opin Hematol. 2003 Mar;10(2):150-8.
- Oh JH1, Park EJ, Park JW, Lee J, Lee SH, Kwon TK. A novel cyclin-dependent kinase inhibitor down-regulates tumor necrosis factor-alpha (TNF-alpha)-induced expression of cell adhesion molecules by inhibition of NF-kappaB activation in human pulmonary epithelial cells. Int. Immunopharmacol. 2010 May;10(5):572-9.
- Lawson C, Ainsworth M, Yacoub M, Rose M. Ligation of ICAM-1 on endothelial cells leads to expression of VCAM-1 via a nuclear factor-kappaB-independent mechanism. J. Immunol. 1999 Mar 1;162(5):2990-6.
- Davies MG, Hagen PO. The vascular endothelium. A new horizon. Ann Surg. 1993 Nov;218(5):593-609.
- Kaplanski G, Marin V, Fabrigoule M, Boulay V, Benoliel AM, Bongrand P, et al. Thrombin-activated human endothelial cells support monocyte adhesion in vitro following expression of intercellular adhesion molecule-1 (ICAM-1; CD54) and vascular cell adhesion molecule-1 (VCAM-1; CD106). Blood. 1998 Aug 15;92(4):1259-67.
- Kilbridge PM, Mayer JE, Newburger JW, Hickey PR, Walsh AZ, Neufeld EJ. Induction of intercellular adhesion molecule-1 and E-selectin mRNA in heart and skeletal muscle of pediatric patients undergoing cardiopulmonary bypass. J Thorac Cardiovasc Surg. 1994 May;107(5):1183-92.
- Kato GJ, Martyr S, Blackwelder WC, Nichols JS, Coles WA, Hunter LA, et al. Levels of soluble endothelium-derived adhesion molecules in patients with sickle cell disease are associated with pulmonary hypertension, organ dysfunction, and mortality. Br J Haematol. 2005 Sep;130(6):943-53.
- Solovey A, Lin Y, Browne P, Choong S, Wayner E, Hebbel RP. Circulating activated endothelial cells in sickle cell anemia. N Engl J Med. 1997 Nov 27; 337 (22):1584-90.
- Merisio PR. Avaliação de marcadores de lesão endotelial nas crises vasoclusivas das doenças falciformes. 2012. 77 p. Defesa de Dissertação de Mestrado – Centro de Ciências Biológicas e da Saúde. Pós-graduação em Ciências da Saúde. PUCPR. Curitiba.
- Libby P, Ridker PM, Maseri A. Inflammation and atherosclerosis. Circulation. 2002 Mar 5;105(9):1135-43.
- Conran N, Fattori A, Saad ST, Costa FF. Increased levels of soluble ICAM-1 in the plasma of sickle cell patients are reversed by hydroxyurea. Am J Hematol. 2004 Aug;76(4):343-7.
- Blum A, Yeganeh S, Peleg A, Vigder F, Kryuger K, Khatib A, et al. Endothelial function in patients with sickle cell anemia during and after sickle cell crises. J Thromb Thrombolysis. 2005 Apr;19(2):83-6.
- Vichinsky E. Novas terapias na doença falciforme. Lancet. 2002;360: 629-31.
- Rother RP, Bell L, Hillmen P, Gladwin MT. The clinical sequelae of intravascular hemolysis and extracellular plasma hemoglobin: a novel mechanism of human disease. JAMA. 2005 Apr 6;293(13):1653-62.
- Gladwin MT, Kato GJ. Cardiopulmonary complications of sickle cell disease: role of nitric oxide and hemolytic anemia. Hematology Am Soc Hematol Educ Program. 2005:51-7.
- Vilas-Boas W, Cerqueira BA, Zanette AM, Reis MG, Barral-Netto M, Goncalves MS. Arginase levels and their association with Th17-related cytokines, soluble adhesion molecules (sICAM-1 and sVCAM-1) and hemolysis markers among steady-state sickle cell anemia patients. Ann Hematol. 2010 Sep;89(9):877-82.
- Wu H, Gower RM, Wang H, Perrard XY, Ma R, Bullard DC, et al. Functional role of CD11c+ monocytes in atherogenesis associated with hypercholesterolemia. Circulation. 2009 May 26;119(20):2708-17.
- Glowinska B, Urban M, Peczynska J, Florys B. Soluble adhesion molecules (sICAM-1, sVCAM-1) and selectins (sE selectin, sP selectin, sL selectin) levels in children and adolescents with obesity, hypertension, and diabetes. Metabolism. 2005 Aug;54(8):1020-6.
- Benkerrou M, Delarche C, Brahimi L, Fay M, Vilmer E, Elion J, et al. Hydroxyurea corrects the dysregulated L-selectin expression and increased H(2)O(2) production of polymorphonuclear neutrophils from patients with sickle cell anemia. Blood. 2002 Apr 1;99(7):2297-303.
- Kanavaki I, Makrythanasis P, Lazaropoulou C, Kattamis A, Tzanetea R, Kalotychou V, et al. Adhesion molecules and high-sensitivity C-reactive protein levels in patients with sickle cell beta-thalassaemia. Eur J Clin Invest. 2012 Jan;42(1):27-33.
- Michaels LA, Ohene-Frempong K, Zhao H, Douglas SD. Serum levels of substance P are elevated in patients with sickle cell disease and increase further during vaso-occlusive crisis. Blood. 1998;92(9):3148-51.
- Klimiuk PA, Sierakowski S, Latosiewicz R, Cylwik JP, Cylwik B, Skowronski J, et al. Soluble adhesion molecules (ICAM-1, VCAM-1, and E-selectin) and vascular endhotelial growth factor (VEGF) in patients with distinct variants of rheumatoid synovitis. Ann Rheum Dis. 2002 Sep;61(9):804-9.
- Peakman M, Vergani D. [tradução Eliseanne Nopper, et al. Imunologia Básica e Clínica. 2ª ed. Rio de Janeiro, Elsevier, 2011.
- Nagel RL. Severity, pathobiology, epistatic effects, and genetic markers in sickle cell anemia. Semin Hematol. 1991 Jul;28(3):180-201.
- Quinn CT, Lee NJ, Shull EP, Ahmad N, Rogers ZR, Buchanan GR. Prediction of adverse outcomes in children with sickle cell anemia: a study of the Dallas Newborn Cohort. Blood. 2008 Jan 15;111(2):544-8.
- Casella Filho A, Araújo RG, Galvão TG, Chagas ACP. Inflamação e aterosclerose: integração de novas teorias e valorização dos novos marcadores. Rev Bras Cardiol Invas. 2003;11(3):14-9.
- Ataga KI, Moore CG, Hillery CA, Jones S, Whinna HC, Strayhorn D, et al. Coagulation activation and inflammation in sickle cell disease-associated pulmonary hypertension. Haematologica. 2008; 93(1):20-6.
Correspondência
Paulo Roberto Merisio
Avenida de União, 500 – Jardim Coopagro
85902-532 – Toledo, PR
