Comparação da atividade de antifúngicos imidazólicos e triazólicos frente a Candida albicans
Activity comparison of imidazole and triazole antifungals against Candida albicans
Issis Maria Nogueira de Castro1
Antônio Alexandre de Vasconcelos Júnior1
Francisco Afrânio Cunha2
Maria da Conceição dos Santos Oliveira Cunha3
Everardo Albuquerque Menezes4
1Farmacêutica. Universidade Federal do Ceará – UFC – Fortaleza, CE, Brasil.
2MsC. Universidade Federal do Ceará – UFC – Fortaleza, CE, Brasil.
3Bolsista/PIBIC – Universidade Federal do Ceará – UFC – Fortaleza, CE, Brasil.
4PhD, Professor Titular. Universidade Federal do Ceará – UFC – Fortaleza, CE, Brasil.
Instituição: Departamento de Análises Clínicas e toxicológicas do curso de Farmácia da Universidade Federal do Ceará – Fortaleza, CE, Brasil.
Suporte Financeiro: CNPq/FUNCAP
Artigo recebido em 16/09/2013
Artigo aprovado em 29/01/2016
Resumo
Objetivo: O objetivo deste estudo foi avaliar a ação antifúngica de imidazólicos (cetoconazol, clotrimazol e miconazol) e triazólicos (fluconazol, itraconazol e voriconazol) frente a C. albicans. Métodos: Foram utilizadas trinta cepas de C. albicans. Após isolamento, purificação, identificação presuntiva e confirmação da identificação das cepas, estas foram inoculados em placas plásticas estéreis com 96 orifícios contendo as soluções de antifúngicos. Resultados: Após 24 horas a 35°C foi observado visualmente a menor concentração de antifúngico, que causava uma redução de 50% (CIM50) e 90% (CIM90) no crescimento da C. albicans quando comparado com o crescimento sem antifúngico. O fluconazol apresentou a maior CIM50 e CIM90, voriconazol e itraconazol apresentaram as menores CIM50 e CIM90. Conclusão: O miconazol, clotrimazol e cetoconazol apresentaram uma atividade antifúngica importante. No entanto, o miconazol foi o que apresentou menor atividade do grupo dos imidazólicos.
Palavras-chave
Antifúngicos; Candida; Teste de susceptibilidade
INTRODUÇÃO
Infecções fúngicas invasivas continuam a ser uma causa de morbidade e mortalidade entre pacientes de alto risco. Na última década, a epidemiologia das micoses invasivas tem mudado e mostrando patógenos importantes que antes eram deixados de lado, dentre eles temos: Candida glabrata, Candida krusei, Aspergillus e Fusarium.(1)
O fungo mais isolado continua sendo Candida spp. que faz parte da microbiota humana e pode ocasionar uma série de doenças clínicas que dependem do local de desenvolvimento do fungo e do tipo de paciente envolvido. A mortalidade associada às infecções causadas por Candida spp. situa-se entre 30% e 40%.(2)
Dentro do gênero Candida, a levedura mais importante é a Candida albicans, visto que é um patógeno oportunista que pode causar infecções disseminadas em grupos de pacientes específicos, ou seja, pacientes com o HIV, os que utilizam corticosteroides, pacientes transplantados e pacientes com câncer. Essa levedura faz parte da nossa microbiota e, em algum momento, ela adquire a capacidade de causar doenças. Essa transição ainda não é bem compreendida, mas estudos apontam que a capacidade desse microrganismo em produzir fatores de virulência aliada ao sistema imune do hospedeiro não plenamente funcionante podem ser os fatores que auxiliam na instalação da condição patológica.(3,4)
Candídiase invasiva é um problema de saúde pública associada com elevada morbidade, mortalidade e custos. C. albicans é ainda a principal espécie envolvida, causando cerca de 50% a 70% dos casos. Em décadas passadas, esse percentual já foi maior, mas, no momento, outras espécies como C. glabrata, C. tropicalis, C. parapsilosis e C. krusei começam a emergir.(2,5,6)
Cerca de 50 anos atrás, somente estavam disponíveis os antifúngicos nistatina, griseofulvina e anfotericina B, sendo o último o único disponível para uso endovenoso. Um grupo de cientistas da Janssen começou a pesquisar e encontrou um composto imidazólico com atividade antifúngica. Na época, o mercado para antifúngicos era pequeno e não motivava a indústria farmacêutica, girando em torno de alguns milhões de dólares, no entanto, hoje, o mercado para essas drogas está avaliado em 3 a 5 bilhões de dólares.(7) Os principais antifúngicos azólicos comercializados no Brasil estão descritos na Tabela 1.

Os antifúngicos azólicos são divididos em dois subgrupos: os imidazólicos – drogas que apresentam toxicidade elevada, o que compromete a sua maior utilização. Os principais antifúngicos deste grupo são: cetoconazol, miconazol e clotrimazol. O outro subgrupo são os triazólicos – devido a seu espectro de atividade e excelente perfil de segurança, os antifúngicos triazólicos tornaram-se os mais utilizados no tratamento de IFIs. Os principais representantes desse grupo são: fluconazol, itraconazol e voriconazol.(8,9)
Médicos, quando confrontados com o dilema de qual o antifúngico escolher para tratar uma infecção fúngica, deverão sempre optar pelo teste de susceptibilidade como um indicador da terapia adequada. A redução de infecções causadas por C. albicans que ocorreu na década de 90 é um indicador do sucesso do uso do fluconazol, entretanto esse cenário começa a mudar com o surgimento de cepas resistentes ao fluconazol. A única maneira de se detectar a resistência é com a realização do teste de susceptibilidade.
O objetivo desse estudo foi avaliar a ação antifúngica de imidazólicos e triazólicos frente a Candida albicans.
MATERIAL E MÉTODOS
Foram utilizadas trinta cepas de Candida albicans pertencentes ao banco de leveduras do Laboratório de Microbiologia de Leveduras do Departamento de Análises Clínicas e Toxicológicas da Faculdade de Farmácia, Odontologia e Enfermagem da Universidade Federal do Ceará.
As cepas em estoque foram descongeladas e semeadas em agar batata dextrose e incubadas a 37°C por 24/48 horas. Após o crescimento foram inoculadas em agar Sabouraud dextrose e incubadas a 37°C por 24/48 horas, para garantir a pureza das cepas.(3,10,11)
A identificação presuntiva e a pureza das cepas foram realizadas em meio cromógeno e incubadas a 35°C por 24/48 horas. Esse meio cromógeno identifica as cepas de leveduras de acordo com a cor produzida; verde: C. albicans; azul: C. tropicalis; violeta claro: C. parapsilosis; e rosa: C. krusei. A confirmação das identificações foi realizada com o teste do microcultivo em agar arroz com tween 80, onde se observou a micromorfologia característica.(12)
Neste estudo foram avaliados os seguintes antifúngicos: imidazólicos: miconazol (MIC) (Mumbai – Índia), clotrimazol (CLO) (Mumbai – Índia) e cetoconazol (CET) (Mumbai – Índia); e os triazólicos: fluconazol (FLU), (Mumbai – Índia), itraconazol (ITR) (Mumbai – Índia) e voriconazol (VOR) (Sigma Pharma – Estados Unidos). Os agentes antifúngicos foram adquiridos em farmácia de manipulação, acompanhados dos devidos laudos técnicos. O FLU foi dissolvido em água destilada e os outros antifúngicos foram dissolvidos em dimetil sulfóxido (DMSO). Os intervalos dos antifúngicos utilizados foram: MIC, CLO, CET 16-0,03 mg/mL, FLU 64-0,12 mg/mL, ITR e VOR 4-0,0075 mg/mL.(13)
Ensaios de sensibilidade antifúngica foram realizados de acordo com os documentos M27-A3 padronizados pelo CLSI (Clinical and Laboratory Standards Institute). As soluções de antifúngicos foram diluídas em RPMI 1640 (INLAB – São Paulo) tamponado com ácido morfolino polissulfônico (MOPS) (Sigma Pharma – USA) e colocadas em placas plásticas estéreis com 96 orifícios e estocadas a -20°C até o momento do uso.(14,15)
As cepas de C. albicans foram diluídas em salina e rediluídas em RPMI para produzir um inóculo de 0,5-2,5 x 103 UFC/mL. Desse inóculo foram retirados 100 mL e inoculados nas placas com os antifúngicos. As placas foram colocadas a 35°C por 24 horas, e decorrido esse período foi observada visualmente a menor concentração de antifúngico, que causava uma redução de 50% e 90% no crescimento da C. albicans quando comparada com o crescimento sem antifúngico. A essa concentração chamamos de CIM50 e CIM90. Como controles foram utilizadas C. parapsilosis ATCC 22019 e C. krusei ATCC 6258.(14,15)
Na avaliação dos resultados utilizamos os pontos de corte disponíveis para os antifúngicos testados. O CLSI não disponibilizou ainda pontos de corte para todos os antifúngicos. Os que estão disponíveis são apenas para os triazólicos: fluconazol: S £ 8 µg/mL, S-DD 16-32 µg/mL, R ³ 64 µg/mL, itraconazol: S £ 0.12 µg/mL, S-DD 0.25-0.5 µg/mL, R ³ 1 µg/mL e voriconazol: S £ 1 µg/mL, S-DD 2 µg/mL, R ³ 4 µg/mL (CLSI, 2008a e CLSI, 2008b). Para o cetoconazol, clotrimazol e miconazol utilizamos os pontos de corte S £1 µg/mL, S-DD 2-4 µg/mL, R ³ 4 µg/mL.(16)
Análise Estatística
As CIMs obtidas para os Imidazólicos foram comparadas com as obtidas para os Triazólicos e avaliadas estatisticamente com o teste t de Student e um nível de significância de 5% foi utilizado. A análise estatística foi realizada pelo programa SPSS.
RESULTADOS E DISCUSSÃO
O século XXI é uma época excitante para a terapia antifúngica devido ao número de agentes terapêuticos disponíveis para o tratamento de doenças micóticas, como nunca visto na história da humanidade. Infelizmente, o número de infecções e o surgimento de novos agentes fúngicos também estão aumentando.(17)
Dentre as classes de antifúngicos disponíveis, temos os azólicos, os poliênicos e as cancidas. Destas três classes, as duas primeiras têm sido amplamente utilizadas na clínica, enquanto que na última os estudos clínicos ainda são muito recentes.(18)
O primeiro passo para a realização dos testes de sensibilidade é a rápida e correta identificação das cepas de Candida spp. Para isso, os meios cromógenos são ferramentas importantes. No nosso estudo, esses meios foram essenciais para purificação e identificação das cepas de C. albicans, sendo indispensável seu uso em laboratórios de análises clínicas.
Nas Figuras 1 e 2 podemos observar cepas de C. albicans em meio cromógeno. Cepas de C. albicans são verdes nesse meio. É possível observar a pureza das colônias isoladas.
 Figura 1 – Cepas de C. albicans em meio cromógeno (C. albicans marcadas com estrela).
Figura 1 – Cepas de C. albicans em meio cromógeno (C. albicans marcadas com estrela).

Figura 2 – Cepas de C. albicans em detalhes exibindo um pronunciado pigmento verde.
Os métodos utilizados no teste de sensibilidade são recentes e somente há cerca de dez anos vêm se popularizando. O teste de sensibilidade para azólicos avalia a capacidade desses antifúngicos em inibir 50% do crescimento fúngico quando comparado aos controles, pois esses fármacos são fungistáticos.
O teste de susceptibilidade é atualmente padronizado internacionalmente e está se tornando essencial no manejo de pacientes e vigilância da resistência fúngica. Embora o teste de susceptibilidade in vitro seja utilizado para adequar e escolher o antifúngico mais apropriado, sua verdadeira utilidade está no fato de que com este teste podemos identificar cepas resistentes e, principalmente, acompanhar a evolução da resistência fúngica ao longo do tempo. Podem ser analisadas as principais espécies envolvidas, a área geográfica e a droga com maior percentual de resistência entre outras variáveis.(19) O teste de susceptibilidade é trabalhoso e necessita de pessoal treinado para sua execução e interpretação, no entanto fornece resultados precisos quanto à CIM de cada droga testada. No nosso trabalho realizamos o teste com trinta cepas frente a seis drogas (Tabelas 1, 2 e Figuras 3,4).
O teste de susceptibilidade consome tempo e tem custos que são as principais desvantagens desse método, por isso nem todos os laboratórios de análises clínicas o realizam. Devido a isso, deixamos de conhecer a suscetibilidade das cepas fúngicas, e a utilização dos antifúngicos acaba sendo empírica ou simplesmente baseada na escolha do médico. O farmacêutico é um dos profissionais aptos a realizar e interpretar os resultados desses testes, podendo contribuir de forma importante no manejo de pacientes com infecção fúngica.
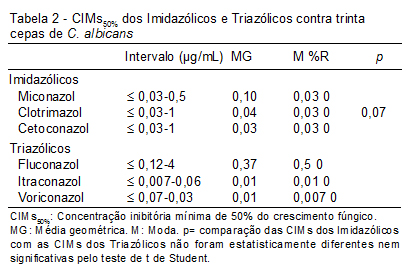
Na Tabela 2 e Figura 3 temos CIM50% dos Imidazólicos e Triazólicos. Como podemos observar, não ocorreu diferença significativa nos dois grupos de fármacos (p=0,07).
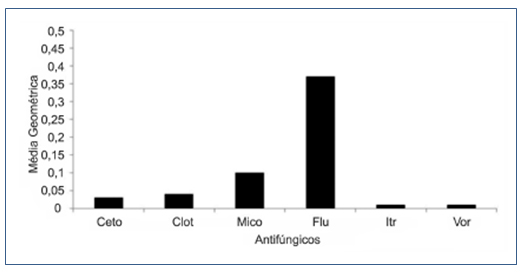 Figura 3. Média Geométrica da CIM50% de todos os antifúngicos testados
Figura 3. Média Geométrica da CIM50% de todos os antifúngicos testados
Podemos observar que o fluconazol apresentou a maior média geométrica. A sensibilidade de 351 espécies de Candida isoladas na Espanha, obtidas de janeiro de 2002 a dezembro de 2003 foi determinada. Das cepas, 51% foram C. albicans, 23% C. parapsilosis, 10% C. tropicalis, 9% C. glabrata, 4% C. krusei. Foi determinado o MIC para seis agentes antifúngicos pelo método de microdiluição e 6,8% das cepas mostraram uma sensibilidade reduzida ao fluconazol.(20) Redução da sensibilidade ao fluconazol também foi encontrada no nosso estudo (Figura 3). Inúmeras causas podem explicar estes achados no Ceará, no entanto, a mais evidente é o uso indiscriminado do fluconazol como profilático.
Além da atividade 50% também mensuramos a atividade 90%, ou seja, a concentração do antifúngico capaz de inibir 90% do crescimento fúngico; esses resultados são mostrados na Tabela 3 e Figura 4. As CIMs90% para Imidazólicos e Triazólicos não foram estatisticamente significativas (p=0,12).
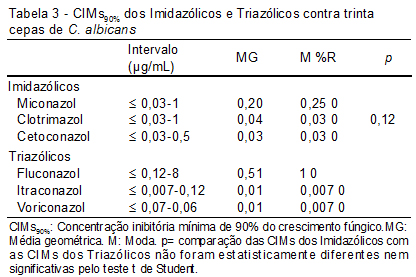
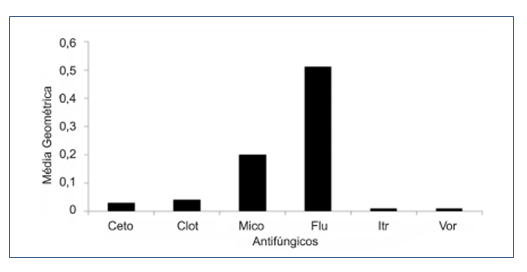 Figura 4 – Média Geométrica da CIM90% de todos os antifúngicos testados
Figura 4 – Média Geométrica da CIM90% de todos os antifúngicos testados
Nas Tabelas 2 e 3 observamos que as maiores Médias Geométricas (MG) e a Moda (M) foram para o fluconazol. A MG representa os valores obtidos pelas CIMs, essa variável estatística é mais confiável que a média aritmética, pois a MG não é afetada por valores extremos. No caso da Moda, esse valor reflete a CIM que mais se repetiu dentro do intervalo testado. Essas duas variáveis dão uma visão geral do comportamento dos antifúngicos testados.
A experiência clínica com o fluconazol no estado do Ceará é ampla. Essa droga vem sendo usada há mais de uma década,(12) no entanto a experiência clínica com o voriconazol é limitada ou desconhecida no nosso estado. Portanto, no estado do Ceará, a utilização do voriconazol como alternativa para fracassos terapêuticos frente ao fluconazol pode ser de grande importância para os quadros de resistência.
Rautemaa et al.,(21) avaliaram a sensibilidade de 43 cepas de C. albicans, com decréscimo de sensibilidade ao fluconazol, sendo que todas foram sensíveis ao voriconazol, o que comprova que a resistência cruzada não é um achado confirmado para triazólicos. No nosso estudo, as cepas apresentaram CIMs elevados para o fluconazol, no entanto continuaram com CIMs baixas para o voriconazol (Tabelas 2 e 3).
A ao voriconazol foi avaliada com 7.191 cepas de Candida spp. de 78 centros médicos entre 2004 a 2007, sendo esta droga muito ativa in vitro com CIM50/CIMC90, 0,008/0,25 mg/mL e 98% de sensibilidade.(22) No nosso trabalho encontramos para o voriconazol CIM50/CIMC90, 0,007/0,007 mg/mL e 100% de sensibilidade (Tabelas 2 e 3). Esse achado mostra que as nossas C. albicans são muito sensíveis a esse novo antifúngico triazólico.
Um trabalho multicêntrico avaliou a sensibilidade de 7.725 cepas de C. albicans ao fluconazol e voriconazol; nesse trabalho, 73% das cepas apresentaram CIM de 0,007mg/mL para o voriconazol e 84% mostraram CIM de até 0,5mg/mL para o fluconazol.(23) Nossos resultados evidenciaram que 97% das cepas testadas tiveram CIM de 0,007 mg/mL para o voriconazol; esse percentual mais elevado de sensibilidade pode ser explicado pela recente introdução desse fármaco no Ceará. Para o fluconazol, os resultados foram dispersos e a comparação foi difícil de ser realizada.
Um estudo avaliou a sensibilidade de 3.895 cepas de C. albicans ao itraconazol. Nesse estudo, 99% das cepas apresentaram CIM de 4 mg/mL e 46% CIM de 0,03 mg/mL para o itraconazol.(24) Nesse mesmo estudo, 86% das cepas de C. albicans, C. parapsilosis, C. tropicalis e C. krusei resistentes ao fluconazol foram inibidas por uma concentração £1 mg/mL de itraconazol.(23) No nosso estudo, 96% das cepas testadas tiveram CIM £1mg/mL para o itraconazol.
Estudos com o clotrimazol são raros, pois esta droga está presente no mercado brasileiro há cerca de 40 anos e somente é utilizado na forma de creme vaginal e pomadas. Em um estudo com cem cepas de Candida spp. provenientes de isolados vaginais, essa droga provou ser a mais ativa com 70% de eficácia, sendo superior à nistatina (63,5%) e ao fluconazol (36,2%).(25) No nosso estudo, o clotrimazol se mostrou muito ativo frente às C. albicans. Dos antifúngicos imidazólicos testados, o clotrimazol foi o mais efetivo com os valores mais baixo de CIM, como pode ser observado nas Figuras 3 e 4. Essa sensibilidade ao clotrimazol não pode ser explicada tão facilmente, pois é antifúngico que já se encontra no mercado farmacêutico há bastante tempo e, mesmo assim, não mostra sinais importantes de resistência.
Em um trabalho realizado com 593 cepas de Candida spp., das quais 420 eram C. albicans, os quatro imidazólicos testados (econazol, clotrimazol, miconazol e cetoconazol) foram ativos de 94,3% a 98,5% com CIM <1 µg/mL.(16) Nossos resultados foram semelhantes, testamos a atividade dos imidazólicos miconazol, cetoconazol e clotrimazol, os quais foram efetivos com 100% das cepas testadas e a CIM £1,0 µg/mL.
Apesar da ampla utilização do miconazol e cetoconazol, a resistência a estas drogas mantém-se baixa. No entanto, onde longos sistemas profiláticos e tratamentos têm sido utilizados, a aquisição de resistência microbiológica e clínica predominantemente para o cetoconazol tem sido um problema clínico.(26)
Siikala et al.,(26) analisaram a susceptibilidade de 43 cepas de C. albicans com sensibilidade variável ao fluconazol. Os testes foram realizados de acordo com os protocolos do CLSI e o ponto de corte para miconazol e cetoconazol foi CIM £ 1 µg/mL. Um total de 16% de todos os isolados tinha a susceptibilidade ao miconazol diminuída (CIM ³ 2 µg/mL). Nossos resultados não apontaram cepas resistentes aos antifúngicos testados, o que observamos foi uma diminuição na sensibilidade ao fluconazol e ao miconazol, como pode ser visto nas Figuras 3 e 4. Essa diminuição deve- se à larga utilização desses dois fármacos. A resistência fúngica, assim como a resistência bacteriana, é uma tragédia em curso. A indústria farmacêutica não consegue produzir antifúngicos na mesma velocidade em que eles são destruídos, e em um cenário futurista bastante negativo talvez o fluconazol não apresente mais atividade daqui a 20 anos, e infecções fúngicas que comprometem a vida deixarão de ser tratadas.
Uma das alternativas para minimizar ou retardar a resistência fúngica seria resgatar antigos antifúngicos, como o clotrimazol, que no nosso estudo mostrou uma excelente atividade com CIMs muita baixas (Tabelas 2 e 3 ). Nossos resultados coincidem com os encontrados na literatura médica.(27)
Clotrimazol é um antifúngico imidazólico que está disponível no mercado há cerca de 40 anos, no entanto, devido a problemas de toxicidade e farmacotécnicos não teve uma utilização mais ampla.(28-30)
O cetoconazol é um antifúngico imidazólico com excelente atividade antifúngica, como pode ser observado nos nossos resultados; no entanto, sua toxicidade é elevada e compromete sua utilização mais abrangente.(31)
Finalizando os imidazólicos, temos o miconazol, que é a base de muitas preparações farmacêuticas para o tratamento de candídiase vaginal. Uma droga com mecanismo de ação ainda não totalmente compreendido, mas que devido ao uso abusivo vêm sendo documentados casos de resistência. No nosso estudo, com um número pequeno de cepas, apenas trinta, observamos esse fenômeno.
O que podemos observar nesse trabalho é que os imidazólicos não apresentaram diferenças significativas na ação contra cepas de C. albicans, quando comparados aos antifúngicos triazólicos. Outros estudos com um número maior de cepas devem ser realizados para verificar se esse fenômeno se repete e como está evoluindo a resistência no estado do Ceará.
CONCLUSÕES
Cepas de C. albicans apresentaram sensibilidade aos antifúngicos imidazólicos: cetoconazol, clotrimazol e miconazol.
Cepas de C. albicans apresentaram sensibilidade aos antifúngicos triazólicos: fluconazol, itraconazol e voriconazol.
Não foram encontradas diferenças significativas entre as atividades dos imidazólicos e triazólicos frente a C. albicans, quando testados pelo método de microdiluição em caldo RPMI.
As CIMs do miconazol e do fluconazol foram mais elevadas do que dos outros antifúngicos. A CIMs do itraconazol e do voriconazol foram as mais baixas de todos os antifúngicos testados.
Abstract
Objective: The objective of this study was to evaluate the antifungal effect of imidazoles (ketoconazole, clotrimazole and miconazole) and triazoles (fluconazole, itraconazole and voriconazole) against C. albicans. Methods: We used 30 strains of C. albicans. After isolation, purification, identification of strains, they were inoculated in sterile plastic plates with 96 well containing the antifungal solutions. Results: After 24 hours at 35°C was observed visually the lowest concentration of antifungal that caused a 50% (MIC50) and 90% (MIC90) on growth of C. albicans compared to growth without antifungal agent. Fluconazole showed the greatest MIC50 and MIC90, voriconazole and itraconazole had the lowest MIC50 and MIC90. Conclusion: The miconazole, clotrimazole and ketoconazole showed an important antifungal activity. However, miconazole showed the lowest activity group of the imidazole.
Keywords
Antifungals; Candida; Susceptiblility Test
REFERÊNCIAS
- Lewis RE. Importance of pharmacokinetic considerations for selecting therapy in the treatment of invasive fungal infections. Am J Ther. 2012 Jan;19(1):51-63
- Arendrup MC. Epidemiology of invasive candidiasis. Curr Opin Crit Care. 2010 Oct;16(5):445-5.
- Menezes, EA. Cunha, MCSO, Cunha, FA. Identificação preliminar de algumas espécies do gênero Candida spp em meio cromógeno: resultados de dois anos de um estudo multicêntrico realizado no Ceará. Rev. Patol. Trop. 2011;40: 297-303.
- 4. Menezes EA, Marinho JA, Angelo MR, Cunha Mda C, Cunha FA, Vasconcelos Júnior AA. Isolation and antifungal susceptibility testing of Trichosporon assahii in Ceará, Brazil. Rev Inst Med Trop Sao Paulo. 2012 Jan-Feb;54(1):1-3.
- Kett DH, Azoulay E, Echeverria PM, Vincent JL; Extended Prevalence of Infection in ICU Study (EPIC II) Group of Investigators. Candida bloodstream infections in intensive care units: analysis of the extended prevalence of infection in a intensive care unit study. Crit Care Med. 2011 Apr;39(4):665-70
- Sampaio Camargo TZ, Marra AR, Silva CV, Cardoso MF, Martino MD, Camargo LF, et al. Secular trends of candidemia in a tertiary care hospital. Am J Infect Control. 2010 Sep;38(7):546-51.
- Heeres J. Meerpoel L. Lewi P. Conazoles. Molecules. 2010 Jun 9;15 (6): 4129-88.
- Arnold TM, Dotson E, Sarosi GA, Hage CA. Traditional and emerging antifungal therapies. Proc Am Thorac Soc. 2010 May; 7(3):222-8.
- de Vasconcelos AA Jr1, Menezes EA, Cunha FA. Chromogenic medium for direct susceptibility testing of Candida spp. Isolated from urine. Mycopathologia. 2011 Aug;172(2):125-30.
- Cunha, FA. Menezes, EA. Mendes, LG. Resistência a antifúngicos de Candida tropicalis isoladas no Estado do Ceará. Rev Soc Bras Med Trop. 2009; 2: 354-55.
- Gomes CL, Cavalcante JE, Cunha FA, Amorim LN, Menezes EA. Identificação e perfil de sensibilidade de Candida spp isoladas de urina de pacientes com Candidúria em Iguatu – Ceará. RBAC. 2010;42:223-6.
- Menezes EA, Mendes LG, Cunha FA. Antifungal resistance of Candida tropicalis isolated in the State of Ceará. Rev Soc Bras Med Trop. 2009 May-Jun;42(3):354-5. [Article in Portuguese]
- Espinel-Ingroff A. Cantón E. Antifungal susceptibility testing of yeasts. in: antimicrobial susceptibility testing protocols. In: Schwalbe R, Steele-Moore L, Goodwin AC (Eds.) Antimicrobial susceptibility testing protocols. Boca Raton, Flórida: CRC Press, 2007. Cap. 9, p. 173-208.
- Clinical and Laboratory Standards Institute. Reference method for broth dilution antifungal susceptibility testing of yeasts: informational supplement, M27-A3. Clinical and Laboratory Standards Institute, Wayne, PA. 2008a.
- Clinical And Laboratory Standards Institute. Reference method for broth dilution antifungal susceptibility testing of yeasts: informational supplement, M27-S3. Clinical and Laboratory Standards Institute, Wayne, PA. 2008b.
- Richter SS, Galask RP, Messer SA, Hollis RJ, Diekema DJ, Pfaller MA. Antifungal susceptibilities of Candida species causing vulvovaginitis and epidemiology of recurrent cases. J Clin Microbiol. 2005 May;43(5):2155-62.
- Arthington-Skaggs BA, Rex JH. Resistance to antifungal agents. In: Fong IW, Drlica K (Editors). Antimicrobial Resistance and Implications for the Twenty-First Century. Springer. Chapter 10, p.325-369, 2008.
- Hope WW, Smith PB, Arrieta A, Buell DN, Roy M, Kaibara A, et al. Population pharmacokinetics of micafungin in neonates and young infants. Antimicrob Agents Chemother. 2010 Jun;54(6): 2633-7.
- Pfaller MA. Antifungal drug resistance: mechanisms, epidemiology, and consequences for treatment. Am J Med. 2012 Jan;125(1 Suppl): S3-13.
- Cuenca-Estrella M1, Rodriguez D, Almirante B, Morgan J, Planes AM, Almela M, et al; Barcelona Candidemia Project Study Group. In vitro susceptibilities of bloodstream isolates of Candida species to six antifungal agents: results from a population-based active surveillance programme, Barcelona, Spain, 2002-2003. J Antimicrob Chemother. 2005 Feb;55(2):194-9.
- Rautemaa R, Richardson M, Pfaller MA, Perheentupa J, Saxén H. Activity of amphotericin B, anidulafungin, caspofungin, micafungin, posaconazole, and voriconazole against Candida albicans with decreased susceptibility to fluconazole from APECED patients on long-term azole treatment of chronic mucocutaneous candidiasis. Diagn Microbiol Infect Dis. 2008 Oct;62(2):182-5.
- Diekema DJ, Messer SA, Hollis RJ, Boyken L, Tendolkar S, Kroeger J, et al. A global evaluation of voriconazole activity tested against recent clinical isolates of Candida spp. Diagn Microbiol Infect Dis. 2009 Feb;63(2):233-6.
- Pfaller MA, Messer SA, Boyken L, Rice C, Tendolkar S, Hollis RJ, et al. Use of fluconazole as a surrogate marker to predict susceptibility and resistance to voriconazole among 13,338 clinical isolates of candida spp. tested by clinical and laboratory standards institute-recommended broth microdilution methods. J Clin Microbiol. 2007 Jan;45(1):70-5.
- Pfaller, Ma. Boyken, L. Hollis, Rj. Messer, Sa. Tendolkar, S. Diekema, DJ. In vitro susceptibilities of clinical isolates of Candida species Cryptococcus neoformans, and Aspergillus species to itraconazole: global survey of 9,359 isolates tested by Clinical and Laboratory Standards Institute broth microdilution methods. J Clin Microbiol. 2005;(43):3807-10.
- Khan F, Baqai R. In vitro antifungal sensitivity of fluconazole, clotrimazole and nystatin against vaginal candidiasis in females of childbearing age. J Ayub Med Coll Abbottabad. 2010 Oct-Dec; 22(4):197-20.
- Siikala E, Richardson M, Pfaller MA, Diekema DJ, Messer SA, Perheentupa J, et al. Candida albicans isolates from APECED patients show decreased susceptibility to miconazole. Int J Antimicrob Agents. 2009 Dec;34(6):607-9.
- Isham N, Ghannoum MA. Antifungal activity of miconazole against recent Candida strains. Mycoses. 2010 Sep;53(5):434-7.
- Coelho RG, Calaça Ide C, Celestrini Dde M, Correia AH, Costa MA, Sola-Penna M. Clotrimazole disrupts glycolysis in human breast cancer without affecting non-tumoral tissues. Mol Genet Metab. 2011 Aug;103(4):394-8.
- Furtado CM, Marcondes MC, Sola-Penna M, de Souza ML, Zancan P. Clotrimazole preferentially inhibits human breast cancer cell proliferation, viability and glycolysis. PLoS One. 2012;7(2):e30462.
- Marcondes MC, Sola-Penna M, Zancan P. Clotrimazole potentiates the inhibitory effects of ATP on the key glycolytic enzyme 6-phosphofructo-1-kinase. Arch Biochem Biophys. 2010 May;497(1-2):62-7.
- Lat A, Thompson GR 3rd. Update on the optimal use of voriconazole for invasive fungal infections. Infect Drug Resist. 2011;4:43-53.
Correspondência
Everardo Albuquerque Menezes
Rua Capitão Francisco Pedro, 1210 – Rodolfo Teófilo
60430-370 – Fortaleza, CE
