Estabilidade de antígenos eritrocitários humanos para controle interno da qualidade imunohematológica
Stability of human erythrocyte antigens for immunohematological Internal Quality Control
Bruna Sutter1
Marcella Pereira Paulo2
Cristine Valença Bordini3
Daiane Cobianchi da Costa4
Alexandre Geraldo5
1Biomédica. Universidade do Vale do Itajaí – Univali – Itajaí – SC, Brasil.
2Graduanda em Biomedicina – Universidade do Vale do Itajaí – Univali – Itajaí – SC, Brasil.
3Farmacêutica. Mestrado em Ciências Farmacêuticas pela Universidade do Vale do Itajaí. Universidade do Vale do Itajaí – Univali
Itajaí – SC, Brasil.
4Biomedicina – Universidade de Marília, Doutorado em Farmácia pela Universidade Federal de Santa Catarina – Florianópolis – SC, Brasil.
5Farmacêutico Bioquímico. Mestrado em Farmácia Análises Clínicas pela Universidade Federal de Santa Catarina – Florianópolis – SC, Brasil.
Instituição: Universidade do Vale do Itajaí – Univali – Itajaí – SC, Brasil.
Artigo recebido em 12/08/2016
Artigo aprovado em 02/05/2017
DOI: 10.21877/2448-3877.201700527
Resumo
Objetivo: Determinar a estabilidade dos antígenos eritrocitários do Sistema ABO, Rh e Ag Kell, a fim de estabelecer a temporalidade de armazenamento de amostras in natura e sem conservantes para uso no Controle Interno de Qualidade (CIQ) dos testes imunohematológicos. Métodos: Foram coletadas 20 amostras contendo EDTA e realizada a detecção dos antígenos A, B, RhD, RhC, RhE, Rhe, Rhc, Kell (K1) através do uso de anticorpos monoclonais. Os testes de hemólise através da inspeção visual da suspensão de eritrócitos foram executados no primeiro dia de coleta. Os mesmos testes foram repetidos após os 5º, 13º, 15º, 21º, 37º, 50º e 77º dia da coleta, sendo observados a intensidade de hemaglutinação e o grau de hemólise. Resultados: Dentre as 18 amostras, 55,6% foram classificadas como A RhD Positiva, 5,6% AB RhD Positiva, 38,8% O RhD Positiva e nenhuma do grupo B RhD Positiva, tendo sido duas amostras excluídas do estudo por não apresentarem o Ag RhD. Detectaram-se 61% de Ag RhC nas amostras estudadas, 77,7% de Rhc, 38,8% de RhE, 88,9% de Rhe e 11,1% de Kell. No 77º dia foi observada uma maior diminuição na intensidade da hemaglutinação para os antígenos Rhe, RhC e RhD, respectivamente, não sendo observada esta diminuição para os demais antígenos detectados. A partir do 37º dia de coleta foi observada hemólise em todas as amostras coletadas. Conclusão: Amostras in natura com EDTA por até 21 dias após a coleta não tiveram diminuição na intensidade da hemaglutinação e hemólise representativa. São necessários demais estudos de estabilidade para outros antígenos eritrocitários.
Palavras-chave
Eritrócitos; Controle da Qualidade; Reatividade-Estabilidade; Antígenos de Grupos Sanguíneos
INTRODUção
Os sistemas de grupos sanguíneos são caracterizados pela presença ou ausência de antígenos na membrana eritrocitária. Esses antígenos são herdados geneticamente e definidos por sequências específicas de aminoácidos, constituindo proteínas que podem ou não estar ligadas a carboidratos ou a lipídios.(1-3)
De acordo com a nomenclatura da Sociedade Internacional de Transfusão Sanguínea (ISBT), estão descritos mais de 328 antígenos eritrocitários, distribuídos em 36 sistemas de grupos sanguíneos. Esses números não são estáticos e novos antígenos de grupos sanguíneos estão sendo identificados periodicamente.(4,5)
Dentre os sistemas já descritos é possível destacar o sistema ABO, Rh e Kell como os de grande importância clínica e estes serão brevemente explanados a seguir. O Sistema ABO, cujos antígenos não estão restritos apenas à membrana dos eritrócitos, são moléculas complexas presentes também em glicolipídios e glicoproteínas membranares.(1,2) A expressão dos antígenos do Sistema ABO depende da atividade de glicosiltransferases específicas codificadas pelo gene ABO.(4)
O Sistema de grupo sanguíneo Rh é o mais polimórfico, composto por 54 antígenos de natureza glicoproteica com importante papel na integridade da membrana eritrocitária, possuindo função estrutural e de transporte de gases.(3,6)
Dentre esses, apenas cinco antígenos possuem importância clínica pelo fato de estarem envolvidos com formas clinicamente significantes da Doença Hemolítica do Feto e Recém-nascido e reação transfusional (RhD, RhC, RhE, Rhc, Rhe), sendo o antígeno RhD o mais importante, devido ao seu alto grau de imunogenicidade.(4,7)
O Sistema Kell é composto por antígenos glicoproteícos com função enzimática e estão expressos nos eritrócitos com baixa densidade antigênica. Estes estão expressos na glicoproteína Kell, que pertence à subfamília das endopeptidases zincodependentes, cuja principal função é a ativação de peptídeos bioativos por clivagem enzimática; estes antígenos estão bem desenvolvidos ao nascimento e estão presentes no cérebro, órgãos linfoides, coração e músculos esqueléticos.(2-4) Com a instituição rotineira do pré-natal e prevenção de aloimunização em gestantes RhD negativas, tem-se observado um aumento da frequência de casos de DHFRN por anti-K1.(2)
Os aloanticorpos contra antígenos dos demais sistemas de grupos sanguíneos, além do ABO são produzidos em resposta a uma sensibilização que pode ser em uma transfusão, aborto ou gravidez, devido à exposição do indivíduo a um antígeno eritrocitário diferente dos seus. Esses são capazes de desenvolver reações hemolíticas como na incompatibilidade transfusional, incompatibilidade materno-fetal, e anemia hemolítica autoimune.(2,8)
O uso de amostras controle no Controle de Qualidade Interno (CQI) contendo antígenos ABO, RhD, RhC, RhE, Rhc, Rhe e K (Kell (K1) se faz necessário no laboratório de análises clínicas de acordo com o que é preconizado pela legislação vigente (RDC 302 de 15 de Outubro de 2005), com o objetivo de avaliar a estabilidade dos reagentes imunohematológicos.(9)
A obtenção de amostras controle é relevante para a validação de técnicas como também para verificar a reprodutibilidade dos resultados liberados. O emprego de amostras controle, bem como de outras medidas de CQI e externo em Laboratórios de Análises Clínicas é pertinente para avaliar constantemente a variabilidade das determinações e a confiabilidade dos resultados. Tais fatores contribuem para um diagnóstico mais preciso e eficiente, bem como para uma melhoria na qualidade dos produtos e serviços oferecidos pelos laboratórios clínicos.(10-13)
Os eritrócitos produzidos comercialmente para emprego nos testes imunohematológicos têm validade de até 35 dias. Essas suspensões de eritrócitos fenotipados são produzidas a partir de amostras de sangue humano,(14) que durante a conservação dos eritrócitos podem sofrer as chamadas lesões de estoque. Essas lesões são alterações bioquímicas que ocorrem no eritrócito, tais como deformidade na membrana, alterações no metabolismo e hemólise, que podem levar a modificações no resultado dos exames e gerar resultados falsos negativos.(12,15,16) Nesse sentido, o aperfeiçoamento de técnicas de avaliação da estabilidade de eritrócitos que sejam efetivas e que possam manter sua viabilidade e função representa uma necessidade na área da imunohematologia, a fim de possibilitar a realização de exames laboratoriais e controle de qualidade, fornecendo subsídios para diagnóstico e prevenção.(12)
A obtenção de suspensões de eritrócitos estáveis que mantenham todas as suas características físico-químicas e morfológicas pode proporcionar melhorias na qualidade de serviços de imunohematologia, visto que essas mantêm o Potencial Zeta ideal para proporcionar a hemaglutinação nos testes imunohematológicos.(2,12) Portanto, o estudo da estabilidade de antígenos eritrocitários em amostras utilizadas no CQI se faz necessário para melhorar a qualidade dos produtos oferecidos pelos laboratórios de análises clínicas, de forma que os serviços prestados possam ser precisos e confiáveis. Sendo assim, o presente estudo teve como objetivo avaliar a estabilidade dos principais antígenos eritrocitários do Sistema ABO (A e B), do Sistema Rh (RhD, RhC, Rhc, RhE, Rhe) e Kell (K) para o uso destas amostras sem o uso de conservantes eritrocitários no CQI dos exames laboratoriais imunohematológicos.
Material e Métodos
Após a aprovação do projeto pelo Comitê de Ética em Pesquisa da Universidade do Vale do Itajaí (UNIVALI) sob parecer 1.259.259 e a assinatura do Termo de Consentimento Livre e Esclarecido pelos pacientes do Laboratório Escola de Análises Clínicas (LEAC), foram coletadas aleatoriamente as vinte amostras de indivíduos de ambos os sexos com volume de 4 mL de sangue venoso anticoagulado com EDTA, sem uso de conservantes preservadores de eritrócitos.
Foram incluídas no estudo amostras de indivíduos com idade entre 18 e 65 anos e excluídas amostras de indivíduos portadores do fenótipo RhD Negativo e TAD Positivo, sendo que, para esse teste, foram utilizados antiglobulinas humanas e reagentes de hemácias da Bio-Rad Laboratories®.
Após a coleta das amostras, estas foram avaliadas através da inspeção visual de hemólise e detecção dos antígenos eritrocitários pela fenotipagem eritrocitária utilizando anticorpos monoclonais (Fresenius Kabi®) para os antígenos A, B, RhC, RhE, Rhe, Rhc, K e para a fenotipagem RhD o uso de anticorpos monoclonais (Bio-Rad Laboratories®) no primeiro dia de coleta e nos dias 5, 13, 15, 21, 37, 50 e 77 posteriores à coleta.
As amostras coletadas foram armazenadas in natura, sem adição de conservantes, visando a diminuição de custos para o CQI e avaliação da estabilidade destes antígenos. As amostras foram armazenadas no refrigerador do Laboratório Escola de Análises Clínicas (LEAC) da Univali e, durante seu armazenamento, foi monitorada à temperatura de 4º a 6°C visando preservar as amostras em temperaturas adequadas conforme legislação vigente.(17)
Os testes executados de forma singular (e não em duplicata) foram realizados em temperatura ambiente (20º a 24°C) no 1º, 5º, 13º, 15º, 21º, 37º, 50º e 77º dia. Os testes foram executados, sendo a leitura dos resultados realizada imediatamente conforme instruções dos fabricantes.
Para a realização dos testes imunohematológicos não foi realizada em paralelo amostra controle comercial para a validação dos experimentos, visto que, conforme a literatura, há subgrupos sanguíneos que podem diminuir significativamente a expressão antigênica dos antígenos eritrocitários.(1,2) Visto assim, em amostras controle (no qual possuem conservantes estabilizadores de eritrócitos) estas não mimetizam a amostra coletada originalmente neste experimento (in natura). Desta forma, não foi necessário realizar testes em duplicatas, visto que este estudo teve como objetivo avaliar a estabilidade das amostras de acordo com o grau de hemaglutinação preconizado por testes qualitativos padronizados com uso de equipamentos, materiais e insumos validados seguindo os critérios mínimos de intensidade da Portaria Ministerial 158 de 2016 e artigo científico.(17)
As intensidades mínimas da hemaglutinação esperadas para os antígenos A, B e RhD foram de no mínimo 3+, conforme descrito na literatura.(17) Para os antígenos RhC, RhE, Rhe, Rhc e K não há artigos científicos preconizando sua intensidade mínima devida à variação antigênica entre indivíduos.(1,2) Desta forma, este trabalho teve como critério a adesão de intensidade mínima de hemaglutinação de 3+ por ser uma intensidade de fácil visualização na técnica em tubo.
Fenotipagem ABO
Para a determinação do fenótipo ABO foi preparada uma suspensão de eritrócitos a 3% em solução salina (NaCl 0,9%), e aos tubos identificados como A, B e AB foram adicionados 50 µL desta suspensão. Posteriormente, a cada tubo foram adicionados 50 µL dos respectivos antissoros monoclonais antiA, antiB, antiAB da Fresenius Kabi® e, após homogeneização dos tubos, estes foram centrifugados a 2.326 g (sendo que g é a força centrífuga relativa) por 15 segundos e então submetidos a leitura.
A técnica em tubo seguiu o padrão de leitura da intensidade da reação de 0 (Negativo) a 4+ (Positivo) conforme Judd.(18)
Fenotipagem, RhC, RhE, Rhe, Rhc, K
Para a identificação dos principais antígenos do Sistema Rh foi preparada uma suspensão de eritrócitos a 3% em solução salina (NaCl 0,9%), e a cada tubo identificado como RhC, RhE, Rhe, Rhc, K foram adicionados 50 µL desta suspensão. Posteriormente, a cada tubo foram adicionados 50 µL dos respectivos antissoros monoclonais Fresenius Kabi® e, após a homogeneização da reação, foram centrifugadas as reações a 2.326g por 15 segundos e então realizada a leitura.(20) A técnica em tubo seguiu o padrão de leitura da intensidade da reação conforme Judd.(18)
Fenotipagem RhD
Para realização da fenotipagem RhD em tubo, foi preparado uma suspensão de eritrócitos a 3% em solução salina (NaCl 0,9%) e, posteriormente, aos dois tubos identificados como D e Controle de Rh foram adicionados 50 µL da suspensão. Foram adicionados 50 µL de antiD Bio-Rad Laboratories® e 50 µL do Controle do Rh Bio-Rad Laboratories® nos respectivos tubos e, após homogeneização da reação, estas foram centrifugadas a 2.326 g por 15 segundos para leitura das reações. No caso das leituras negativas foi realizada a Pesquisa do Antígeno D Fraco, conforme preconizado pela legislação em vigor.(17) Para a pesquisa de D fraco, as amostras negativas ou com intensidade de hemaglutinação £ 2+ foram incubadas a 37ºC por vinte minutos e então lavadas por três vezes com solução de NaCl a 0,9%. Às soluções lavadas foram adicionados 100 µL de soro de Coombs antiIgG Bio-Rad Laboratories® e então foram centrifugadas por 15 segundos a 2.326 g.
Foi realizada posteriormente a leitura visualizando a presença ou a ausência de hemaglutinação. Em caso de não hemaglutinação foram adicionados 50 µL de hemácias para Controle Coombs Bio-Rad Laboratories®, os tubos foram homogeneizados e centrifugados por 15 segundos a 2.326 g e então realizada a leitura de acordo com Judd.(18)
Teste de Antiglobulina Direto
O Teste de Coombs Direto (TAD) foi realizado de acordo com Roback e colaboradores.(2) Os eritrócitos das amostras coletadas foram lavados três vezes em solução salina (NaCl 0,9%) e posteriormente preparada uma suspensão de eritrócitos a 3% em NaCl 0,9%. Aos tubos identificados (IgG, Poli) foram acrescentados 50 µL de suspensão de eritrócitos e 100 µL do soro antiglobulina correspondente a cada tubo (Soro Antiglobulina Humana Monoespecífica IgG Bio-Rad Laboratories® e Soro Antiglobulina Humana Poliespecífica IgG+C3d Bio-Rad Laboratories®) respectivamente. Após homogeneização, os tubos foram centrifugados a 2.326 g por 15 segundos. A técnica em tubo seguiu o padrão de leitura da intensidade da reação conforme Judd.(18) No caso de resultados negativos, a reação permaneceu incubada por cinco minutos em temperatura ambiente e, posteriormente, foi centrifugada à força de 2.326 g por 15 segundos, sendo realizada uma nova leitura das reações.
Os resultados negativos foram confirmados com adição do controle de Coombs Bio-Rad Laboratories®, centrifugando e observando a hemaglutinação, conforme descrito por Judd.(18)
Hemólise
O teste de hemólise foi realizado mediante a inspeção visual. As suspensões de eritrócitos 3% foram centrifugadas a 2.326 g por 45 segundos.(18) Em seguida, foi observado o sobrenadante da suspensão, visualizando a presença (sobrenadante rosado ou avermelhado) ou ausência de hemólise (sobrenadante límpido), conforme Portaria 158 de 2016.(17)
Resultados
Dentre as vinte amostras coletadas, duas (10%) foram excluídas por apresentarem resultado RhD negativo e nenhuma amostra analisada apresentou resultado positivo para o TAD. Sendo assim, o estudo deu continuidade na avaliação da estabilidade dos antígenos eritrocitários com 18 amostras.
Do total das 18 amostras, 11 (55,6%) eram do A RhD Positivo, uma (5,6%) AB RhD Positivo, sete (38,8%) O RhD Positivo e nenhuma amostra possuía o fenótipo B RhD Positivo. O número absoluto e o percentual de amostras, respectivamente, contendo o antígeno RhC foi de 11 (61%), Rhc 14 (77,7%), RhE 7 (38,8%), Rhe 16 (88,9%) e K 2 (11,1%).
Em todas as amostras classificadas como A RhD Positivo, pôde-se observar que a intensidade de hemaglutinação de 4+ entre o antígeno A e o anticorpo monoclonal AntiA se manteve constante ao longo dos 77 dias. Em uma amostra (AB RhD Positiva), essa manteve a intensidade de hemaglutinação entre o antígeno B e o anticorpo monoclonal AntiB constante de 4+ até o 77º dia.
O antígeno RhD apresentou variação na intensidade das reações ao longo dos 77 dias. Do total de amostras, uma (5,55%) apresentou diminuição na intensidade da hemaglutinação a partir do 50º dia. As demais amostras apresentaram variação de 4+ e 3+ entre os 1º e 77º dia.
Para o antígeno RhC, não foi observada variação de intensidade em dez (90,9%) das 11 amostras entre os dias 1º ao 77º, sendo o percentual da diminuição da amostra apresentada na Tabela 1.

Dentre as dez amostras que não sofreram diminuição na intensidade da hemaglutinação, no 37º dia houve a observação de que uma amostra apresentou intensidade de 2+. Contudo, a mesma amostra voltou a apresentar intensidade de 3+ e 4+ nos 50º e 77º dias, respectivamente. Assim, essa amostra não foi considerada rejeitada pelos pesquisadores, visto que pode ter ocorrido excesso de homogeneização no 37º dia. Assim, dentre as 11 amostras que possuíam o antígeno RhC, uma amostra sofreu diminuição na intensidade da reação antígeno-anticorpo no 77º dia de 4+ para 2+.
Ao avaliar a estabilidade dos antígenos Rhc e RhE ao longo dos 77º dias, a intensidade de aglutinação se manteve em 100% das amostras, tendo variações entre 3+ e 4+ durante a interpretação da intensidade da hemaglutinação ao longo dos dias.
Houve uma maior diminuição na estabilidade dos antígenos Rhe durante o estudo conforme descrito na Tabela 1.
Dentre as 16 amostras, nove (56,2%) se mantiveram constantes ao longo dos testes. Destacando que sete amostras apresentaram intensidade de 2+ somente no 77º dia da pesquisa.
Apenas duas amostras continham o antígeno K e estas demonstraram intensidade entre 4+ e 3+ do primeiro dia de análise até o 77º dia. Contudo, uma amostra no 13º dia apresentou intensidade de 2+, voltando a apresentar intensidades entre 4+ e 3+ nos dias posteriores. Desta forma, essa amostra não foi considerada rejeitada pelos pesquisadores, visto que pode ter ocorrido excesso de homogeneização no 13º dia.
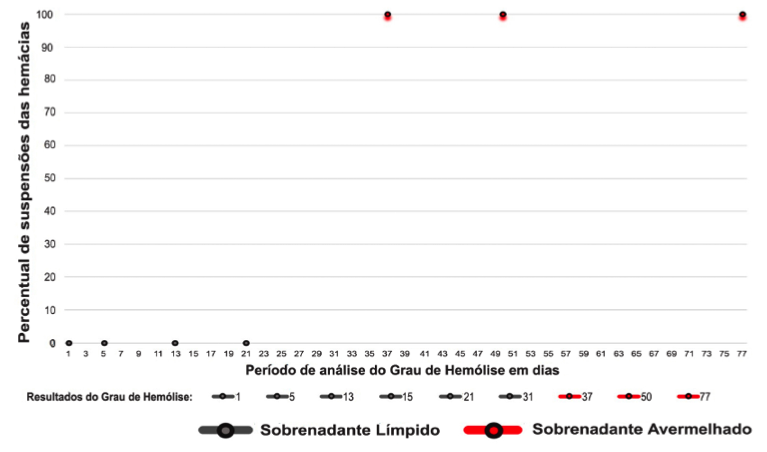
Ao analisar a Figura 1 o grau de hemólise das Suspensões de Hemácias a 3% foi evidenciado que no 1º, 5º, 13º e 21º dias de análises (marcadores em cinza) estas não apresentaram hemólise.
A partir do 37º dia (marcadores em vermelho) pôde-se observar presença de hemólise avermelhada em 100% das amostras.
Discussão
O desenvolvimento de estudos para o uso de eritrócitos fenotipados em técnicas de CQI de forma eficiente, em que os antígenos eritrocitários tornam-se estáveis por longos períodos, é relevante.(12) A elaboração destes estudos deve levar em consideração antígenos transmembranares, de superfície e/ou adsorvidos à membrana.(1,2) É necessário o desenvolvimento de metodologias que visem aumentar o tempo de estabilidade dos antígenos em relação às suspensões de eritrócitos disponíveis comercialmente ou in house, podendo contribuir para melhorar a qualidade de serviços em análises clínicas durante a execução dos exames imunohematológicos.(12)
O armazenamento de eritrócitos resulta no aumento de hemólise, sendo este um parâmetro importante para avaliar a qualidade dos eritrócitos armazenados.(19) Com o armazenamento também poderá ocorrer uma redução nos níveis de adenosina trifosfato (ATP), sendo este necessário para a proteção da forma e estabilidade da membrana dos eritrócitos. Eventualmente, estas alterações causam redução na viabilidade dos eritrócitos.(20,21) O grau de hemólise dos eritrócitos durante a preservação constitui-se um fator limitante para o tempo de armazenamento, e autores têm considerado a taxa de hemólise espontânea como marcador fundamental da preservação.(11,12)
A partir da análise dos resultados, foi possível observar que 100% das amostras começaram a apresentar hemólise a partir do 37º dia. Pesquisas anteriores mostram baixos índices de hemólise, com valores inferiores a 2% após 60 dias de preservação em meio de conservação de eritrócitos (CE) (meio contendo Na2HPO4 8 mmoles/L, glicose 20 mmoles/L, EDTANa2 1 mmol/L, KCl 8 mmoles/L, NaCl 75 mmoles/L, citrato de sódio 40 mmoles/L e albumina bovina (AB) 6 g/L), e de menos de 1% após 90 dias de preservação de eritrócitos em meio CE após fixação parcial com glutaraldeído.(8) No presente estudo não foi observada interferência da hemólise na diminuição da intensidade de hemaglutinação, porém foi evidenciado que, após o dia 21, a hemólise era observada visualmente e, por consequência disso, pode ocorrer a diminuição de antígenos na suspensão de hemácias e essa diminuição interfere diretamente na reação antígeno-anticorpo.(2)
De acordo com Sallem, foi possível manter os antígenos eritrocitários A, B, D, C, c, E, e, K estáveis por 63 dias em solução CE, sendo que alguns deles apenas diminuíram a sua intensidade de hemaglutinação ao longo dos 63 dias.(12) No presente estudo foi possível observar que a intensidade dos antígenos A e B foram constantes ao longo de 77 dias sem o uso de conservantes de eritrócitos, sendo que estes mantiveram a intensidade de hemaglutinação de 4+ do primeiro ao último dia de análise. Para a aprovação de reagentes imunohematológicos quanto à reatividade, os antígenos A e B precisam ter reatividade mínima de 3+, o que condiz com o encontrado neste trabalho.(17) Esta intensidade constante pode estar relacionada com a alta densidade antigênica do Sistema ABO, no qual a hemólise observada nesses dias não seria suficiente para interferir nos testes imunohematológicos.(1)
Os estudos de Myhre e colaboradores mostram que não há nenhuma mudança significativa nos antígenos do Sistema ABO e Rh (C, c, E, e) durante o armazenamento, de 21 a 42 dias, com qualquer um dos sistemas de conservação de anticoagulantes testados por eles (citrato-fosfatodextrose, fosfatocitrato de dextrose-adeninaona, citratofosfatodextrose com aditivo salinoadeninaglicose e um sistema de citrato fosfato dupla de dextrose com aditivo de solução de glucose e solução salina tamponada com adenina).(22) Nesse mesmo estudo foi observado que apenas o antígeno RhD teve alteração na reatividade e em poucos casos houve mudanças individuais mudando de 4+ para 3+.(22) Esses dados corroboram o presente estudo, ainda que, sem uso de conservantes de eritrócitos, se observou apenas que uma amostra sofreu redução na intensidade de hemaglutinação de 2+. Vale ressaltar que a expressão do antígeno RhD de um indivíduo pode variar qualitativa ou quantitativamente devido a mutações no gene RHD.(2) A quantidade de sítios antigênicos expressos por eritrócitos também é diferente para cada indivíduo, visto que esta expressão está envolvida com os demais fenótipos do Sistema Rh. Contudo, todos os eritrócitos possuem a mesma quantidade de antígenos expressos. A densidade antigênica do antígeno RhD varia de 10.000 a 25.000 sítios por eritrócitos.(2) No presente estudo, diferentes amostras apresentaram reação de intensidade inicial de 3+ e ao final do estudo aumentaram a intensidade para 4+. Essas mudanças podem estar relacionadas também com homogeneização excessiva, que destaca a possibilidade de resultados falsos negativos ou diminuição na intensidade das reações na fase de leitura devido à agitação excessiva, já que os testes em tubos são subjetivos e dependem do desempenho e habilidade do operador.(23)
Pesquisadores estabeleceram requisitos mínimos esperados na inspeção de qualidade dos soros identificadores de antígenos eritrocitários que o antígeno RhC tenha reatividade mínima de 3+ e o antígeno Rhc 1+.(24) De acordo com esses dados, todas as amostras que continham o antígeno Rhc se mostraram em conformidade, apresentando os requisitos mínimos. Já para o antígeno RhC, apenas 9,1% das amostras não apresentaram o valor mínimo esperado, tendo diminuído sua intensidade de hemaglutinação para 2+ no 77º dia. Os antígenos RhC e Rhc estão localizados em duas proteínas expressas na membrana dos eritrócitos e possuem menor expressão que o antígeno RhD, o que pode justificar a variação encontrada.(1)
São requisitos mínimos para a aprovação de reagentes imunohematológicos quanto à reatividade, que o antígeno RhD tenha intensidade de 3+.(24) Segundo a legislação hemoterápica, o serviço de hemoterapia deve realizar controles de qualidade de reagentes em imunohematologia, sendo que a intensidade mínima esperada para o reagente RhD é de 3+.(17) Embora os Laboratórios de Análises Clínicas não possuam critérios mínimos de aprovação através da RDC 302, os resultados encontrados neste estudo demonstram a importância desta avaliação da estabilidade dos antígenos no CQI utilizando amostras sem uso de conservantes, avaliando assim a estabilidade dos mesmos.
Embora o antígeno RhE seja antígeno transmembranar e possuir uma diferença do antígeno RhD de aproximadamente 39 aminoácidos, neste estudo não foram evidenciadas alterações na estabilidade do antígeno RhE. Os resultados corroboram aos de Novaretti e colaboradores na inspeção de qualidade, visto que o mesmo necessita ter reatividade mínima de 3+.(24) Já o antígeno Kell (K1), que não teve alterações na reatividade dos eritrócitos, apenas uma amostra apresentou decréscimo de 4+ para 3+. No entanto, essa diminuição não faz com que as amostras entrem em não conformidade, já que elas precisam ter reatividade mínima de 1+ para aprovação na inspeção de qualidade.(24) Os resultados encontrados neste trabalho são semelhantes com os encontrados por Sallem,(12) onde houve decréscimo de 1+ na reatividade do antígeno Kell (K), amostras que iniciaram com 3+ apresentavam 2+ ao final de 63 dias e amostras com 4+ apresentavam 3+. Contudo, quando avaliado o antígeno Rhe, foi evidenciada uma diminuição representativa da estabilidade e capacidade de detecção do antígeno Rhe. O decréscimo de intensidade foi de 4+ nos dias iniciais do estudo. Ao final do 77º dia, 50% das amostras continuaram em conformidade. Porém, este estudo não utiliza conservantes de eritrócitos, o que pode justificar um maior percentual para este antígeno transmembranar. A homogeneização excessiva pode ter relação com essa diminuição de intensidade de hemaglutinação, já que, para Rumsey, os testes manuais são menos precisos e aumentam a subjetividade dos resultados.(25)
Os conservantes de eritrócitos podem auxiliar na estabilidade dos antígenos por um período maior. Um estudo que utilizou conservante de eritrócitos e que estabeleceu reatividade mínima de 1+ obteve resultados que contrapõem aos evidenciados neste estudo, sem uso de conservantes. O antígeno Rhe com uso de conservantes pode ter reatividade média de 4+ por 63 dias.(12) Outros pesquisadores, ao avaliarem a estabilidade de antígenos de outros grupos sanguíneos (Luhteran e Diego), obtiveram resultados de estabilidade desses antígenos de até 120 dias. Contudo, pesquisadores utilizaram metodologias de criopreservação, nas quais, os resultados utilizando criopreservadores de eritrócitos evitaram a diminuição dos níveis de expressão dos antígenos estudados. Frequentemente é observada, após ciclos de congelamento e descongelamento, a diminuição da expressão antigênica dos mesmos. Por fim, os autores concluíram que as células estabilizadas podem ser armazenadas e transportadas a um menor custo e risco, em comparação com as células criopreservadas.(26)
Existe a necessidade de desenvolvimento de técnicas efetivas para preservação de eritrócitos que mantenham in vitro a viabilidade, a fim de possibilitar a realização de exames laboratoriais e controle de qualidade, fornecendo subsídios para diagnóstico, prevenção e conduta em casos de sensibilização associados à transfusão, gestação e transplante de órgãos.(13) Desta forma, a partir de resultados de pesquisas sobre estabilidade dos eritrócitos sem uso de conservantes, foi possível manter as amostras com antígenos eritrocitários A, B, RhD, RhC, Rhc, RhE, Rhe, K estáveis até 77 dias. Esse estudo pode contribuir para o controle de qualidade interno imunohematológico, assegurando resultados mais fidedignos e trazendo uma alternativa às suspensões de eritrócitos fenotipados disponíveis comercialmente. Novos métodos de análise envolvendo nanocristais de semicondutores, como sondas fluorescentes, têm sido utilizados na Imunohematologia para avaliar a estabilidade dos antígenos eritrocitários.(27) É importante avaliar a estabilidade de antígenos eritrocitários de outros sistemas de grupos sanguíneos. Esses estudos são de suma importância, visto que antígenos eritrocitários do sistema de grupo sanguíneo I, Lewis e P1pK são adsorvidos na membrana do eritrócito. Assim, ao longo do tempo de armazenamento de reagentes eritrocitários, mesmo contendo conservantes de eritrócitos, esses antígenos podem ser removidos da membrana eritrocitária, ocasionando resultados falsos-negativos na detecção de anticorpos irregulares.(1,15,20) Assim como, são necessários estudos para avaliar a estabilidade do antígeno RhD com outros clones de anticorpos utilizados nesse estudo. Esses estudos são importantes, uma vez que observamos variações na intensidade de hemaglutinação ao longo do estudo. Essas alterações podem estar associadas à avidez dos clones de anticorpos anti-RhD utilizados na rotina laboratorial.(17,23,25)
Conclusão
Para laboratórios clínicos que possuem recursos financeiros escassos é viável manter amostras de antígenos eritrocitários (A, B, RhD, RhE, Rhe, RhC, Rhc, K (K1)) armazenado por até 21 dias em geladeira (4 – 6ºC), para uso no CQI imunohematológico, visto que a partir desta data foi observada a presença de hemólise nas amostras, embora as intensidades de hemaglutinação tenham ficado dentro dos requisitos legais.
Reforça-se a importância da análise da hemólise apresentada nas amostras, embora não tenham interferido no decréscimo de intensidade de hemaglutinação das amostras, sendo que muitas delas mantiveram seu grau de hemaglutinação mesmo após a constatação de hemólise.
A hemólise, apesar de não ser um interferente para os antígenos estudados, pode vir a variar a intensidade de hemaglutinação de antígenos que não são de membrana, e sim adsorvidos à membrana eritrocitária, como os antígenos do Sistema P1pk e Sistema Lewis). O uso de amostras in natura até 21 dias para CQI pode ser um método econômico, evitando assim o uso de controles comerciais. Os resultados desta e outras pesquisas se fazem necessários e podem contribuir para melhorar o controle de qualidade dos serviços de análises clínicas.
Abstract
Objective: To determine the stability of the ABO, Rh and Ag Kell erythrocyte antigens to establish the storage time of preservative-free and in natura samples for use in the Internal Quality Control (IQC) of immunohematological tests. Methods: Twenty samples containing EDTA were collected. Through the use of monoclonal antibodies the detection of A, B, RhD, RhC, RhE, Rhe, Rhc, Kell (K1) antigens and the hemolysis test were performed by visual inspection of the erythrocyte suspension. The tests were performed on the first day of collection and repeated after fifth, 13th, 15th, 21st, 37th, 50th and 77th of the collection, in which hemagglutination intensity and degree of hemolysis were observed. Results: Among the 18 samples, 55.6% were classified as A RhD Positive, 5.6% AB RhD Positive, 38.8% RhD Positive and none of Group B RhD Positive, having two samples excluded from the study because they did not present the RhD antigen. 61% ag RhC in the studied samples, 77.7% Rhc, 38.8% RhE, 88.9% Rhe and 11.1% Kell were detected. On the 77th day, a greater decrease in hemagglutination intensity was observed for Rhe, RhC and RhD antigens, respectively, and no decrease was observed for the other antigens detected. From the 37th day of collection, hemolysis was observed in all samples collected. Conclusion: In natura samples with EDTA for up to 21 days after collection had no decrease in hemagglutination intensity and representative hemolysis. Further stability studies are required for other erythrocyte antigens
Keywords
Erythrocytes; Quality control; Reactivity-stability; Blood group antigen
REFERÊNCIAS
- Daniels G. Human Blood Groups. 2th ed. Oxford: Blackwell Science; 2002.
- Roback JD, Aronson CA. Technical manual. 17 ed. Estados Unidos: AABB. 2011.
- Bonifácio SL, Novaretti MCZ. Funções biológicas dos antígenos eritrocitários. Rev Bras Hematol Hemoter. 2009;31(2):104-11.
- Daniels G, Castilho L, Flegel WA, Fletcher A, Garratty G, Levene C, et al. International Society of Blood Transfusion Committee on Terminology for Red Blood Cell Surface Antigens: Macao report. Vox Sang. 2009;96(2):153-6.
- Storry JR, Castilho L, Daniels G, Flegel WA, Garratty G, de Haas M, et al. International Society of Blood Transfusion Working Party on red cell immunogenetics and blood group terminology: Cancun report (2012). Vox Sang. 2014 Jul;107(1):90-6.
- Reid ME, Lomas Francis C, Olsson ML. The blood group antigen facts book. 3rd ed. San Diego: Academic Press; 2012.
- Denomme GA. Kell and Kx blood group systems. Immunohematology. 2015;31(1):14-9.
- Machado SL, Vizzoni AG. Introdução à ImunoHematologia. In: Paulo CJLS, Silva AM, Neto LMR. Hematologia: métodos e interpretação. São Paulo: Roca; 2013;389421.
- Agência Nacional de Vigilância Sanitária (Brasil). RDC nº 302, de 13 de outubro de 2005. Dispõe sobre Regulamento Técnico para funcionamento de Laboratórios Clínicos.
- Leonart MSS. Estudos Sobre a Preservação de Eritrócitos [dissertação]. São Paulo: Universidade de São Paulo; 1994.
- Cozac APCNC. Estudo do potencial antigênico relativo dos antígenos de grupos sanguíneos menores em pacientes sob esquema transfusional [dissertação]. Ribeirão Preto: Faculdade de Medicina de Ribeirão Preto/USP; 2009.
- Sallem ZV. Estudo sobre a preservação de eritrócitos humanos para emprego em exames imunohematológicos e controle de qualidade para a contagem de reticulócitos [dissertação]. Curitiba: Universidade Federal do Paraná; 2011.
- Hauser AB. Programa de controle de qualidade em hematologia: variações interlaboratoriais para eritrograma e plaquetas em Curitiba e Região Metropolitana – PR [dissertação]. Curitiba: Universidade Federal do Paraná; 2003.
- Novaretti MCZ et al. Controle de qualidade interno de reagentes em imunohematologia – aspectos práticos. Rev Bras Hematol Hemoter. 2002;24(4):270-85.
- Chin Yee I, Arya N, d’Almeida MS. The red cell storage lesion and it simplication for transfusion. Transfus Sci. 1997;18(3):447-58.
- Kriebardis AG, Antonelou MH, Stamoulis KE, Economou-Petersen E, Margaritis LH, Papassideri IS. Membrane protein carbonylation in non-leukodepleted CPDA preserved red blood cells. Blood Cells Mol Dis. 2006;36(2):279-82.
- Ministério da Saúde (Brasil). Portaria Nº 158, de 4 de fevereiro de 2016. Redefine o regulamento técnico de procedimentos hemoterápicos.
- Judd WJ, et al. Judd´s Methods in Immunohematology. 3rd ed. Bethesd: AABB; 2008.
- Brecher ME, Zylstra-Halling VW, Pineda AA. Rejuvenation of erythrocytes preserved with AS-1 and AS-3. Am J Clin Pathol. 1991;96(6):767-9.
- Stapley R, Rodriguez C, Oh JY, Honavar J, Brandon A, Wagener BM, et al. Red blood cell washing, nitrite therapy, and antiheme therapies prevent stored red blood cell toxicity after trauma-hemorhage. Free Radic Biol Med. 2015;85:207-18
- Hogman CF, Meryman HT. Red blood cells intended for transfusion: quality criteria revisited. Transfusion. 2006;46(1):137-42.
- Myhre BA, Demaniew S, Nelson EJ. Preservation of red cell antigens during storage of blood with different anticoagulants. Transfusion. 1984;24(6):499-501.
- Malomgré W, Neumeister B. Recent and future trends in blood group typing. Anal Bioanal Chem. 2009;393(5):1443-51.
- Novaretti MCZ et al. Controle de qualidade de reagentes de glóbulos vermelhos para detecção e identificação de anticorpos irregulares: experiência da Fundação Pró-Sangue/Hemocentro de São Paulo. Boletim de hematologia. 1997. 251.
- Rumsey DH, Ciesielski DJ. New protocols in serologic testing: a review of techniques to meet today schallenges. Immunohematology. 2002;16(4):2-9.
- González C, Esteban R, Canals C, Muñiz-Díaz E, Nogués N. Stabilization of Transfected Cells Expressing Low-Incidence Blood Group Antigens: Novel Methods Facilitating Their Use as Reagent-Cells. PLoS One. 2016;11(9):e0161968.
- Cabral Filho PE, et al. Blood group antigen studies using CdTe quantum dots and flow cytometry. International Journal of Nanomedicine. 2015;10:4393-404.
Correspondência
Bruna Sutter
Rua Uruguai, 458
88 302-202 – Itajaí – SC, Brasil
Tel/fax: +55 47 33417540
