Mecanismo de resistência da bactéria Acinetobacter Baumannii e suas implicações no controle das infecções hospitalares
Mechanism of resistance of Acinetobacter Baumannii bacteria and its implications in control of hospital infections
Yamine Maia de Queiroz1, Isaura Abreu Maciel1, Fabiolla da Silva dos Santos2
1 Biomédica – Pós-graduanda. Escola Superior da Amazônia (ESAMAZ). Belém, PA, Brasil.
2 Doutora em virologia. Escola Superior da Amazônia (ESAMAZ). Belém, PA, Brasil.
Recebido em 23/01/2021
Aprovado em 04/03/2022
DOI: 10.21877/2448-3877.202202098
INTRODUÇÃO
O gênero Acinetobacter spp. surgiu como patógeno hospitalar oportunista, com numerosos surtos hospitalares. O gênero Acinetobacter spp. compreende até 31 espécies, entre elas a espécie Acinetobacter baumannii, responsável por cerca de 80% das infecções, a qual pode se espalhar de forma epidêmica entre os pacientes hospitalizados e gravemente doentes. Acinetobacter são bacilos ou cocobacilos aeróbios Gram-negativos que pertencem à família Moraxellaceae.(1) Eles são onipresentes e podem sobreviver em superfícies secas por até um mês, aumentando a probabilidade de pacientes serem colonizados e equipamentos médicos serem contaminados. A. baumannii são não fermentadores de glicose, capazes de sobreviver por longos períodos no ambiente nosocomial, fator este que favorece sua propagação hospitalar.(2)
Esta bactéria apresenta mecanismos que facilitam a colonização de pacientes e de equipamentos hospitalares, como a formação de biofilmes por ação das proteínas da membrana bacteriana externa, que são aglomerados de microrganismos protegidos por uma matriz polimérica e se aderem a superfícies sólidas quando em contato com material líquido.(3) As células que se ligam irreversivelmente a superfícies começam a divisão celular, em microcolônias, e produzem os polímeros extracelulares que definem um biofilme e representam um grave problema para a saúde pública em razão do aumento da resistência dos organismos associados.(4) A formação de biofilmes pode ser considerada um processo clinicamente relevante devido a quatro fatores: (1) eles são mais resistentes aos agentes antimicrobianos; (2) podem ser uma fonte de infecção persistente; (3) são capazes de abrigar organismos patogênicos e (4) permitem a troca de plasmídeos de resistência. A maioria dos isolados clínicos deste patógeno é suscetível a muitos antibióticos disponíveis, incluindo beta-lactâmicos, como carbapenéns.(5)
No entanto, este microrganismo apresenta uma elevada capacidade de desenvolver resistência contra antibióticos, o que resultou em uma elevação da incidência de cepas multirresistentes desta bactéria e associação com altos índices de mortalidade.(6) Antibióticos beta-lactâmicos são uma opção terapêutica importante no tratamento de infecções por A. baumannii, em razão da sua eficácia e à possibilidade de potencialização de sua ação, por modificação química.(7) Dentre os beta-lactâmicos, destacam-se os carbapenens (imipeném e meropeném), fármacos com amplo espetro de ação. As cepas resistentes à vasta maioria dos beta-lactâmicos, incluindo carbapenéns, põe em foco o potencial deste patógeno em responder rapidamente a mudanças de pressão seletiva ambiental.(8)
Os mecanismos de resistência do A. baumannii podem ter origem intrínseca ou adquirida e são mediados por diversos fatores, como perda da permeabilidade da membrana, mais expressivamente a produção de beta-lactamases, enzimas que degradam antibióticos beta-lactâmicos, sendo a principal causa de resistência bacteriana.(9) O mecanismo de resistência bacteriano mais importante e frequente é a degradação do antimicrobiano por enzimas que se localizam no espaço periplasmático, como exemplo as beta-lactamases que inativam os agentes beta-lactâmicos. São várias as classes de beta-lactamases e as do tipo OXA são amplamente mencionadas em vários estudos no mundo. Um dos genes que codifica a produção de oxacilinases (OXA), o blaOXA-51, é usado como marcador da espécie A. baumannii. Outros genes também são encontrados, como o blaOXA-24/40 e blaOXA-58 de relevância na resistência intrínseca desse gênero.(10) Portanto, Conhecer a sua taxonomia; os genes mais relevantes como blaOXA-51 e blaOXA-23, sua habilidade de formar biofilme; os mecanismos de interação com o hospedeiro; as recomendações dos órgãos fiscalizadores e os tratamentos preconizados atualmente é essencial para identificar maneiras mais eficientes de combater e controlar o referido microrganismo, que está entre as principias bactérias multirresistentes no mundo, tornando necessária a pesquisa e a descoberta de novos fármacos para tratamentos mais eficientes para os pacientes, principalmente aqueles assistidos em centros de tratamento intensivo.(5)
Sendo assim, o objetivo desse trabalho é descrever as características e os aspectos fisiológicos da espécie Acinetobacter spp., apresentar os mecanismos de resistência da Acinetobacter e descrever medidas no controle das infecções hospitalares.(2)
MATERIAL E MÉTODOS
Nesta pesquisa, de caráter descritivo e exploratório, serão consultados artigos através das bases de dados Scientific Eletronic Library online (SciELO), National Library of Medicine (PubMed), e realizadas buscas de artigos científicos relacionados à resistência bacteriana em ambiente hospitalar, entre o período de 2015 a 2020, utilizando as palavras-chave: Acinetobacter baumannii, infecção hospitalar e resistência a antimicrobiano.
Taxonomia e Fisiologia
O microrganismo do gênero Acinetobacter passou por várias revisões taxonômicas, sendo atualmente classificado na família Moraxellaceae. É um bacilo Gram-negativo, que se apresenta como cocobacilos, é não seletivo, imóvel, aeróbio, não formador de esporos, e pode apresentar cápsula e fímbrias para adesão e formação de biofilmes.(11)
Sua história taxonômica teve início em 1911, por um cientista alemão, que descobriu novas seis espécies isoladas do solo, nomeando-as Micrococcus calcoaceticus.(12) No entanto, com o passar dos anos, novas bactérias com características semelhantes foram descritas e, então, classificadas em cerca de 31 espécies e gêneros diferentes de Acinetobacter, como Acinetobacter calcoaceticus, A. baumannii, A. haemolyticus, A. junii, A. johnsonii, A. lwoffii, A. radioresistens e outras espécies não denominadas. Recentemente, duas novas espécies foram descritas e denominadas como A. ursingii sp. nov. e A. schindleri sp. nov.(13) Dentre as espécies descritas, A. baumannii tem sido a mais encontrada em amostras clínicas, especialmente relacionada com infecções hospitalares.(14)
Transmissão
Acinetobacter spp. são frequentemente transmitidos aos pacientes através da persistência nas superfícies ambientais e colonização transitória das mãos dos profissionais de saúde.(15) Dentre as Acinetobacter spp., a espécie A. baumanni é um patógeno oportunista associado a surtos de infecções nosocomiais, com incidência mais elevada em unidades de terapia intensiva (UTIs).(16)
A principal forma de transmissão do Acinetobacter ocorre por contato direto ou indireto. Contato direto: transferência física de microrganismos entre o hospedeiro suscetível e a pessoa infectada ou colonizada durante procedimentos como mudança de decúbito, banho no leito e verificação de pressão arterial. Contato indireto: transferência por meio de um objeto contaminado (reservatório), por exemplo, material contaminado como luvas, máquinas de diálise, ventiladores mecânicos, sistemas de ventilação; nas fontes de água; na pele e mucosas.(15)
Estudos de Rock et al.(17) mostram que esta espécie é capaz de sobreviver por longos períodos em objetos inanimados, superfícies situadas em imediações próximas ao paciente debilitado, podendo ser transmitida diretamente ou por meio das mãos dos profissionais de saúde ou, ainda, ser passada de paciente para paciente. Surtos de Acinetobacter têm sido atribuídos particularmente à terapia respiratória e aos equipamentos de ventilação e infecção cruzada pelas mãos de trabalhadores de saúde que cuidaram de pacientes colonizados ou infectados (Figura 1).
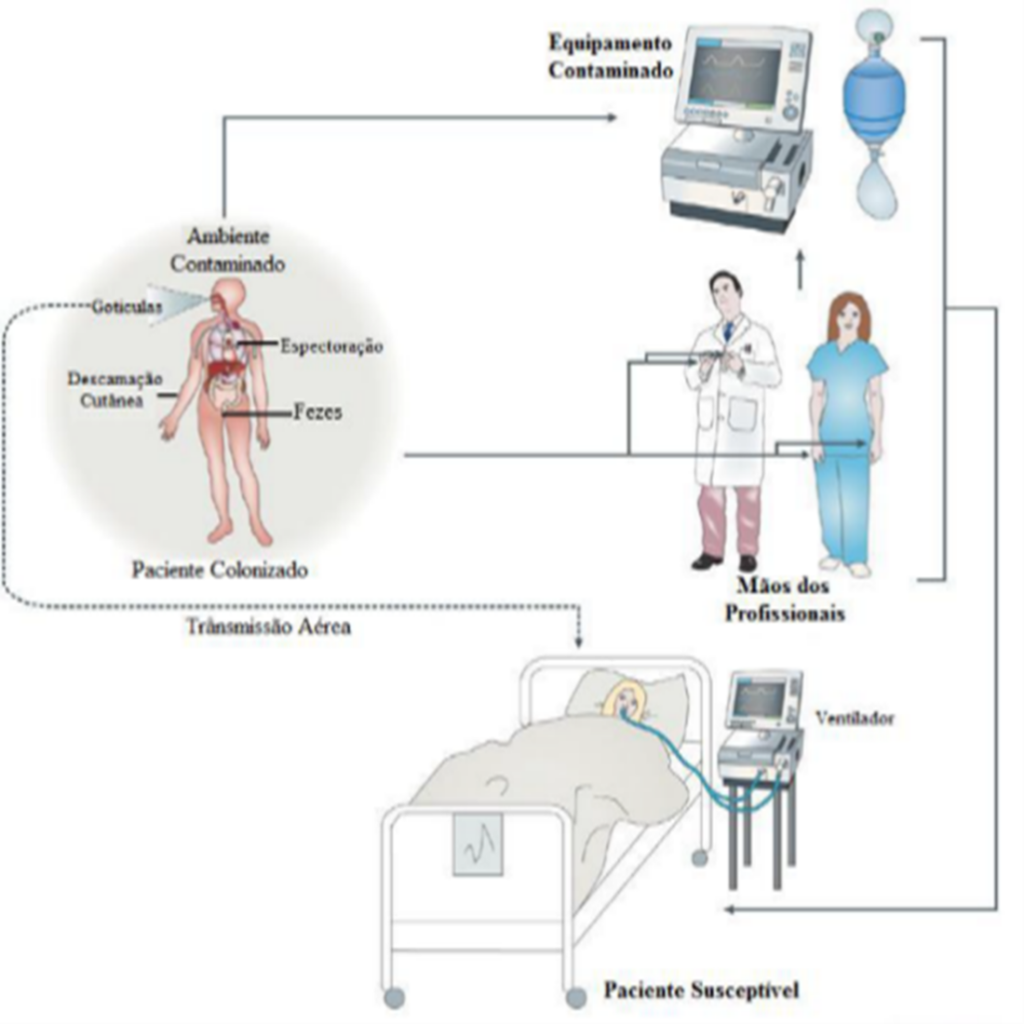
Figura 1
Apresentando as formas de transmissão.
Fonte: Adaptado https://alagoasreal.blogspot.com/2011/07/admission-screening-disinfection. 2011.
Formação de biofilme
Os biofilmes são microrganismos acumulados protegidos por uma matriz polimérica e se fixam a superfícies sólidas em contato com material líquido. As células que aderem a essas superfícies iniciam sua divisão celular e produzem polímeros extracelulares que definem um biofilme.(11)
Os biofilmes podem representar um grande problema para a saúde pública devido ao aumento da resistência dos organismos associados. As evidências de biofilmes sobre dispositivos médicos veio por meio de estudos em que os dispositivos foram examinados após a remoção dos doentes.(18) A formação de biofilmes pode ser considerada clinicamente relevante em razão de fatores como: são resistentes aos agentes antimicrobianos; podem se tornar uma fonte de infecção persistente; podem abrigar organismos patogênicos e permitem a troca dos plasmídeos.(19)
A formação de biofilmes é uma grande preocupação, pois podem se formar em instrumentos de uso hospitalar e ser compostos por múltiplas bactérias que segregam ampla gama de fatores de virulência. Com isso a estrutura do biofilme torna o tratamento químico difícil e leva à resistência a antimicrobianos.(20)
Perfil ou mecanismo de resistência bacteriana
Para Darren et al.(11) e Noto et al.(21) o principal desafio do tratamento de infecções por Acinetobacter centra-se na superação da resistência aos antibióticos. A. baumannii possui elevada versatilidade nutricional e metabólica, permitindo a sua adaptação a múltiplos ambientes. Os patógenos oportunistas como A. baumannii raramente são aptos para causar uma infecção devido à eficiência da resposta imune inata do hospedeiro.
Com o passar do tempo e a descoberta de novos estudos a bactéria tornou-se mais resistente a antimicrobianos devido a fatores como alteração nos sítios de ligações a esses fármacos, produção de proteínas que hidrolisam e os modificam, alteração nas ligações proteicas com penicilinas, perdas de proteínas na membrana externa e a produção de beta-lactamases, enzimas que tem a capacidade de hidrolisar antimicrobianos beta-lactamâmicos. Pode sobreviver em superfícies inanimadas e secas por vários meses, tem bom crescimento em altas temperaturas e variações de pH.(22)
A escolha do tratamento antimicrobiano deve considerar a história do paciente, a síndrome clínica e os testes de sensibilidade aos antimicrobianos. A terapia antimicrobiana deve considerar os dados de resistência bacteriana. Alguns estudos sugerem que o uso de ampicilina em altas doses no tratamento de Acinetobacter multirresistente apresenta resultados equivalentes a carbapenêmicos mesmo em pneumonias associadas à ventilação mecânica de início tardio, razão pela qual esse antimicrobiano tem sido utilizado como opção para tratamento dessa bactéria, o que permite evitar o uso de carbapenêmicos.(23)
Porém tem havido resistência crescente do Acinetobacter à ampicilina, e nestes casos os antimicrobianos carbapenêmicos são normalmente considerados como a última alternativa para o tratamento de escolha de infecções causadas por Acinetobacter, principalmente com a emergência de resistência a outros beta-lactâmicos.(24)
Fatores de riscos no ambiente hospitalar
Bactérias do gênero Acinetobacter spp. apresentam habilidade de crescimento em ambientes como solo e água, pode sobreviver em superfícies inanimadas e secas por vários meses, têm bom crescimento em altas temperaturas e variações de pH.(25) No ambiente hospitalar, esta bactéria forma biofilmes em instrumentos médicos, em destaque: estetoscópio, termômetro, torniquetes, nebulizadores, umidificadores, circuito de respirador, dentre outros, e superfícies como bancadas e leitos de centros hospitalares, como unidades de tratamento intensivo – UTIs.(26)Além disso, podem acometer pacientes imunocomprometidos que recebem tratamentos mais complexos, em unidades de tratamento intensivo, queimados, com ferimentos ou doenças de base graves.(27)
Diagnóstico
O diagnóstico da infecção por Acinetobacter é feito em ambiente hospitalar, visto que a maioria das pessoas que apresentam essa infecção estão internadas, através da coleta de amostra de sangue, de secreção traqueal e/ou de urina, que é enviada para o laboratório de microbiologia para que seja feita a análise.(26)
No diagnóstico é possível serem observadas características morfotintoriais após coloração pela metodologia de Gram, teste da oxidase, teste da catalase, teste de crescimento em caldo a 44ºC, e observar a produção de hemólise em ágar-sangue. Acinetobacter é composta por bactérias em formato de varetas curtas na fase logarítmica de crescimento, tornando-se, maioria das vezes, mais cocoides na fase estacionária, em que podem ocorrer agrupamento de células, variabilidade na coloração de Gram, assim como variações no tamanho da célula e arranjo, dentro de uma mesma cultura pura.(28)
Tratamento com o uso de antimicrobianos
Acinetobacter possui resistência a uma enorme variedade de antimicrobianos e uma grande capacidade para adquirir mecanismos de resistência a praticamente todos os antimicrobianos de uso comum, como penicilina, cefalosporinas de primeira e segunda geração, cloranfenicol, e resistência antimicrobiana à base de carbapenêmicos (por exemplo, imipeném e meropeném). Essa resistência aos carbapenêmicos em Acinetobacter pode ser mediada por um ou mais mecanismos, incluindo inativação enzimática, efluxo ativo, diminuição da permeabilidade da membrana e modificação dos sítios alvo de ligação aos antimicrobianos.(29)
As polimixinas são um grupo de antibióticos usados contra várias bactérias Gram-negativas. São constituídas por cinco substâncias, que receberam o nome de polimixinas A, B, C, D e E, sendo esta última chamada de colistina, produzida pelo Bacillus colistinus, entretanto somente as polimixinas B e E são utilizadas clinicamente, em virtude da grande toxicidade das demais.(30)
RESULTADOS
A revisão da literatura foi realizada em duas bases de dados, com os descritores “Acinetobacter baumannii” “infecção hospitalar” e “resistência a antimicrobiano”, que contabilizaram 209 artigos, dos quais 100 foram encontrados na base de dados eletrônico National Library of Medicine (PubMed) e 109 na base de dados SciELO (Scientific Electronic Library Online). Foram utilizados os filtros idioma (inglês e português), espécie (humano) e ano (2015 a 2020) de publicação. Desses citados foram excluídos 194 artigos por não abordarem a temática da pesquisa e selecionados 15 artigos em síntese quantitativa para compor a revisão.
O Gráfico 1 apresenta o perfil das publicações selecionadas para a revisão de acordo com o ano e o quantitativo de trabalhos. Dos 15 estudos incluídos que foram selecionados entre os anos de 2015 a 2020, verificaram-se cinco (33,3%) de 2015, dois (13,3%) de 2016, cinco (33,3%) de 2017, um (6,7%) de 2018, um (6,7%) de 2019 e um (6,7%) de 2020.
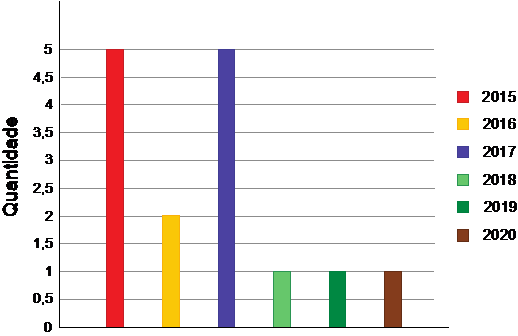
Gráfico 1
Material encontrado por ordem cronológica de publicação.
DISCUSSÃO
Acinetobacter baumannii vem assumindo um importante papel nos processos infecciosos com inúmeras infecções hospitalares no mundo, acarretando o aumento da morbidade e mortalidade de pacientes internados em unidade de terapia intensiva (UTI).(20) O uso extensivo de terapia antimicrobiana em hospitais tem contribuído para a seleção e o aumento no número de isolados de A. baumannii multirresistentes aos antimicrobianos, inclusive aos carbapenêmicos, dificultando o tratamento.(25)
Segundo o estudo de Noto et al.,(21) a resistência ao carbapeném entre isolados de A. baumannii aumentou drasticamente nos últimos anos devido ao surgimento e disseminação desse patógeno específico. Os sistemas bacterianos de multidrogas contribuem para o desenvolvimento de padrões de multirresistência de A. baumannii, um patógeno nosocomial de importância crescente devido à sua resistência emergente aos carbapenêmicos. O fenômeno de multirresistência é gerado por uma combinação de mecanismos que inclui inativação enzimática, efluxo ativo, diminuição da permeabilidade da membrana. Alharbe et al.(23) e Vanegas et al.(28) relatam um desses mecanismos que vem sendo considerado importante fator, que é o sistema de bomba de efluxo. Muitos desses isolados multirresistentes de A. baumannii abrigam genes para o sistema de efluxo de múltiplos fármacos, relacionados à resistência a vários grupos de agentes antibacterianos, incluindo ampicilina e meropeném. De acordo com Scarcella et al.(27) e Dalmasio,(29) as bombas de efluxo bacterianas transportam ativamente diversos antibióticos para fora da célula e são os principais contribuintes para a resistência intrínseca e aos muitos medicamentos que podem ser utilizados no tratamento de doenças infecciosas por Gram-negativas. Com isso a inibição desse sistema permitiria aumentar a eficácia desses antimicrobianos.
Vários autores como Viana et al.,(16) Trindade et al.(19) e Weber et al.(14) discutem sobre a formação de biofilmes, que é frequente em amostras clínicas de A. baumannii e é um requerimento importante para a colonização crônica de tecidos humanos e persistência em instrumentos médicos. Biofilmes microbianos que são comunidades envoltas em uma matriz extracelular são produzidos por várias bactérias. A habilidade de a A. baumannii crescer como biofilme em superfícies abióticas desempenha um importante papel em doenças infecciosas nosocomiais, devido à colonização de equipamentos hospitalares e dispositivos médicos, como cateteres urinários, cateteres venosos centrais, tubos endotraqueais e ventiladores mecânicos. É provável que os biofilmes contribuam nas interações de virulência da A. baumannii com seu hospedeiro.
De acordo com Leão et al.(15) e Kurihara et al.,(22) algumas características devem ser consideradas por estarem relacionadas aos fatores de risco para infecções dos pacientes por A. baumannii, por exemplo, tabagismo, alcoolismo, hipertensão, com maior frequência no sexo masculino, idade > 60 anos e com prevalências de doenças de base, incluindo diabetes mellitus, doenças cardiovasculares, doenças pulmonares como pneumonia grave, foram semelhantes e que apresentou mortalidade associada a infecção por A. baumannii de 75%. As durações totais de internação hospitalar também foram semelhantes com tempo de internação em UTI para tais pacientes em mais de sete dias significativamente associadas a um prognóstico ruim por esses fatores.
Com base no estudo de Darren et al.(11) e Leão,(26) as investigações em surtos hospitalares por A. baumannii se revelam incapazes de identificar uma única fonte de contaminação, a qual então pode estar relacionada à resistência bacteriana, às condições do paciente, à presença do patógeno em equipamentos médicos ou à equipe de saúde. Todo esse conjunto dificulta a prevenção e o controle das infecções por A. baumannii. Pacientes colonizados e a contaminação do ambiente são os maiores reservatórios para a infecção, enquanto a prevenção inadequada e a transmissão cruzada são determinantes para persistência do A. baumannii. O uso de equipamentos exclusivos para os pacientes pode facilitar o controle de surtos, assim como a manutenção de um regime apropriado de higiene das mãos para os profissionais de saúde também é importante. Para prevenir o contágio, profissionais da saúde devem tomar precauções lavar as mãos como precauções de barreira, com cuidado e limpeza apropriada dos ventiladores mecânicos para pacientes colonizados ou infectados por A. baumannii.
CONCLUSÃO
- baumannii está ganhando cada vez mais atenção e se mostrando como uma grande ameaça à saúde pública, uma vez que possui mecanismos poderosos de resistência inatos ou adquiridos contra muitos agentes antimicrobianos, ou seja, de se adaptar ao ambiente nosocomial e de resistir a desafios ambientais adversos, burlando as barreiras de proteção local. Os principais mecanismos de resistência são a alteração da permeabilidade, alteração do sítio de ação do antimicrobiano, bomba de efluxo e mecanismo enzimático pela produção de beta-lactmases, sendo que os principais processos ocorrem por meio de conjugação, transformação e transdução. Sendo assim, cada vez mais esforços e recursos científicos serão necessários para estudos epidemiológicos e de controle de infecção relacionada à A. baumannii, evitando assim graves infecções nosocomiais e surtos descontrolados em ambiente clínico.
REFERÊNCIAS
- Silva MFP. Revisão sobre Acinetobacter baumannii: epidemiologia molecular e opções terapêuticas disponíveis em Portugal. Tese de Doutorado. Faculdade de Medicina da Universidade do Porto; 2018.
- Lopes MC, Évora BS, Cidral TA, Botelho LB, Melo MC. Bacteremia por Acinetobacter radioresistens: primeiro relato de caso no Brasil. J. Bras. Patol. Med. Lab. 2019;55(6):669-674. doi.org/10.5935/1676-2444.20190059.
- Gomes DB et al. Acinetobacter baumannii multirresistentes: emergência de resistência à polimixina no Rio de Janeiro. Visa em Debate. 2016;4(3):28-34. doi.org/10.22239/2317-269x.00732.
- Bierhals CG et al. Avaliação da expressão relativa dos genes envolvidos na formação de biofilme por Acinetobacter baumannii. Revista Brasileira de Biociências, 2018;16(3).
- Machado MC. Perfil de doentes infetados com Acinetobacter baumannii em um hospital privado de Vitória da Conquista-Bahia-Brasil. Tese de Doutorado. Instituto de Higiene e Medicina Tropical; 2018.
- Simões AS. Contribuição do efluxo para a aquisição de resistência aos antibióticos em isolados clínicos de Acinetobacter baumannii. Tese de Doutorado. Instituto de Higiene e Medicina Tropical; 2016.
- Loureiro RJ, Roque F, Rodrigues AT, Herdeiro MT, Ramalheira E. O uso de antibióticos e as resistências bacterianas: breves notas sobre a sua evolução. Rev. Port. Sau. Pub. 2016;34(1):77-84. doi.org/10.1016/j.rpsp.2015.11.003.
- Évora BH. Susceptibilidade aos antibióticos e aos biocidas clorexidina e cloreto de benzalcônio em isolados clínicos de Acinetobacter baumannii. Dissertação de Mestrado. Universidade Federal do Rio Grande do Norte; 2019.
- Rocha L, Pagano M, Campos JC, Sampaio JLM, Martins AF, Barth AL. Carbapenem-resistant Acinetobacter baumannii in Brazil: susceptibility profile and diversity of oxacillinases. J. Bras. Patol. Med. Lab. 2017;53(6):358-361. doi.org/10.5935/1676-2444.20170057.
- Schuenck RP. Epidemiologia molecular e caracterização da resistência de amostras de Acinetobacter baumannii e Pseudomonas aeruginosa resistentes aos carbapenêmicos provenientes de hospitais da Grande Vitória-ES. Dissertação de Mestrado. Universidade Federal do Espírito Santo; 2018.
- Darren W, Travis BN, Robert AB, Paul P, Brian L. Clinical and Pathophysiological Overview of Acinetobacter Infections: a Century of Challenges. Clin Microbiol Rev. 2017Jan;30(1):409–447. doi: 10.1128 / CMR.00058-16.
- Oliveira SC. Estudo da monitorização farmacocinética de amicacina no tratamento de infeções nosocomiais por Acinetobacter baumannii. Dissertação de Mestrado. Faculdade de Farmácia da Universidade de Coimbra; 2015.
- C Cangussu EWS. Importância do Acinetobacter baumannii no ambiente hospitalar. J. Biotechnol. Biodivers. 2020;8(1):41-46. doi.org/10.20873/jbb.uft.cemaf.v8n1.cangussu.
- Weber BS, Harding CM, Feldman MF. Pathogenic Acinetobacter: from the cell surface to infinity and beyond. J Bacteriol. 2015;198(6):880–887. doi:10.1128/JB.00906-15.
- Leao AC, Menezes PR, Oliveira MS, Levin AS. Acinetobacter spp. are associated with a higher mortality in intensive care patients with bacteremia: a survival analysis. BMC Infect Dis. 2016Aug9;16:386. doi:10.1186/s12879-016-1695-8.
- Viana RE, Santos SG, Oliveira AC. Recovery of resistant bacteria from mattresses of patients under contact precautions. American Journal of Infection Control. 2016;44(4):465-469. doi: 10.1016/ j.ajic.2015.10.027.
- Rock C, Harris AD, Johnson JK, Bischoff WE, Thom KA. Infrequent air contamination with Acinetobacter baumannii of air surrounding known colonized or infected patients. Infect Control Hosp Epidemiol. 2015;36(3):830–832. doi:10.1017/ice.2015.68.
- Borges RM, Nunes CP. Infecções por acinetobacter baumannii em unidades de terapia intensiva. Revista de Medicina de Família e Saúde Mental. 2019;1(2):45-56.
- Trindade M, Vieira CD, Ferreira JF, Sousa JK, Haddad JPA, Farias JF, et al. Dynamic of Biofilm Formation on Surgical Clamps by Staphylococcus aureus and Acinetobacter baumannii Strains. British Journal of Medicine and Medical Research. 2017;19(7):1–9. doi:org/10.9734/BJMMR/2017/31167.
- Vieira PB, Picoli SU. Acinetobacter baumannii Multirresistente: Aspectos Clínicos e Epidemiológicos. Revista Brasileira de Ciências da Saúde, 2015;19(2):151–156. doi: 10.4034/RBCS.2015.19.02.10.
- Noto MJ, Boyd KL, Burns WJ, Varga MG, Peek RM Jr, Skaar EP. Toll-like receptor 9 contributes to defense against Acinetobacter baumannii infection. Infect Immun. 2015;Oct;83(10):4134–4141. doi:10.1128/IAI.00410-15.
- Kurihara MNL, Sales RO, Silva KE, Maciel WG, Simionatto S. Multidrug-resistant Acinetobacter baumannii outbreaks: a global problem in healthcare settings. Rev. Soc. Bras. Med. Trop. 2020;53:1-13. doi.org/10.1590/0037-8682-0248-2020.
- Alharbe R, Almansour A, Kwon DH. Antibacterial activity of exogenous glutathione and its synergism on antibiotics sensitize carbapenem-associated multidrug resistant clinical isolates of Acinetobacter baumannii. International Journal of Medical Microbiology. 2017;307(7):409–414. doi.org/10.1016/j.ijmm.2017.07.009.
- Mendes GF et al. Acinetobacter baumannii isolados em amostras de pacientes pediátricos internados em um hospital especializado em doenças infectocontagiosas. Brazilian Journal of Health Review, 2020;3(6):16849-60. doi.org/10.34119/bjhrv3n6-116.
- Pagano M, Martins AF, Barth AL. Mobile genetic elements related to carbapenem resistance in Acinetobacter baumannii. Brazilian Journal of Microbiology. 2016;47(4):785–792. doi:10.1016/j.bjm.2016.06.005.
- Leão AC. Impacto das bacteremias por Acinetobacter spp. em relação a bacteremias causadas por outras bactérias na sobrevida de pacientes internados em unidade de terapia intensiva. Tese de Doutorado. Universidade de São Paulo; 2015.
- Scarcella A, Scarcella AS, Berretta A. Infeccção relacionada a assistência a saúde associada a Acinetobacter baumannii: revisão de literatura. RBAC, 2017;49(1):18-21. doi: 10.21877/2448-3877.201600361.
- Vanegas-múnera M, Roncancio-villamil G, Jiménez-quiceno J. Acinetobacter baumannii: importancia clínica, mecanismos de resistencia y diagnóstico. Rev CES Med 2019;28(2):233-246.
- Dalmasio MRS. Aspectos epidemiológicos da espécie Acinetobacter baumannii no controle de infecções relacionadas à assistência à saúde: uma revisão da literatura. 2018. Disponível em:http://hdl.handle.net/1843/ICBB-BDASU4.
- Rigatto, MH. Polimixina B em comparação com outros antibióticos no tratamento da pneumonia e traqueobronquite associadas à ventilação mecânica causadas por Pseudomonas aeruginosa ou Acinetobacter baumannii. Dissertação de Mestrado. Universidade Federal do Rio Grande do Sul; 2011.
Correspondência
Yamine Maia de Queiroz
Escola superior da Amazônia (ESAMAZ) – Unidade Arcipreste
Rua Arcipreste Manoel Teododo, 820 – Batista Campos
Belém – PA, CEP: 66015-040
E-mail: [email protected]
