Perfil de sensibilidade antimicrobiana em urinoculturas de um hospital universitário do estado do Ceará no período de janeiro a junho de 2015
Antimicrobial sensitivity profile of urine cultures of a university hospital of the Ceará State in the period of January to June 2015
Darcielle Bruna Dias Elias1
Adriana Claudia de Sousa Ribeiro2
1Doutorado. Universidade Federal do Ceará – Fortaleza-CE, Brasil.
2Graduada em Farmácia pela Faculdade de Ensino e Cultura do Ceará – FAECE – Fortaleza-CE, Brasil.
Instituição: Hospital Universitário Walter Cantídeo – Universidade Federal do Ceará – Fortaleza-CE, Brasil.
Artigo recebido em 13/05/2017
Artigo aprovado em 18/10/2017
DOI: 10.21877/2448-3877.201700580
Resumo
Objetivo: Caracterizar o perfil dos principais microrganismos isolados estabelecendo uma relação dos antimicrobianos com melhor sensibilidade e maior resistência para os microrganismos mais prevalentes. Métodos: Realizou-se um estudo retrospectivo quantitativo baseado na análise do banco de dados. A pesquisa incluiu todos os indivíduos com uroculturas positivas realizadas nos meses de janeiro a junho de 2015 para a prevalência dos isolados. Os microrganismos isolados foram identificados e avaliados quanto à sensibilidade antimicrobiana por meio do equipamento Vitek II Compact (Biomérieux). Resultados: Observou-se uma prevalência de infecção do trato urinário (ITU) em indivíduos do sexo feminino. Os bacilos Gram-negativos foram os principais agentes causadores de ITU, principalmente as enterobactérias; destas, a mais prevalente foi Escherichia coli com o índice de 39,10% . Quanto à resistência encontramos nos Gram positivos uma maior taxa de resistência, frente aos antibióticos testados, o Staphylococcus saprophyticus com 100% no ácido fusídico, penicilina e ampicilina e 83% frente à eritromicina. Nos Gram- negativos encontramos as Pseudomonas, como microrganismos mais resistentes frente a todos os antimicrobianos testados, restando somente a amicacina com 80% de sensibilidade e ertapenem como melhor indicativo de tratamento. Conclusão: Conclui-se que o monitoramento da resistência e o estudo do perfil de sensibilidade das bactérias patogênicas contribuem com o acompanhamento farmacoterapêutico dos pacientes.
Palavras-chave
Antibacterianos; Testes de sensibilidade; Disco-difusão; Prevalência; Infecções urinárias
INTRODUção
O sistema urinário é composto por órgãos que regulam a composição química e o volume de sangue. Pela necessidade de um acesso ao ambiente externo, esse sistema fica susceptível às infecções por exposição a esse ambiente. Quando comparado à pele, o sistema urinário, por ser recoberto por membranas mucosas úmidas, torna-se mais susceptível ao crescimento de bactérias.(1) As infecções urinárias podem ser definidas como invasão e multiplicação de microrganismos nos tecidos do sistema urinário, podendo ser classificadas, quanto à topografia, em:
- a) altas – que envolvem o parênquima renal (pielonefrite) ou ureteres (uretrites) (2)
- b) baixas – que envolvem a bexiga (cistite), ureteres (uretrites), e, nos homens, a próstata (prostatite) e o epidídimo (epididimite)(2)
A diferença destes dois grupos (altas ou baixas) é importante tanto do ponto de vista de conduta como do prognóstico. Enquanto há necessidade de tratamento imediato para o primeiro grupo (altas), para o segundo grupo (baixas) não implica necessariamente tratamento, pois cerca de 25% delas passam espontaneamente, observando-se resultados negativos de uroculturas no período de um ano. Esse grupo geralmente é constituído de meninas em idade escolar (1% a 2%) e de mulheres jovens com vida sexual ativa (5%), sendo que existe grande probabilidade de desenvolverem ITU no futuro. Um grupo que merece seguimento pelo elevado risco de ITU são as gestantes, idosos e pacientes cateterizados, identificados com bacteriúria assintomática.(2)
Os sintomas incluem disúria (dificuldade, dor e urgência para urinar) e piúria (quantidade de bactérias aumentadas na urina). O risco dessas infecções é que elas podem evoluir migrando para os ureteres e afetar os rins, causando pielonefrite, uma inflamação de um ou de ambos os rins; os sintomas incluem febre e dores nas costas. No sexo feminino é mais frequente a complicação das infecções do trato urinário inferior ou cistite evoluírem para uma pielonefrite pelo fato de a uretra feminina ter menos de 5 cm de comprimento, e, por isso, os microrganismos a atravessam facilmente; além disso, há também a proximidade com o ânus e seus contaminantes. Essas considerações refletem o fato de que a taxa de infecção do sistema urinário em mulheres é cerca de oito vezes maior que em homens. Escherichia coli está presente em ambos os sexos.(1)
Dentre os mecanismos que contribuem para a esterilidade do trato urinário estão: o fluxo de urina; o pH ácido (5,5); a baixa osmolaridade; a presença de ureia e ácidos orgânicos fracos na urina são fatores que corroboram na inibição do desenvolvimento bacteriano. Entretanto, quando a mucosa do trato urinário sofre algum tipo de lesão, o pH e a osmolaridade da urina podem ser alterados (devido à inserção de instrumentos como o uso de cateteres) e durante a gravidez.(3)
O gênero Candida colabora para infecções do trato urinário causadas por fungos. Candida albicans é o fungo mais frequentemente encontrado nas urinoculturas, particularmente em pacientes diabéticos não tratados ou em indivíduos imunodeprimidos.(3)
A ITU é responsável por 35% a 45% de todas as infecções adquiridas no hospital, sendo essa a causa mais comum de infecção nosocomial. Dos pacientes que são hospitalizados, mais de 10% são expostos temporariamente à cateterização vesical de demora, sendo esse o fator isolado mais importante, pois predispõe esses pacientes à infecção do trato urinário.(3)
Pacientes internados desenvolvem ITU com mais frequência que pacientes ambulatoriais, tendo em vista as condições gerais da internação desses pacientes e a alta probabilidade de instrumentação do trato urinário, que são os maiores contribuintes para esta diferença. A importância da ITU hospitalar está na sua elevada frequência e, principalmente, por ser considerada a principal causa de bacteremia por Gram-negativo, considerado o maior disseminador das infecções hospitalares.(2,3)
A urocultura é considerada padrão-ouro no diagnóstico de ITU.(4) A infecção urinária é caracterizada pelo crescimento bacteriano de, no mínimo, 100 mil unidades formadoras de colônia (UFC) por mililitro de urina, sendo a urina colhida em jato médio e de maneira asséptica.(5) O conhecimento epidemiológico das ITUs e do padrão de sensibilidade/resistência dos agentes causais cresce em importância diante da falha no tratamento empírico. O teste de sensibilidade a antimicrobianos orienta a conduta terapêutica. A prevalência de resistência bacteriana aos antibióticos nas infecções comunitárias vem crescendo e esse crescente aumento de bactérias multirresistentes aos antimicrobianos representa um desafio no tratamento das infecções.(6)
O perfil de resistência bacteriana local contribui na escolha dos antimicrobianos, considerando a eficácia clínica ante um determinado grupo de bactérias, a prevalência de resistência local e os custos.(7) Estas avaliações têm sido úteis no controle de infecção tanto comunitária como hospitalar. Entretanto, estudos não recomendam a utilização de um determinado fármaco na terapia empírica quando a sua taxa de resistência local for superior a 20%.(8)
A resistência bacteriana aos antibióticos pode ser considerada uma manifestação natural devido ao processo evolutivo da adaptação genética de organismos que se alteram no seu próprio meio ambiente. Pode ocorrer naturalmente em consequência de vários fatores, como ausência de sítio específico, impermeabilidade da membrana ou parede celular para que o fármaco possa atuar; também pode ocorrer resistência adquirida, onde normalmente o microrganismo sensível a determinado fármaco torna-se resistente, adquirindo uma nova característica bacteriana de nova espécie.(3)
Algumas enterobactérias adquirem resistência por transmitirem seu material genético através dos plasmídeos, como é o caso da Escherichia coli e Klebsiella pneumoniae, desenvolvendo a capacidade de produzir bombas de resistência a múltiplos fármacos, as quais permitem bombear o fármaco para fora da célula bacteriana antes que ela possa ser destruída. Outro processo pelo qual ocorre resistência aos antibióticos, especificamente aos beta-lactâmicos, é a produção de beta-lactamases, enzima responsável pela perda da ação do antibiótico, como também pela ausência de receptores de penicilinas (PLPs), falta de ativação das enzimas autolíticas na parede celular e incapacidade de sintetizar peptidoglicano. Na intenção de combater os efeitos das beta-lactamases foram produzidos fármacos com inibidor para essa enzima, o qual se liga irreversivelmente à enzima, favorecendo a ação do antibiótico.(3)
Considerando a importância de todos esses aspectos, o presente trabalho tem por objetivo estudar os principais microrganismos encontrados, sua distribuição segundo o sexo e o perfil de sensibilidade antimicrobiano em urinoculturas dos pacientes no Hospital Universitário Walter Cantídio no período de janeiro a junho de 2015.
MATERIAL E MÉTODOS
Delineamento do estudo e coleta de dados
Realizou-se um estudo retrospectivo de caráter descritivo, transversal, com abordagem quantitativa. A presente pesquisa avaliou o perfil de sensibilidade de todas as amostras de urinoculturas positivas analisadas no período de janeiro a junho de 2015 no Hospital Universitário Walter Cantídio (HUWC). Os resultados foram retirados de relatórios diários, no laboratório de Análises Clínicas do HUWC. Foram excluídas da pesquisa amostras não identificadas ou coletadas em recipientes inadequados. Os resultados das amostras positivas foram retirados do equipamento Vitek II Compact (Biomérieux). Todas as amostras analisadas eram de pacientes atendidos nas unidades assistenciais da área hospitalar
O presente estudo avaliou os dados das amostras de uroculturas enviadas ao laboratório de microbiologia do Complexo Hospitalar da Universidade Federal do Ceará, no período de janeiro a junho de 2015, seguindo orientações adequadas de coleta e acondicionamento desse tipo de material. As amostras foram semeadas em meio de cultura cromogênio ágar (CPS) e incubadas a 37ºC em estufa por até 48 horas. Observou-se o possível crescimento de microrganismos nas primeiras 24 horas. Quando os microrganismos são significativos, as amostras já seguem para identificação e TSA (Teste de sensibilidade a antibióticos). Caso contrário, são reincubadas por mais 24 horas.
Processamento das amostras
As amostras foram coletadas seguindo as orientações de assepsia da região genital na intenção de eliminar contaminações do material enviado ao laboratório de microbiologia; a coleta foi realizada através de jato médio em frascos assépticos, preferencialmente pela manhã, quando há maior possibilidade de se concentrar a urina por permanecer um período maior na bexiga, ou, se a amostra for coletada no decorrer do dia, orientou-se o paciente a permanecer no mínimo por duas horas sem urinar.
Foram consideradas positivas as amostras que apresentarem 100.000 UFC/mL ou mais. Foram avaliados também casos especiais como nos pacientes transplantados e/ou imunocomprometidos com amostras apresentando aproximadamente 30.000UFC/mL. As bactérias foram identificadas de acordo com as normas recomendadas pela Sociedade Americana de Microbiologia.
Identificação dos isolados
Os microrganismos isolados foram identificados e avaliados quanto à sensibilidade antimicrobiana através do equipamento Vitek II Compact (Biomérieux). Para determinação e interpretação dos resultados seguiram-se todas as normativas estabelecidas pelo Clinical Laboratory Standards Institute – CLSI, 2015.
Os dados analisados foram realizadas por meio do Microsoft® Office®Excel.
A pesquisa seguiu todos os preceitos éticos conforme a Resolução 466/2012. Foi aprovada pelo Comitê de Ética em Pesquisa Clínica (CEP) do Hospital Universitário Walter Cantídio sob protocolo de número: 021.03.16
Número de amostras
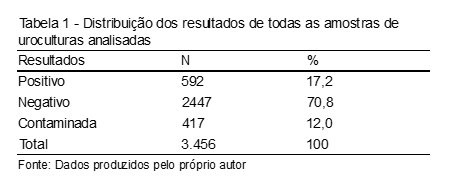
As amostras foram contabilizadas de acordo com os pacientes cadastrados no laboratório com solicitações de exames de uroculturas recebidas no setor de microbiologia, totalizando 3.456 uroculturas nesse período, sendo 592 com resultados positivos, 2.447 negativos e 417 contaminados.
Foram incluídas todas as amostras de uroculturas que possuíam microrganismos isolados sem contaminações e que puderam ser identificados.
Foram excluídas da pesquisa todas as amostras de uroculturas contaminadas, tendo como avaliação de contaminação a quantidade e crescimento de microrganismos diferentes na mesma amostra, impossibilitando o isolamento de bactérias para posterior identificação.
RESULTADOS
Foram realizadas 3.456 uroculturas no Laboratório de Microbiologia do Hospital Universitário Walter Cantídio, no período de janeiro a junho de 2015, sendo 592 (17,20%) positivas, 2.447(70,80%) negativas e 417 (12,0%) contaminadas. (Tabela 1)
Os microrganismos mais isolados estão distribuídos no Gráfico 1, tendo como maior frequência a Escherichia coli (39,10%) e Klebsiella pneumoniae (15,90%), seguidas da Proteus mirabilis (5,30%), Enterococcus faecalis (5,20%), Candida tropicalis (3,50%), Streptococcus agalactiae (3,50%), Pseudomonas aeruginosa (3,30%), Candida glabrata (3,20%), Enterobacter cloacae complex (2,30%), Staphylococcus saprophyticus (2,0%), Acinetobacter baumannii (1,80%), Morganella morganii ssp (1,50%), Candida parapsilosis (1,0%), Staphylococcus aureus (1,0%). Os outros microrganismos restantes (7,3%) correspondem a Acinetobacter haemolyticus (0,3%), Acinetobacter junii (0,2%), Acinetobacter lwoffii (0,3%), Candida lusitaniae (0,5%), Citrobacter freundii (0,2%), Citrobacter koseri (0,2%), Cryptococcus laurentii (0,2%), Cryptococcus neoformans (0,2%), Enterobacter aerogenes (0,8%), Enterobacter cloacae ssp cloacae (0,2%), Enterococcus faecium (0,8%), Enterococcus hirae (0,2%), Klebsiella pneumoniae ssp ozaenae (0,2%), Providencia stuartii (0,2%), Pseudomonas putida (0,5%), Salmonella group (0,2%), Serratia marcescens (0,3%), Sphingomonas paucimobilis (0,2%), Staphylococcus epidermidis (0,2%), Staphylococcus haemolyticus (0,2%), Staphylococcus hominis ssp hominis (0,5%), Stenotrophomonas maltophilia (0,5%), Stephanoascus ciferrii (0,2%).
Devido à baixa frequência de alguns microrganismos que foram isolados, foram selecionados os 14 mais frequentes. (Gráfico 1)
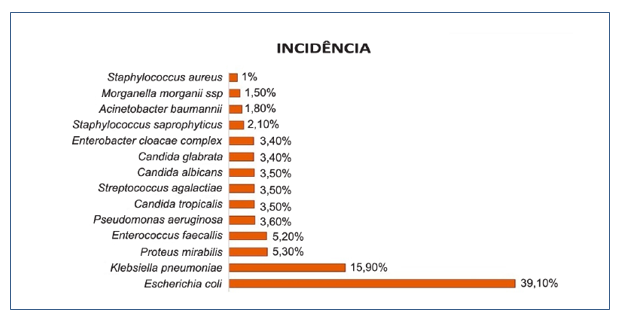
Gráfico1. Prevalência dos microrganismos isolados nas uroculturas.
Fonte: Dados produzidos pelo próprio estudo
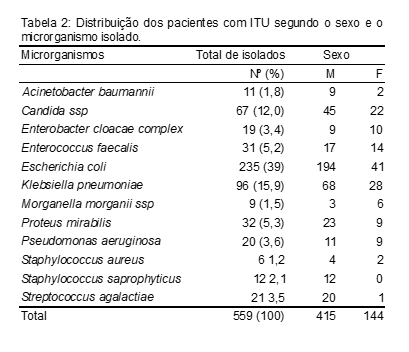
A Tabela 2 nos mostra a distribuição dos pacientes com ITU segundo o sexo e o microrganismo. Nela podemos observar que a prevalência da Escherichia coli, seguida da Klebsiella pneumoniae em ambos os sexos; logo depois temos a Candida ssp, Proteus mirabilis, Streptococcus agalactiae, Enterococcus faecalis no sexo feminino; no sexo masculino só altera a prevalência da Morganella morganii ssp.
Dos microrganismos analisados, 415 (74%) foram isolados de pacientes do sexo feminino e 144 (26%) do sexo masculino (Gráfico 2).
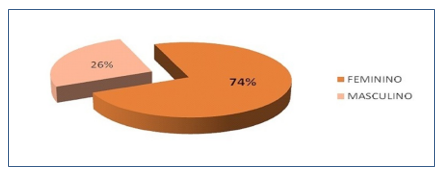
Gráfico 2. Incidência de ITUs distribuídas por sexo.
Fonte: Dados produzidos pelo próprio estudo
Nas culturas com crescimento bacteriano significativo foi realizado o teste de sensibilidade a antimicrobianos (TSA), utilizando as classes de antimicrobianos padronizadas, segundo o CLSI, para os microrganismos isolados.
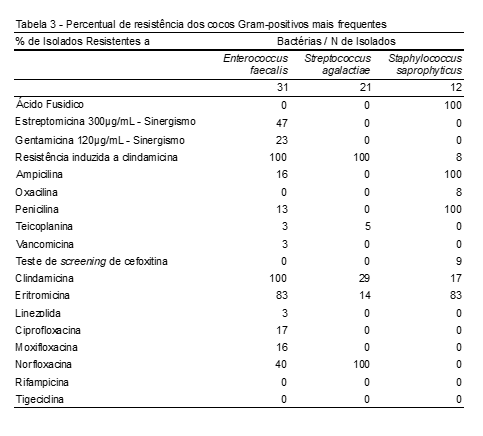
A Tabela 3 mostra os cocos Gram-positivos mais frequentes na ITU e, em relação à sua resistência, observamos que, para o ácido fusídico, a resistência foi encontrada apenas no Staphylococcus saprophyticus (100,0%). Já para os aminoglicosídeos, estreptomicina (47%) e gentamicina (23%), observamos apenas resistência ante Enterococcus faecalis, tendo a clindamicina a maior taxa de resistência – 100%.
Em relação à classe dos beta-lactâmicos tivemos maior taxa de resistência para penicilina (100%) para os isolados de Staphylococcus saprophyticus, e, para os isolados de Enterococcus faecalis, tivemos a ampicilina (16%) seguida da penicilina (13%).
Na clindamicina, as taxas de resistência ante os cocos Gram-positivos foram mais elevadas, sendo 100% para os isolados de Enterococcus faecalis, seguida de 29% ante as cepas de Streptococcus agalactiae e 17% ante as cepas de Staphylococcus saprophyticus. Das quinolonas testadas, a norfloxacina foi a que apresentou maiores taxas de resistência, tendo o Streptococcus agalactiae 100%, seguido do Enterococcus faecalis com 40%; esta cepa também teve resistência à ciprofloxacina (17%) seguida da voxifloxacina (16%).
No Gráfico 3 representamos os grupos de microrganismos estudados, onde as enterobactérias representaram 59,20%, os cocos Gram-positivos representaram 12,50%, as leveduras 12,0% e os bacilos Gram-negativos não fermentadores de glicose corresponderam a 16,30% .
De acordo com a Tabela 4, representando as bactérias Gram-negativas mais frequentes frente aos antimicrobianos testados, foi verificado o perfil de resistência. Podemos observar que, da classe dos aminoglicosídeos, o microrganismo encontrado mais resistente foi a Pseudomonas aeruginosa, sendo que a gentamicina (60%) apresentou a maior resistência em relação à amicacina (20%) frente a esse microrganismo.
Em relação aos beta-lactâmicos, a ampicilina/sulfabactam, uma aminopenicilina associada contra cepas produtoras de beta-lactamases, apresentou maior resistência ante os microrganismos isolados Proteus mirabilis (100%), Pseudomonas aeruginosa (100%), Morganella morganii (100%), Enterobacter aerogenes (100%), Enterobacter cloacae (100%), seguidos de Klebsiella pneumoniae (76%) e Escherichia coli (67%). Quanto à ampicilina, mostrou maior resistência ante os microrganismos isolados Klebsiella pneumoniae (100%), Pseudomonas aeruginosa (100%), Morganella morganii (100%), Enterobacter aerogenes (100%), Enterobacter cloacae (100%), seguidos da Escherichia coli (71%) e Proteus mirabillis (41%).
A Morganella morganii e a Enterobacter cloacaese apresentaram maior resistência à classe dos carbapenêmicos, onde o imipenem apresentou maior percentual de resistência, com 100%. Também foram resistentes a Klebsiella pneumoniae (72%), Pseudomonas aeruginosa (62%), Proteus mirabillis (50%) e Escherichia coli (33%) frente a esse antimicrobiano.
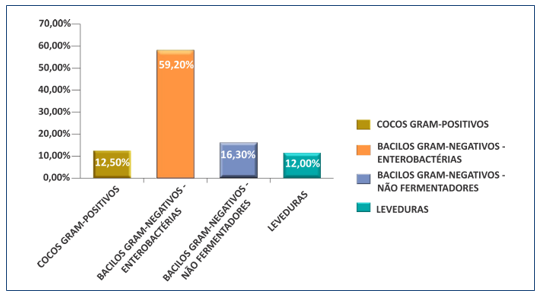
Gráfico 3. Frequência dos grupos de microrganismos isolados.
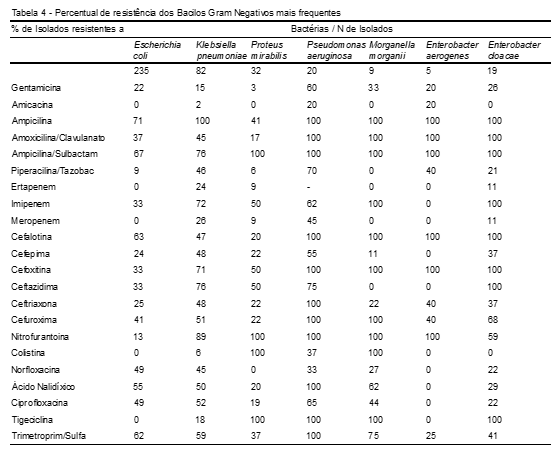
Nas cefalosporinas, o microrganismo que se apresentou mais resistente a essa classe de beta-lactâmicos foi a Pseudomonas aeruginosa seguida de Morganella morganii, sendo a cefalotina com 100%, cefoxitina com 100% e cefuxocima com 100%; os que obtiveram maior resistência em ambos os isolados, no Enterobacter cloacae e Enterobacter aerogenes, ambos tiveram resistência a cefalotina (100%) e cefoxitina (100%) .
Para a nitrofurantoína encontramos os seguintes percentuais de resistência: 100%, 89%, 59% e 13%, apresentando maior resistência nos isolados Pseudomonas aeruginosa, Morganella morganii, Enterobacter aerogenes, Proteus mirabillis seguidos da Klebsiella pneumoniae, Enterobacter cloacae, respectivamente.
A colistina foi mais resistente no Proteus mirabilis e Morganella morganii, apresentando 100% dos isolados resistentes.
Das quinolonas testadas, a Pseudomonas aeruginosa teve maior resistência, seguida da Klebsiella pneumoniae, sendo que a nitrofurantoína apresentou 100% de resistência nos dois isolados. A tigeciclina foi encontrada mais resistente no Proteus mirabilis, Pseudomonas aeruginosa, Morganella morganii e Enterobacter cloacae com 100% das cepas resistentes.
Para o antibiótico trimetroprim/sulfa, a Pseudomonas aeruginosa foi mais resistente (100%), seguida da Morganella morganii (75%).
DISCUSSÃO
A importância da utilização e monitoramento do padrão de sensibilidade/resistência dos antimicrobianos frente aos microrganismos cresce diante das falhas no tratamento que, na maioria das vezes, é empírico; no entanto, a orientação de uma nova conduta terapêutica favorece o sucesso na terapia. O crescente aumento de bactérias resistentes a vários antimicrobianos representa um enorme desafio aos profissionais da área da saúde no tratamento das infecções, necessitando, portanto, de revisões e análises periódicas.(4)
Observou-se em nosso trabalho uma alta incidência de contaminações, com 417 (12%) amostras advindas provavelmente do transporte e coletas inadequadas, tendo em vista que muitos dos pacientes atendidos no laboratório trazem as amostras coletadas em casa e não há um ambiente adequado para que os mesmos coletem no próprio laboratório, como orienta Boas Práticas em Microbiologia Clínica – 2015, esclarecendo que o método de coleta de urina, usualmente, em pacientes ambulatoriais, é passível de contaminação com a microbiota genital.(9)
A forma mais correta de coleta tem relação direta com a diminuição nos índices de contaminação. O ideal é que se realize a coleta no próprio laboratório, e não em casa, visando eliminar o viés gerado pelo aumento da contagem de colônias durante o transporte. Vale lembrar que o transporte em temperatura inadequada pode alterar significativamente a contagem bacteriana, levando a culturas falso-positivas.(10)
Dos resultados de uroculturas positivas foi encontrada maior incidência em mulheres (74%) do que em homens (26%), representados no Gráfico 2 , segundo o estudo de Silveira et al.(11) Hörner(12) observou um maior número de infecções urinárias em mulheres (62,4%) do que nos homens (27,6%). Em consequência das suas características anatômicas, menor tamanho da uretra e sua localização ser próxima da região perianal, há uma predisposição dos indivíduos deste sexo a infecções urinárias, colaborando para que este dado seja predominante na maioria dos estudos realizados no mundo todo ao longo de muitos anos.(13,14)
No estudo de Hörner et al.(12) foram encontrados resultados semelhantes à Escherichia coli (52,1%) e Klebsiella pneumoniae (5,4%), Proteus mirabilis (2,71%), Enterococcus faecalis (5,4%), Streptococcus agalactiae (1,8%), Pseudomonas aeruginosa (6,8%), Enterobacter cloacae complex (4,8%), Staphylococcus saprophyticus (2,071%), Acinetobacter baumannii (1,6%), Morganella morganii ssp (0,9 %) e Staphylococcus aureus (3,6%); esses resultados corroboram com os resultados desse estudo, representado no Gráfico 1. Essa semelhança só difere do patógeno Pseudomonas aeruginosa (6,8%) que se apresenta em maior frequência que Proteus mirabilis (2,71%). Já para Candida sp. foram encontrados 3,3% no estudo de Barros et al.(15)
Nossos resultados evidenciaram no presente estudo que os bacilos Gram-negativos foram os principais agentes causadores de ITU, principalmente as enterobactérias; destas, a de maior incidência isolada nas uroculturas, a Escherichia coli, representando 39,10%, seguida da Klebsiella pneumoniae com 15,90% do total de amostras positivas. Na literatura encontramos estas bactérias como agentes mais frequentes no estudo de Barros,(15) Oliveira,(3) Pires et al.,(4) e Santana.(16) Segundo Koch,(17) Escherichia coli é a bactéria mais incidente em infecções urinárias no mundo inteiro, corroborando com esse estudo.
Em relação às bactérias Gram-positivas isoladas das uroculturas em nosso estudo, encontramos o ácido fusídico resistente somente frente a S. saprophyticus. Das quinolonas, a norfloxacina obteve maior resistência frente a Streptococcus agalactiae (100%) e Enterococcus faecalis (40%); já a ciprofoxacina e a moxifloxacina encontraram uma resistência menor frente ao Enterococcus faecalis, com 17% e 16% respectivamente.
Segundo Hörner et al.,(12) somente os antimicrobianos rotineiramente usados em ITU foram testados – levofloxacino, ciprofloxacina e norfloxacino. O microrganismo que obteve melhor sensibilidade, com 100%, 90,2% e 91,6%, respectivamente, frente a esses antimicrobianos, foi o Staphylococcus saprophyticus. Observando os dois trabalhos, o ciprofloxacino sugere melhor opção terapêutica para Enterococcus faecalis.
Os bacilos Gram-negativos foram os principais agentes causadores de ITU, destacando-se as enterobactérias; destas, a de maior incidência foi Escherichia coli com o índice de 39,10%. O resultado obtido corrobora com o estudo de Araújo et al.,(14) que apresentou 58,75%. Santana et al.(16) também encontraram em seus estudos a prevalência da E. coli com índices de 90%. A segunda mais prevalente foi a Klebsiella pneumoniae (15,9%), seguida do Proteus mirabilis e Pseudomonas aeruginosa, embora esta última tenha sido a de menor incidência entre as anteriores. Foi evidenciada em nossos estudos uma resistência bastante expressiva frente aos antimicrobianos testados.
Observamos que, das classes dos aminoglicosídeos, o microrganismo encontrado mais resistente foi a Pseudomonas aeruginosa, sendo que a gentamicina (60%) apresentou a maior resistência em relação à amicacina (20%). Verificou-se uma resistência antimicrobiana em relação ao sulfazotrim (56%) e imipenem (26%), segundo Roriz-Filho.(18) No entanto, quase todos os antimicrobianos testados tiveram uma resistência elevada ante esse microrganismo, restando somente a amicacina com 80% de sensibilidade e o ertapenem como melhor indicativo para o tratamento de ITU desse microrganismo, sendo esse um fator preocupante, pelo fato de os carbapenêmicos serem uma das últimas opções terapêuticas indicadas.(19)
Em várias literaturas está evidente a preocupação com a capacidade elevada da Pseudomonas aeruginosa em criar mecanismos de resistência aos antimicrobianos. Sabe-se que esse microrganismo encontra-se amplamente disseminado nos ambientes hospitalares, bem como formulando meios de escapar dos mecanismos de defesa do hospedeiro. A primeira escolha de antibióticos para esse microrganismo quase sempre são beta-lactâmicos, incluindo as cefalosporinas, carbapenêmicos e as cefalosporinas; no entanto, esse microrganismo mostrou-se resistente a quase todos estes antibióticos.(14,20)
CONCLUSÃO
De modo geral, em nosso estudo, dentre os grupos de microrganismos, as enterobactérias representaram maior incidência, sendo a Escherichia coli a bactéria mais prevalente, os cocos Gram-positivos representaram o segundo grupo, tendo como mais prevalente Enterococcus faecalis. Embora a Escherichia coli represente em maior incidência, alguns antimicrobianos ainda são eficazes para o tratamento das ITUs para esse microrganismo, porém o fator mais preocupante nesse estudo foi a resistência a muitos antimicrobianos frente a Pseudomonas aeruginosa. As bactérias revelaram resistência a muitos antibióticos frequentemente utilizados na prática clínica, e o presente estudo mostrou que o perfil de sensibilidade e resistência antimicrobiana é de extrema importância para vigilância constante do aparecimento de novas cepas bacterianas resistentes e debelar infecções causadas pelas mesmas, diminuindo assim as infecções nosocomiais e os custos com terapias antimicrobianas.
CONSIDERAÇÕES FINAIS
O estudo epidemiológico dos uropatógenos e o estabelecimento do perfil da sensibilidade aos antimicrobianos contribuem significantemente no tratamento das ITU. Trabalhos como esse devem ser realizados com certa periodicidade, para que se possa ter um controle maior dessas taxas de resistências, norteado pelas bases microbiológicas para uma boa terapêutica das infecções bacterianas.
Abstract
Objective: To characterize the profile of the main isolated microorganisms establishing a relation of antimicrobials with better sensitivity and greater resistance for the most prevalent microorganisms. Methods: A quantitative retrospective study was carried out based on the analysis of the database. The survey includes all individuals with positive urocultures performed from January to June 2015 for the prevalence of isolates. The isolated microorganisms were identified and evaluated for antimicrobial sensitivity through the Vitek II Compact (Biomérieux) equipment. Results: A prevalence of UTI was observed in female subjects. Gram negative bacilli were the main causative agents of UTI, especially enterobacteria, of which the most prevalent was Escherichia coli with a rate of 39.10%. As resistance was found in the Gram positive bacteria with the highest resistance against the antibiotics tested was Staphylococcus saprophyticus 100% in fusidic acid, penicillin and ampicillin, 83% against erythromycin. In Gram negative we found Pseudomonas aeruginosa as the most resistant microorganisms against all antimicrobials tested, leaving only amicacine with 80% sensitivity and ertapenem as the best indication of treatment. Conclusion: It is concluded that the monitoring of resistance and the study of the sensitivity profile of the pathogenic bacteria contribute to the pharmacotherapeutic follow-up of the patients.
Keywords
Antimicrobial; Susceptibility tests; Disk diffusion; Prevalence; Urinary tract infections
REFERÊNCIAS
- Tortora GJ. Microbiologia. 10ª Edição; Porto Alegre: Artmed, 2012.
- Brasil. Agência Nacional da Vigilância Sanitária – Anvisa. Manual de Microbiologia Clinica para o Controle de Infecção Relacionada à Assistência a Saúde: Procedimentos Laboratoriais da requisição do exame a análise microbiológica e laudo final. Brasília: Anvisa, 2013. 101p.
- Oliveira AC, Silva ACO. Prevalência de infecção do trato urinário relacionada ao cateter vesical de demora em pacientes de UTI. Revista de Pesquisa em Saúde. 2010;11(1):27-1.
- Pires MCS, Frota KS, Martins PO Jr, Correia AF, Cortez-Escalante JJ, Silveira CA. Prevalência e suscetibilidades bacterianas das infecções comunitárias do trato urinário, em Hospital Universitário de Brasília, no período de 2001 a 2005. Rev. Soc. Bras. Med. Trop., 2007;40(6):643-47.
- Braoios A, Turatti TF, Meredija LCS, Campos TRS, Denadai FHM. Infecções do trato urinário em pacientes não hospitalizados: etiologia e padrão de resistência aos antimicrobianos. J. Bras. Patol. Med. Lab.. 2009;45:449-56.
- Sato AF, Svidzinski AE, Consolaro MEL, Boer CG. Nitrito urinário e infecção do trato urinário por cocos gram-positivos. J Bras Patol Med Lab . 2005;41(6):397-404.
- Bail L, Esmerino LA, Ito CAS. Infecções do trato urinário: comparação entre o perfil de susceptibilidade e a terapia empírica com antimicrobianos. Rev. Bras. Anal. Clin. 2006;38:51-56.
- De Francesco MA, Ravizzola G, Peroni L, Negrini R, Manca N. Urinary tract infections in Brescia, Italy: Etiology of uropathogens and antimicrobial resistance of common uropathogens. Med Sci Monit. 2007;13(6):BR136-44.
- Levy CE. Manual de Microbiologia Clínica Para o Controle de Infecção Hospitalar em Serviço de Saúde. 1ª edição; Brasília (DF): Agência Nacional de Vigilância Sanitária , 2004.
- Cardoso CL, Muraro CB, Siqueira VLD, Guilhermetti M. Simplified technique for detection of significant bacteriuria by microscopic examination of urine. J Clin Microbiol. 1998 Mar;36(3):820-3.
- Silveira SA, Araújo MC, Fonseca FM, Okura HM, Oliveira ACS. Prevalência e suscetibilidade bacteriana em infecções do trato urinário de pacientes atendidos no Hospital Universitário de Uberaba. Rev. Bras. Anal. Clin. 2010;42(3):157-60.
- Horner R, Vissotto R, Mastella A, Salla A, Dal Forno NLF, Righi RA, et al. Prevalência de microrganismos em infecções do trato urinário de pacientes atendidos no Hospital Universitário de Santa Maria. Rev. Bras. Anal. Clin. 2006;38(3):147-50.
- Rodrigues FJB, Barroso APD. Etiologia e sensibilidade bacteriana em infecções. Rev Port Saúde Pública. 2011;29(2):23-131.
- Araújo AK, Queiroz AC. Análise do perfil dos agentes causadores de infecção do trato urinário e dos pacientes portadores, atendidos no Hospital e Maternidade Metropolitano J. Health Sci. Inst. 2012;30:7-12.
- Barros LM, Bento JNC, Caetano JÁ, Moreira RAN, Pereira FGF, Frota NM F, et al. Prevalência de micro-organismo e sensibilidade antimicrobiana de infecções hospitalares em unidade de terapia intensiva de hospital público no Brasil. Rev. ciênc. farm. básica apl. 2012;33(3):429-35.
- Santana TCFS, Pereira EMM, Monteiro SG, Carmo MS, Turri RJG, Figueiredo PMS. Prevalência e resistência bacteriana aos agentes antimicrobianos de primeira escolha nas infecções do trato urinário no Município de São Luís-MA. Rev. Patol. Trop.2012;41 (4): 409-418.
- Koch CR, Ribeiro JC, Schnor OH, Zimmermann BS, Müller FM, D’Agostin J, et al. Resistência antimicrobiana dos uropatógenos em pacientes ambulatoriais. Rev. Soc. Bras. Med. Trop. 2008; 41(3): 277-81.
- Roriz-Filho JS, Vilar FC, Mota LM, Leal CL, Pisi PCB. Infecção do trato urinário. Revista da Faculdade de Medicina de Ribeirão Preto e do Hospital das Clínicas da FMRP da Universidade de São Paulo. 2010;43(2):118-25.
- Muller EV, Santos D F, Correa NAB. Prevalência de microrganismos em infecções do trato urinário de pacientes atendidos no laboratório de análises clínicas da Universidade Paranaense-Umuarama-PR Rev. Bras. Anal. Clin. 2008; 40(1): 35-7.
- Vieira JMS, Saraiva RMC, Mendonça LCV, Fernandes VO, Pinto MRC, Vieira ABR. Suscetibilidade antimicrobiana de bactérias isoladas de infecções do trato urinário de pacientes atendidos no Hospital Universitário Bettina Ferro de Souza, Belém – PA. Rev. Bras. Anal. Clin. 2007;39(2):119-121.
Correspondência
Darcielle Bruna Dias Elias
Rua Capitão Francisco Pedro, 1314-1394 – Rodolfo Teófilo
60430-372 – Fortaleza-CE, Brasil
