Prevalência de infecções fúngicas em um laboratório de análises clínicas da cidade de Veranópolis, Rio Grande do Sul
Prevalence of the fungal infecctions in a clinical analysis laboratory in the city of Veranópolis, Rio Grande do Sul
Gabriela Pigatto1
Otávio Von Ameln Lovison2
Fernanda Cattani3
1Biomédica. Faculdade Cenecista de Bento Gonçalves – CNEC Bento. Bento Gonçalves-RS, Brasil.
2Farmacêutico bioquímico. Especialista em Microbiologia Clínica, Laboratório de Pesquisa em Resistência Bacteriana (LABRESIS). Porto Alegre-RS, Brasil.
3Biomédica. Docente do Curso de Biomedicina, Faculdade Cenecista de Bento Gonçalves – CNEC Bento. Bento Gonçalves-RS, Brasil.
Instituição: Faculdade Cenecista de Bento Gonçalves – CNEC Bento. Gonçalves-RS, Brasil.
Recebido em 26/11/2018
Artigo aprovado em 08/08/2019
DOI: 10.21877/2448-3877.201900794
INTRODUÇÃO
Os fungos estão amplamente distribuídos na natureza e contam com variados fatores favoráveis à sua dispersão, incluindo vento, água, alimentos e animais.(1) Apesar de diversos fungos serem parte da microbiota normal, quando estes microrganismos encontram fatores locais ou sistêmicos predisponentes podem invadir tecidos e tornarem-se patogênicos.(1-3)
Atualmente, com os avanços da medicina que permitem a sobrevida de pacientes críticos e imunocomprometidos, submetidos à terapia com antimicrobianos de amplo espectro, bem como o uso de agentes citotóxicos e imunossupressores, as infecções fúngicas têm sido consideradas um problema de saúde pública, devido à alta prevalência e o aumento na incidência na última década.(1,4,5)
O espectro das doenças fúngicas abrange desde infecções cutâneas superficiais e mucosas a processos altamente invasivos, associados a patógenos sistêmicos clássicos e oportunistas.(2) Os principais fatores predisponentes para a ocorrência destas infecções envolvem as condições climáticas favoráveis ao desenvolvimento dos fungos. A prevalência das espécies pode variar de acordo com o clima e as características culturais e socioeconômicas da população, além de hábitos ocupacionais e de lazer.(5-7)
O Brasil, por ser um país de clima tropical e subtropical, possui altos índices de infecções causadas por fungos, principalmente, micoses superficiais e cutâneas.(5,8,9) No entanto, as infecções fúngicas não figuram entre as doenças de notificação compulsória no país, deste modo, não se tem ideia exata da extensão do problema na saúde pública. Tal fato aponta para a necessidade da realização periódica de levantamentos de frequência destas infecções e de seus agentes etiológicos em função dos fatores socioeconômicos, geográficos e climáticos.(5,9)
O conhecimento da epidemiologia das doenças fúngicas e suas causas pode contribuir na implementação de medidas preventivas na saúde pública, a fim de evitar o aumento destas infecções e a ocorrência de microepidemias, e, dessa forma, melhorar a qualidade de vida da população.(6,8,9)
Dados epidemiológicos de infecções fúngicas foram publicados em diversas regiões do Brasil nos últimos anos, onde foi possível verificar variações dos agentes etiológicos conforme a região analisada.(5,6,9,10,11) Contudo, não se tem registros sobre doenças fúngicas na região da Serra Gaúcha, onde as condições bioclimáticas são favoráveis ao desenvolvimento de tais infecções.
Dentro desse contexto, o presente estudo teve como objetivo determinar a prevalência das infecções fúngicas em pacientes atendidos em um laboratório de análises clínicas localizado na cidade de Veranópolis, Rio Grande do Sul.
MATERIAL E MÉTODOS
Foi realizado um estudo retrospectivo, documental e descritivo com abordagem quantitativa a partir dos laudos de exames micológicos de pacientes atendidos em um laboratório de análises clínicas localizado na cidade de Veranópolis, RS, no período de abril de 2014 a abril de 2017.
A metodologia utilizada pelo laboratório coparticipante para a realização do exame micológico direto (EMD) foi a clarificação do material biológico com uma solução aquosa de hidróxido de potássio (KOH) a 10%-20%, e, para a realização do exame cultural, o material foi semeado em tubos contendo Ágar Mycosel (BBL)® ou Ágar Sabouraud dextrose (ASD), sendo estes meios selecionados de acordo com o tipo de amostra e a suspeita clínica condizentes aos aspectos observados no exame microscópico, conforme orientação da Agência Nacional de Vigilância Sanitária (Anvisa).(1)
Os dados coletados nos laudos foram referentes ao gênero, faixa etária, sítio anatômico acometido, resultado do exame direto e resultado da cultura fúngica. Foram excluídos laudos que não continham informações acerca destas variáveis, bem como exames nos quais os pacientes haviam feito uso de antimicóticos, tópicos ou sistêmicos, anteriores à coleta do material biológico.
Este estudo não envolveu risco a nenhum dos pacientes envolvidos, pois se tratou de uma pesquisa documental em banco de dados do laboratório, sem qualquer acesso à identidade dos pacientes, não havendo violação de direitos de privacidade durante a sua realização. Os dados obtidos foram tabulados e apresentados através de frequência absoluta e relativa, sendo analisados através de estatística descritiva simples.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa da Faculdade Cenecista de Bento Gonçalves, conforme parecer nº 2.504.300.
RESULTADOS
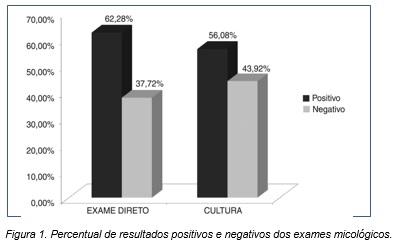
Foi analisado um total de 403 laudos de exames micológicos. Ambos os exames (EMD e cultura) tiveram percentuais de positividade e negatividade próximos, sendo 62,28% (251) positivos e 37,72% (152 amostras) negativos no EMD, e 56,08% (226 amostras) positivos e 43,92% (177 amostras) negativos no exame cultural (Figura 1).
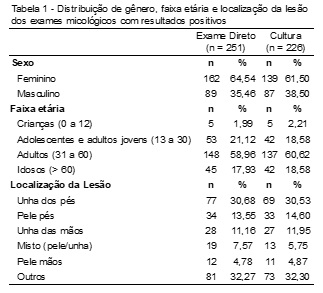
Em relação ao gênero dos pacientes com exame direto e culturas positivas, a maioria foi, respectivamente, do sexo feminino, com 64,54% (162/251) e 61,50% (139/226) de frequência, como demonstrado na Tabela 1.
Foram analisados laudos de exames micológicos de pacientes de idades aleatórias, sendo relatados resultados positivos em pacientes de 2 a 84 anos para ambos os exames. O grupo mais afetado, tanto no EMD quanto no cultivo, foram adultos de 31 a 60 anos, representando 58,96% (148/251) e 60,62% (137/226) respectivamente (Tabela 1).
As unhas dos pés corresponderam ao sítio anatômico mais afetado por infecções fúngicas, representando 30,68% (77/251) e 30,53% (69/226) dos casos em ambos os exames (Tabela 1).
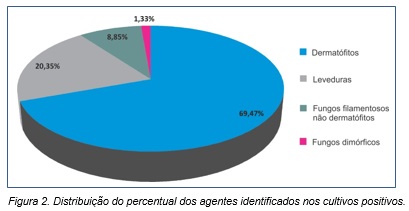
Quanto aos agentes etiológicos, as espécies mais isoladas foram os fungos dermatófitos, representando 69,47% (157/226) das culturas positivas (Figura 2).
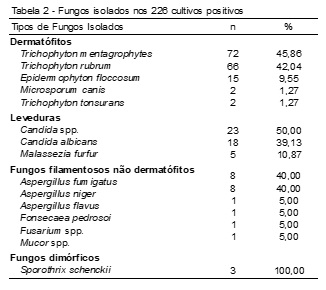
Entre as amostras positivas para fungos dermatófitos, 45,86% (72/157) dos casos foram causados pela espécie Trichophyton mentagrophytes. Dentre as leveduras isoladas, 50,00% (23/46) dos casos foram causadas pelo gênero Candida, enquanto que entre os fungos filamentosos não dermatófitos, os agentes mais isolados foram Aspergillus fumigatus e Aspergillus niger, ambos com 40,00% (8/20) de frequência. Quanto aos fungos dimórficos, Sporothrix schenckii foi a única espécie isolada, tendo 100,00% (3/3) de frequência nos casos identificados (Tabela 2).
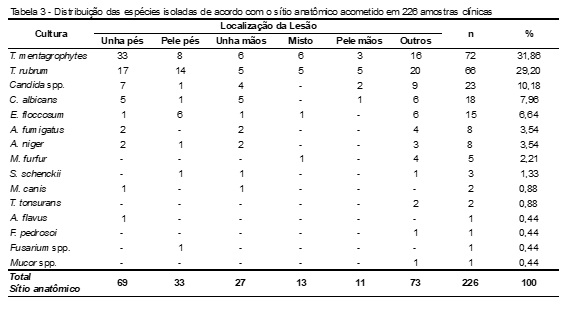
Na Tabela 3 podemos observar que o fungo mais prevalente nas lesões fúngicas foi o T. mentagrophytes, representando 31,86% (72/226) dos agentes isolados nas amostras. No que diz respeito às regiões anatômicas afetadas, foi possível relacionar diferentes sítios para a maioria dos agentes fúngicos isolados. Quanto às lesões nos pés, tanto na região ungueal como na pele, os dermatófitos T. mentagrophytes e T. rubrum foram os agentes mais isolados, bem como as leveduras do gênero Candida, também encontradas nestes sítios (Tabela 3).
DISCUSSÃO
Os resultados mostram uma prevalência de micoses superficiais e cutâneas diagnosticadas na rotina laboratorial, com predomínio de infecções causadas por fungos dermatófitos (69,47%), em concordância a estudos anteriores realizados em outras regiões do país.(3,12,13) Por outro lado, diversos autores relataram em suas publicações maior prevalência de micoses causadas por leveduras, especialmente as pertencentes ao gênero Candida.(10,11,14,15)
As dermatofitoses são infecções causadas por espécies de fungos dermatófitos pertencentes aos gêneros Trichophyton, Microsporum e Epidermophyton.(2) Neste estudo, T. mentagrophytes foi o dermatófito isolado com maior frequência (45,86%), corroborando com os resultados encontrados por Schoeler et al.(7) e Morais e Aquino,(16) com um percentual de 52% e 58,8%, respectivamente, enquanto que no estudo de Fajardo et al.,(11) realizado em Itajaí (SC), a prevalência foi ainda maior, chegando a 90,5%. Em contrapartida, em vários outros estudos foi evidenciada uma predominância de T. rubrum em relação ao T. mentagrophytes.(3,6,8,12,13,15,17) Este fato demonstra a possibilidade de variação das espécies em um mesmo local geográfico, dependendo também de fatores como condições climáticas, práticas sociais, hábitos de higiene e frequência de contato com animais.(17,18)
As dermatofitoses têm ocorrência mundial e embora a maior parte da literatura descreva um predomínio de T. rubrum, como relatado em pesquisas realizadas na Venezuela(19) e na Índia,(20) alguns estudos realizados em outros países demonstraram maior prevalência da espécie T. mentagrophytes,(21-23) entretanto, em outro estudo realizado na Grécia,(24) o dermatófito mais isolado foi M. canis, evidenciando novamente a variação dos agentes etiológicos das dermatofitoses conforme a região geográfica, não somente no Brasil, mas em todo o mundo.
As leveduras também podem desenvolver micoses cutâneas, em especial as espécies do gênero Candida, devido à sua presença na pele saudável como componente da microbiota normal humana.(4) A transmissão pode ocorrer facilmente nos indivíduos imunocomprometidos ou que possuam traumas cutâneos, possibilitando portas de entrada para o desenvolvimento de infecções superficiais, como reportado neste estudo, bem como para afecções mais graves, como a candidemia.(2,6,10) Por essa razão, Candida spp. constituem o grupo mais importante de patógenos oportunistas, sendo considerados os principais agentes de infecções relacionadas à assistência à saúde (IRAS).(1,25) No presente estudo, as espécies do gênero Candida corresponderam à metade das leveduras isoladas nos cultivos (50,00%), em concordância com os resultados encontrados por Souza et al.(14) em um estudo realizado em Goiânia (GO), onde 56,7% dos casos de micoses observadas foram causados por estas leveduras.
As espécies do gênero Malassezia são frequentemente encontradas nas regiões tropicais e subtropicais, causando a Ptiríase versicolor, uma das principais micoses superficiais descritas na literatura. Manifestam-se clinicamente por lesões com colorações variáveis, geralmente no tórax, membros superiores, pescoço e face de adultos jovens, sem distinção de sexo.(2,4) Neste trabalho, houve pouca prevalência de casos ocasionados por Malassezia spp. (10,87%), corroborando com os resultados encontrados por Coelho et al.,(12) onde a Ptiríase representou 9,0% das micoses diagnosticadas, enquanto que no estudo de Araújo et al.,(9) realizado no Nordeste do país, houve um percentual um pouco maior de casos positivos causados por estas espécies (27,92%). A baixa prevalência se deve a esta levedura raramente ser isolada em cultura, ficando seu diagnóstico restrito ao exame micológico direto.
Os fungos filamentosos não dermatófitos, geralmente são mais prevalentes em áreas quentes e com umidade, como zonas de clima tropical e subtropical, causando principalmente lesões em unhas e em espaços interdigitais dos pés.(2) Podem acometer com mais frequência indivíduos imunodeprimidos, entretanto, também podem causar infecções em pacientes imunocompetentes, especialmente em áreas rurais quando há manuseio de solo e plantas.(2,10) A frequência destes patógenos, de acordo com alguns autores, oscila entre 1% a 15% das micoses diagnosticadas, corroborando com os achados encontrados neste estudo (8,85%).(14,15,19) A prevalência reduzida desse grupo quando relacionado às dermatofitoses e micoses ocasionadas por leveduras já foi evidenciada em outras publicações na região sul do Brasil, onde se verificaram poucos casos de fungos não dermatófitos nas amostras analisadas.(11,12)
Além das micoses superficiais e cutâneas, foram isolados alguns casos de infecções subcutâneas causadas por S. schenckii e F. pedrosoi, representando 1,33% e 0,44%, respectivamente, dos microrganismos isolados. Estes fungos acometem animais ou humanos, sendo encontrados no solo, madeira e vegetais em decomposição. São adquiridos inicialmente por inoculação direta após ocorrência de traumatismos diversos. A exposição é, em sua maioria, ocupacional, afetando especialmente pessoas que trabalham em áreas rurais. A infecção pode se apresentar como lesão limitada à derme e ao tecido celular subcutâneo, ou pode disseminar-se para tecidos adjacentes, por via linfática ou hematogênica.(2,4,26) Não foram relatados casos de infecções subcutâneas em outros estudos realizados no Rio Grande do Sul, entretanto, as infecções reportadas neste estudo, embora com baixa prevalência, sugerem a contaminação dos pacientes através do contato com solo e material contaminado, visto que grande parte da população da região da Serra trabalha na agricultura e reside em áreas rurais. Deste modo, o uso de ferramentas apropriadas para a manipulação do material vegetal, assim como a remoção de focos na natureza, se fazem necessários para a contenção de possíveis epidemias.
Em relação à eficiência de diagnóstico das metodologias utilizadas neste estudo para o EMD e cultura fúngica, quanto ao meio Ágar Mycosel (BBL)®, ambas são utilizadas na maioria das rotinas laboratoriais e se apresentaram em concordância com percentuais de positividade próximos (62,28% EMD e 56,08% cultura), o que corrobora com os resultados encontrados por Morais e Aquino(16) em estudo semelhante realizado na região litoral do Rio Grande do Sul, onde também obtiveram valores aproximados de positividade para estas metodologias em suas amostras. A positividade no exame micológico direto com ausência de crescimento em cultura pode ser relacionada ao uso prévio de medicamentos antifúngicos sem prescrição médica, não relatada pelos pacientes no momento da coleta, o que poderia ter induzido resultados laboratoriais falso-negativos. Além disso, deve-se ressaltar que os meios de cultura empregados contêm os inibidores cicloheximida e cloranfenicol, que impedem o crescimento de bactérias e fungos contaminantes que poderiam prejudicar o isolamento dos patógenos, o que evita que a microbiota do indivíduo interfira no resultado final.(1,12,15)
Houve uma maior ocorrência de positividade em pacientes do sexo feminino (64,54% EMD e 61,50% cultura), resultado também observado em cidades como Porto Alegre (RS), Itajaí (SC), Goiânia (GO) e São José do Rio Preto (SP).(10,11,14,15) Em contrapartida, estudos realizados em países como Índia e Nepal relataram maior prevalência de infecções fúngicas no sexo masculino, com percentual variando de 60,0% a 85,0%.(20,21,23) A susceptibilidade das mulheres pode ser explicada pelos hábitos diários, como uso de calçados abertos ou de salto alto, que podem facilitar a ocorrência de traumas, bem como a realização de tarefas domésticas que demandam contato prolongado com água e produtos químicos ou de limpeza, os quais favorecem a penetração do agente fúngico. Além do que, a utilização de materiais de manicure e pedicure não esterilizados corretamente constituem importante fonte de infecção. Pode-se destacar também a procura por tratamento médico ser mais assídua por parte do sexo feminino devido aos maiores cuidados com a estética e com a saúde, em relação aos homens.(5,7,10,12,14,16)
A faixa etária mais afetada pelas infecções fúngicas nesse estudo encontra-se entre 31 e 60 anos (58,96% EMD e 60,62% cultura), corroborando com resultados encontrados por outros autores, onde foi descrita maior prevalência em pacientes adultos.(3,7,10,14-16) O predomínio de micoses nesta parcela da população pode estar relacionado à maior atividade produtiva, no qual os indivíduos estão mais propensos à ocorrência de traumas durante as atividades profissionais, principalmente na região da Serra Gaúcha, onde os hábitos de trabalho nas pequenas propriedades são mais rudimentares e, muitas vezes, não há utilização do mínimo de equipamentos de proteção individual necessários, favorecendo a agressão por produtos químicos, o que viabiliza a entrada de patógenos e o desenvolvimento de infecções.(6,7,15)
A região ungueal dos pés foi o sítio mais acometido (30,68% EMD e 30,53% cultura), confirmando a tendência relatada por outros autores, na qual os pés, incluindo pele, interdígitos e unhas foram os locais preferenciais para o desenvolvimento das micoses.(3,6,7,10,11,17) A presença de fungos em unhas dos pés, denominada onicomicose, pode estar relacionada com o uso de calçados fechados, associada ao suor e secagem inadequada dos pés, o que proporciona um ambiente quente, úmido e escuro, favorável ao desenvolvimento de dermatofitoses e de candidíases, principalmente durante o período de inverno na região sul do Brasil. Além disso, a taxa reduzida de crescimento das unhas dos pés também contribui para a maior propensão de crescimento fúngico nessa região.(5,10,11,15)
Corroborando com pesquisas anteriores, os dados encontrados neste estudo demonstram maior ocorrência de infecções ocasionadas por dermatófitos em lesões fúngicas nos pés, tanto na região ungueal como na pele.(8,12-14) A alta frequência de localização ungueal também foi observada para a infecção por Candida spp., sendo compatível com outros estudos, onde leveduras deste gênero foram isoladas predominantemente em unhas, especialmente das mãos.(11-13)
CONCLUSÃO
Concluímos que as micoses superficiais e cutâneas são as mais prevalentes, acometendo principalmente pacientes do sexo feminino e adultos entre 31 e 60 anos de idade. O local mais afetado pelas infecções foi a região ungueal dos pés. Quanto aos agentes etiológicos, os fungos dermatófitos foram os mais isolados, representados majoritariamente pela espécie T. mentagrophytes.
O diagnóstico laboratorial correto é fundamental na detecção precoce da infecção, visto que apresenta influência direta no prognóstico e na conduta terapêutica específica do agente causal. Deste modo, estudos sobre infecções fúngicas têm relevância para o conhecimento do perfil epidemiológico local, permitindo a identificação das espécies mais frequentes em determinada região, auxiliando na escolha do tratamento e contribuindo na implementação de medidas preventivas na saúde pública.
Agradecimentos
Ao laboratório coparticipante pelo suporte e a todos os colaboradores envolvidos pelo apoio e auxílio no desenvolvimento desta pesquisa.
Abstract
Objective: The fungal infections are a public health issue, because of the high prevalence and frequency that they victimize the population. Predisposal factors as bioclimatic conditions, geographic region and cultural and socioeconomic characteristics favor the occurrence of this infections, generating, this way, variation in the prevalence of species in each region. The goal of the present study was to determinate the prevalence of fungal infections in patients in a clinical analysis laboratory in the city of Veranópolis, Rio Grande do Sul (RS). Methods: A retrospective study was made, using the consult of data basis, of 403 direct and culture mycological examination reports made in the laboratory during the period of April 2014 to April 2017. Results: In the analyzed examination reports in the study, there was positivity in 251 (62,28%) mycological direct exams (EMD) and, in 226 (56,08%) cultural exams. The superficial and cutaneous mycosis constituted the mainly diagnosed infections, being the dermatophytic fungi the most isolated etiological factors (69,47%), represented mainly, by the Trichophyton mentagrophytes species, followed by yeasts (20,35%), especially those who belong to the Candida genre. There was prevalence of infections in women patients (64,54% EMD and 61,5% culture). Adults among 31 and 60 years old were the most victimized by the diagnosed mycosis (58,96% EMD e 60,62% cultural). Conclusion: Knowledge of the epidemiological profile can serve as guide in the correct identification of the pathogen in the laboratory diagnosis, influencing directly in the prognosis and in the choice of the right therapeutic conduct.
Keywords
Dematomycosis; Candida spp.; Dermatophytes; non-dermatophyte filamentous fungi; epidemiology
REFERÊNCIAS
- Brasil. Agência Nacional de Vigilância Sanitária. Microbiologia Clínica para o Controle de Infecção Relacionada à Assistência à Saúde. Módulo 8: Detecção e identificação de fungos de importância médica / Agência Nacional de Vigilância Sanitária – Brasília: Anvisa, 2013.
- Murray PR, Rosenthal KS, Pfaller MA. Microbiologia Médica. 6ª ed. Rio de Janeiro: Elsevier; 2011.
- Wille MP, Arantes TD, Silva JLM. Epidemiologia das dermatomicoses em população da periferia de Araraquara – SP. Rev Bras Clin Med. 2009;7(5):295-8.
- Oliveira JC. Tópicos em Micologia Médica. 4ª ed. Rio de Janeiro: Controllab; 2014.
- Pereira CA, Sousa NM, Franco PIR, Reis AF, Barbosa MS. Análise das principais micoses encontradas na rotina de um laboratório de análises clínicas na cidade de Jataí, estado de Goiás, Brasil. SaBios: Rev. Saúde e Biol. 2014 Jan/Apr;9(1):108-114.
- Mezzari A, Hernandes KM, Fogaça RFH, Calil LN. Prevalência de micoses superficiais e cutâneas em pacientes atendidos numa atividade de extensão universitária. Rev bras ci Saúde. 2017; 21(2): 151-6. doi: 10.4034/RBCS.2017.21.02.08.
- Schoeler AP, Sguissardi CH, Bernardi E, Cembranel LR, Fuentefria AM. Prevalência de dermatófitos na rotina de micologia em hospital particular de médio porte na cidade de Chapecó, estado de Santa Catarina, Brasil. Rev Ciênc Farm Básica Apl. 2010;31(1): 103-6.
- Olsever V, Rodrigues DMG, Gonçalves SMB, Rocha ITM, Mezzari A. Prevalência de dermatofitoses no Rio Grande do Sul no período de 2007-2011. Rev Panam Infectol. 2014;16(4):200-5.
- Araújo Gde M, Araújo ND, Farias RP, Cavalcanti FC, Lima Mdo L, Braz RA. Superficial mycoses in Paraíba: a comparative analysis and bibliographical revision. An Bras Dermatol. 2010 Nov-Dec;85(6):943-6.
- Schünemann M, Nunes PR, Oliveira MS. Prevalência de micoses superficiais em pacientes ambulatoriais da região metropolitana de Porto Alegre, RS. RBAC. 2016;48(1):63-7.
- Fajardo AD, Silva RR, Costa APM, Rossetto AL, Cruz RCB. Estudo epidemiológico das infecções fúngicas superficiais em Itajaí, Santa Catarina. RBAC. 2017;49(4):396-400. doi: 10.21877/2448-3877. 201700584.
- Coelho MPP, Mendes BG, Soprana HZ, Santos LFV, Nappi BP, Santos JI. Micoses observadas em pacientes atendidos no Hospital Universitário, Florianópolis, Santa Catarina. RBAC. 2005;37(1):27-30.
- Polo A, Grazziotin NA. Micoses superficiais em idosos residentes em entidade beneficente na Região Norte do estado do Rio Grande do Sul. RBAC. 2011;43(1):29-33.
- Souza TS, Paula NCR, Souto RCF. Prevalência de micoses superficiais diagnosticadas em um laboratório de análises clínicas em Goiânia, Goiás. Estudos. 2014;41(4):855-68.
- Montarin DTA, Almeida MTG, Colombo TE. Onicomicoses: estudo epidemiológico e micológico no município de São José do Rio Preto, SP. J Health Sci Inst. 2015;33(2):118-21.
- Morais WA, Aquino VR. Dermatofitoses em pacientes ambulatoriais de um laboratório de análises clínicas do litoral norte do Rio Grande do Sul. Novo Hamburgo. Monografia [Especialização em Microbiologia Clínica] – Universidade Feevale; 2017.
- Aquino VR, Constante CC, Bakos L. Frequência das dermatofitoses em exames micológicos em Hospital Geral de Porto Alegre, Brasil. An Bras Dermatol. 2007;82(3):239-44.
- Dalla Lana DF, Batista BG, Alves SH, Fuentefria AM. Dermatofitoses: agentes etiológicos, formas clínicas, terapêutica e novas perspectivas de tratamento. Clin Biomed Res. 2016;36(4):230-41. doi: 10.4322/2357-9730.68880.
- Capote AM, Ferrara G, Panizo MM, Garcia N, Alarcón V, Reviakina V, et al. Micosis superficiales: casuística del Departamento de Micología del Instituto Nacional de Higiene “Rafael Rangel”, Caracas, Venezuela (2001-2014). Invest Clin. 2016;57(1):47-58.
- Surendran KAK, Bhat RM, Boloor R, Nandakishore B, Sukumar D. A clinical and mycological study of dermatophytic infections. Indian Journal of Dermatology. 2014 May/Jun;59(3):262-7. doi: 10.4103/0019-5154.131391.
- Khadka S, Sherchand JB, Pokharel DB, Pokhrel BM, Mishra SK, Dhital S, et al. Clinicomycological characterization of superficial mycoses from a tertiary care hospital in Nepal. Dermatol Res Pract. 2016;1-7. doi: 10.1155/2016/9509705.
- Samuel TO, Adekunle AA, Ogundipe OT. Prevalence of dermatomycoses in tertiary health institutions in Lagos State, Nigéria. J. Public Health Epidemiol. 2013 Feb;5(2):101-9. doi: 10.5897/JPHE12.110.
- Bhatia VK, Sharma PC. Epidemiological studies on dermatophytosis in human patients in Himachal Pradesh, India. SpringerPlus. 2014;3(134):1-7. doi: 10.1186/2193-1801-3-134.
- Maraki S, Mavromanolaki VE. Epidemiology of dermatophytoses in Crete, Greece: a 5-year survey. Med Mycol J. 2016;57(4):69-75.
- Nakamura HM, Caldeira SM, Avila MAG. Incidência de infecções fúngicas em pacientes cirúrgicos: uma abordagem retrospectiva. Rev SOBECC. 2013 Jul/Sep;18(3):49-58.
- Gaviria-Giraldo CM, Cardona-Castro N. Esporotricosis y cromoblastomicosis: revisión de la literatura. Rev CES Med. 2017; 31(1):77-91.
Correspondência
Gabriela Pigatto
: Rua Arlindo Franklin Barbosa, 460, Bairro São Roque
Bento Gonçalves-RS, Brasil
