Uso da citometria de fluxo no diagnóstico sorológico da COVID-19
The use of flow cytometry for the serological diagnosis of COVID-19
Ingrid Fatima Zattoni1
Geraldo Picheth1,2
Fabiane Gomes de Moraes Rego1,2
Mauren Isfer Anghebem2,3
Vivian Rotuno Moure*1,2
Glaucio Valdameri*o1,2
1Programa de Pós-graduação em Ciências Farmacêuticas (PPGCF), Universidade Federal do Paraná (UFPR), Curitiba, Paraná, Brasil.
2Departamento de Análises Clínicas, Universidade Federal do Paraná (UFPR), Curitiba, Paraná, Brasil.
3Escola de Ciências da Vida, Pontifícia Universidade Católica do Paraná (PUCPR), Curitiba, Paraná, Brasil.
Recebido em 10/03/2021
Aprovado em 29/04/2021
DOI: 10.21877/2448-3877.202100968
INTRODUÇÃO
A COVID-19 é uma síndrome respiratória aguda, causada pelo SARS-CoV-2 (Síndrome Respiratória Aguda Grave-Coronavírus 2) que se converteu em um processo pandêmico global, com os primeiros casos identificados no final de 2019. Após cerca de 20 meses, mais de 200 milhões de casos e 4 milhões de mortes por COVID-19 foram relatados no mundo. O Brasil registrou 10% do número de casos e 14% do número de óbitos.(1)
A elevada taxa de transmissão e agressividade da COVID-19 aumentou a taxa de internação hospitalar de infectados, em particular nas Unidades de Terapia Intensivas (UTIs), que levaram ao colapso o Sistema de Saúde em muitos locais. Entre os processos para conter a expansão da COVID-19 a testagem em massa, identificando os infectados, é uma premissa essencial para o planejamento e as ações da Infectologia. Neste contexto, o desenvolvimento de testes diagnósticos rápidos, sensíveis e de baixo custo é essencial entre as ferramentas de combate ao processo pandêmico.(2)
As metodologias que utilizam a transcrição reversa seguida de reação em cadeia da polimerase em tempo real (Real time reverse transcription polymerase chain reaction – RT-qPCR), bem como testes sorológicos que detectam anticorpos e antígenos associados ao vírus, estão disponíveis ao laboratório.(2)
A RT-qPCR segue como padrão-ouro para diagnóstico de casos de infecção por SARS-CoV-2.(3) A detecção de anticorpos é uma abordagem importante para o monitoramento da resposta imunológica e para acompanhamento da soroconversão, relevância mais acentuada, num contexto de vacinação em massa.
Os métodos de detecção de anticorpos anti-SARS-CoV-2 devem ser aplicados durante o processo epidêmico do Coronavírus. Após cerca de uma semana desde as primeiras manifestações clínicas, a sensibilidade do diagnóstico molecular (RT-qPCR) diminui gradualmente para infecções por SARS-CoV-2, devido à redução da quantidade de partículas de vírus no trato respiratório. Nesses casos, os pacientes podem apresentar resultados falsos negativos, apesar da infecção em curso.(4)
Características imunológicas da infecção por SARS-CoV-2
Estruturalmente, o vírus SARS-CoV-2 é formado pela proteína nucleocapsídeo ou nucleoproteína (N), proteína de membrana (M), proteína do envelope viral (E) e proteína Spike (S). A primeira é responsável pelo empacotamento de RNA viral formando uma estrutura helicoidal que se liga às proteínas de membrana. A proteína do envelope e a Spike interagem para formar o envelope viral, ligando-se às proteínas de membrana. A proteína S é a responsável pela entrada do vírus na célula do hospedeiro através da interação com um receptor celular, a enzima conversora de angiotensina-2 (ECA-2). Esta interação acontece através do domínio de ligação no domínio RBD (do inglês receptor-binding domain), que se encontra na subunidade S1.(5,6)
A proteína S, mais especificamente o domínio RBD, é considerada o melhor alvo para terapias e anticorpos neutralizantes. A detecção de anticorpos neutralizantes anti-S pode ser utilizada como estratégia de triagem para o tratamento através de soro convalescente. A proteína N também é altamente imunogênica e comumente utilizada na identificação de anticorpos.(5)
A resposta imune clássica a patógenos virais envolve a produção de IgM no início do processo, frequentemente acompanhada pela emergência de IgA, e então seguida a produção de IgG.(7) Na COVID-19, a evidência atual é conflitante, sendo descrito em algumas pesquisas que a IgM é produzida primeiro(8) e, em outras, que as produções de IgM e IgG ocorrem simultaneamente, semelhante ao que foi observado em outras SARS associadas a outros coronavírus.(9) O teste para a identificação da IgA associado à COVID-19 fornece uma alternativa clinicamente útil, pois estes anticorpos são secretados na superfície das mucosas e sua detecção e títulos no soro ou plasma podem refletir uma função imunológica das membranas mucosas.(10) A soroconversão para IgM e IgG ocorre sete dias após infecção sintomática em 50% dos pacientes (14 dias em todos), mas não é seguida por declínio rápido na carga viral.(11-13) Em geral, se considera que a soroconversão acontece no período de 20 dias após início dos sintomas para IgG e IgM, com aumento persistente por três semanas com variações na ordem de aparecimento das imunoglobulinas.(3) Também, estudos apontam que a IgA pode desempenhar uma função importante na proteção contra infecção por SARS-CoV-2, uma vez que IgA está presente em mucosas, na sua forma dimérica e o trato respiratório superior é a principal porta de entrada para o vírus.(14) O perfil do aparecimento de IgA é semelhante às outras imunoglobulinas.(8) A determinação do perfil sorológico tem função relevante na epidemiologia da COVID-19 e na determinação do status imune dos pacientes assintomáticos.(3,13)
Em relação à metodologia para testagem da COVID-19, inicialmente, diferentes métodos imunoenzimáticos e imunocromatográficos foram desenvolvidos, devido ao baixo custo e flexibilidade de adaptação dos testes para uso em ambientes com pouca infraestrutura.(15) Entretanto, muitos destes testes apresentam limitações, como a dificuldade de aplicação em larga escala e resultados inconsistentes.(16–18)
Métodos de detecção de anticorpos na COVID-19
Os testes sorológicos para COVID-19 podem ser realizados através das várias metodologias comercialmente disponíveis, a citar: ensaios imunoenzimáticos (ELISA), imunoensaios fluoroenzimáticos, imunoensaios quimioluminescentes e imunocromatografia de fluxo lateral. Na essência, estes ensaios detectam duas classes de anticorpos, IgM e IgG. De uma forma geral, os testes sorológicos apresentam alta sensibilidade no período de três semanas após o início dos sintomas da doença (3,12). Com relação à especificidade dos testes, é considerada elevada para a detecção de IgM e IgG (maior ou igual a 95%). Entretanto, para a detecção de IgA a especificidade é inferior (84%, considerando o teste da EUROIMMUN Anti-SARS-CoV-2 ELISA).(19) Por isso, ainda existe necessidade do desenvolvimento de outras metodologias para o diagnóstico sorológico da COVID-19.
Entre os princípios metodológicos para identificação e monitoramento da COVID-19, a citometria de fluxo tem se mostrado como uma alternativa relevante.(18,20–23)
A citometria de fluxo é uma técnica capaz de detectar múltiplos parâmetros em uma única célula ou em amostras biológicas como soro ou plasma. Devido à capacidade de analisar células individualizadas ou “beads” (micropartículas ligadas com elementos de interesse, no caso proteínas virais) e com marcações fluorescentes específicas, a citometria de fluxo sempre esteve muito relacionada ao uso de anticorpos conjugados a fluorocromos para pesquisa de marcadores celulares específicos. Por conta da flexibilidade e do uso consolidado de citômetros de fluxo para uso diagnóstico, é previsível e imperativo o desenvolvimento de metodologias baseadas em citometria de fluxo no diagnóstico imunológico da COVID-19.
As estratégias metodológicas baseadas em citometria de fluxo podem ser divididas em duas grandes categorias: sistemas baseados no uso de células e sistemas livre de células (Figura 1).
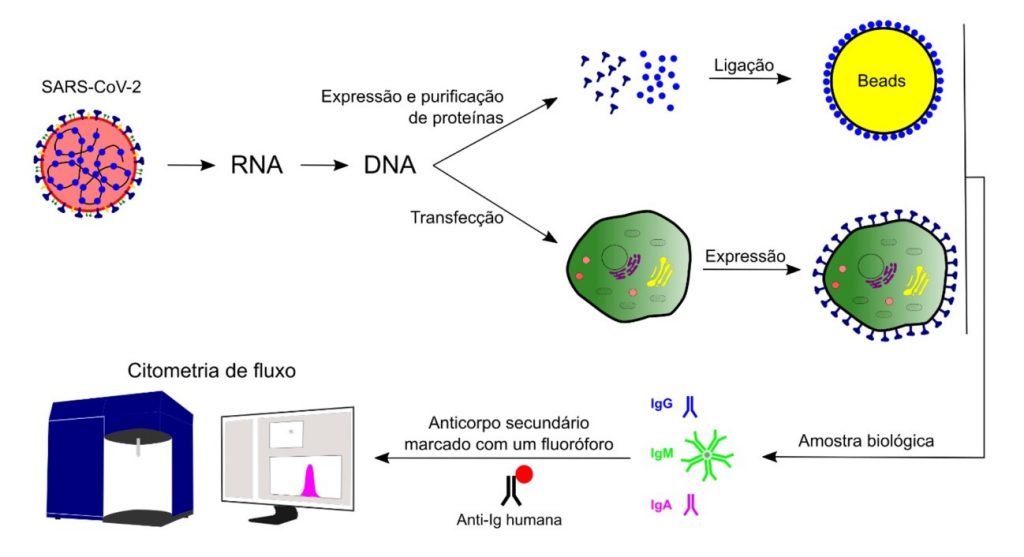
Figura 1. Representação das duas estratégias experimentais do uso da citometria de fluxo para detecção de anticorpos anti-SARS-CoV-2. Em amarelo está representado beads (microesferas) recobertas com proteínas do vírus. Em verde está representada uma célula que foi transfectada para expressar em sua superfície as proteínas do vírus. Para ambas as estratégias são utilizadas amostras biológicas, como soro, para investigação de diferentes tipos de imunoglobulinas. A reação é revelada com anticoporpos anti-imunoglobulinas humanas conjugadas com fluorocromos (fluoróforos) por citometria de fluxo.
Métodos baseados em células
Estes métodos foram desenvolvidos a partir da transfecção de células com vetores contendo o gene da proteína Spike, permitindo a expressão desta proteína na membrana plasmática das células eucarióticas. Uma das linhagens celulares utilizadas neste tipo de abordagem foram as células HEK293T. Estas células foram transfectadas com um plasmídeo contendo o gene que codifica para a proteína Spike. Assim, as células passaram a expressar a proteína Spike nativa na sua membrana plasmática, possibilitando o reconhecimento de imunoglobulinas no soro do paciente. Depois de incubar com o soro, uma segunda etapa de incubação com anticorpo secundário fluorescente foi realizada, possibilitando a detecção por citometria de fluxo.(20,24) Células Jurkat também foram avaliadas como “suporte” para a expressão da proteína Spike. A grande vantagem neste caso é que estas células são cultivadas em suspensão, tornando o teste mais prático.(22,23)
De maneira geral, os métodos baseados em citometria de fluxo usando células foram eficazes na detecção de imunoglobulinas no soro, sendo considerados superiores aos ensaios de ELISA, com alta sensibilidade/especificidade e diminuindo o limite de detecção.(18) A expressão da proteína nativa permite a ligação de anticorpos que reconhecem diferentes epítopos na proteína Spike e não apenas a cadeia S1 ou o domínio RBD, como acontece em alguns kits comerciais.(20) Uma grande desvantagem desta estratégia é a necessidade de infraestrutura para cultivo celular, que pode não ser uma realidade para laboratórios clínicos em geral. Outro problema é a padronização e execução de procedimentos de transfecção transiente, que geralmente apresentam alta variabilidade na expressão de proteínas na membrana celular, impactando diretamente os resultados obtidos.
Métodos livres de células
Uma alternativa aos métodos baseados no uso de células é o uso de beads ou microesferas para imobilização de proteínas. As beads são esferas poliméricas com superfície quimicamente modificada que possibilita a conjugação de um anticorpo/antígeno. Elas funcionam como um suporte sólido para a captura do analito em uma matriz líquida.(25) Uma vez feita a conjugação, as beads são incubadas com a amostra biológica. O sistema é revelado através do uso de anticorpos conjugados com fluoróforos específicos para o analito, formando uma espécie de sanduíche. Quanto maior a ligação do anticorpo conjugado, maior a concentração do analito e maior o sinal emitido pelo equipamento.(26,27) Outra forma de marcação é através do uso do complexo biotina-streptavidina, que proporciona um aumento na sensibilidade do ensaio. Neste caso, o analito capturado ou o anticorpo secundário deve ser biotinilado, permitindo o uso da streptavidina conjugada com o fluoróforo.(28)
As beads comercialmente disponíveis usualmente possuem fluorescência intrínseca e podem variar em tamanho e intensidade de fluorescência. Esta variabilidade de características possibilita a personalização do painel analítico permitindo uma análise multiparamétrica, conhecida como multiplex. É possível conjugar, em beads de tamanho e intensidade de fluorescência diferentes, antígenos/anticorpos de interesse para avaliação de diferentes fatores, como presença de diferentes classes de imunoglobulinas e mediadores inflamatórios/citocinas ligadas à resposta imunológica.(25,27)
Esta metodologia vem sendo utilizada no desenvolvimento de testes baseados em citometria de fluxo para o diagnóstico da COVID-19. Egia-Mendikute et al. e Fong et al.(16,18) utilizaram beads funcionalizadas com streptavidina para ligação de antígenos biotinilados (S1 Spike, RBD e Nucleocapsídeo). As beads foram incubadas com soro para posterior marcação com anticorpos secundários anti-IgM e anti-IgG com diferentes fluorocromos. Para Egia-Mendikute et al.,(18) a combinação de três antígenos proporcionou um teste mais específico e rápido para detecção de anticorpos, além de diminuir o limite de detecção quando comparado a um ensaio de ELISA. As duas metodologias foram superiores ao ELISA em sensibilidade e especificidade. Fong et al.(16) apontam que testes com beads são superiores aos testes imunocromatográficos devido à facilidade de interpretação do teste (resultados fracamente positivos no teste imunocromatografico podem gerar dúvidas de interpretação), além de fornecerem resultados quantitativos, possibilitando o acompanhamento da soroconversão.
De maneira original, Zattoni et al.(29) desenvolveram uma estratégia baseada em beads para a ligação covalente da proteína do nucleocapsídeo através da reação de conjugação sulfo-SMCC. O teste foi capaz de detectar anticorpos no soro do paciente usando uma diluição de 1:1000. O uso de um conjunto de três anticorpos secundários comerciais permitiu a detecção simultânea de IgG, IgM e IgA. De fato, a detecção de IgA foi realizada através do uso de anticorpo secundário biotinilado, com posterior incubação com streptavidina conjugada com fluorocromo, aumentando a sensibilidade da detecção. Importante ressaltar que este é o primeiro ensaio descrito na literatura que usa beads comerciais conhecidas como CBA (BD™ Cytometric Bead Array), possibilitando a detecção simultânea de IgG, IgM e IgA.
Testes para a identificação de anticorpos neutralizantes são outra possibilidade para o uso da estratégia baseada no uso de beads. O RBD é a porção da proteína Spike capaz de ligar na ECA-2 para infectar os tecidos. A ligação desta sequência proteica nas beads e incubação com ECA-2 biotinilada permite a avaliação da competição entre anticorpos neutralizante anti-RBD e ECA-2. Na ausência de anticorpos neutralizantes, as beads são marcadas pela formação do complexo RBD-ECA-2-biotina-streptavidina, gerando sinal fluorescente pela streptavidina. Na presença de anticorpos neutralizantes, ocorre competição pela ligação na sequência RBD entre ECA-2 e anticorpo neutralizante e verifica-se a diminuição da marcação por streptavidina, portanto, quanto maiores os títulos de anticorpos neutralizantes, menor a fluorescência apresentada pela streptavidina.(30)
Considerações Finais
A detecção de novos casos de infecções por SARS-CoV-2 no contexto pandêmico atual continua vital para a contenção da propagação viral, ainda mais com o surgimento de novas variantes com potencial infectante maior. Por outro lado, a vacinação em massa também demanda testes confiáveis para acompanhamento da imunidade coletiva.
A citometria de fluxo é uma técnica consolidada no diagnóstico laboratorial e utilizada como ferramenta com capacidade de triagem em grande escala e elevada confiabilidade. Diferentes testes com matrizes poliméricas e celulares para pesquisa de anticorpos foram desenvolvidos, porém as possibilidades de avanços tecnológicos se ampliam rapidamente. A estratégia baseada em beads, especialmente, permite a conjugação de diferentes proteínas e possibilita a pesquisa de vários antígenos simultaneamente, ampliando o espectro do resultado com inúmeras vantagens diagnósticas. No contexto, a inclusão de antígenos de outros vírus respiratórios pode permitir a pesquisa multiparamétrica para diferentes agentes infecciosos e a criação de painéis diagnósticos bastante completos, realizados em uma única análise.
Em síntese, a citometria de fluxo para uso diagnóstico tem potencial para se tornar uma ferramenta relevante no curso da pandemia da COVID-19 e futuros processos similares.
Abstract
The COVID-19 pandemic has had a devastating impact around the world and has led to the rapid development of diagnostic tests. Different technologies have been used to detect immunoglobulins produced against SARS-CoV-2 infection. Immunoenzymatic (ELISA), chemiluminescent and immunochromatographic assays are available and, in general, they have limited diagnostic accuracy, especially for the detection of IgA. Flow cytometry has emerged as an alternative for the development of sensitive and specific methods for COVID-19 applied for diagnosis, screening and stratification of the disease. Flow cytometry is a laser-based optical technology that detects physicochemical characteristics of cells or particles in a heterogeneous fluid. The article explores flow cytometry for the diagnosis of COVID-19 in two strategies for detecting antibodies in serum or plasma, the first one using viral antigens expressed on the surface of mammalian cells and the other one with these elements immobilized on microspheres (beads). The possibility of rapid detection of multiple antibodies simultaneously, with a small sample volume and high sensitivity and specificity, makes flow cytometry a promising methodology for the clinical laboratory, as a reference tool to help stop the COVID-19 pandemic process and similar future events.
Keywords
Flow cytometry; SARS-CoV-2; COVID-19; IgG, IgM and IgA antibodies
Referências
- Worldometer. Coronavirus Cases [Internet]. 2021 [cited 2021 Aug 7]. Available from: https://www.worldometers.info/coronavirus/?utm_campaign=homeAdvegas1?
- Kubina R, Dziedzic A. Molecular and serological tests for covid-19 a comparative review of SARS-COV-2 coronavirus laboratory and point-of-care diagnostics. Diagnostics (Basel, Switzerland). 2020 Jun;10(6) doi: 10.3390/diagnostics10060434
- Long QX, Liu BZ, Deng HJ, Wu GC, Deng K, Chen YK, et al. Antibody responses to SARS-CoV-2 in patients with COVID-19. Nat Med [Internet]. 2020;26(6):845–8 doi: 10.1038/s41591-020-0897-1
- Hsueh P-R, Huang L-M, Chen P-J, Kao C-L, Yang P-C. Chronological evolution of IgM, IgA, IgG and neutralisation antibodies after infection with SARS-associated coronavirus. Clin Microbiol Infect Off Publ Eur Soc Clin Microbiol Infect Dis. 2004 Dec;10(12):1062–6 https://doi.org/ 10.1111/j.1469-0691.2004.01009.x
- Ji T, Liu Z, Wang G, Guo X, Akbar khan S, Lai C, et al. Detection of COVID-19: A review of the current literature and future perspectives. Biosens Bioelectron [Internet]. 2020;166:112455 doi: 10.1016/j.bios.2020.112455
- Anghebem MI, Rego FG de M, Picheth G. COVID-19 e Diabetes: a relação entre duas pandemias distintas. Rev Bras Análises Clínicas. 2020;52(2):28-33 doi: 10.21877/2448-3877.20200001
- Gunther N, Hoffmann GW. Qualitative dynamics of a network model of regulation of the immune system: a rationale for the IgM to IgG switch. J Theor Biol. 1982 Feb;94(4):815–22 doi: 10.1016/0022-5193(82)90080-7
- Guo L, Ren L, Yang S, Xiao M, Chang D, Yang F, et al. Profiling Early Humoral Response to Diagnose Novel Coronavirus Disease (COVID-19). Clin Infect Dis an Off Publ Infect Dis Soc Am. 2020 Jul;71(15):778–85 doi: 10.1093/cid/ciaa310
- Li G, Chen X, Xu A. Profile of Specific Antibodies to the SARS-Associated Coronavirus. N Engl J Med [Internet]. 2003;349(5):508–9 doi: 10.1056/NEJM200307313490520
- Padoan A, Sciacovelli L, Basso D, Negrini D, Zuin S, Cosma C, et al. IgA-Ab response to spike glycoprotein of SARS-CoV-2 in patients with COVID-19: A longitudinal study. Clin Chim Acta [Internet]. 2020;507:164-6 doi: 10.1016/j.cca.2020.04.026
- Haveri A, Smura T, Kuivanen S, Österlund P, Hepojoki J, Ikonen N, et al. Serological and molecular findings during SARS-CoV-2 infection: the first case study in Finland, January to February 2020. Eurosurveillance [Internet]. 2020;25(11) doi: 10.2807/1560-7917.ES.2020.25.11.2000266
- Zhang W, Du R-H, Li B, Zheng X-S, Yang X-L, Hu B, et al. Molecular and serological investigation of 2019-nCoV infected patients: implication of multiple shedding routes. Emerg Microbes Infect [Internet]. 2020;9(1):386–9 doi: 10.1080/22221751.2020.1729071
- Wölfel R, Corman VM, Guggemos W, Seilmaier M, Zange S, Müller MA, et al. Virological assessment of hospitalized patients with COVID-2019. Nature [Internet]. 2020;581(7809):465–9 doi: 10.1038/s41586-020-2196-x
- Chao YX, Rötzschke O, Tan E-K. The role of IgA in COVID-19. Brain Behav Immun [Internet]. 2020 Jul;87:182–3 doi: 10.1016/j.bbi.2020.05.057
- Huergo LF, Selim KA, Conzentino MS, Gerhardt ECM, Santos ARS, Wagner B, et al. Magnetic Bead-Based Immunoassay Allows Rapid, Inexpensive, and Quantitative Detection of Human SARS-CoV-2 Antibodies. ACS sensors [Internet]. 2021/01/26. 2021 Mar 26;6(3):703–8 doi: 10.1021/acssensors.0c02544
- Fong CH-Y, Cai J-P, Dissanayake TK, Chen L-L, Choi CY-K, Wong L-H, et al. Improved Detection of Antibodies against SARS-CoV-2 by Microsphere-Based Antibody Assay. Int J Mol Sci [Internet]. 2020;21(18):1–10 doi: 10.3390/ijms21186595
- Pegoraro M, Militello V, Salvagno GL, Gaino S, Bassi A, Caloi C, et al. Evaluation of three immunochromatographic tests in COVID-19 serologic diagnosis and their clinical usefulness. Eur J Clin Microbiol Infect Dis [Internet]. 2021;40(4):897-900 https://doi.org/10.1007/s10096-020-04040-1
- Egia-Mendikute L, Bosch A, Prieto-Fernández E, Lee SY, Jiménez-Lasheras B, García del Río A, et al. Sensitive detection of SARS-CoV-2 seroconversion by flow cytometry reveals the presence of nucleoprotein-reactive antibodies in unexposed individuals. Commun Biol [Internet]. 2021;4(1):486 doi:10.1038/s42003-021-02011-6
- Gededzha MP, Mampeule N, Jugwanth S, Zwane N, David A, Burgers WA, et al. Performance of the EUROIMMUN Anti-SARS-CoV-2 ELISA Assay for detection of IgA and IgG antibodies in South Africa. PLoS One [Internet]. 2021;16(6):1–14. Available from: https://doi.org/10.1371/journal.pone.0252317
- Lapuente D, Maier C, Irrgang P, Hübner J, Peter AS, Hoffmann M, et al. Rapid response flow cytometric assay for the detection of antibody responses to SARS-CoV-2. Eur J Clin Microbiol Infect Dis [Internet]. 2021;40(4):751–9 doi: 10.1007/s10096-020-04072-7
- Simard C, Richard J, Bazin R, Finzi A, Trépanier P. Standardization of a flow cytometry SARS-CoV-2 serologic test. MedRxiv. 2021 doi: 10.1101/2021.01.29.21250770
- Horndler L, Delgado P, Abia D, Balabanov I, Martínez-Fleta P, Cornish G, et al. Flow cytometry multiplexed method for the detection of neutralizing human antibodies to the native SARS-CoV-2 spike protein. EMBO Mol Med [Internet]. 2021;13(3):e13549 doi: 10.15252/emmm.202013549
- Piñero P, Marco De La Calle FM, Horndler L, Alarcón B, Uribe Barrientos M, Sarmiento H, et al. Flow cytometry detection of sustained humoral immune response (IgG + IgA) against native spike glycoprotein in asymptomatic/mild SARS-CoV-2 infection. Sci Rep. 2021 May;11(1):10716 doi: 10.1038/s41598-021-90054-4
- Goh YS, Chavatte JM, Lim Jieling A, Lee B, Hor PX, Amrun SN, et al. Sensitive detection of total anti-Spike antibodies and isotype switching in asymptomatic and symptomatic individuals with COVID-19. Cell Reports Med [Internet]. 2021;2(2):100193 doi: 10.1016/j.xcrm.2021.100193
- Morgan E, Varro R, Sepulveda H, Ember JA, Apgar J, Wilson J, Lowe L, et al. Cytometric bead array: a multiplexed assay platform with applications in various areas of biology. Clin Immunol [Internet]. 2004;110(3):252–66 doi: 10.1016/j.clim.2003.11.017
- Parsa SF, Vafajoo A, Rostami A, Salarian R, Rabiee M, Rabiee N, et al. Early diagnosis of disease using microbead array technology: A review. Anal Chim Acta [Internet]. 2018;1032:1–17 doi: 10.1016/j.aca.2018.05.011
- Antal-Szalmás P, Nagy B, Debreceni IB, Kappelmayer J. Measurement of Soluble Biomarkers by Flow Cytometry. EJIFCC [Internet]. 2013 Jan;23(4):135-42.
- Hattori T, Koide A, Panchenko T, Romero LA, Teng KW, Corrado AD, et al. Multiplex bead binding assays using off-the-shelf components and common flow cytometers. J Immunol Methods [Internet]. 2021;490:112952 https://doi.org/10.1016/j.jim.2020.112952
- Zattoni IF, Huergo LF, Gerhardt ECM, Nardin JM, dos Santos AMF, Rego FG de M, et al. Multiplexed flow cytometric approach for detection of anti-SARS-CoV-2 IgG, IgM and IgA using beads covalently coupled to the nucleocapsid protein. ChemRxiv. 2021;1–17 https://doi.org/ 10.26434/chemrxiv.14219999.v1
- Tian L, Elsheikh EB, Patrone PN, Kearsley AJ, Gaigalas AK, Inwood S, et al. Towards Quantitative and Standardized Serological and Neutralization Assays for COVID-19. Int J Mol Sci [Internet]. 2021;22(5):1–15 doi: 10.3390/ijms22052723
Correspondência
Vivian Rotuno Moure
Departamento de Análises Clínicas, Faculdade de Farmácia, Universidade Federal do Paraná (UFPR), Curitiba, Paraná, Brasil
Av. Prefeito Lothário Meissner, 632 – Jardim Botânico,
Curitiba – PR, 80210-170 – E
