Avaliação de desempenho analítico do equipamento de hematologia de um laboratório de análises clínicas da Serra Gaúcha através da métrica Seis Sigma
Evaluation of the analytical performance of the hematology equipment of a Serra Gaúcha clinical analysis laboratory through Six Sigma metric
Flávia Fachini1
Rejane Giacomelli Tavares2
1Farmacêutica. Faculdade da Serra Gaúcha (FSG). Caxias do Sul-RS, Brasil.
2Universidade Federal de Pelotas. Pelotas-RS, Brasil.
Instituição: Faculdade da Serra Gaúcha (FSG). Sociedade Educacional Santa Rita S.A. Caxias do Sul-RS, Brasil.
Recebido em 12/06/2020
Aprovado em 19/11/2020
DOI: 10.21877/2448-3877.202102008
INTRODUção
Exames laboratoriais exercem um papel cada vez mais importante na assistência médica em termos de diagnóstico, monitoramento e prognóstico. Para garantir que o médico tenha acesso a resultados confiáveis, endossando o tratamento adequado, seguro e efetivo do paciente, é primordial que a avaliação do desempenho analítico (DA) seja realizada periodicamente.(1)
Todos os processos da medicina laboratorial devem ser constantemente controlados e aprimorados. Na fase analítica, nem sempre o controle de qualidade (CQ) convencional é suficiente para se atingir um nível de excelência em qualidade no DA, pois frequentemente o foco da análise desses dados é na liberação das corridas analíticas diárias. Medidas de controle interno da qualidade (CIQ), como a utilização de controles comerciais e aplicação das regras de controle, e de controle externo da qualidade (CEQ), como a participação em ensaios de proficiência, são básicas e emitem dados importantes para a adequada verificação do DA dos equipamentos.(2,3)
Um CQ bem delineado é essencial para garantir a liberação de resultados confiáveis. O primeiro passo no planejamento do CQ é definir as especificações da qualidade de maneira clara e objetiva. Estabelecer os requisitos de qualidade para cada analito ou parâmetro é tão importante quanto inspecionar o DA do processo. Deve-se primeiramente conhecer qual o nível de qualidade necessário para assegurar decisões clínicas satisfatórias, para depois manter os ensaios dentro destes níveis. Assim, as análises não extrapolam o limite máximo de variação permitido e garante-se que os resultados emitidos representem fidedignamente o estado clínico do paciente.(4)
Em novembro de 2014, o Scientific Programme Committee (SPC), a European Federation of Clinical Chemistry and Laboratory Medicine (EFLM) e organizadores realizaram uma conferência(5) para revisar o Consenso de Estocolmo,(6) ponderando se a hierarquia de 1999 para escolha das especificações de desempenho analítico (EDA) ainda seria válida atualmente. Essa revisão passou por modificações e acréscimos em 2016.(7) Na tentativa de simplificar e aperfeiçoar a aplicação das EDA, estabeleceu-se que três modelos devem ser considerados para defini-las, e houve consonância em que alguns são mais adequados para certos analitos do que para outros, devendo haver articulação entre os modelos, dependendo do propósito pretendido. Os modelos são: modelo 1 – EDA baseado no efeito do DA no resultado clínico; modelo 2 – baseado nos componentes da variação biológica (VB); modelo 3 – baseado no estado da arte da medição.(7)
Definidas as EDA, os métodos devem ser monitorados para que se mantenham dentro destes limites. Para se ter uma visão mais ampla da estabilidade do método e do DA, e para assegurar a análise assertiva dos dados do CIQ e CEQ, existem recursos disponíveis baseados no CQ estatístico: a avaliação mensal da imprecisão, da inexatidão, do erro total analítico (ET) e da métrica sigma (MS) dos ensaios. A imprecisão trata do nível de discordância entre medidas replicadas e reflete a habilidade da análise em reproduzir o mesmo resultado ao longo do tempo, sendo definida pela medida estatística do coeficiente de variação (CV). A inexatidão é a diferença entre o valor encontrado pelo ensaio em avaliação e o valor de referência considerado como verdadeiro para essa determinação laboratorial. É numericamente definida pelo cálculo do viés ou bias, em inglês. O ET é um dado estatístico calculado que representa a soma dos efeitos da imprecisão e da inexatidão do sistema, sendo um importante requisito da qualidade.(3,8)
Por sua vez, a estratégia Seis Sigma (definida pelo valor numérico da MS) é referência mundial em qualidade, monitorando o número de defeitos por milhão de um processo, com o objetivo de reduzi-lo nos produtos até valores próximos de zero. Para ensaios laboratoriais, defeitos são definidos como resultados fora dos limites de tolerância, especificados para cada analito como o seu erro total permitido (ETa), sigla derivada do inglês allowable total error. A MS é medida em uma escala de 0 a 6, sendo 6 o mais alto nível de excelência em qualidade, onde o processo não produz mais do que 3,4 defeitos por milhão, e 3 sendo o nível mínimo de desempenho aceito para um sistema (cerca de 66.800 defeitos por milhão). Com a elevação da MS do processo, mais eficientemente o método fornecerá resultados dentro dos limites de ETa. Por combinar características chave como o viés, o CV e o ETa de cada analito, a MS é cada vez mais aceita como a melhor abordagem para avaliar o DA.(9,10)
O propósito deste estudo foi avaliar o DA do equipamento Mindray® BC-5380, utilizado no setor de hematologia de um laboratório de análises clínicas da Serra Gaúcha, através da MS. Para este objetivo, determinaram-se também o CV, o viés e o ET do sistema analítico.
Material e Métodos
O sistema automatizado utilizado neste estudo é o BC-5380 (Shenzhen Mindray Bio-Medical Electronics Co., Ltd., Shenzhen, China), sendo avaliados os seguintes parâmetros hematológicos: leucócitos totais (WBC), eritrócitos totais (RBC), hemoglobina (HB), hematócrito (HT), volume corpuscular médio (VCM), hemoglobina corpuscular média (HCM), concentração de hemoglobina corpuscular média (CHCM), amplitude de distribuição dos eritrócitos medida em CV (RDW-CV) e plaquetas (PLT).
O CIQ inclui a dosagem diária do Mindray® BC-5D Control, de níveis baixo, normal e alto. O CEQ é realizado testando-se as amostras enviadas pelo ensaio de proficiência do Programa Nacional de Controle de Qualidade (PNCQ). Os dados do CIQ e CEQ analisados neste estudo foram referentes ao mês de setembro de 2019.
Para a definição das EDA de CV e viés dos parâmetros hematológicos, optou-se pelo modelo 2, baseando-se os requisitos de qualidade em estudos de VB(11,12) disponíveis na base de dados de Westgard, para níveis mínimo e desejável de qualidade.(13,14) Para ET e MS foram utilizadas EDA derivadas de VB para níveis de qualidade mínima e desejável e, também, EDA provenientes de Clinical Laboratory Improvement Amendments (CLIA) 88.(15) Ressalta-se que não há EDA disponíveis para parâmetros hematológicos no nível ótimo de qualidade na base de dados consultada.(16)
Todos os cálculos estatísticos do estudo foram realizados utilizando-se o software Microsoft® Excel 2010 a partir de dados originais provenientes da rotina de CQ do laboratório.
Determinação do CV
Calculou-se o CV para cada parâmetro hematológico em cada um dos três níveis de controle, conforme a fórmula: CV (%) = (SD/MÉDIA) x 100, onde SD = desvio padrão. A Média e o SD são expressos nas unidades de concentração dos parâmetros.(4)
Determinação do viés
Os resultados do CEQ, obtidos para cada parâmetro hematológico através da dosagem da amostra enviada pelo ensaio de proficiência do Programa Nacional de Controle da Qualidade (PNCQ), foram utilizados para cálculo do viés.
Determinação do ET
O ET foi estimado pela fórmula ET (%) = Viés (%) + Z x CV (%), aplicando-se os valores de viés e CV calculados conforme proposto anteriormente. Z trata-se do score Z, fator relativo ao nível de confiança desejado, obtido na tabela de distribuição normal padronizada. Para este estudo, Z = 1,65, significando que o CV foi calculado com 95% de confiança.(4)
Determinação da MS
A equação para determinação da MS é: MS = {[ETa (%) – Viés (%)] / CV (%)}.(17)
Resultados
Os resultados da determinação da imprecisão, expressos pelo CV (%) de cada parâmetro hematológico para cada um dos três níveis de CIQ encontram-se descritos na Tabela 1. Como se trabalha com diferentes fontes de EDA, os resultados destacados nas tabelas serão sempre aqueles em que o parâmetro não atingiu a EDA proposta para um nível mínimo de qualidade. No caso da imprecisão e da inexatidão, a EDA menos rígida é referente à EDA de VB para nível mínimo de qualidade.
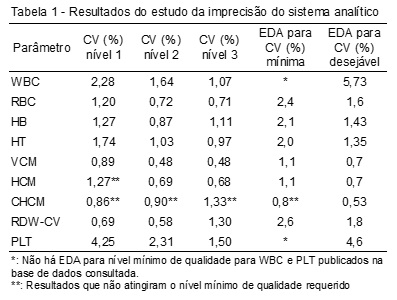
Os dados da determinação da inexatidão, expressos pelo viés (%), encontram-se discriminados na Tabela 2.
Os resultados de ET (%) estão apresentados na Tabela 3. Para o ET e a MS, o nível de qualidade mínimo determinado é caracterizado pela EDA CLIA.
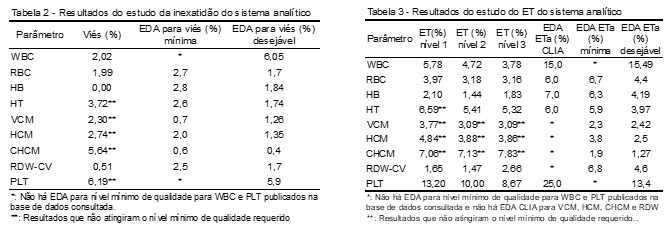
A MS calculada baseando-se em EDA da CLIA está apresentada na Tabela 4, enquanto que a Tabela 5 apresenta as MS considerando-se EDA baseadas em VB. De acordo com a MS, o DA é dividido nos seguintes níveis de qualidade: “world class”, uma metodologia no mais alto nível de excelência (MS ³ 6); excelente (5 < MS < 6), boa (4 < MS < 5), limítrofe (3 < MS < 4), ruim (2 < MS < 3) e inaceitável (MS < 2).(10)
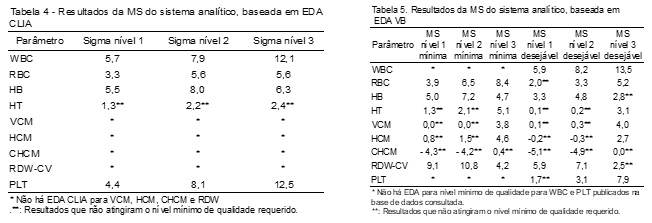
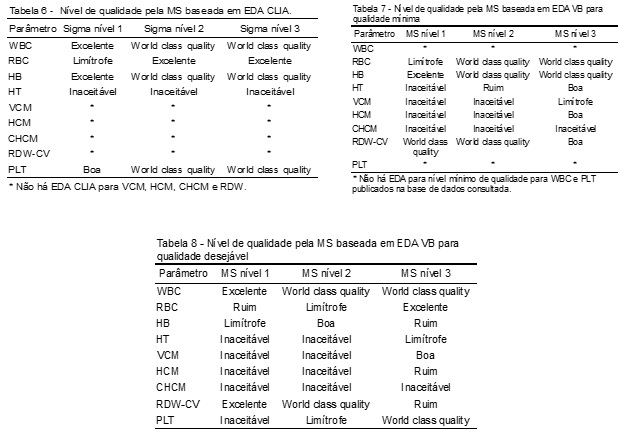
A Tabela 6 indica os respectivos níveis de qualidade nos quais os parâmetros se enquadram embasando-se em suas MS calculadas com EDA CLIA, enquanto que as Tabelas 7 e 8 elucidam os níveis de qualidade fundamentados nas MS dos parâmetros perante EDA baseadas em VB, níveis mínimo e desejável de qualidade, respectivamente. Estas tabelas serão utilizadas para a discussão dos resultados de DA perante a MS, por resumirem de forma mais prática o que os dados numéricos das Tabelas 4 e 5 significam.
Discussão
O primeiro ponto a ser discutido é referente à definição das EDA para os parâmetros hematológicos. A conferência estratégica de 2014(5) diz que a preferência deve ser dada aos modelos 1 e 2, enquanto que o modelo 3, embasado no estado da arte, deve ser temporariamente usado somente para analitos que aguardam estudos avaliando EDA pelos modelos 1 e 2, ou para analitos em que estes não possam ser aplicados. O modelo 3 não deve ser cogitado para hematologia, pois existem EDA bem definidas baseadas nos modelos 1 e 2 para este setor. O modelo 1 apresenta como vantagem o enfoque na influência direta do DA nos desfechos clínicos relevantes para a prática clínica. A principal desvantagem é que ela só é útil para exames onde as evidências de correlações entre o teste, a tomada de decisão médica e os desfechos clínicos são claras e bem estabelecidas. Além disso, essas EDA são influenciadas pela qualidade da tecnologia disponível e os resultados podem variar de acordo com o método utilizado, a população investigada e os ambientes de saúde.(7)
Já o modelo 2, escolhido para este estudo, tem a vantagem de poder ser aplicado à maioria dos parâmetros e analitos do laboratório. Não há ligação direta com o uso clínico do teste, mas há minimização do ruído analítico gerado pela VB.(7) Essa interferência fisiológica deve ser considerada para facilitar a interpretação dos resultados pelos médicos assistentes. A VB é utilizada há décadas para definição das EDA, e os critérios atuais continuam corroborando a escolha deste modelo para os parâmetros hematológicos.(7) Outra vantagem é permitir a definição de EDA em diferentes níveis de qualidade (mínimo, desejável e ótimo),(18) permitindo que se inicie utilizando EDA menos rigorosas, enquanto se trabalha gradativamente para melhorar o DA e atingir níveis cada vez melhores de qualidade.(7) Uma das limitações desse modelo é que os estudos precisam ser criteriosamente delineados para gerarem dados relevantes,(19) porém, mesmo com algumas limitações, o modelo clássico de VB continua sendo a abordagem mais utilizada para a definição de EDA na medicina laboratorial.(20)
Se os parâmetros deste estudo fossem analisados baseando-se numa abordagem tradicional de CQ, o equipamento em avaliação não apresentaria nenhum desvio de performance: todos os pontos dos três níveis de controle obedeceram às regras de Westgard(4) durante as análises diárias de CIQ, no decorrer do mês analisado, e nenhum parâmetro obteve resultado inaceitável ou não satisfatório no CEQ.
Entretanto, quando os dados são analisados de forma mais minuciosa, é possível se detectarem oportunidades de melhorias. Avaliando-se a imprecisão do equipamento perante EDA VB, quase a totalidade dos parâmetros evidenciaram resultados satisfatórios, exceto o CHCM. Considerando-se os níveis de qualidade propostos por Fraser et al.,(18) WBC, RBC, HB, RDW-CV e PLT enquadram-se no nível desejável de qualidade em todos os níveis de controle, enquanto que HT e VCM demonstraram qualidade desejável nos níveis alto e normal, e qualidade mínima no nível baixo do CIQ. HCM demonstrou desempenho desejável de qualidade nos níveis alto e normal, porém insatisfatório no nível baixo. CHCM teve desempenho inadequado perante EDA de VB em todos os níveis de controle. Shu et al.(21) e Xiang et al.(22) avaliaram equipamentos hematológicos do mesmo fabricante deste estudo e os resultados foram similares, porém consideraram valores de CV < 2,5% como excelentes por superarem as especificações de aceitabilidade do fabricante, o que não condiz com a abordagem aqui proposta. Sabe-se que os limites fornecidos pelos fabricantes são amplos, o que pode superestimar a qualidade dos ensaios. A decisão deste estudo em aplicar EDA VB para CV e viés está alinhada ao planejamento estratégico para a melhoria contínua do DA e não à abordagem clássica de CQ.
Os resultados da inexatidão do equipamento também evidenciam problemas. Somente WBC, HB e RDW-CV apresentaram resultados satisfatórios para níveis desejáveis de qualidade. A contagem de RBC está dentro das EDA para nível mínimo de qualidade, enquanto que os demais parâmetros (HT, VCM, HCM, CHCM e PLT) extrapolaram os limites de suas EDA até para o nível mínimo de qualidade. É importante ressaltar que um parâmetro pode apresentar um viés um pouco aumentado se o seu CV for baixo e vice-versa. É aceitável trabalhar com flexibilidade de julgamento, desde que os limites de ETa não sejam extrapolados, garantindo-se que não se introduzam erros de importância médica nos resultados.(8)
Os estudos de Shu et al.(21) e Xiang et al.(22) também avaliaram a inexatidão dos equipamentos, através de numerosas amostras de pacientes, por coeficiente de correlação e regressão linear, metodologia estatística diferente da abordada neste estudo, usada em um enfoque principal de validação ou verificação de instrumentos. Diferentes formas de estimar o viés, com diferentes propósitos, acabam invalidando a comparação de resultados. Sabe-se que a melhor estimativa do valor alvo do parâmetro é quantificando-o em materiais e por métodos de referência, mas essa abordagem nem sempre é praticável rotineiramente no laboratório, devido ao custo elevado. A comparação de resultados entre o laboratório e o grupo alvo que utiliza o mesmo equipamento no CEQ ampara o enfoque no monitoramento mensal do DA e à melhoria contínua da qualidade, sem exagerado aumento de custos operacionais.(23)
Na avaliação do ET, destaca-se inicialmente RBC e PLT. O nível mínimo de qualidade da RBC e o desempenho insatisfatório das PLT perante seus vieses foram compensados por seus bons CV, integrando os parâmetros na especificação de nível desejável de qualidade segundo seus resultados de ET, exemplificando a flexibilidade de julgamento antes mencionada. Os parâmetros WBC, HB e RDW-CV apresentaram bons ET perante o nível desejável de qualidade. O HT apresentou resultado satisfatório perante EDA da CLIA e de VB para qualidade mínima para as determinações em níveis alto e normal, porém insatisfatório perante todas as EDA em determinações no nível baixo. Já VCM, HCM e CHCM apresentaram DA inadequado em todos os níveis de controle perante as EDA propostas.
Para o enfoque principal deste estudo, a avaliação do DA do equipamento baseada na MS, considera-se o nível de qualidade a que cada parâmetro se enquadra. Na Tabela 6, onde a qualidade foi baseada em EDA CLIA, obtiveram-se, majoritariamente, bons resultados. A exceção é o HT, que evidencia qualidade inaceitável em todos os níveis de controle, requerendo um plano de melhoria imediato. Quando se avaliam as MS derivadas de EDA VB, observa-se uma realidade diferente: analisando-se a Tabela 7, a primeira conclusão é que somente os parâmetros RBC, HB e RDW-CV apresentam bons níveis de qualidade. WBC e PLT não apresentam EDA para este nível de qualidade, como já salientado. HT, VCM e HCM apresentam desempenho inaceitável em pelo menos algum nível de controle, e CHCM apresenta resultado inaceitável em todos os níveis. Considerando-se as MS calculadas com base em VB para qualidade desejável, expostas na Tabela 8, ressalta-se que WBC é o único parâmetro com DA excelente em todos os níveis de controle avaliados.
O primeiro ponto a ser destacado após a análise do DA baseado na MS é o impacto significativo da escolha das diferentes fontes de EDA do ETa nos resultados. Essa discrepância nos valores obtidos endossa a flexibilidade permitida aos laboratórios para a escolha das EDA. Embora pareça lógico usar a mesma fonte para todos os parâmetros, a escolha deve ser transigente conforme a qualidade de cada ensaio. Alguns alvos de ETa são muito liberais e superestimam a qualidade, enquanto que outros são rigorosos demais e resultam em estimativas excessivamente pessimistas.(24) Aplicar VB para a MS é discutida por ser uma EDA bastante exigente e um objetivo bastante difícil de alcançar, mas permite verificar adequadamente o DA do parâmetro, objetivando identificar desvios na qualidade e necessidades de ações alinhadas à melhoria contínua. Em contrapartida, outro ponto pode ser destacado: parâmetros de excelente qualidade se destacam sejam quais forem as EDA aplicadas, e metodologias inadequadas (ou mal controladas) assim o são independentemente de qual seja a EDA. Em relação à Tabela 5, deve-se observar que há parâmetros com valores negativos de MS, refletindo situações em que o viés excede completamente o ETa, resultando, obviamente, em qualidade inaceitável. Cabe também salientar, como já mencionado, que o viés determinado pelo CEQ não garante robustez estatística para se obter a melhor estimativa do valor real do parâmetro, mas é capaz de direcionar as ações da gestão da qualidade.
De maneira geral, HT, VCM, HCM e CHCM apresentaram resultados inaceitáveis perante as EDA propostas. Cabe lembrar que VCM, HCM e CHCM não apresentam EDA CLIA, mas os dados provenientes de VB corroboram a necessidade de melhorias. Estes parâmetros apresentam claramente um desvio de exatidão, comprovado pelos seus vieses fora das EDA. Em relação a PLT, o DA foi adequado perante EDA CLIA, mas não se tem EDA VB para nível mínimo de qualidade e o DA perante EDA VB desejável foi inaceitável para determinações realizadas no nível baixo. O estudo da inexatidão elucidou um viés um pouco aumentado, mas deve-se considerar a avaliação do ET do parâmetro: os ótimos resultados comprovam que não há impacto na segurança dos pacientes com plaquetopenia, que dependem criticamente da determinação no nível baixo. Alguns analitos podem ter diferentes EDA definidas dependendo de suas aplicações clínicas.(7) O mesmo raciocínio pode ser aplicado à RBC.
Fuadi(25) avaliou o equipamento Cell-Dyn Ruby (Abbott®) pela MS aplicando somente EDA CLIA, portanto avaliando exclusivamente WBC (7,3), RBC (3,6), HB (4,3), HT (2,5) e PLT (6,3), com suas MS médias entre parênteses. Os achados também são de pior DA para HT. Ramírez et al.(26) avaliaram o equipamento LH 750 (Beckman Coulter®) durante 18 meses, somente analisando parâmetros com EDA CLIA, e também obtiveram HT como o parâmetro de pior DA, com MS média de 4,21, mas ressaltaram que chegou a 1,85 no pior mês. HB teve variação da MS média de 3,43 a 14 durante os meses do estudo, endossando a importância do cálculo da MS como prática mensal para o acompanhamento de longo prazo do DA. Outro estudo, realizado por Shaikh e Moiz,(27) avaliou o DA mensal do equipamento XE-5000 (Sysmex®) perante EDA VB nível desejável e encontraram valores de MS superiores a 3 para todos os analitos, exceto VCM e PLT. Eles não excluem o possível efeito do armazenamento do controle comercial hematológico nos resultados, salientando a necessidade de melhorias na hora de auditar todas as etapas do CQ, desde o transporte até o manuseio e armazenamento adequados das amostras de controle. Harrison e Jones(28) utilizaram a MS baseada em EDA CLIA para monitorar o DA em uma rede integrada de assistência médica, incluindo a avaliação de vários equipamentos Sysmex® (XS-1000, XE-5000, XT-4000 e modelos XN), em diferentes laboratórios, através de um sistema de interfaceamento de dados. Todos os parâmetros resultaram consistentemente em MS > 4, com exceção do HT. Logo, os resultados encontrados neste estudo não são muito diferentes de dados internacionais.
É relevante destacar que um nível de MS persistente abaixo de 3 exige investigações e ações imediatas para solucionar os desvios de qualidade. Este trabalho tem como limitação o curto prazo de tempo da análise de dados, porém é a partir de seus resultados que o aperfeiçoamento da qualidade pode ser conduzido. Uma discussão abrangente das ações corretivas necessárias a serem tomadas está além do escopo deste estudo.
Conclusões
Com base nos resultados avaliados neste estudo, é evidente a importância do monitoramento mensal do DA, garantindo a uniformidade de resultados. É essencial a reflexão sobre o impacto de erros analíticos na segurança do paciente, considerando toda a complexidade da análise laboratorial.
A determinação da MS é uma prática notável para que o DA seja verificado e otimizado continuamente, acompanhando os avanços tecnológicos da medicina laboratorial. A avaliação dos parâmetros hematológicos perante esta abordagem permitiu, neste estudo, identificar falhas não detectadas pelo CQ convencional. Alinhar a abordagem Seis Sigma com a avaliação de CV, viés e ET permite que o laboratório disponha de dados importantes para atender adequadamente as EDA, com o objetivo de conquistar a excelência no diagnóstico in vitro e qualificar constantemente a prestação de serviço ao paciente.
Abstract.
Objective: To evaluate the performance of the Mindray® BC-5380 equipment using the sigma metric. Methods: The parameters included in this study are leukocytes, erythrocytes, hemoglobin, hematocrit, average corpuscular volume, mean corpuscular hemoglobin, mean corpuscular hemoglobin concentration, red cell distribution width and platelets. The calculations were performed based on data from the laboratory’s quality control routine, determining inaccuracy, imprecision, total analytical error and the sigma metric of the parameters. Results: Acceptable values of Sigma (> 3) calculated based on CLIA specifications were found for all parameters, except hematocrit Calculating the metric based on specifications of biological variation, hematocrit, mean corpuscular volume and mean corpuscular hemoglobin present unacceptable performance in at least one level of control, and the mean corpuscular hemoglobin concentration shows unacceptable results at all levels. The total leukocyte count was the only parameter with excellent performance at all levels of control, with the quality specifications applied. Conclusion: The use of the sigma metric in the evaluation of analytical performance allows to identify flaws not detected by conventional quality control, being an important resource for continuous quality improvement.
Palavras-chave
Quality control; hematology; analytical quality control
REFERÊNCIAS
- Berlitz FA. Controle da qualidade no laboratório clínico: Alinhando melhoria de processos, confiabilidade e segurança do paciente. J Bras Patol e Med Lab. 2010;46(5):353-63. https://doi.org/10.1590/S1676-24442010000500003
- Plebani M, Sciacovelli L, Aita A. Quality Indicators for the Total Testing Process. Clin Lab Med. 2017 Mar;37(1):187-205. doi: 10.1016/j.cll.2016.09.015.
- Westgard JO, Westgard SA. Establishing evidence-based statistical quality control practices. Am J Clin Pathol. 2019;151(4):364-70. doi: 10.1093/ajcp/aqy158.
- ControlLab. Gestão da fase analítica do laboratório: como assegurar a qualidade na prática v.2 [Internet]. 1st ed. Vol. 2. 2012. 148 p.
- Sandberg S, Fraser CG, Horvath AR, Jansen R, Jones G, Oosterhuis W, et al. Defining analytical performance specifications: Consensus Statement from the 1st Strategic Conference of the European Federation of Clinical Chemistry and Laboratory Medicine. Clin Chem Lab Med. 2015;53(6):833-5.
- D. Kenny CG, Fraser P, Hyltoft Petersen, A. Kallner (1999) Consensus agreement. Scand J Clin Lab Invest, 59:7, 585, DOI: 10.1080/00365519950185409.
- Ceriotti F, Fernandez-Calle P, Klee GG, Nordin G, Sandberg S, Streichert T, et al. Criteria for assigning laboratory measurands to models for analytical performance specifications defined in the 1st EFLM Strategic Conference. Clin Chem Lab Med. 2016; 55(2):189-94. doi: 10.1515/cclm-2016-0091
- Basques JC. Especificações da Qualidade Analítica. Labtest. 2009;1-32.
- Litten J. Applying Sigma Metrics to Reduce Outliers. Clin Lab Med. 2017;37(1):177-86. doi: 10.1016/j.cll.2016.09.014.
- Westgard S, Bayat H, Westgard JO. Analytical Sigma metrics: A review of Six Sigma implementation tools for medical laboratories. Biochem Med (Zagreb). 2018 Jun 15;28(2):020502. doi: 10.11613/BM.2018.020502.
- Fraser CG. Biological variation in clinical chemistry. An update: collated data, 1988-1991. Arch Pathol Lab Med. 1992 Sep; 116(9):916-23.
- Perich C, Minchinela J, Ricos C, Fernandez-Calle P, Alvarez V, Domenech MV, et al. Biological variation database: structure and criteria used for generation and update. Clin Chem Lab Med. 2015 Feb;53(2):299-305. doi: 10.1515/cclm-2014-0739.
- Westgard JO. Desirable Biological Variation Database specifications [Internet]. 2014 [cited 2019 Dec 12]. Available from: https://www.westgard.com/biodatabase1.htm
- Westgard JO. Minimum Specifications from Biological Variation database [Internet]. 2014 [cited 2020 Mar 20]. Available from: https://www.westgard.com/minimum-biodatabase1.htm
- Medicare, Medicaid and CLIA programs; regulations implementing the Clinical Laboratory Improvement Amendments of 1988 (CLIA)-HCFA. Final rule with comment period. Fed Regist. 1992 Feb;57 (40):7002-186.
- Westgard JO. Optimal Biological Variation database specifications [Internet]. 2014 [cited 2020 Apr 3]. Available from: https://www.westgard.com/optimal-biodatabase1htm.htm
- Westgard JO, Westgard SA. Six Sigma Quality Management System and Design of Risk-based Statistical Quality Control. Clin Lab Med [Internet]. 2017;37(1):85-96.
- Fraser CG, Kallner A, Kenny D, Petersen PH. Introduction: strategies to set global quality specifications in laboratory medicine. Scand J Clin Lab Invest. 1999 Nov;59(7):477-8.
- Bartlett WA, Braga F, Carobene A, Coskun A, Prusa R, Fernandez-Calle P, et al; Biological Variation Working Group, European Federation of Clinical Chemistry and Laboratory Medicine (EFLM). A checklist for critical appraisal of studies of biological variation. Clin Chem Lab Med. 2015 May;53(6):879-85. doi: 10.1515/cclm-2014-1127.
- Braga F, Panteghini M. Generation of data on within-subject biological variation in laboratory medicine: An update. Crit Rev Clin Lab Sci. 2016;53(5):313-25. doi: 10.3109/10408363.2016.1150252.
- Shu G, Lu H, Du H, Shi J, Wu G. Evaluation of Mindray BC-3600 hematology analyzer in a university hospital. Int J Lab Hematol. 2013;35(1):61-9. doi: 10.1111/j.1751-553X.2012.01464.x
- Xiang D, Yue J, Lan Y, Sha C, Ren S, Li Y, et al. Evaluation of Mindray BC-5000 hematology analyzer: A new miniature 5-part WBC differential instrument. Int J Lab Hematol. 2015;37(5):597-605. doi: 10.1111/ijlh.12370.
- Vis JY, Huisman A. Verification and quality control of routine hematology analyzers. Int J Lab Hematol. 2016 May;38 Suppl 1:100-9. doi: 10.1111/ijlh.12503.
- Hens K, Berth M, Armbruster D, Westgard S. Sigma metrics used to assess analytical quality of clinical chemistry assays: importance of the allowable total error (TEa) target. Clin Chem Lab Med. 2014;52(7):973-80. doi: 10.1515/cclm-2013-1090.
- Fuadi R. Using Six Sigma to evaluate analytical performance of hematology analyzer. Indones J Clin Pathol Med Lab. 2019 Apr 13;25(2):165. DOI: http://dx.doi.org/10.24293/ijcpml.v25i2.1375.
- Cumplido-Uribe R, Hernández-Hernández J, Andujo-González S, Guzmán-Ramírez H. Implementación de sigma métrico como parte esencial del control de calidad interno en hematología. Rev Latinoam Patol Clínica y Med Lab. México, 2015;62(3):140-5.
- Shaikh MS, Moiz B. Analytical performance evaluation of a high-volume hematology laboratory utilizing sigma metrics as standard of excellence. Int J Lab Hematol. 2016 Apr;38(2):193-7. doi: 10.1111/ijlh.12468
- Harrison HH, Jones JB. Using Sigma Quality Control to Verify and Monitor Performance in a Multi-Instrument, Multisite Integrated Health Care Network. Clin Lab Med 2017;37(1):207-41. doi: 10.1016/j.cll.2016.10.001.
Correspondência
Flávia Fachini
Faculdade da Serra Gaúcha
Sociedade Educacional Santa Rita S.A.
Av. Rua Os Dezoito do Forte, 2366
95020-472 – Caxias do Sul – RS, Brasil
