Prevalência sorológica do vírus da Hepatite C na região carbonífera do Rio Grande do Sul
Sorological prevalence of Hepatitis C virus in carboniferous region of Rio Grande do Sul
Cleomara Vieira Almeida
Biomédica. Ulbra. Canoas-RS, Brasil.
Instituição: Universidade Luterana do Brasil. Canoas-RS, Brasil.
Recebido em 05/11/2020
Aprovado em 14/01/2021
DOI: 10.21877/2448-3877.202100949
INTRODUÇÃO
Em 1989, mediante sucessivos estudos de biologia molecular, Qui-Lim-Choo, George Kuo, Daniel Bradley e Michael Hougthon, após seis anos de intensa investigação (1982-1988), identificaram o genoma de um agente viral que revelou a presença do maior causador de doenças hepáticas, o vírus da hepatite C (HCV). A suspeita do vírus surgiu nos anos 70 quando foram relatados vários casos de indivíduos infectados com um agente infeccioso diferente dos vírus da hepatite A e B (HAV e HBV), que causava hepatite crônica e era frequentemente transmitido por sangue e produtos sanguíneos.(1-3)
A decodificação do genoma do HCV, no ano de 1989, a partir de um clone derivado de um paciente infectado por um vírus causador da então denominada hepatite não A não B, facilitou a compreensão da biologia viral e permitiu o desenvolvimento de todos os testes laboratoriais para detecção, identificação e caracterização deste vírus.(4-6) Com a introdução da terapia para as hepatites causadas pelo HCV, principalmente o emprego de Interferon e Ribavirina, constatou-se uma grande variabilidade quanto à resposta terapêutica obtida.(7)
Estudos recentes têm atribuído esta variabilidade à existência de tipos de HCV mais ou menos sensíveis à terapia. Entre os seis genótipos caracterizados (nomeados de 1 a 6 e subclassificados em subtipos 1a, 1b, 2a, 2b, 2c, 3a, 4a, 4d, 5a e 6a), os HCV de genótipo 1 estão ligados a um prognóstico desfavorável, além de apresentarem pior resposta ao tratamento, enquanto que os HCV do tipo 2 e 3 apresentam uma melhor resposta aos medicamentos. Por este motivo, o tratamento de pacientes com genótipos 2 e 3 pode ser feito por apenas seis meses, dependendo da carga viral, enquanto que os pacientes com genótipo 1 devem ser sempre tratados por um ano. A determinação do genótipo do HCV por PCR e sequenciamento é indicado para a determinação do tratamento de portadores do HCV.(7)
Habitualmente, a hepatite C é diagnosticada em sua fase crônica. Como os sintomas são muitas vezes escassos e inespecíficos, quando ocorrem são sintomas de resfriado ou gripe, elevação dos níveis de enzimas hepáticas, fadiga (cansaço muscular), perda de apetite, dores nas articulações ou musculares e náuseas. A doença evolui durante décadas sem diagnóstico.(8,9)
A epidemiologia do HCV não é homogênea no cenário nacional. No início da epidemia, o desconhecimento da doença e a falta de exame para o diagnóstico dos portadores assintomáticos levaram à maior concentração da doença em indivíduos submetidos à transfusão de sangue e hemoderivados. As regiões em que o uso de drogas injetáveis era frequente abrigam também maior número de portadores do HCV.(10-13)
A infecção pelo HCV é atualmente considerada como um grande problema também de saúde pública. Dados da Organização Mundial da Saúde (OMS) estimam que 170 a 200 milhões de pessoas no mundo estejam infectadas pelo HCV. No Brasil, o inquérito epidemiológico de âmbito nacional realizado pela Sociedade Brasileira de Hepatologia apontou prevalência de 1,23% entre 1.173.406 doadores de sangue. No entanto, dados da OMS estimam que 2,5% a 4,9% da população em geral esteja infectada pelo HCV, podendo corresponder à existência de 3,9 a 7,6 milhões de portadores crônicos do vírus no Brasil. Com relação ao genótipo, 64% possuíam o genótipo 1, 33% o genótipo 3 e 3% os genótipos 2 e 4.(10,12)
De 1999 a 2015, foram notificados 289.459 casos de HCV no Brasil. Do total de casos nesse período, 64,2% foram contabilizados na região sudeste, 24,2% na região sul, 5,6% na região nordeste, 3,2% na região centro-oeste e 2,7% na região norte.(5) Do ano 2000 até 2014, foram identificados 42.383 óbitos associados ao HCV. Dentre eles, 54,4% tiveram o HCV como causa básica, sendo 57,0% registrados no Sudeste, 23,6% no Sul, 10,6% no Nordeste, 4,5% no Norte e 4,2% no Centro-Oeste.(14)
O presente estudo teve como objetivo estimar a prevalência sorológica e fatores de risco para o HCV da Região Carbonífera do Rio Grande do Sul. O presente estudo possui aprovação pelo Comitê de Ética em Pesquisa em Seres Humanos da Universidade Luterana do Brasil, sob o número de CAAE 13308019.9.0000.534.
Material e Métodos
Foram coletados 1.136 dados de prontuários de pacientes que realizaram exame sorológico para HCV em um laboratório localizado na Região Carbonífera do Rio Grande do Sul durante o período de janeiro de 2017 a julho de 2018. A metodologia empregada no exame de Anti-HCV foi a quimioluminescência.
Dos laudos, foram analisadas as variáveis sociodemográficas, incluindo sexo, faixa etária, cidade de origem e variáveis clínicas, como a realização da vacina H1N1.
Os dados foram compilados e analisados através do software SPSS® (23.0 version, Chicago, IL Statistical Package for the Social Sciences). As avaliações de possíveis diferenças estatísticas entre as variáveis qualitativas foram verificadas pelo teste qui-quadrado de Pearson. O tipo de distribuição da variável idade foi verificado pelo teste de Kolmogorov-Smirnov e a comparação entre os grupos foi efetuada pelo teste t de Student para amostras independentes. Todas as análises foram bilaterais com nível de significância pré-estabelecido para o erro a de 5% (p<0,05).
Resultados
Os resultados do presente estudo estão apresentados na Tabela 1 e no Gráfico 1.
Foram analisados 1.136 laudos de exames para detecção de HCV, predominando o mês de agosto de 2017 como o mês com mais realização de exames (7,1%) e o mês de fevereiro de 2017 com menos exames efetuados (3,7%).
Sobre o perfil sociodemográfico, observou-se que o sexo feminino realizou mais exames (80,1%) comparados ao sexo masculino (19,9%) tendo uma idade média no momento da realização do exame de 35,9 anos (DP ±15,7), apresentando um maior número de pacientes na cidade de Butiá (47,6%), seguida de Minas do Leão (22,8%), Triunfo (16,8%) e Arroio dos Ratos (12,8%). Quanto à variável clínica, procedeu a não vacinação da H1N1 (70,2%).
Em relação à variável do vírus da Hepatite C, 29 (2,6%) apresentaram resultados reagentes enquanto 1.107 (97,4%) não reagentes. Considerando os pacientes reagentes para a detecção do Anti-HCV, constatou-se que houve predomínio do sexo masculino 15 (51,7%), seguido das mulheres 14 (48,3%).
Quanto a cidade de origem dos pacientes observou-se que a cidade de Arroio dos Ratos tem uma prevalência maior para presença do vírus HCV, 13 (44,8%), seguida por Butiá, 8 (27,6%), Triunfo, 6 (20,7%) e Minas do Leão, 2 (6,9%).
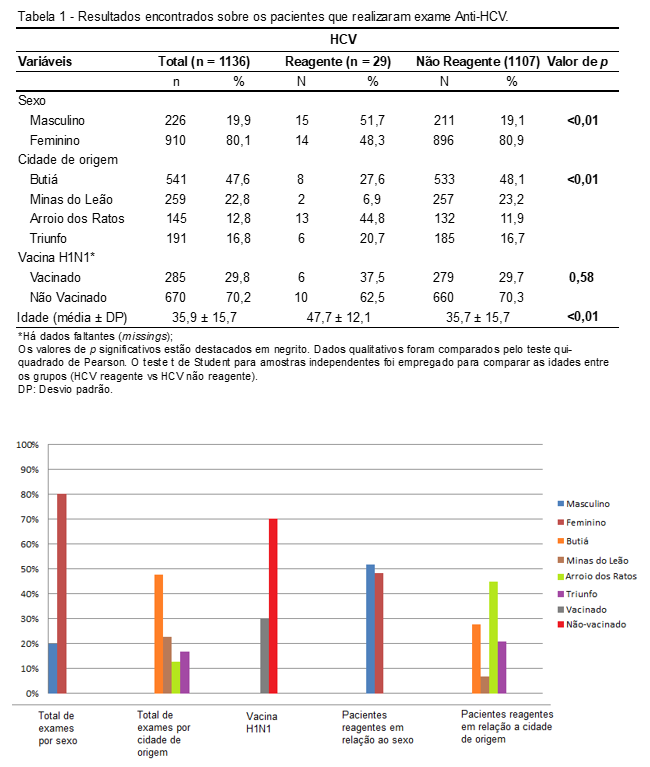
Gráfico 1. Resultados encontrados sobre os pacientes que realizaram exame Anti-HCV. Fonte: autoral.
Discussão
O presente estudo foi realizado com pacientes atendidos em um laboratório da Região Carbonífera do Rio Grande do Sul, para a detecção da prevalência da presença do HCV. A doença evolui durante décadas sem diagnóstico. Em geral, o diagnóstico específico ocorre após teste sorológico de rotina ou por doação de sangue(10).
Neste estudo utilizamos a metodologia de quimioluminescência com uma sensibilidade de ³98% e especificidade de ³97% em todos os exames realizados. A utilização de diferentes métodos de imunodiagnóstico traz uma grande variabilidade de especificidade e sensibilidade e assim, consequentemente, resultados divergentes.(16)
Resultados falso-positivos podem ser decorrentes de problemas técnicos no procedimento do exame ou de alterações biológicas no indivíduo e que determinam reatividade, independente da condição investigada. Entre as causas de origem técnica, podemos citar: contaminação de ponteiras, contaminação da reação por soros vizinhos fortemente positivos, troca de amostras, ciclos repetidos de congelamento e descongelamento das amostras, pipetagens de baixa acurácia, inativação da amostra a 56°C e transporte ou armazenamento inadequado das amostras ou dos kits.(17,18)
É importante salientar que nem todos os casos de reações falso-positivas tem a sua causa definida ou podem ser evitados. Além disso, tais causas podem variar ou não, de acordo com os métodos utilizados. No entanto, em populações de baixo risco, como doadores de sangue e população geral, o teste tem baixo valor preditivo positivo, gerando exames falso-positivos em pessoas que nunca foram expostas ao HCV.(18)
Com relação aos resultados falso-negativos, é importante mencionar a sensibilidade do teste como uma das principais causas, em função das diferentes capacidades de detecção dos kits, da ocorrência do período de janela imunológica ou da variabilidade na constituição antigênica dos conjuntos de diagnóstico. Entre as causas de ordem técnica como fatores que contribuem para o aparecimento de resultados falso-negativos, podemos citar: a troca da amostra, o uso de reagentes fora do prazo de validade, a utilização de equipamentos desajustados, pipetagem incorreta e o transporte ou armazenamento inadequado das amostras ou dos kits.(26)
Todo resultado de um teste anti-HCV positivo deve ser obrigatoriamente seguido por um teste RNA/HCV (carga viral ou biologia molecular) a fim de confirmar se o indivíduo está realmente infectado, para então poder o paciente ser encaminhado para cuidados e tratamento para evitar a morbidade e mortalidade associadas à infecção pelo HCV.(18)
Dados da Organização Mundial da Saúde estimam que de 2,5% a 4,9% da população brasileira esteja infectada pelo HCV, significando 3,9 a 7,6 milhões de pessoas com risco de desenvolver cirrose ou hepatocarcinoma. Estima-se também que no Brasil de 20% a 58% dos pacientes com hepatopatia crônica têm anticorpos contra o HCV.(10) Neste estudo foi encontrada uma prevalência de 2,6% de pacientes reagentes para o HCV, o que condiz com os dados da OMS.
Um estudo de base populacional sobre as infecções pelos vírus das hepatites A, B e C nas capitais brasileiras encontrou as seguintes prevalências de Anti-HCV reagente: 2,1% na região norte; 0,7% no Nordeste; 1,3% no Centro-Oeste; 1,3% no Sudeste; 1,2% na região sul; e 0,8% no Distrito Federal. O fator de risco mais relevante encontrado na população de 13 a 69 anos foi o uso de drogas.(10) Neste estudo não foi possível encontrar a forma de contaminação dos pacientes, pois não se obteve acesso a esta informação na planilha de dados analisados.
Segundo o panorama das hepatites virais, as maiores taxas de detecção são observadas em homens com 58% de casos confirmados no Rio Grande do Sul.(19) No estudo foi revelado que a prevalência maior de pacientes com o vírus HCV foi do sexo masculino com 51,7%. Uma das hipóteses para esse número ser elevado no sexo masculino pode estar relacionada com a falta de uso de preservativo em relações sexuais, uso compartilhado de aparelho de barbear e o uso de drogas injetáveis. Ainda, o mesmo estudo permite inferir que a faixa etária que apresentou o maior número de casos foi de 40 a 69 anos,(19) corroborando com esta pesquisa, que indica uma idade média de 47,7 (± 12,1) anos entre os pacientes positivos.
Um estudo realizado na Universidade Federal do Pará, Fecury A. (2011), sobre a prevalência do HCV, revela que as dosagens das transaminases (ALT e AST), g-GT e fosfatase alcalina não se mostraram bons marcadores para avaliar o grau de alteração da função hepática de pacientes portadores de infecção pelo HCV. Trabalhos relatados na literatura, como os de Marquesine et al. (2008) e Pereira et al. (2005) indicaram resultados semelhantes e Boulaajaj et al. (2005) afirmaram que aproximadamente metade dos pacientes com hepatite crônica têm transaminases normais.(20-24) Nos resultados reagentes encontrados no presente estudo nem todos tinham exames bioquímicos, porém, alguns apresentaram alterações em exames complementares para diagnóstico de lesão hepatocelular. O estudo também indica que a maioria dos pacientes reagentes para HCV não obteve alterações bioquímicas em seus exames complementares, ou seja, provavelmente ainda não tiveram sintomas clínicos para hepatite C.
Podem ocorrer resultados falso-positivos nos testes sorológicos que utilizam o método ELISA para detectar anticorpos contra HIV-1, hepatite C e, especialmente, HTLV-1 após vacinação contra gripe. Esses resultados falsos-positivos transitórios podem ser causados por reatividade cruzada da IgM produzida em resposta à vacina. Por essa razão, o diagnóstico definitivo de infecção por HIV-1, hepatite C ou HTLV-1 requer a confirmação por resultado positivo de um teste vírus-específico (por ex., Western blot ou imunoblot).(25) Entretanto, há discordância observada na literatura citada em relação ao presente estudo, pois não foi encontrada reação cruzada e/ou resultados falso-positivos da vacina H1N1 com os exames analisados para Anti-HCV.
O presente estudo demonstrou que a cidade de Arroio dos Ratos foi a que obteve o maior número de pacientes positivos para o HCV (13) 44,8%, onde também pode-se observar que a cidade de Minas do Leão teve a menor quantidade de infectados (2) 6,9%. O número de habitantes na cidade de Arroio dos Ratos, segundo dados do IBGE, indica 13.606 habitantes, dentre eles segundo dados da Superintendência dos Serviços Penitenciários (Susepe), 669 são população carcerária.(26,27)
A infecção pelo HCV tem uma distribuição universal, com altas taxas de prevalência nos centros prisionais, onde cada vez mais a doença está se disseminando entre os detentos. A população prisional apresenta um alto risco de contrair infecções que estão relacionadas às condições de confinamento, entre elas o HCV.(28,29) As prevalências encontradas em diversos estudos realizados entre internos são altas, variam de 3,1% a 52%, o que causa particular preocupação, justificando assim a maior prevalência em Arroio dos Ratos.
Estudos realizados em presídios brasileiros evidenciam a vulnerabilidade dessa população à transmissão parenteral de HCV e HIV por meio do uso de drogas injetáveis e a transmissão via práticas sexuais de risco, além de associarem esse quadro às condições de confinamento, marginalização e serviços de saúde precários.(30,31)
Conclusão
Os dados obtidos apresentam relevância clínica uma vez que a prevalência sorológica de 2,6% encontrada no presente estudo está relacionada com a base populacional de 2,5% a 4,5%, bem como ao predomínio do sexo masculino com resultados reagentes para Anti-HCV.
Os resultados podem servir de base para desenvolver as ações de promoção da saúde, prevenção e assistência aos pacientes com HCV, reforçando a vigilância epidemiológica e sanitária. Desta forma, avalia-se a doença no presente e passado, possibilitando predizer o futuro risco de infecção em determinada população, consequentemente reduzindo gastos e tendo menos infectados, originando uma melhoria contínua da saúde.
O diagnóstico precoce do HCV amplia a eficácia do tratamento. Existem centros de assistência do SUS que disponibilizam tratamento para o HCV em todos os estados do país, sendo assim, é possível alcançar a meta da OMS e eliminar novas infecções por HCV até 2030.
Abstract
Objective: In order to estimate the serological prevalence of HCV patients in the Carboniferous Region, Rio Grande do Sul. Methods: A total of 1,136 data were collected from patients who underwent HCV serological examination in a laboratory located in the Rio Grande do Sul Carboniferous Region from January 2017 to July 2018. Results: In the results, 29 (2.6%) patients were identified with HCV, most of them male, with a higher prevalence in the city of Arroio dos Ratos. Conclusion: The results can serve as a basis for developing health promotion, prevention and care actions for HCV patients, strengthening the epidemiological and health surveillance.
Keywords
Hepatitis C; sorology; prevalency
REFERÊNCIAS
- Bezerra C. Estudo molecular do vírus da hepatite C isolados de pacientes atendidos em hospital de referencia em fortaleza, Ceará. [graduado]. Universidade Federal do Ceará; 2006.
- Wilkins T, Malcolm JK, Raina D, Schade RR. Hepatitis C: diagnosis and treatment. Am Fam Physician. 2010 Jun 1;81(11):1351-7.
- Getchell JP, Wroblewski KE, DeMaria Jr, A, Bean CL, Parker M M, Pandori M, et al; Centers for Disease Control and Prevention (CDC) (2013). Testing for HCV infection: an update of guidance for clinicians and laboratorians. MMWR Morb Mortal Wkly Rep. 2013 May 10; 62(18):362–365.
- Buriol A. Análise de marcadores laboratoriais utilizados no diagnóstico do vírus da hepatite c (hcv) em pacientes hemodialisados de Porto Alegre – RS. [mestre]. Universidade Luterana do Brasil; 2007.
- Tan SL. (Ed.). (2006). Hepatitis C viruses: genomes and molecular biology. Horizon Scientific Press.
- Ninio L, Nissani A, Meirson T, Domovitz T, Genna A, Twafra S, et al. Hepatitis C Virus Enhances the Invasiveness of Hepatocellular Carcinoma via EGFR-Mediated Invadopodia Formation and Activation. Cells. 2019 Nov 5;8(11):1395. doi: 10.3390/cells8111395. PMID.
- HCV Genotipagem| Genomika Diagnósticos [Internet]. Genomika Diagnósticos. 2019 [cited 2 December 2019]. Available from: https://www.genomika.com.br/exames/LT022/
- Diagnósticos de hepatite C – Roche [Internet]. 2019 [cited 9 September 2019]. Available from: https://www.roche.pt/corporate/index.cfm/infosaude/patologias/hepatite-c/diagnostico-da-hepatite-c/
- Kohli A, Shaffer A, Sherman A, Kottilil S. Treatment of hepatitis C: a systematic review. JAMA. 2014 Aug 13;312(6):631-40. doi: 10.1001/jama.2014.7085.
- Ministério da Saúde. Protocolo Clínico e Diretrizes Terapêuticas para Hepatite C e Coinfecções. Distrito Federal: conitec; 2017 p. 16-72.
- Hajarizadeh B, Grebely J, Dore GJ. Epidemiology and natural history of HCV infection. Nat Rev Gastroenterol Hepatol. 2013 Sep; 10(9):553-62. doi: 10.1038/nrgastro.2013.107.
- Mohd Hanafiah K, Groeger J, Flaxman AD, Wiersma ST. Global epidemiology of hepatitis C virus infection: new estimates of age-specific antibody to HCV seroprevalence. Hepatology. 2013 Apr;57(4):1333-42. doi: 10.1002/hep.26141.
- Lok AS, Seeff LB, Morgan TR, di Bisceglie AM, Sterling RK, Curto TM, et al; HALT-C Trial Group. Incidence of hepatocellular carcinoma and associated risk factors in hepatitis C-related advanced liver disease. Gastroenterology, 136(1), 138-148. doi: 10.1053/j.gastro.2008.09.014
- Hepatite C – Secretaria da Saúde [Internet]. Saude.pr.gov.br. 2019 [cited 9 September 2019]. Available from: http://www.saude.pr.gov.br/modules/conteudo/conteudo.php?conteudo=519.
- Indicadores e Dados Básicos das Hepatites nos Municípios Brasileiros [Internet]. Indicadoreshepatites.aids.gov.br. 2018 [cited 03 December 2018]. Available from: http://indicadoreshepatites. aids.gov.br/.
- da Saúde M. Manual Técnico Para O Diagnóstico Das Hepatites Virais. 2nd ed. Brasília – DF: Assessoria de Comunicação (ASCOM); 2018.
- Resultados falsos positivos no teste da hepatite C – Hepato [Internet]. 2019 [cited 1 December 2019]. Available from: https://www. hepato. com/2017/02/resultados-falsos-positivos-no-teste-da-hepatite-c/
- [Internet]. Bvsms.saude.gov.br. 2019 [cited 1 December 2019]. Available from: http://bvsms.saude.gov.br/bvs/publicacoes/20diagnostico_sorologico.pdf
- Panorama das hepatites virais no rio grande do sul. Divisão de Vigilância Epidemiológica Programa Estadual de Hepatites Virais. 2018;:3-7.
- Fecury A. Vírus da hepatite c: prevalência dos genótipos, fatores de risco, alterações bioquímicas e histopatológicas de pacientes atendidos no núcleo de medicina tropical . [Graduado]. Universidade Federal do Pará; 2011.
- Marquesini G, Gonçales NSL, Gonçales Júnior . Prevalência dos marcadores sorológicos dos vírus da hepatite B (VHB) e da hepatite C (VHC) em hemodialisados. Revista Panamericana de Infectologia. v. 10, n. 1, p. 23-27, 2008.
- Pereira HMV, Cavalheiro NP, Tengan FM, Melo CE, Mello ES, Barone AA. Patients with chronic hepatitis C and normal transaminases.Rev Inst Med Trop Sao Paulo. 2005 Sep-Oct;47(5):247-51. doi: 10.1590/s0036-46652005000500002.
- Boulaajaj K, Elomari Y, Elmaliki B, Madkouri B, Zaid D, Benchemsi N. Prevalence of hepatitis C, hepatitis B and HIV infection among haemodialysis patients in Ibn-Rochd university hospital, Casablanca. Nephrol Ther. 2005 Nov;1(5):274-84. doi: 10.1016/j.nephro.2005.06.012. [Article in French].
- Conti F, Buonfiglioli F, Scuteri A, Crespi C, Bolondi L, Caraceni P, et al. Early occurrence and recurrence of hepatocellular carcinoma in HCV-related cirrhosis treated with direct-acting antivirals. J Hepatol. 2016 Oct;65(4):727-733. doi: 10.1016/j.jhep.2016.06.015.
- [Internet]. Anvisa.gov.br. 2018 [cited 8 October 2019]. Available from: http://www.anvisa.gov.br/datavisa/fila_bula/frmVisualizarBula. asp?pNuTransacao=4104872018&pIdAnexo=10550071
- [Internet]. Cidades.ibge.gov.br. 2019 [cited 16 October 2019]. Available from: https://cidades.ibge.gov.br/brasil/rs/arroio-dos-ratos/panorama
- Penitenciária Estadual de Arroio dos Ratos | SUSEPE – Superintendência dos Serviços Penitenciários [Internet]. Susepe.rs.gov.br. 2019 [cited 1 December 2019]. Available from: http://www.susepe.rs.gov.br/conteudo.php?cod_menu=16&cod_ conteudo=269
- Prevalência do Hiv e Hcv em presídio de Aparecida de Goiânia, Goiás. | Movimenta (ISSN 1984-4298) [Internet]. Revista.ueg.br. 2019 [cited 1 December 2019]. Available from: https://www.revista.ueg.br/index.php/movimenta/article/view/3824
- Rosa Fd, Carneiro M, Duro LN, Valim AR, Reuter CP, Burgos MS, et al. Prevalence of anti-HCV in an inmate population. Rev Assoc Med Bras (1992). 2012 Sep-Oct;58(5):557-60. [Article in English, Portuguese]. doi: 10.1590/s0104-42302012000500012
- de Albuquerque AC, da Silva DM, Rabelo DC, de Lucena WA, de Lima PC, Coelho MR,et al . Seroprevalence and factors associated with human immunodeficiency virus (HIV) and syphilis in inmates in the state of Pernambuco, Brazil. Cien Saude Colet. 2014 Jul;19(7):2125-32. doi: 10.1590/1413-81232014197.08602013. [Article in Portuguese]
- Felisberto M, Saretto AA, Wopereis S, Machado MJ, Spada C.. Prevalence of HCV infection in a prison population of the greater Florianópolis area. Rev Soc Bras Med Trop. 2019 Jul 18; 52: e20190143. doi: 10.1590/0037-8682-0143-2019.
Correspondência
Cleomara Vieira Almeida
Av. Farroupilha, 8001 – São José
92425-020 – Canoas – RS, Brasil
