Proposta de escala colorimétrica para inspeção visual do grau de hemólise em bolsas de concentrado de hemácias
Colorimetric scale proposal for visual inspection of the hemolysis degree in red cells concentrate bags
Adriana Guimarães Estácio1
Thaís Bezerra de Figueiredo2
Jeovaci Moreira de Souza3
Neidiane Farias Ramos3
Lacy Cardoso de Brito Junior4
1Biomédica. Mestre pelo Programa de Pós-graduação Mestrado Profissional em Análise Clínicas pela Universidade Federal do Pará (UFPA), Gerente do Controle de Qualidade da Fundação Hemopa. Belém-PA, Brasil.
2Enfermeira. Especialista em Hematologia e Imunologia pela Universidade Federal do Pará (UFPA), Servidora da Fundação Hemopa. Belém-PA, Brasil.
3Biomédico(a). Especialista em Hematologia e Imunologia pela Universidade Federal do Pará (UFPA), Servidor da Fundação Hemopa. Belém-PA, Brasil.
4Doutor/Universidade Federal do Pará (UFPA). Belém-PA, Brasil. (Professor/Pesquisador).
Instituição: Universidade Federal do Pará (UFPA). Belém-PA, Brasil.
Recebido em 20/01/2019
Artigo aprovado em 24/03/2020
DOI: 10.21877/2448-3877.202000816
INTRODUÇÃO
A transfusão de hemocomponentes hoje é um método bastante seguro, contudo não é livre de eventos adversos.(1-5) Para que um hemocomponente chegue adequado e seguro ao seu destino final, o sangue percorre várias etapas submetidas a rígido controle, que vão desde a captação de doadores, triagem clínica e sorológica, coleta do sangue, processamento, controle de qualidade, armazenamento, distribuição e, por fim, a hemotransfusão. É o chamado ciclo do sangue.(6-10)
O processamento das bolsas de sangue total e o armazenamento dos concentrados de hemácias (CH) muitas vezes podem ocasionar lesões celulares em hemácias (hemólise) decorrentes de traumas físicos do processamento (centrifugação e separação dos hemocomponentes) ou do próprio armazenamento destes produtos (tempo de estocagem e temperaturas inadequadas) e que, em muitos casos, são imperceptíveis ao exame de olho desarmado.(8,10-15)
Visando minimizar estes efeitos indesejáveis, a legislação brasileira, por meio da Portaria nº 158/201616, estabeleceu que 1% do total de bolsas de CH deve passar por rigorosos testes colorimétricos para verificar o grau de hemólise do produto no setor de controle de qualidade dos hemocentros. Contudo, como nem sempre estes produtos são utilizados de imediato, torna-se necessária a retestagem dos mesmos (teste de hemólise) após o armazenamento sob refrigeração do produto.(11,12,14)
Esta retestagem, teste de hemólise, é feita normalmente após o descongelamento de bolsas de CH no serviço de distribuição de um hemocentro antes de sua liberação para transfusão, ou em situações de reintegração do produto por falta de uso ao estoque do hemocentro.(11,15) Em todos estes casos, o teste de hemólise tem caráter qualitativo, baseando-se unicamente na inspeção visual empírica, a olho desarmado, da coloração do plasma proveniente da bolsa após centrifugação e diluição da amostra em soro fisiológico, tendo alto risco de falsos positivos ou falsos negativos dependentes da experiência do observador.(11,14)
Assim, diante do caráter empírico do teste de hemólise e o risco de presença de hemólise, este estudo propôs a criação de uma escala colorimétrica de inspeção visual que correlacione o teste de hemólise com grau de hemólise em bolsas de CH.
MATERIAL E MÉTODOS
Amostras
Para a criação da escala colorimétrica que associasse o grau de hemólise com o teste de hemólise foi utilizado um total de 102 bolsas de concentrados de hemácias (n=36), concentrados de hemácias pobres em leucócitos (n=36) ou de concentrados de hemácias desleucotizados (n=36) com até 28 dias da sua produção, mantidas em condições padrões de armazenamento e oriundas da rotina para grau de hemólise da Gerência de Controle de Qualidade (GECOQ) do Hemocentro Coordenador da Fundação Hemopa, no período de setembro a outubro de 2015.
Teste de Grau de Hemólise
Para a determinação do grau de hemólise foram utilizadas 12 amostras de cada tipo de bolsa de concentrados de hemácias (n=36), sempre em duplicata, das quais foram obtidos 2 mL de amostras de segmentos das bolsas de concentrados de hemácias (CH), concentrados de hemácias pobres em leucócitos (CHPL), ou de concentrados de hemácias desleucotizados (CHD), para a realização da leitura da hemoglobina total e hematócrito em contador hematológico automatizado Sysmex Modelo KX 21N (Roche, Long Grove, USA).
Em seguida foram coletados 10 mL de amostras do segmento das bolsas de CH, CHPL ou CHD que, posteriormente, foram centrifugados a 2.500 RPM por 15 minutos para obtenção do sobrenadante. Seguiram-se diluições do sobrenadante em água destilada na proporção de 1/10 para a determinação da hemoglobina livre no plasma por análise fotocolorimétrica em filtros de 370, 415, 510 e 600 nm, em espectrofotômetro Spectronic™ 20 MV (Thermo Fisher Scientific, Madison, USA), e posterior cálculo do grau de hemólise em planilha do software Bioestat 5.3 (2012), para obtenção do resultado final em porcentagem. Foram tomados como valores aceitáveis < 0,6% para as amostras negativas para o grau de hemólise e ³ 0,6% para as amostras positivas, conforme padronizado pela gerência de controle de qualidade da Fundação Hemopa.
Teste de Hemólise
Para a determinação do teste de hemólise foram utilizadas as mesmas 12 amostras de cada tipo de bolsa de concentrados de hemácias (n=36), sempre em duplicata, das quais foram obtidas três gotas (150 mL) de amostras do segmento das bolsas de CH, CHPL ou CHD em tubo seco, com a adição posterior de 4 mL de solução fisiológica a 0,9%, homogeneização e centrifugação a 3.000 rpm por dez minutos para posterior inspeção do sobrenadante a olho desarmado (método padrão), para verificação de hemólise e/ou sedimentação de hemácias, por dois observadores em estudo duplo-cego.
Confecção da escala colorimétrica de correlação entre o grau de hemólise e o teste de hemólise
Para a determinação da escala colorimétrica entre o grau de hemólise e o teste de hemólise foram utilizadas primeiramente 12 amostras de cada tipo de bolsa de concentrados de hemácias (n=36), sempre em duplicata, para a determinação do padrão do grau de hemólise e teste de hemólise.
Em seguida foi realizado o registro fotográfico dos vários tubos contendo amostras com os vários níveis de grau de hemólise das bolsas de CH, CHPL ou CHD, usando-se máquina digital Sony G3 (Sony Corporation, USA), sem uso de filtros ou correção de imagem.
A escala colorimétrica, em si, foi confeccionada utilizando-se duas ferramentas do MacBook Air (Appel, USA). A primeira ferramenta foi a “Fromatting Palete”, opção Colors, Welghts, and Fills com as subopções “Color – More Colors Dosador”; em seguida, a ferramenta utilizada foi o “Medidor de Cor Digital” opção “Exibir Valores Nativos”, para a definição de diagramação de cores para (R) Red – Vermelho; (G) Green – Verde; (B) Blue – Azul.
Validação da escala colorimétrica de correlação entre testes de grau de hemólise e teste de hemólise
Para a validação da escala colorimétrica foram realizados testes de grau de hemólise e teste de hemólise para as bolsas de CH, CHPL ou CHD restantes (n=66), conforme descrito anteriormente, porém, com os resultados das leituras sendo comparados com a escala colorimétrica proposta, também em estudo do tipo duplo-cego.
Ética
Este estudo, por não envolver diretamente seres humanos, dados pessoais ou clínicos não foi submetido so Comitê de Ética em Pesquisa, apenas foi solicitada autorização para a realização do mesmo junto à Fundação Hemopa e assinatura de termo de compromisso sigilo de dados pelos autores.
RESULTADOS
Foi criada uma escala colorimétrica para a correlação entre teste de hemólise com seu respectivo correspondente do percentual (%) para o grau de hemólise, considerando-se como positivo os tubos com teste de hemólise de colorações correspondentes aos valores de grau de hemólise iguais ou superiores a 0,6% da massa eritrocitária (Figura 1).
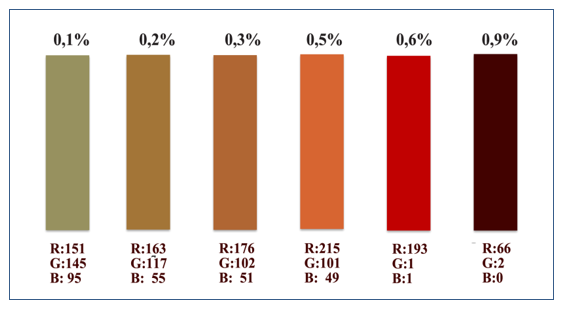
Figura 1. Escala Colorimétrica para correlação entre o teste de hemólise e o seu percentual correspondente de grau de hemólise para inspeção visual de bolsas de concentrados de hemácias, concentrados de hemácias pobres em leucócitos e concentrados de hemácias desleucotizados: Diagramação de cores para o teste de hemólise: (R) Red – Vermelho, (G) Green – Verde, (B) Blue – Azul).
O total de bolsas de CH, CHD ou CHPL (n=64) testadas por método convencional, e concomitantemente por comparação com a escala colorimétrica proposta, através de estudo duplo-cego para os testes de grau de hemólise e teste de hemólise, mostrou que apenas 7,5% (5/66) dos concentrados de hemácias testados apresentavam resultados negativos para o teste de hemólise clássico (visual), porém, quando estas mesmas amostras foram reavaliadas com o uso da escala colorimétrica, os mesmos apresentaram grau de hemólise com leitura ³ 0,6% da massa eritrocitária, devendo então ser descartados se considerada a escala colorimétrica proposta.
DISCUSSÃO
No Brasil, nas últimas quatro décadas, muito foi investido em tecnologia, treinamentos e programas de qualidade para os centros de hemoterapia. Contudo, embora os avanços tecnológicos para a segurança transfusional do paciente tenham sido grandiosos, como, por exemplo, com a criação dos NATs, ainda hoje existem procedimentos simples, não menos importantes, como o teste de hemólise, necessário para a liberação de bolsas de hemocomponentes, que é totalmente empírico e impreciso, gerando assim risco à saúde do paciente por possibilitar o surgimento de reações transfusionais imediatas caso o produto liberado esteja hemolisado.(4,8-10,13,17,18)
Nestes casos de transfusão de bolsas de CH hemolisados, a reação transfusional é do tipo imediata, de caráter não imune, com ocorrência em até 24 horas após iniciado o procedimento transfusional,(2,6-10,13,14) com a patogênese da hemólise nas bolsas de CH normalmente associada a condições inadequadas de armazenamento, que geram lesões de estocagem das hemácias (bioquímicas ou morfológicas) e/ou associadas a trauma físico, isto é, transporte incorreto das hemácias, ou circulação extracorporal.(2,6,8,10,12)
Para alguns autores, porém, a hemólise normalmente observada em bolsas de CH, CHD ou CHPL e a consequente reação transfusional hemolítica não imune não acarretam danos severos ao organismo humano, mas apenas alteração na coloração do plasma e urina do paciente.(7,12-15)
Para Carvalho et al.,(12) por sua vez, a presença de hemoglobina livre em uma destas bolsas de hemocomponentes transfundidos pode gerar efeitos adversos em relação aos sistemas renal (nefrotoxicidade) e cardiovascular (efeito vasomotor).
Independente da opinião de diferentes autores, porém, segundo a Portaria nº 158,(16) cerca de 1% do total de bolsas de concentrados de hemácias a ser dispensado para transfusão deve ser submetido a um teste específico (quantitativo) no setor de controle de qualidade dos hemocentros para verificar o grau de hemólise deste produto. Contudo, a mesma portaria deixa para o setor de distribuição de cada hemocentro a responsabilidade de testar os outros 99% de bolsas de CH a serem transfundidas.
Entretanto, esta última checagem para a presença de hemólise em bolsas de CH, o teste de hemólise, ainda hoje é realizado, de modo geral, por método empírico e impreciso, que avalia a presença de hemólise apenas de forma visual (olho desarmado) e totalmente dependente da experiência do observador. Neste sentido, diversos modelos de escala colorimétrica têm sido apresentados, contudo, a única recomendada é a escala colorimétrica apresentada pela Cruz Vermelha Americana.(20) Ainda assim, a mesma apresenta como principal limitação a sua própria apresentação e capacidade de reprodução gráfica (cópias).
Neste sentido, a escala colorimétrica proposta por nós apresenta como grande vantagem sobre as demais a capacidade de poder ser reproduzida fielmente graças à definição precisa das cores gráficas da mesma. E, ainda, por manter uma relação numérica entre o percentual do grau de hemólise com o resultado da inspeção visual do teste de hemólise, melhorando assim a segurança transfusional ao paciente.
Makroo et al.,(21) porém, apresentaram em seus estudos os resultados de hemólise de hemácias em bolsas de CH por método automatizado (HemoCue) de forma mais precisa e com alta reprodutibilidade. No mesmo estudo, os autores mostraram ainda que a hemólise, nestes casos, é dependente do tempo de armazenamento das bolsas de CH, independente do conservante utilizado. Mostraram ainda que, mesmo assim, a hemólise máxima observada não excedia os limites permitidos pelas agências reguladoras americanas e europeias.
Janatpour et al.,(22) por sua vez, mostraram em seus estudos que a avaliação visual de hemólise em bolsas de CH, pelos métodos tradicionais, pode resultar em desperdício desnecessário de hemocomponente por ser um método muito impreciso. E que a utilização de métodos automatizados, como o HemoCue, oferece técnicas mais objetivas para avaliar a quantidade de hemoglobina plasmática e para definir o grau de hemólise na rotina de controle de qualidade dos hemocentros.
Estes métodos automatizados, contudo, são também bastante dispendiosos e difíceis de serem implantados para uso na rotina de muitos hemocentros e agências transfusionais do Brasil.
CONCLUSÃO
A proposição de uma escala colorimétrica para correlação entre o teste de hemólise com o percentual do grau de hemólise para bolsas de CH, CHPL e CHD mostrou-se um método simples, reproduzível, barato e rápido para a verificação do teste de hemólise, além de sua grande aplicabilidade na rotina de hemocentros e agências transfusionais em todo o Brasil.
Abstract
Objective: Red blood cell (RBC) concentrates are not free of stock lesions, the most common of which is lysis of RBC. Create a colorimetric scale for visual inspection of the degree of hemolysis of bag red blood cells. Methods: Eighty-two bags of RBC concentrates (n = 36), RBC concentrates poor in leukocytes (n = 36) or RBC concentrates desleucotizadas (n = 36) were used with up to 28 days of production, under standard storage conditions of the Hemopa Foundation routine. Hemoglobin and hematocrit values were read in automated counter. The degree of hemolysis performed in 5ml samples from the bag segment, with spectrophotometer reading. The hemolysis test was performed with three drops of bag segment samples, in a dry tube, addition of 4 mL of physiological solution, centrifugation and visual inspection of the supernatant (double-blind study). To prepare the colorimetric scale used was the degree of hemolysis and hemolysis test results (n = 36) and photographic records of multiple levels of degree of hemolysis of bags. For the validation of the Colorimetric scale, hemolysis degree and hemolysis test were performed for the remaining bags (n = 66), and the results were compared with the proposed scale (double-blind study). Results: Only 7.5% (5/66) of the tested bags were negative for the classical (visual) hemolysis test, and positive when reevaluated on the proposed colorimetric scale. Conclusion: The proposed colorimetric scale was simple and reproducible for the definition of hemolysis test and the degree of hemolysis for RBC concentrates.
Keywords
Hemolysis; Hemotherapy Service; erythrocyte transfusion
REFERÊNCIAS
- 1. Bihl F, Castelli D, Marincola F, Dodd RY, Brander C. Transfusion-transmitted infections. J Transl Med. 2007 Jun 6;5:25. doi: 10.1186/1479-5876-5-25.
- Callera F, Silva ACO, Moura AF, Melo DB, Melo CMTP. Descriptions of acute transfusion reactions in a Brazilian transfusion service. Rev. Bras. Hematol. Hemoter. 2004;26(2):78-83. https://doi.org/10.1590/S1516-84842004000200003.
- Carrazone CFV, Brito AM, Gomes YM. Importância da avaliação sorológica pré-transfusional em receptores de sangue. Rev Bras. Hematol. Hemoter. 2004;26(2):93-98. https://doi.org/10.1590/S1516-84842004000200005.
- Chiattone CS, Pereira JPM, Langhi Junior DM, Rugani MA, Souza CA, Saraiva JCP, et al. Urgência na introdução do NAT: é fundamental não cometer os erros do passado. Rev. Bras. Hematol. Hemoter. 2009;31(2):113-114.https://doi.org/10.1590/S1516-84842009000200015.
- Keller-Stanislawski B, Lohmann A, Gunay S, Heiden M, Funk MB. The german haemovigilance system – reports of serious adverse transfusion between 1997 and 2007. Transfus Med. 2009 Dec;19(6):340-9. doi: 10.1111/j.1365-3148.2009.00947.x.
- Pedrosa AKKV, Pinto FJM, Lins LDB, Deus GM. Blood transfusion reactions in children: associated factors. J. Pediatria. 2013;89(4): 400-406. doi:10.1016/j.jped.2012.12.009.
- Macedo ED, Silveira VMJ, Athayde LA. Índice de reação transfusional em pacientes submetidos a transfusão em um hemocentro do Norte de Minas Gerais. RBPeCS. 2015;2(2): 54-59.
- Sousa Neto AL, Barbosa ML. Incidentes Transfusionais imediatos: revisão integrativa da literatura. Acta Paul Enferm. 2012; 25(1):146-150.https://doi.org/10.1590/S0103-21002012000100025.
- Squires JE. Risk of transfusion. South Med J. 2011;104(11):762-169. doi:10.1097/SMJ.0b013e31823213b6.
- Tinegate H, Birchall J, Gray A, Haggas R, Massey E, Norfolk D, et al. Guideline on the investigation and management of acute transfusion reactions. Prepared by the BCSH Blood Transfusion Task Force. Br J Haematol. 2012;159(2):143–153. doi:10.1111/bjh.12017.
- Almac E, Ince C. The impact of storage on red cell function in blood transfusion. Best Pract Res Clin Anaesthesiol. 2007?21(2):195-208. doi: 10.1016/j.bpa.2007.01.004.
- Carvalho EB, Borges EL, Carlos LMB, Silva MAM, Magalhães SMM, Gomes FVBAF, et al. Efeito da bomba de infusão de soluções sobre o grau de hemólise em concentrados de hemácias. Rev. Bras. Hematol. Hemoter. [Internet]. 2007 June; 29(2):149-152. Available from: http://www.scielo.br/scielo.php?script=sci_arttex t&pid=S1516-84842007000200013&lng=en.
- Bittencourt R, Costa J, Lobo JE, Aguiar FC. Consciously transfusion of blood products. Systematic review of indicative factors for blood components infusion’s trigger. Rev Bras Anestesiol. 2012;62(3):402–410. doi:10.1016/S0034-7094(12)70140-X.
- Proietti ABFC, Cioffi JGM. Hemovigilância: verificação final da qualidade da transfusão. Rev. Bras. Hematol. Hemoter. 2008;30(3): 173-74.
- Regan F, Taylor C. Blood transfusion medicine. BMJ. 2002;325 (7356):143-147. doi:10.1136/bmj.325.7356.143.
- Ministério da Saúde (Brasil). Portaria nº 158, de 04 de fevereiro de 2016. Redefine o regulamento técnico de procedimentos hemoterápicos. Brasília, Publicada em DOU, seção 3, p. 17, 05 de fevereiro de 2016.
- Alter HJ, Klein HG. The hazards of blood transfusion in historical perspective. Blood. 2008 Oct 1;112(7):2617-26. doi: 10.1182/blood-2008-07-077370.
- Junqueira PC, Rosenblit J, Hamerschlak N. História da Hemoterapia no Brasil. Rev. Bras. Hematol. Hemoter. 2005;27(3):201-07. Available from: http://www.scielo.br/scielo.php?script=sci_arttext &pid=S 1516-84842005000300013&lng=en.
- Ministério da Saúde (Brasil). Agência Nacional de Vigilância Sanitária. Resolução da Diretoria Colegiada – RDC n° 34. Dispõe sobre as boas práticas do ciclo do sangue. Brasília, Publicada em DOU nº 113, 16 de junho de 2014.
- American Red Cross Biomedical Services. Visual Inspection Reference Guide. Hemolysis. Red Cell and Whole Blood. The American Red Cross. Page 20. 21.4ja024 v-1.0. 2006.
- Makroo RN, Raina V, Bhatia A, Gupta R, Majid A, Thakur UK, Rosamma NL. Evaluation of the red cell hemolysis in packed red cells during processing and storage. Asian J Transfus Sci. 2011 Jan;5(1):15-7. doi:10.4103/0973-6247.75970.
- Janatpour KA, Paglieroni TG, Crocker VL, DuBois DJ, Holland PV. Visual assessment of hemolysis in red cell units and segments can be deceptive. Transfusion. 2004;44:984-989. doi:10.1111/j.1537-2995.2004.03315.x.
Correspondência
Lacy Cardoso de Brito Junior
Universidade Federal do Pará
Instituto de Ciências Biológicas
Laboratório de Patologia Geral Imunopatologia e Citologia (sala 303)
Av. Augusto Corrêa n°1 Bairro Guamá
66075900, Belém-PA, Brasil
Tel.: 55 91 3201 71 02
Fundação Hemopa
