Infecção por Candida auris em crianças e neonatos: uma revisão integrativa de literatura
Candida auris infection in children and neonates: an integrative literature review
Brennda Araújo Nogueira1, Tiffany Nogueira Sampaio2, Antônio Victor Paz Ibiapina2, Monique Maria de Souza Frota2, Victoria Maria Paz Ibiapina2, Francisco Yuri Neves Filizola2, João Carlos Carneiro de Aguiar2, Beatriz Araújo Nogueira3, Francinaldo Filho Castro Monteiro4, Paulo Henrique Soares Peixoto5, Olga Samara Silva Cavalcante6, Carla Ceres Azevedo Araújo Melo Miranda7
1 Faculdade de Medicina Estácio (IDOMED), Graduação em Medicina. Canindé, CE, Brasil.
2 Centro Universitário Inta (UNINTA), Graduação em Medicina. Sobral, CE, Brasil.
3 Universidade de Fortaleza (UNIFOR), Graduação em Farmácia. Fortaleza, CE, Brasil.
4 Hospital Universitário Walter Cantídio, Complexo Hospitalar da Universidade Federal do Ceará (UFC), Residência em Terapia Intensiva. Fortaleza, CE, Brasil.
5 Hospital Infantil Albert Sabin (HIAS), Microbiologia. Fortaleza, CE, Brasil.
6 Hospital Infantil Albert Sabin (HIAS), Farmácia Clínica. Fortaleza, CE, Brasil.
7 Centro Universitário Inta (UNINTA), Docência. Sobral, CE, Brasil.
Recebido em 02/05/2024
Aprovado em 19/10/2024
DOI: 10.21877/2448-3877.202400178.pt
INTRODUÇÃO
As infecções causadas por fungos vêm tomando grande importância na medicina nas últimas décadas por impactarem negativamente na saúde, sobretudo em pacientes com imunossupressão ou hospitalizados com doenças graves associadas. As espécies de fungos do gênero Candida são a causa predominante de infecções fúngicas nosocomiais e a quarta principal causa de todas as infecções hospitalares.(1,2) De acordo com Du et al.(1) (2020), anualmente ocorrem aproximadamente 400.000 infecções por corrente sanguínea (IPCS) causadas por Candida spp. em todo o mundo, com taxas de mortalidade superiores a 40%.
A levedura Candida auris foi isolada pela primeira vez no Japão em 2009 a partir da secreção auditiva de uma paciente do sexo feminino. Nos anos seguintes, infecções causadas por C. auris tornaram-se uma ameaça global de saúde pública devido a sua rápida disseminação ao redor do mundo e do tipo de resistência a múltiplos fármacos antifúngicos exibido por essa levedura. A candidemia tem sido o tipo de infecção invasiva mais frequentemente relatada por C. auris, com mortalidade variando de 30% a 60%.(1,2)
Com relação ao público pediátrico, devido à presença de um sistema imunológico imaturo, no geral, pode aumentar a suscetibilidade a doenças infecciosas. No ambiente hospitalar, a necessidade de ventilação mecânica, sedação, uso de sondas, aspiração recorrente, hospitalização prolongada e a presença de comorbidades são fatores de risco reconhecidos para o desenvolvimento de infecções nosocomiais.(3)
Apesar de uma taxa de incidência menor, infecções fúngicas em recém-nascidos e crianças são uma realidade alarmante devido à morbidade e mortalidade associadas e poucas opções de terapia farmacológica.(3,4) Em um estudo de Almazeedi et al.(3) (2023), na avaliação das infecções hospitalares em uma unidade de terapia intensiva pediátrica, foi relatado que a taxa de mortalidade das infecções por fungos foi superior em comparação a infecções bacterianas. Vale ressaltar que todas as espécies de fungos relatadas neste estudo são do gênero Candida.
Dessa forma, o objetivo desta pesquisa é realizar um estudo exploratório na literatura acerca das implicações associadas à infecção por Candida auris em indivíduos na faixa etária pediátrica.
MATERIAL E MÉTODOS
O presente trabalho trata-se de um estudo observacional e descritivo com abordagem qualitativa do tipo revisão integrativa de literatura. A seleção dos artigos científicos para compor esta revisão foi feita nas seguintes bases de dados eletrônicos: National Library of Medicine (PubMed), BVS Brasil (Biblioteca Virtual em Saúde – Brasil) e SciELO (Scientific Electronic Library Online). Para a busca cruzou-se o descritor ‘‘Candida auris” com “pediatrics”, “children” e “neonatal”; o cruzamento se deu por meio do operador booleano AND.
Foram considerados estudos em qualquer idioma, pesquisas com seres humanos na faixa etária pediátrica ou com correlações e publicados nos últimos cinco anos (2020 a 2024). Como critérios de exclusão foram adotados: trabalhos que não se adequassem ao objetivo da pesquisa, revisões de literatura, pre-print e fora dos demais critérios de inclusão.
RESULTADOS
Foram encontrados 117 trabalhos nas bases de dados selecionadas dos quais, 71 resultados na PubMed e 46 na BVS. Na base de dados do SciELO não houve resultado. Após triagem pelo título foram selecionadas 57 publicações, destas, 5 eram duplicadas nas bases de dados.
Após leitura do resumo e texto completo foram excluídas 44 publicações e 8 estudos foram selecionados como mostra a Figura 1. Os 8 estudos selecionados que avaliaram os impactos da infecção por C. auris em populações pediátricas encontram-se descritos no Quadro 1.
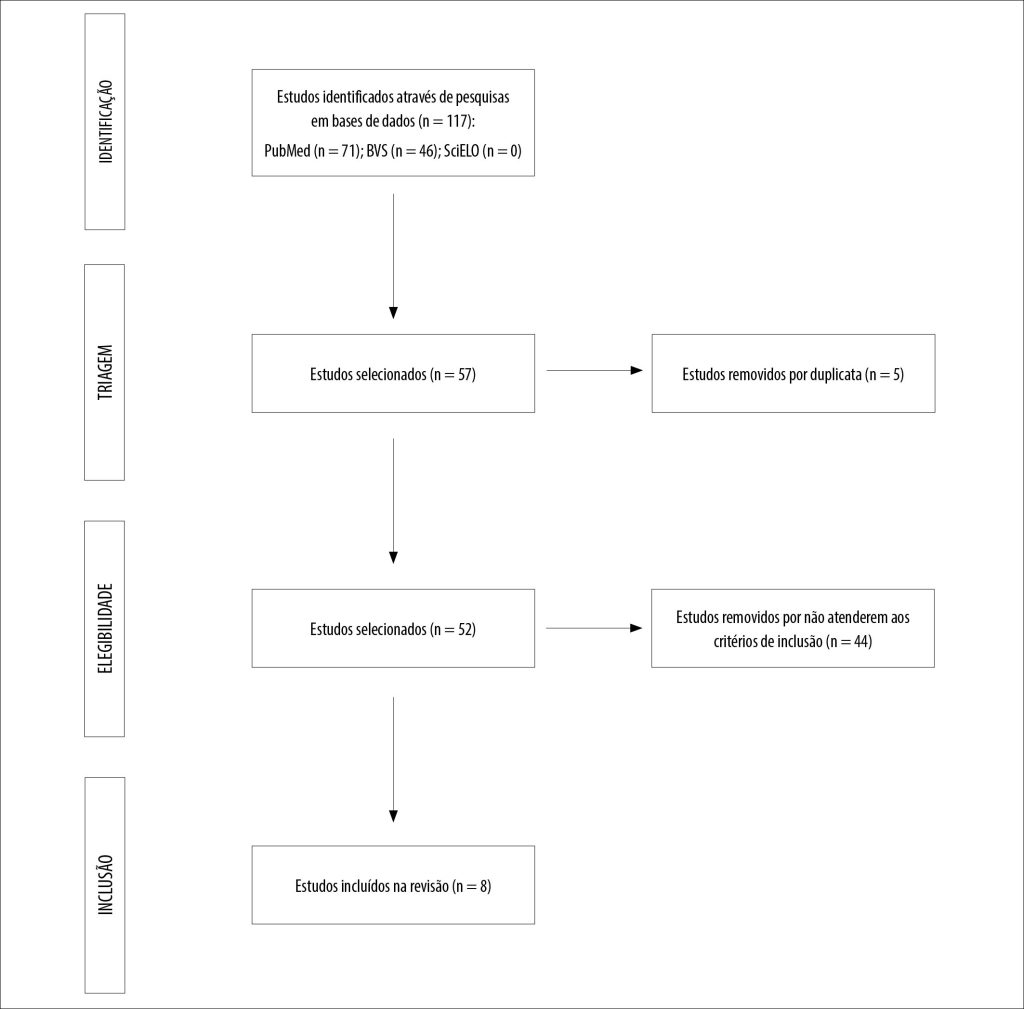
Figura 1
Fluxograma de pesquisa
Fonte: Elaborada pelos autores.
Quadro 1
Estudos que avaliaram os impactos da infecção por C. auris em populações pediátricas.
| AUTOR | TÍTULO | TIPO DE ESTUDO | RESULTADOS |
| Berrio et al.(5) (2020) | Bloodstream infections with Candida auris among children in Colombia: Clinical characteristics and outcomes of 34 cases | Estudo retrospectivo | Das 34 crianças com candidemia por C. auris. 65% dos pacientes eram do sexo masculino, 47% tinham idade entre 29 e 365 dias. 82% tinham CVC. A mortalidade hospitalar associada foi de 41%, incluindo 57% em neonatos, 50% em bebês não neonatais, 17% em crianças de 1 a 5 anos e 20% naquelas com idade acima de 5 anos. O tempo médio desde a ICS por Candida até a morte foi de 10 dias (IQR, 6-23 dias). |
| Chandramati et al.(6) (2020) | Neonatal Candida auris infection: Management and prevention strategies – A single centre experience | Estudo retrospectivo | A gestação média foi de 32,4 ± 4,9 semanas com mortalidade geral de 41%. As características clínicas eram indistinguíveis de outras causas de sepse. C. auris foi sensível à micafungina, mas resistente ao fluconazol e teve sensibilidade variável ao voriconazol e à anfotericina. A sobrevivência melhorou para 83% quando os bebés foram tratados com uma combinação de micafungina e anfotericina B. Os não sobreviventes tinham menor peso ao nascer e apresentavam outros fatores de risco. |
| Escandón et al.(7) (2021) | Laboratory-based surveillance of Candida auris in Colombia, 2016-2020 | Estudo retrospectivo | Foram identificados 1.720 casos de C. auris. A idade média dos pacientes foi de 34 anos; 317 (18%) casos eram crianças menores de 16 anos, 54% eram do sexo masculino. A suscetibilidade antifúngica foi testada em 379 isolados; 35% dos isolados eram resistentes ao fluconazol, 33% eram resistentes à anfotericina B e 0,3% dos isolados eram resistentes à anidulafungina, 12% eram multirresistentes e nenhum isolado pan-resistente foi identificado. |
| Kekana et al.(8) (2023) | Candida auris Clinical Isolates Associated with Outbreak in Neonatal Unit of Tertiary Academic Hospital, South Africa | Estudo transversal | Dos 287 casos com infecção por C. auris confirmada por cultura e identificados através de vigilância laboratorial, 207 (72%) tinham isolados viáveis e 188 (66%) foram processados para sequenciação do genoma completo. Os isolados clado III (118/188, 63%) e IV (70/188, 37%) cocircularam no hospital. Todos os 181/188 isolados que apresentavam CIM de fluconazol > 32µg/mL apresentavam mutações no ERG11. Dominado pelo clado III, o surto em unidades neonatais foi responsável por 32% (91/287) de todos os casos durante o período do estudo. |
| Mohsin et al.(9) 2020 | A Cluster of Candida auris Blood Stream Infections in a Tertiary Care Hospital in Oman from 2016 to 2019 | Estudo retrospectivo | Dos 23 pacientes com fungemia por C. auris, 2 eram pacientes pediátricos. Todas as amostras isoladas não foram suscetíveis ao fluconazol, mas eram sensíveis às equinocandinas e estas foram utilizadas como terapia de primeira linha. C. auris afeta adultos e crianças com uma variedade de fatores de risco, incluindo cateteres venosos centrais e uso excessivo de antibióticos. |
| Moin et al.(10) (2021) | C. auris and non-C. auris candidemia in hospitalized adult and pediatric COVID-19 patients; single center data from Pakistan | Estudo de coorte retrospectivo | Um total de 26 casos de candidemia (4 C. auris, 22 não- C. auris) em 2.438 internados por COVID-19 e 59 casos de candidemia (6 C. auris, 53 não- C. auris) em internados foram identificados pacientes não-COVID-19. Quatro dos 26 dos pacientes com candidemia e com COVID-19 tinham idade ≤ 15 anos (10 meses a 15 anos). Os pacientes com candidemia por C. auris tiveram uma permanência mais longa no hospital antes da candidemia (20 vs. 9 dias) e maior taxa de isolamento de bactérias multirresistentes (100 vs. 50%) Tanto os pacientes com COVID-19 com C. auris quanto os não-C. auris tiveram taxa de mortalidade semelhante (67 vs. 65%). |
| Shuping et al.(11) (2023) | High Prevalence of Candida auris Colonization during Protracted Neonatal Unit Outbreak, South Africa | Estudo transversal | Avaliação e vigilância infecciosa de 195 crianças. A sensibilidade de uma PCR para detecção rápida de colonização foi de 44% em comparação com a cultura. A taxa de incidência de infecção diminuiu 85% após a pesquisa e implementação do isolamento/coorte. |
|
Socarras et al.(12) (2021) |
A Cluster of Neonatal Infections Caused by Candida auris at a Large Referral Center in Colombia | Série de casos | É relatada uma série de casos de 8 pacientes neonatos e infantis que foram atendidos em um grande centro de referência na Colômbia e que desenvolveram infecções invasivas causadas por C. haemulonii e C. auris. |
Fonte: Elaborado pelos autores.
Legenda: CVC: cateter venoso central; ICS: infecção de corrente sanguínea; CIM: concentração inibitória mínima
DISCUSSÃO
Quando C. auris foi identificado pela primeira vez em 2009, a infecção pelo patógeno era considerada rara, contudo, na última década, a espécie distribuiu-se globalmente, causando surtos em unidades de saúde em mais de 50 países. As maiores problemáticas associadas são: fácil transmissão e resistência a vários medicamentos antifúngicos disponíveis.(13)
Nesse contexto, Berrio et al.(5) (2021) conduziram um estudo retrospectivo, que acompanhou 34 crianças com candidemia por C. auris, sendo 65% do sexo masculino e 47% com idade entre 29 e 365 dias. A maioria possuía cateter venoso central (CVC), somando 82%, que é um dos principais fatores associados à infecção fúngica em crianças, sobretudo em um ambiente de cuidados intensivos. Pacientes pediátricos onco-hematológicos que necessitam utilizar CVC por longo tempo tendem a desenvolver infecções recorrentes por Candida spp. Outros fatores de risco vistos clinicamente que também influenciam no desenvolvimento de infecções fúngicas são: idade, doença de base, neutropenia, imunodeficiência, uso de corticoides e de nutrição parenteral total.
No estudo, 97% receberam tratamento antifúngico específico para IPCS por C. auris. Desses, 47% receberam desoxicolato de anfotericina B, 29% receberam azóis e 21% receberam caspofungina. O teste de suscetibilidade antifúngica foi realizado em 13 isolados. 54% eram resistentes à anfotericina B, 15% eram resistentes ao fluconazol e 8% eram resistentes à anidulafungina e também resistentes à anfotericina B, mas suscetíveis à caspofungina e à micafungina. A anfotericina B é amplamente utilizada em pacientes graves clinicamente pelo amplo espectro de ação, contudo um perfil de resistência como descrito no estudo e a demora no crescimento das culturas microbiológicas fazem com que os pacientes não tenham acesso a uma farmacoterapia efetiva.
Na prática clínica, pacientes com sinais e sintomas evidentes de infecção fúngica usam antifúngicos empiricamente devido à demora nos resultados laboratoriais microbiológicos. Frequentemente iniciam com fluconazol, contudo logo escalonam para micafungina ou anfotericina B em casos de instabilidade clínica, plaquetopenia grave, cirurgias abdominais. O acompanhamento laboratorial e de imagem são imprescindíveis para o diagnóstico rápido da patologia quando há forte suspeita clínica, hemogramas com plaquetopenia, leucocitose e aumento das formas imaturas destes. Raio-X, ultrassonografia, tomografia computadorizada e fundo de olho são arcabouços utilizados para pesquisa de focos profundos.
Neste mesmo estudo, a mortalidade hospitalar associada foi de 41%, incluindo 57% em neonatos, 50% em bebês não neonatais, 17% em crianças de 1 a 5 anos e 20% naquelas com idade acima de 5 anos. O tempo médio desde a infecção de corrente sanguínea por Candida spp. até a morte foi de 10 dias (IQR, 6-23 dias). Neonatos prematuros, sobretudo de baixo peso ou muito baixo peso, são pacientes que tendem a ter quadros clínicos mais graves e maior tendência a candidemia, devido ao uso prolongado de antibióticos, sistema imunológico imaturo e malformações do trato gastrointestinal. Portanto, são pacientes que vão ao óbito mais rápido quando infectados por fungos do que crianças de idade superior.
Ademais, na população pediátrica, a infecção mais comum por C. auris é a de corrente sanguínea, a incidência é maior no sexo masculino e a média de mortalidade nos estudos com crianças e neonatos é de aproximadamente 40%, com associações a outras complicações.(14) Na pesquisa de Berrio et al.(5) (2020), 26% dos pacientes eram prematuros, 59% estavam desnutridos, 12% tinham câncer, 3% tinham um transplante de órgão sólido e 3% tinham doença renal subjacente; 82% receberam transfusão de sangue 7 dias antes da infecção de corrente sanguínea e 9% entraram em hemodiálise. O câncer mais prevalente na infância é a LLA frequentemente associada a internações recorrentes, sobretudo por neutropenia febril e o uso prolongado de CVC para a realização de quimioterapia. Esses fatores citados anteriormente concomitante à baixa imunidade favorecem a infecção por Candida spp. Em consonância, devido a fragilidade geral do quadro clínico, a mortalidade tende a ser significativa nessa população.
Chandramati et al.(6) (2020) obtiveram resultados similares, em uma avaliação com neonatos; a gestação média foi de 32,4 (± 4,9) semanas com mortalidade geral de 41%. As características clínicas eram indistinguíveis de outras causas de sepse. Candida auris presente nas amostras foi sensível à micafungina, mas resistente ao fluconazol e teve sensibilidade variável ao voriconazol e à anfotericina B. A sobrevivência melhorou para 83%, quando os bebês foram tratados com uma combinação de micafungina e anfotericina B. Os que foram a óbito tinham menor peso ao nascer e apresentavam outros fatores de risco.
Em consonância, Socarras et al.(12) (2021) avaliaram uma série de 8 casos, cuja mortalidade foi de 37,5%. No entanto, esse resultado foi secundário à doença de base. O autor cita, ainda, que infecções invasivas causadas por C. auris aumentam provavelmente a mortalidade se a terapia antifúngica não for otimizada e associada a outras medidas, como a remoção de dispositivos colonizados invasivos, devido à formação de biofilme.(12)
O uso da terapia antibacteriana de amplo espectro foi um fator de risco crítico compartilhado por todos os casos da série relatados neste estudo, no qual é reconhecido como um fator de risco para candidíase invasiva. Este risco é compartilhado com muitas classes de antimicrobianos, mas há evidências de que o uso de piperacilina/tazobactam é um importante fator de risco predisponente para candidíase sistêmica. Além disso, neonatos com malformações gastrointestinais (o intestino é um dos reservatórios de Candida spp.) e lactentes com doenças cardíacas complexas apresentam risco aumentado de infecções fúngicas invasivas, principalmente aqueles submetidos a transplante cardíaco em uso de imunossupressores e pacientes cardiopatas com repercussão pulmonar.(12)
Ashkenazi-Hoffnung e Rosenberg Danziger(14) (2023) relataram em sua revisão sobre o tema que vários clones de C. auris surgiram e foram identificados na última década. Análises filogenéticas baseadas no polimorfismo de nucleotídeo único em todo o genoma identificaram cinco clados principais em todo o mundo: Sul da Ásia (I), Leste Asiático (II), Sul-africano (III), Sul-americano (IV) e um novo clado de Irã (V). Foi demonstrado que os clados apresentam características clínicas e microbiológicas únicas. Até agora, surtos nosocomiais e infecções invasivas têm sido associados aos clados I, III e IV de C. auris.(14)
Na pesquisa de Kekana et al.(8) (2023) que avaliou, em um hospital terciário da África do Sul, 287 casos com infecção por C. auris, foi verificado que, destes, 66% foram processados para sequenciamento do genoma completo e identificaram a presença do clado III e IV de C. auris. O clado III foi mais prevalente nas infecções neonatais (32%). Nesta pesquisa, das 188 amostras avaliadas geneticamente, 181 apresentaram concentração inibitória mínima (CIM) de fluconazol > 32µg/mL e mutações no ERG11.
No que se refere ao tratamento para infecções por Candida spp., normalmente devem ser usados antifúngicos azólicos que atuam inativando o lanosterol 14α-desmetilase, inibindo assim a biossíntese de ergosterol, um composto essencial para a membrana fúngica e integridade celular. A resistência aos azóis é comumente associada ao uso indiscriminado de antimicrobianos, mas também pode ocorrer por fatores intrínsecos, como alterações ou mutações na expressão de genes, como o ERG11 e ERG3, que codificam proteínas envolvidas na biossíntese de ergosterol. Mutações nestes dois genes podem alterar criticamente a eficácia dos antifúngicos azólicos.(15,16)
Na avaliação de Escandón et al.(7) (2021) foram identificados 1.720 casos de C. auris na Colômbia entre 2016 e 2020. A idade média dos pacientes foi de 34 anos, dentre estes 18% eram crianças menores de 16 anos e 54% eram do sexo masculino. A suscetibilidade antifúngica foi testada em 379 isolados, destes 35% dos isolados eram resistentes ao fluconazol, 33% eram resistentes à anfotericina B e 0,3% dos isolados eram resistentes à anidulafungina, 12% eram multirresistentes e nenhum isolado pan-resistente foi identificado.(12)
O estudo de Mohsin et al.(9) (2020) também avaliou a terapia antifúngica de pacientes, nesse caso com um total de 23 amostras em um hospital terciário de Oman, com fungemia por C. auris. Dos 23 pacientes com fungemia por C. auris, 2 eram pacientes pediátricos. Todas as amostras isoladas não foram suscetíveis ao fluconazol, confirmando a resistência da levedura a ázois, mas eram sensíveis às equinocandinas e estas foram utilizadas como terapia de primeira linha.
Apesar de muitos estudos demonstrarem a sensibilidade de C. auris a equinocandinas como anidulafungina, caspofungina e micafungina, estas opções terapêuticas podem não ser suficientes no futuro, visto que a resistência a essa classe medicamentosa vem aumentando, o que irá limitar ainda mais o arsenal terapêutico.(12,14)
Além disso, bebês hospitalizados em unidades de terapia intensiva neonatal correm alto risco de candidíase invasiva, sendo a segunda causa mais comum de morte relacionada a infecção, com uma taxa de mortalidade de 24% a 26%. Como a depuração da micafungina ajustada ao peso corporal é maior em neonatos do que em crianças mais velhas e adultos, os bebês necessitam de doses de micafungina mais altas com base no peso corporal.(17)
Auriti et al.(17) (2021) avaliaram, em um estudo clínico com 35 neonatos e lactentes jovens colonizados por Candida spp., a eficácia e segurança da micafungina nesta população. Em 20% dos pacientes foi observado aumento transitório das transaminases. A micafungina na dose de 8 mg/kg por dia foi eficaz e bem tolerada. O sucesso do tratamento com micafungina foi alcançado em 61,9% dos pacientes, independentemente da duração do tratamento, e em pacientes que completaram um mínimo de 14 dias de terapia com micafungina o sucesso foi de 86,7%. Fungemias requerem um tempo maior de utilização e acompanhamento rotineiro de exames laboratoriais e de culturas microbiológicas.
Medidas para o controle de surtos por fungemia também são válidas, foi o que Shuping et al.(11) (2023) avaliaram, com a vigilância infecciosa de 195 crianças em uma unidade neonatal na África do Sul. A sensibilidade da PCR para detecção rápida de colonização foi de 44% em comparação com a cultura. A taxa de incidência de infecção diminuiu 85% após a pesquisa e implementação do isolamento/coorte.
Candida spp. pode ser transferida de superfícies ambientais para as mãos. Candida auris demonstrou persistir em plásticos por pelo menos 14 dias, com testes de viabilidade indicando que as células também são capazes de entrar em um ambiente metabolicamente ativo, mas não cultivável. Dada a propensão de C. auris causar surtos, o Centro de Controle e Prevenção de Doenças dos Estados Unidos enfatiza a adesão a uma boa higiene das mãos, combinada com precauções padrão e de contato, isolamento de pacientes infectados em quartos privados, realização de limpeza diária completa e desinfecção de salas terminais.(18)
Dez anos após a identificação de C. auris, foi reportado o primeiro caso de COVID-19, doença causada pelo vírus SARS-CoV-2. As coinfecções por patógenos são extremamente alarmantes, a persistência de C. auris nas superfícies hospitalares e sua alta resistência aos antifúngicos, associadas às complicações causadas pela COVID-19, podem ser drásticas e resultar em óbitos. Os pacientes internados em Unidades de Terapia Intensiva (UTIs) correm maior risco de colonização/infecção por C. auris.(19)
Moin et al.(10) (2021) avaliaram casos de candidemia associados ou não à COVID-19. Um total de 26 casos de candidemia (4 C. auris, 22 não-C. auris) em 2.438 internados por COVID-19 e 59 casos de candidemia (6 C. auris, 53 não-C. auris) em internados foram identificados pacientes não-COVID. Quatro dos 26 dos pacientes com candidemia por COVID-19 tinham idade ≤ 15 anos (10 meses a 15 anos). Os pacientes com candidemia por C. auris tiveram uma permanência mais longa no hospital antes da candidemia (20 vs. 9 dias) e maior taxa de isolamento de bactérias multirresistentes (100 vs. 50%). Tanto os pacientes com COVID-19 não-C. auris quanto os com C. auris tiveram taxa de mortalidade semelhante (65 vs. 67%).
CONCLUSÕES
Candida auris é um patógeno de relevância a nível global, devido ao seu impacto na saúde humana. O elenco terapêutico para tratamento da candidemia por C. auris é reduzido e a tendência é o aumento da resistência aos antifúngicos disponíveis. O controle de infecções nosocomiais e surtos intra-hospitalares deve ser priorizado.
A associação C. auris e outras condições dos pacientes, como doenças adjacentes, com destaque para COVID-19, favorece o aumento da morbidade e da mortalidade, estando a morbidade associada a danos neurológicos em bebês.
O uso indiscriminado de antimicrobianos foi destaque entre os estudos analisados, como preditor de infecção por Candida spp., em indivíduos com sistema imunológico em formação, como neonatos e crianças, sendo imprescindível um cuidado multiprofissional associado para minimizar quaisquer danos aos pacientes.
REFERÊNCIAS
- Du H, Bing J, Hu T, Ennis CL, Nobile CJ, Huang G. Candida auris: Epidemiologia, biologia, resistência antifúngica e virulência. PLoS Pathog. 2020 Oct;16(10): e1008921. doi: 10.1371/journal.ppat.1008921
- Kordalewska M, Perlin DS. Identification of Drug Resistant Candida auris. Front. Microbiol. 2019 Aug;10:1918. doi: 10.3389/fmicb.2019.01918
- Almazeedi MA, Ghadeer HAAI, Bugshan AS, Alhrthi HL, Alshuaibi MK, Albarqi HH et al. Pattern and Frequency of Nosocomial Infections in the Pediatric Intensive. Cureus. 2023 Oct;15(10):e47561. doi: 10.7759/cureus.47561
- Ochoa S, Constantine GM, Lionakis MS. Genetic susceptibility to fungal infection in children. Current opinion in pediatrics. Curr Opin Pediatr. 2020 Dec;32(6):780–789. doi: 10.1097/MOP.0000000000000948
- Berrio B, Caceres DH, Coronell WR, Salcedo S, Mora L, Marin A, et al. Bloodstream Infections With Candida auris Among Children in Colombia: Clinical Characteristics and Outcomes of 34 Cases. Journal of the Pediatric Infectious Diseases Society. 2021 Feb;10(Issue 2):151–154. doi: 10.1093/jpids/piaa038
- Chandramati J, Sadanandan L, Kumar A, Ponthenkandath S. Neonatal Candida auris infection: Management and prevention strategies – A single centre experience. J Paediatr Child Health. 2020 Oct;56(10):1565-1569. doi: 10.1111/jpc.15019
- Escandón P, Cáceres DH, Lizarazo D, Lockhart SR, Lyman M, Duarte C. Laboratory-based surveillance of Candida auris in Colombia, 2016–2020. Mycoses. 2022 Oct;65:222-225. doi: 10.1111/myc.13390
- Kekana D, Naicker SD, Shuping L, Velaphi S, Nakwa FL, Wadula J, et al. Candida auris Clinical Isolates Associated with Outbreak in Neonatal Unit of Tertiary Academic Hospital, South Africa. Emerg Infect Dis. 2023 Oct;29(10):2044-2053. doi: 10.3201/eid2910.230181
- Mohsin J, Weerakoon S, Ahmed S, Puts Y, Al Balushi Z, Meis JF, et al. A Cluster of Candida auris Blood Stream Infections in a Tertiary Care Hospital in Oman from 2016 to 2019. Antibiotics. 2020 Sep;9(10):638. doi: 10.3390/antibiotics9100638
- Moin S, Farooqi J, Rattani S, Nasir N, Zaka S, Jabeen K. C. auris and non-C. auris candidemia in hospitalized adult and pediatric COVID-19 patients; single center data from Pakistan. Medical Mycology. 2021 Dec;59(Issue12):1238-1242. doi: 10.1093/mmy/myab057
- Shuping L, Maphanga TG, Naicker SD, Mpembe R, Ngoma N, Velaphi S, et al. High Prevalence of Candida auris Colonization during Protracted Neonatal Unit Outbreak, South Africa. Emerg Infect Dis. 2023 Sep;29(9):1913-1916. doi: 10.3201/eid2909.230393
- Socarras JLA, Soler JAV, Paredes CF, Lamus KCV, Torres JPR, Morales AJR. A Cluster of Neonatal Infections Caused by Candida auris at a Large Referral Center in Colombia, Journal of the Pediatric Infectious Diseases Society. 2021 May;10(Issue5): 549–555. doi: 10.1093/jpids/piaa152
- Jenull S, Shivarathri R, Tsymala I, Penninger P, Trinh PC, Nogueira F, et al. Transcriptomics and Phenotyping Define Genetic Signatures Associated with Echinocandin Resistance in Candida auris. mBio. 2022 Aug;13(4):e0079922. doi: 10.1128/mbio.00799-22
- Ashkenazi-Hoffnung L, Rosenberg Danziger C. Navigating the New Reality: A Review of the Epidemiological, Clinical, and Microbiological Characteristics of Candida auris, with a Focus on Children. J Fungi (Basel). 2023 Jan;9(2):176. doi: 10.3390%2Fjof9020176
- Oliveira JMV. Detecção e quantificação da expressão do gene ERG11 de Candida albicans sob diferentes concentrações de fluconazol[dissertation]. Alfenas: Instituto de Ciências da Natureza, Universidade Federal Alfenas; 2017. 67 p.
- Benedetti VP, Savi DC, Aluizio R, Adamoski D, Kava V, Galli-Terasawa LV, et al. ERG11 gene polymorphisms and susceptibility to fluconazole in Candida isolates from diabetic and kidney transplant patients. Journal of the Brazilian Society of Tropical Medicine. 2019 Jan;52:e20180473. doi: 10.1590/0037-8682-0473-2018
- Auriti C, Goffredo BM, Ronchetti MP, Piersigilli F, Cairoli S, Bersani I, et al. High-Dose Micafungin in Neonates and Young Infants with Invasive Candidiasis: Results of a Phase 2 Study. Antimicrob Agents Chemother. 2021 Mar;65(4):e02494-20. doi: 10.1128/AAC.02494-20
- Spivak ES, Hanson KE. Candida auris: an Emerging Fungal Pathogen. J Clin Microbiol. 2018 Jan;56(2):e01588-17. doi: 10.1128/JCM.01588-17
- Auriti C, Goffredo BM, Ronchetti MP, Piersigilli F, Cairoli S, Bersani I, et al. High-Dose Micafungin in Neonates and Young Infants with Invasive Candidiasis: Results of a Phase 2 Study. Antimicrob Agents Chemother. 2021 Mar;65(4):e02494-20. doi: 10.1128/AAC.02494-20
Correspondência
Olga Samara Silva Cavalcante
E-mail: [email protected]
