A relação dos mecanismos fisiopatológicos entre a anemia e a doença renal crônica
The relationship of physiopathological mechanisms between anemia and chronic kidney disease
Alan Marcelo de Souza Farias Filho1, Kely Emi Hirai2, Natalee Mari Lima Sekioka1, Nicole Tavares Batista1
1 Biomédico(a) – Universidade da Amazônia (UNAMA). Belém, PA, Brasil.
2 Biomédica – Universidade Federal do Pará (UFPA). Belém, PA, Brasil.
Recebido em 20/06/2021
Aprovado em 10/03/2022
DOI: 10.21877/2448-3877.202202157
INTRODUÇÃO
Aspectos gerais da anemia
A anemia é um processo patogênico em que há redução na quantidade de hemácias por volume de sangue, ou concentração de hemoglobina (Hb) menor que a média do valor de referência entre homens, mulheres e crianças saudáveis, que é 12g/dL, segundo a OMS (Organização Mundial da Saúde). Por conseguinte, a anemia se desenvolve em decorrência da perda de sangue e destruição ou redução na produção dos glóbulos vermelhos.(1)
As concentrações de Hb variam de acordo com idade, sexo, raça, fatores genéticos e ambientais. No recém-nascido as concentrações de Hb têm seu ponto mais alto entre 17 a 21g/dL, e diminui entre o 2º e 3º mês de vida, antes de aumentar novamente na infância. Na idade adulta há uma estabilização, voltando a diminuir na idade avançada. Além de fatores fisiológicos, o comportamento e as condições ambientais, como tabagismo e altitude, respectivamente, podem afetar as concentrações de Hb, o quadro 1 descreve a classificação quanto à patogênese.(2)
Quadro 1
Classificação quanto à patogênese
| Anemias | Exemplos |
| Relacionadas à hemorragia | Anemia ferropriva; Síndrome de Plummer-Vinson |
| Hemolíticas | Deficiência de G6PD; anemia induzida por medicamentos; anemia mediada pelo sistema imunitário |
| Hemoglobinopatias | Anemia falciforme; talassemia |
| Anemias hipoproliferativas | Deficiência de vitamina B12 e B9; anemia aplásica |
Fonte: Adaptado de Rocha, 2011.(3)
Os fatores que geram essas patologias são: carência nutricional por vitaminas e minerais; baixo nível socioeconômico, que é acompanhado por problemas relacionados ao saneamento básico, provocando doenças infecto-parasitárias, causando perda de sangue e substâncias essenciais; processos inflamatórios e doenças hereditárias que afetam as hemácias, propiciando alterações em sua produção e desenvolvimento.(4)
Anemia de doença crônica
A anemia de doença crônica (ADC), também conhecida como anemia de inflamação crônica, é associada a pacientes hospitalizados. Desencadeia-se a partir de infecções bacterianas ou parasitárias crônicas; em inflamações provocadas por doenças autoimunes, como lúpus eritematoso sistêmico (LES) e artrite reumatoide; em neoplasias e durante a progressão da síndrome de imunodeficiência adquirida (SIDA).(5)
A anemia é uma das complicações associadas à sintomatologia da doença renal crônica (DRC), seu surgimento é precoce e a progressão se dá à medida que a função renal se reduz. A prevalência da deficiência de ferro (Fe) é bastante comum na DRC, cerca de 50%, em razão do estado inflamatório que aumenta a síntese de hepcidina diminuindo a absorção e o trânsito de Fe nos estoques, bem como a deficiência de eritropoietina (EPO) decorrente da perda da função renal, sendo as principais causas. Dentro da fisiopatologia da DRC, a perda da massa renal e o caráter hipoproliferativo medular (baixo estímulo da eritropoiese pela EPO) constituem a patogênese.(6)
A fisiopatologia da ADC compreende, no mínimo, três mecanismos fundamentais: a limitação do movimento de Fe em seu estoque, sobretudo nas células fagocitárias, como nos macrófagos, em que há a redução da absorção do mineral no intestino; inibição na produção de glóbulos vermelhos através de mediadores inflamatórios e, por fim, redução da sobrevida dos glóbulos vermelhos.(7)
A produção de glóbulos vermelhos é estimulada pela eritropoietina (EPO), um hormônio glicoproteico secretado pelas células epiteliais capilares ao redor dos túbulos renais, sendo algumas quantidades produzidas nas células hepáticas. Na ausência de EPO, os precursores dos eritrócitos sofrem um processo de morte celular (apoptose). Com a perda e o lapso de tecidos ao redor dos túbulos renais, ocorre o processo de anemia.(8)
A ADC possui como característica células normocíticas e normocrômicas, em que se visualiza a redução da concentração de Fe sérico e da capacidade de ligação ao mineral. O desenvolvimento da doença é mediado por um conjunto de citocinas pró-inflamatórias, anti-inflamatórias, proteínas de fase aguda, radicais livres, células do sistema reticuloendotelial e por uma proteína essencial, a hepcidina. Na Figura 1, pode-se visualizar a interação entre os macrófagos, os hepatócitos e a hepcidina na geração da anemia da inflamação, também nomeada por ADC.(9)
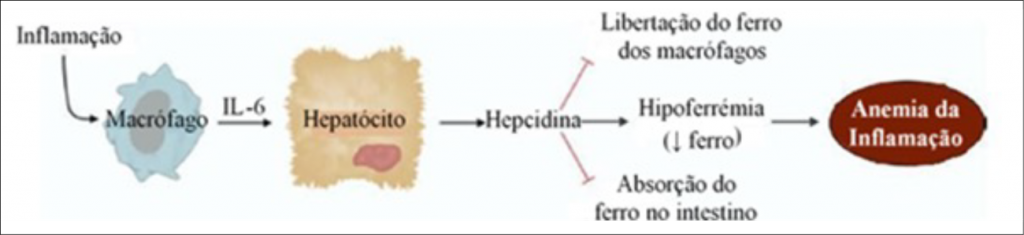
Figura 1
Papel da IL-6 e da hepcidina no desenvolvimento da anemia da inflamação.
Fonte: Lopes, 2011.(9)
A síntese de hepcidina é induzida por um processo inflamatório, sendo responsável pelo quadro de ADC. É mediado pela IL-6 (interleucina 6), e outras citocinas inflamatórias podem estar envolvidas, como a TNF-α (fatores de necrose tumoral-alfa). A hepcidina atua como reguladora do influxo de Fe para o plasma a partir dos tecidos, bem como aos enterócitos (absorção), macrófagos (reciclagem) e os hepatócitos (reservatório).(10)
Devido a ação regulatória no metabolismo do Fe, a hepcidina pode ser utilizada como um biomarcador para a avaliação clínica de pacientes com anemia ferropênica. Os valores do nível de hepcidina se apresentam elevados, em comparação com os níveis de saturação da transferrina e ferritina, durante suplementação de Fe em pacientes com a ADC. Entretanto, em hemoglobinopatias e anemias com eritropoiese ineficiente, há uma redução na síntese de hepcidina. (11)
Doença renal crônica
A DRC é a perda permanente da função renal, e é reconhecida como um problema global de saúde pública. Nos países desenvolvidos, a prevalência de DRC está entre 10% a 13% na população adulta, e no Brasil, entre 3 a 6 milhões de indivíduos são doentes renais crônicos. A hipertensão arterial e o diabetes são as principais causas, e os distúrbios cardiovasculares constituem um dos maiores riscos de mortalidade durante o curso da DRC.(12)
A doença renal associada ao diabetes ocorre no contexto de hipertensão arterial como condição subjacente; os eventos hemodinâmicos iniciais de hiperperfusão, hipertensão e hiperfiltração glomerular causam extravasamento glomerular de macromoléculas como a albumina, esses eventos são expressos clinicamente por albuminúria e diminuição da taxa de filtração glomerular.(13)
O aumento da dificuldade durante a filtração renal do sangue é crescente, sendo necessária hemodiálise para evitar o acúmulo de ureia no sangue (azotemia), lesões sistêmicas e a perda total das funções. Quando há a progressão das doenças subjacentes, a destruição tecidual é seguida por inflamação, onde os néfrons são substituídos por tecido cicatricial e ocorre um desequilíbrio nas citocinas, contribuindo para a diminuição da taxa de filtração glomerular (TFG).(14)
Durante a DRC, é necessário avaliar a anemia regularmente, por conta de sua relação com a TFG. Leves reduções na TFG resultarão em discretas alterações na hemoglobina, as quais são desconsideradas para critérios diagnósticos, principalmente na clínica médica. O surgimento da anemia ocorre comumente à medida que a TFG alcança valores abaixo de 30mL/min. Apesar da anemia precoce encontrar-se ligada a muitas internações e óbitos, a anemia é subdiagnosticada e subtratada.(15)
O estado inflamatório crônico observado na DRC associa-se à elevação dos níveis séricos de proteínas inflamatórias de fase aguda como a proteína C-reativa (PCR) e a vários mediadores imunoinflamatórios, como citocinas, componentes do sistema complemento, prostaglandinas e leucotrienos. Os pacientes com DRC apresentam um fenótipo pró-inflamatório que se acentua à medida que a lesão renal segue rumo a seu estágio terminal.(16)
Para a classificação da DRC, a TFG é utilizada como biomarcador, ordenando-se entre 0 a 5 estágios funcionais conforme o nível de atividade renal do paciente, que é o principal método de diagnóstico da DRC. Se a TFG está acima de 90mL/min, o grau de insuficiência renal (IR) identifica ausência de lesão ou lesão leve; se TFG de 15 a 29mL/min, o grau de IR é severo ou clínico; taxa abaixo de 15mL/min indica grau de IR terminal ou dialítica. Na Tabela 1 está discriminada a classificação dos estágios da DRC.(17)
Tabela 1
Classificação dos estágios da DRC de acordo com a atividade renal do paciente sendo influenciado pela idade, sexo e massa muscular.
| Estágios | Taxa de filtração glomerular (mL/min) | Grau de insuficiência renal (IR) |
| 0 | >90 | Ausência de lesão renal |
| 1 | >90 | Lesão renal com função renal normal |
| 2 | 60-89 | IR leve ou funcional |
| 3 | 30-59 | IR moderada ou laboratorial |
| 4 | 15-29 | IR severa ou clínica |
| 5 | <15 | IR terminal ou dialítica |
Fonte: Adaptado de Zica et al.(17)
A avaliação da TFG é executada criteriosamente levando em consideração que o nível da filtração glomerular muda de acordo com a faixa etária, o sexo do paciente e a massa muscular do corpo. Geralmente a TFG reduz ao decorrer da idade, e dessa maneira é produto do processo natural do envelhecimento. No entanto, para definir a situação da DRC, é preciso ser analisada a TFG média estimada com base na idade para as suas devidas alterações, como nas dosagens medicamentosas.(18)
A TFG é o parâmetro mais importante para avaliar a função renal, utiliza a dosagem de substâncias que são filtradas pelos rins por determinado tempo. A creatinina sérica é a substância utilizada no cálculo, recomendado pelo “Doença Renal: Melhorando os Resultados Globais” (KDIGO-2013), em que se utiliza a equação “Colaboração em Epidemiologia da Doença Renal Crônica” (CKD-EPI). Os níveis de creatinina dependem de fatores como massa muscular, dieta, secreção tubular e eliminação extrarrenal pelo trato gastrointestinal, sendo esses fatores avaliados de acordo com os sintomas do paciente.(19)
Eritropoiese inadequada
A sobrevida dos eritrócitos é reduzida entre os indivíduos com anemia em decorrência da doença renal crônica, em que a deficiência de Fe e a baixa síntese de eritropoietina (EPO) se correlacionam. O estresse oxidativo é um dos fatores de progressão da doença renal, em que há um excesso na produção de substâncias derivadas da metabolização de oxigênio e a diminuição da capacidade antioxidante, causando hipóxia nos tecidos e aumentando a atividade inflamatória.(20)
A eritropoiese pode ser afetada por doenças subjacentes, em que há infiltração de microrganismos ou de células tumorais na medula óssea, que produzem substâncias inflamatórias. O metabolismo do Fe sofre perturbação homeostática, onde há redução da absorção e aumento de sua retenção nas células do sistema reticuloendotelial, havendo redução da disponibilidade para as células progenitoras eritroides.(21)
As citocinas podem influenciar no crescimento de unidades formadoras de células eritroides e unidades formadoras de colônias eritroides, onde as IFN-γ e TNF-α danificam diretamente as células progenitoras. Com isso, há formação de radicais livres lábeis, como o óxido nítrico e o ânion superóxido, diminuindo a meia-vida dos eritrócitos e promovendo a eritrofagocitose, em que um efeito inibitório acomete a medula óssea.(22)
A eritropoiese requer cerca de 30mg de Fe por dia, proporcionada pela reciclagem deste através dos macrófagos, que ingerem hemácias senescentes e liberam o Fe, que se liga à transferrina circulante. As alterações típicas dos parâmetros do metabolismo do Fe estão associadas à DRC, onde a baixa saturação da transferrina circulante promove a redução da disponibilidade de Fe para a eritropoiese.(23)
RESULTADOS E DISCUSSÃO
A DRC é determinada pela lesão no parênquima renal ou pela diminuição das funções renais por um período mínimo de 3 meses. Dentre as complicações da DRC, estão: acidose metabólica, desnutrição, alteração no metabolismo de minerais; e a anemia constitui o principal fator de progressão da DRC. A lesão renal prejudica a produção de EPO, que é fundamental para a diferenciação e proliferação das células-tronco hematopoiéticas, resultando em anemia.(24)
A DRC apresenta anemia ferropriva, apesar de haver elevada quantidade de Fe no interior dos macrófagos. Dentre a patogênese, existem três mecanismos prevalentes: alterações na eritropoiese, diminuição da sobrevida das hemácias e a resposta inadequada da medula óssea perante a hemólise. O distúrbio no metabolismo do Fe ocorre a partir da liberação de citocinas pró-inflamatórias, que estimulam a expressão da hepcidina, uma proteína que inibe a absorção duodenal de Fe.(25)
De acordo com Antunes & Canziani,(26) como o rim é responsável pela excreção de hepcidina, há uma elevação na concentração dessa proteína em doentes renais crônicos, principalmente em estágios avançados e em tratamento dialítico. O aumento na concentração de hepcidina está vinculado à diminuição da excreção renal, porém vale ressaltar que o aumento de sua síntese ocorre também em resposta à inflamação, haja vista que a hepcidina é a ligação entre a inflamação e os distúrbios no metabolismo do Fe nos pacientes com DRC.
Bevilacqua & Canziani(27) mostram que apesar de haver uma quantidade adequada de Fe em seus estoques, há uma deficiência funcional de Fe, ou seja, a diminuição da disponibilidade do mineral para a eritropoiese. A ferritina sérica é o marcador mais utilizado para avaliação dos depósitos orgânicos de Fe. Em casos de valores de ferritina menores que 100ng/mL, há indicativo de deficiência absoluta de Fe e, por outro lado, valores superiores a 800ng/mL indicam sobrecarga do mineral.
Segundo Lacreta et al.,(28) a anemia na DRC é frequentemente normocítica e normocrômica, sem trombocitopenia e leucopenia, e a sobrevivência média dos glóbulos vermelhos e a sua produção sofrem alterações. A EPO participa de processos que promovem a divisão e a maturação dos eritrócitos, e na DRC vinculada à anemia os níveis séricos de EPO encontram-se, geralmente, normais ou discretamente elevados, porém são considerados excessivamente baixos em relação ao grau de anemia, pois em pacientes anêmicos com função renal preservada os valores são de 10 a 100 vezes maiores.
Um dos fatores relacionando eritropoietina à anemia na DRC, destacado por Barros et al.,(29) foi a redução da síntese endógena de EPO por conta da diminuição da massa renal, considerado o principal motivo. Além disso, a elevação da quantidade de hepcidina, causada pela inflamação crônica ou pelo decréscimo da depuração renal desta proteína, resulta em resistência à eritropoietina, sendo também cofatores na manutenção da anemia.
Os pacientes com DRC representam uma população propensa a inflamações e estresse oxidativo, em favor dos fatores predispostos e os desenvolvidos durante o tratamento da doença. O estresse oxidativo se descreve como o dano tecidual que resulta do desequilíbrio entre a produção de substâncias oxidantes e o déficit produtivo da defesa antioxidante. Devido ao estado inflamatório da DRC, as espécies reativas de oxigênio (ERO) são liberadas a partir de monócitos e células polimorfonucleares com citocinas pró-inflamatórias, que aumentam a geração de oxidantes.(30)
Dessa forma, para Plastina et al.,(31) aproximadamente 30% a 50% das pessoas com doença renal crônica exibem altos níveis de proteína C-reativa (PCR) e de citocinas pró-inflamatórias no sangue, entre essas, estão: o fator de necrose tumoral-alfa, as IL-1 e IL-6. A IL-6 proporciona a elevação da quantidade de hepcidina no sangue, no qual impossibilita a absorção e a movimentação do ferro de sua área de reserva (células do sistema reticuloendotelial), ocasionando retenção de ferro e hipoferremia.
Marques et al.(32) salientam a importância da dosagem da ferritina em pacientes com DRC, por se apresentar como um recurso diagnóstico dentre os distúrbios metabólicos do Fe, devido sua associação com o estoque de Fe tecidual. Entre os pacientes em hemodiálise, são relativamente frequentes achados de valores elevados de ferritina, por remeter a ações inflamatórias ou maior estoque de ferro, mas estudos afirmam que o índice elevado de ferritina pode agravar o estresse oxidativo e elevar os riscos de problemas cardiovasculares.
Pedruzzi et al.(33) exemplificam que níveis elevados de ferritina representam um alto preditor de peroxidação lipídica, que possui o malondialdeído (MDA) como biomarcador, tendo correlação positiva com as toxinas urêmicas. Em uma pesquisa com 20 pacientes com DRC em tratamento dialítico, 12 apresentaram valores de ferritina >500ng/mL, considerados elevados; os níveis de PCR, TNF e IL-6 também foram significantemente maiores, concluindo que o excesso dos estoques de Fe resulta em aumento da peroxidação lipídica, fator agravante do estresse oxidativo.
Segundo Janiques et al.,(34) a disparidade entre a ação antioxidante e a produção de ERO em pacientes com DRC em tratamento dialítico ocorre em consequência da ativação de monócitos e neutrófilos, a presença de endotoxinas e toxinas urêmicas na solução de diálise, bioincompatibilidade das membranas de diálise e a baixa ingestão de antioxidantes. Ademais, diversas alterações funcionais e morfológicas ocorrem nos néfrons. A lesão nessas células renais culmina em uma cascata de eventos que provocam um processo inflamatório, resultando na lesão do endotélio e do parênquima renal.
Storino et al.(35) citam que o acúmulo de toxinas urêmicas advindas da deficiência no metabolismo renal gera toxicidade nos pacientes renais crônicos. Foram listadas 152 toxinas pelo grupo europeu de Estudo das Toxinas Urêmicas (EUTox), classificadas em moléculas pequenas, solúveis em água, como ureia e fósforo; moléculas intermediárias, como paratormônio (PTH) e a β2-microglobulina; moléculas ligadas à proteína, como homocisteína e indoxil sulfato (IS), que por conta do tamanho do complexo (toxina + proteína plasmática) não consegue atravessar a membrana do dialisato, sendo difícil a remoção por hemodiálise.
Scapini et al.(36) revelam que o estresse oxidativo está vinculado ao envelhecimento renal, pois há um aumento na peroxidação lipídica, levando à diminuição das funções renais. A cada 10 anos ocorre uma diminuição de 10% do número de néfrons funcionais em indivíduos saudáveis, portanto, em idosos, a lesão oxidativa associada aos fatores de risco comumente visualizados, como diabetes e hipertensão, agravam drasticamente a evolução da DRC.
A doença renal crônica é definida pela disfunção renal irreversível, de progresso lento e gradativo, tanto da parte exócrina, referente à filtração, reabsorção e secreção de substâncias pela urina, como da parte endócrina, referente à produção de EPO e 1,25 – diidroxicolecalciferol, que é a forma ativa da vitamina D. Usualmente, a fase inicial da insuficiência renal é sem sintomas, na qual leva à necessidade de monitoramento e acompanhamento nas fases iniciais para prevenir e controlar a doença.(37)
De acordo com Malta et al.,(38) a avaliação da TFG é normalmente usada como um modelo padrão, sobretudo por ser um indicador de extrema importância para detecção, avaliação e prognóstico da DRC. Manifestações como a redução progressiva da TFG e a perda irreversível dos néfrons apresentam-se, inicialmente, por uma elevação persistente dos níveis plasmáticos dos subprodutos que comumente são excretados pelos rins, por exemplo, ureia e creatinina.
Como relatado por Silva et al.,(39) para a mensuração da TFG é preciso o uso de marcadores, que são: inulina, ácido etilenodiamino tetra-acético (EDTA), iotalamato, iohexol etc. Entretanto, o uso desses marcadores é dispendioso e de complexo processamento na prática clínica. Portanto, a creatinina é o marcador endógeno mais comumente utilizado.
Desta maneira, Gabriel et al.(40) evidenciam a creatinina sérica como o marcador endógeno mais usado na atividade laboratorial, seja pela sua determinação apenas no sangue ou em combinação com a sua depuração na coleta de urina 24 horas. A quantidade de creatinina no sangue (originária da creatina muscular) é inversamente proporcional à TFG. No entanto, diversos aspectos reduzem a sua exatidão, pois sua quantidade sérica reflete a sua produção, é diretamente proporcional à massa muscular e é afetada pela faixa etária e sexo do paciente.
A leitura de Kirsztain et al.(41) sobre as orientações da organização “Doença Renal: Melhorando os Resultados Globais (KDIGO)”, para avaliação e manipulação da DRC, demonstra que a determinação da TFG pela creatinina sérica permanece como a técnica mais correta para diagnóstico, classificação e monitoramento do avanço da DRC. No que diz respeito à avaliação da atividade renal, apesar dos rins possuírem várias funções diferentes, incluindo endócrinas e metabólicas, a TFG, na qual é um componente da função excretora, é considerada a melhor indicadora de avaliação do funcionamento renal.
Conforme Ribeiro-Alves e Gordan(42) evidenciam, para avaliar a anemia é essencial considerar a fase da DRC. Geralmente, a anemia surge quando a TFG reduz para níveis abaixo de 70mL/min/1,73m² e 50mL/min/1,73m², em homens e mulheres, respectivamente, entretanto a prevalência e intensidade são inconstantes e aumentam com o agravamento do funcionamento renal. A anemia da DRC costuma ser silenciosa e de início lento, possibilitando que os pacientes se adaptem a níveis reduzidos de hemoglobina, por isso é importante a avaliação do funcionamento renal por meio da TFG, ferramenta que pode prevenir o desenvolvimento de ambas as patologias.
CONSIDERAÇÕES FINAIS
De acordo com os resultados obtidos, conclui-se que a DRC se tornou um dos principais problemas de saúde pública, por conta de sua elevada e crescente taxa de morbimortalidade, e isso está aliado às doenças de base (hipertensão e diabetes) que promovem a evolução dos casos, levando à principal complicação que é a ADC. A condição do doente renal crônico é complexa e heterogênea, pois compreende eventos fisiopatológicos variados vinculados entre si.
Os principais fatores influenciadores no desenvolvimento da DRC são: o distúrbio no metabolismo do Fe, que engloba alterações funcionais na produção de EPO e hepcidina, participantes da estimulação na síntese hematopoiética e disponibilidade do Fe, respectivamente; e o estresse oxidativo, consequência do caráter inflamatório da DRC, em que citocinas pró-inflamatórias são liberadas gerando intenso desequilíbrio no sistema antioxidante celular, aspectos que agravam a lesão renal. Destarte, é imprescindível a compreensão dessas condições para que a terapêutica tenha êxito.
Além disso, a avaliação da função renal pela TFG é um bom preditor frente ao processo diagnóstico, pois é possível inferir, em cada paciente, o estágio patológico vivenciado. A classificação desse processo possibilita monitorar a evolução da DRC, bem como a saúde renal, sendo possível o devido controle terapêutico. Vinculado a isso, a quantificação da creatinina sérica, como um biomarcador, propicia melhor avaliação.
Em virtude das informações apresentadas, constatou-se que há intensa correlação entre a anemia e a DRC, em virtude da sequência de eventos que geram as doenças, que por ser multifatorial e depender de uma avaliação extensiva eleva a necessidade de acervo bibliográfico para maior esclarecimento do tema. Por isso, a atualização dos aspectos fisiopatológicos e casuísticos de ambas as patologias é imprescindível para mitigar o crescimento da morbimortalidade.
REFERÊNCIAS
- Borges RB, Weffort VRS. Anemia no Brasil–Revisão. Rev Méd Minas Gerais, v.21, n.3 Supl 1, p. S1-144, 2011.
- Chaparro CM, Suchdev PS. Anemia epidemiology, pathophysiology, and etiology in low-and middle-income countries. Annals of the New York Academy of Sciences, v.1450, n.1, p.15, 2019.
- Rocha MAA. Anemias: caracterização e implicações em Medicina Dentária. 2011. Tese de Doutorado. Repositório da Universidade de Lisboa, Faculdade de medicina dentária.
- Amarante MK, et al. Anemia Ferropriva: uma visão atualizada. Biosaúde, v.17, n.1, p.34-45, 2015.
- Roy CN. Anemia of inflammation. Hematology 2010, the American Society of Hematology Education Program Book, v.2010, n.1, p.276-280, 2010.
- Abensur H. Deficiência de ferro na doença renal crônica. Revista Brasileira de Hematologia e Hemoterapia, v.32, p.95-98, 2010.
- De Santis GC. Anemia: definição, epidemiologia, fisiopatologia, classificação e tratamento. Medicina (Ribeiräo Preto), 2019.
- Tamadon M-R, Beladi-Mousavi SS. Erythropoietin; a review on current knowledge and new concepts. Journal of renal injury prevention, v.2, n.4, p.119, 2013.
- Lopes AJDOC, et al. Anemia da doença crônica. 2011. Tese de Doutorado. 00500: Universidade de Coimbra.
- Porto G, Oliveira S, Pinto JP. Hepcidina: a molécula-chave na regulação do metabolismo do ferro. Jornal Português de Gastrenterologia, v.19, n.1, p.26-32, 2012.
- Munareto KA. Hepcidina como regulador da homeostase do ferro: uma revisão. Brazilian Journal of Nephrology, 2016; 38(3):351-355.
- Marinho AWGB, et al. Prevalência de doença renal crônica em adultos no Brasil: revisão sistemática da literatura. Cadernos Saúde Coletiva, v.25, n.3, p.379-388, 2017.
- Vieira Júnior JM, Suassuna JHR. O acometimento renal na hipertensão arterial e diabetes mellitus tipo 2: como identificar e prevenir – A visão do nefrologista. Revista Hospital Universitário Pedro Ernesto, v.12, 2013.
- López-Novoa JM, et al. Common pathophysiological mechanisms of chronic kidney disease: therapeutic perspectives. Pharmacology & therapeutics, v.128, n.1, p.61-81, 2010.
- Gordino SM. “Epidemiologia da insuficiência renal crónica e anemia associada em adultos”. 2019. Tese de Doutorado, Repositório da Universidade de Lisboa, Faculdade de ciências departamento de química e bioquímica.
- Vianna HR, et al. Inflamação na doença renal crônica: papel de citocinas. Brazilian Journal of Nephrology, v.33, n.3, p.351-364, 2011.
- Zica CLA, Oliveira TS, de Gouveia IPP, de Oliveira RR, & de Oliveira Vasconcelos M. (2019). Anemia de doença crônica na doença renal crônica. Conexão Ciências (Online), 14(2).
- Bastos MG, Bergman R, Kirsztajn GM. Doença renal crônica: frequente e grave, mas também prevenível e tratável. Revista da Associação Médica Brasileira, v.56, n.2, p.248-253, 2010.
- Oliveira SL de, Brune MFSS. Avaliação da função renal em adultos por meio da taxa de filtração glomerular e microalbuminúrica. Revista Brasileira de Pesquisa em Saúde/Brazilian Journal of Health Research, v.19, n.3, p.62-68, 2017.
- Fernandes AMP. Eritropoiese e inflamação em doentes com insuficiência renal e/ou com diabetes Mellitus tipo 2. 2012. Tese de Doutorado, Universidade Católica Portuguesa, Instituto de Ciências da Saúde.
- Andrade ARN. Aspectos hematológicos do envelhecimento: anemia fisiológica, patológica ou ambas? 2012. Tese de mestrado, Universidade do Porto, Faculdade de Farmácia.
- Poggiali E, De Amicis MM, Motta I. Anemia of chronic disease: A unique defect of iron recycling for many different chronic diseases. European Journal of Internal Medicine, volume 25, issue 1, pages 12-17, 2013.
- Canavesi E, et al. Hepcidin and HFE protein: Iron metabolism as a target for the anemia of chronic kidney disease. World Journal of Nephrology, v.1, n.6, p.166, 2012.
- Giassi K, Pizzolatti RC. Anemia da doença renal crônica: perfil epidemiológico dos pacientes em hemodiálise em uso de eritropoetina no ano de 2012 na cidade de Criciúma. Arquivos Catarinenses de Medicina, v.44, n.2, p.2-12, 2016.
- Oliveira Júnior WV, et al. Inflamação e má resposta ao uso de eritropoetina na doença renal crônica. Brazilian Journal of Nephrology, v.37, n.2, p.255-263, 2015.
- Antunes, S. A., & Canziani, M. E. F. (2016). Hepcidina: um importante regulador do metabolismo de ferro na doença renal crônica. Brazilian Journal of Nephrology, 38, 351-355.
- Bevilacqua JL, Canziani MEF. Monitoring of hematimetric parameters. Brazilian Journal of Nephrology, v.36, n.1, p.13-14, 2014.
- Lacreta G, et al. Pure red cell aplasia and anti-erythropoietin antibodies in patients on hemodialysis: a report of two cases and a literature review. Brazilian Journal of Nephrology, v.41, n.1, p.145-151, 2019.
- Barros F, et al. Anemia na Doença Renal Crónica: da evidência à prática clínica. Acta Médica Portuguesa, [S.l.], v.24, p.869-74, dez. 2011. ISSN 1646-0758.
- Jaqueto M, et al. Os níveis de PTH estão relacionados com estresse oxidativo e inflamação em pacientes renais crônicos em hemodiálise? Brazilian Journal of Nephrology, v.38, n.3, p.288-295, 2016.
- Plastina JCR et al. Deficiência funcional de ferro em pacientes em hemodiálise: prevalência, avaliação nutricional e de biomarcadores de estresse oxidativo e de inflamação. Brazilian Journal of Nephrology, v.41, n.4, p.472-480, 2019.
- Marques BM et al. Análise de indicadores de qualidade e características clínicas em uma unidade de terapia renal substitutiva. CuidArte, Enferm, p.99-105, 2019.
- Pedruzzi LM, et al. Associação entre níveis de ferritina e peroxidação lipídica em pacientes em hemodiálise. Brazilian Journal of Nephrology, v.37, n.2, p.171-176, 2015.
- Janiques AGDPR, et al. Compostos fenólicos: possíveis aplicações na doença renal crônica. Nutrire Rev. Soc. Bras. Aliment. Nutr, p.322-337, 2013.
- Storino GF, et al. Mortalidade Cardiovascular em Pacientes Renais Crônicos: o Papel das Toxinas Urêmicas. Int J Cardiovasc Sci, v. 28, n. 4, p. 327-334, 2015.
- Scapini KB, et al. Estresse oxidativo, envelhecimento renal e doença renal crônica terminal. Estudos Interdisciplinares sobre o Envelhecimento, v. 15, n. 2, 2010.
- Couto KG, et al. Prevalência de casos de insuficiência renal crônica (IRC) atendidos pelo Serviço de Atendimento Móvel de Urgência de Rio Verde. Goiás. Rev. Salusvita, v.36, n.1, p.47-54, 2017.
- Malta DC, et al. Evaluation of renal function in the Brazilian adult population, according to laboratory criteria from the National Health Survey. Revista Brasileira de Epidemiologia, v.22, p.E190010. SUPL. 2, 2019.
- Silva ACA, et al. Detecção de disfunção renal através da dosagem de creatinina em amostra de gota de sangue seca no papel filtro. “J. Bras. Nefrol.”, São Paulo, v.38, n.1, p.15-21, Marc. 2016.
- Gabriel IC, Nishida SK, Kirsztajn GM. Cistatina C sérica: uma alternativa prática para avaliação de função renal? J. Bras. Nefrol. São Paulo, v.33, n.2, p.261-267, June 2011.
- Kirsztajn GM, et al. Leitura rápida do KDIGO 2012: Diretrizes para avaliação e manuseio da doença renal crônica na prática clínica. J. Bras. Nefrol. São Paulo, v.36, n.1, p.63-73, Mar. 2014.
- Ribeiro-Alves MA, Gordan PA. 1. Diagnóstico de anemia em pacientes portadores de doença renal crônica. J. Bras. Nefrol. São Paulo, v.36, n.1, supl. 1, p.9-12, Mar. 2014.
Correspondência
Alan Marcelo de Souza Farias Filho
E-mail: [email protected]
