Alterações celulares reativas frente ao morfotipo de lactobacilos vaginais
Reative cell changes against the morphotype of vaginal Lactobacillus
Juliane Jagas Neves1
Gabriela Livai Fagundes1
Carmen Antônia Sanches Ito2
Ednéia Peres Machado2
Ana Paula Xavier Ravelli3
Péricles Martim Reche3
1Graduanda de Farmácia. Universidade Estadual de Ponta Grossa (UEPG). Ponta Grossa-PR, Brasil.
2Professor assistente. Universidade Estadual de Ponta Grossa (UEPG). Ponta Grossa-PR, Brasil.
3Professor(a) Doutor(a). Universidade Estadual de Ponta Grossa (UEPG). Ponta Grossa-PR, Brasil.
Instituição: Universidade Estadual de Ponta Grossa (UEPG). Ponta Grossa-PR, Brasil.
Conflito de interesses: não há conflito de interesses.
Recebido em 16/11/2018
Artigo aprovado em 08/08/2019
DOI: 10.21877/2448-3877.201900793
INTRODUÇÃO
A microbiota vaginal é altamente influenciada por fatores ambientais, sejam fatores intrínsecos ao organismo da mulher, como os hormonais e faixa etária, ou extrínsecos, relativos à sexualidade, hábitos de higiene, medicamentos e alimentares.
Por ser um órgão que tem contato com o meio externo, o organismo humano utiliza-se de recursos protetivos que asseguram a integridade do ecossistema vaginal através de uma interação equilibrada entre o estado hormonal, sistema imune e a microbiota, em especial microbiota lactobacilar,(1) a fim de auxiliar no combate a agentes patogênicos.
A composição lactobacilar não é estática, pois sofre variação em resposta ao ciclo menstrual da mulher,(2) assim como a resposta imune humoral ou celular na vagina, que também parece depender da ação hormonal.(3)
Os lactobacilos apresentam formas variadas, desde muito alongadas a muito curtas, de reto a curvo e até mesmo espiralados, incluídas no grupo amplo e heterogêneo de bactérias do ácido lático. São Gram-positivos, não esporulados, cujo catabolismo de açúcares é estritamente fermentativo, tendo como ácido orgânico (ácido lático) o produto final predominante. São bactérias anaeróbias facultativas.(4)
No Brasil, já foram identificadas 83 espécies diferentes de lactobacilos em mulheres saudáveis e assintomáticas, Lactobacillus crispatus demonstrou ser o mais frequente, presente em quase 1/3 das amostras, seguida das espécies L. jensenii e L. gasseri.(5)
Nos períodos de ausência de estímulo estrogênico (infância e climatério), o epitélio escamoso vaginal é atrófico com predomínio de células basais e parabasais. Durante o período reprodutivo, as células do epitélio escamoso estratificado vaginal respondem ao suporte hormonal estroprogestínico. O estrogênio apresenta-se em elevada concentração na primeira fase do ciclo ovariano e propicia a divisão celular com o rápido amadurecimento do epitélio vaginal, de células parabasais em intermediárias e depois em superficiais, promovendo a proliferação do epitélio escamoso, período com escassez de lactobacilos.(6)
Após a ovulação, na segunda metade do ciclo menstrual ocorre um aumento nos níveis de progesterona, favorecendo a produção de vacúolos de glicogênio em células intermediárias do epitélio escamoso, predominantes nessa fase do ciclo, conjuntamente com a proliferação de lactobacilos, os quais lisam as células intermediárias, consumindo o glicogênio presente nelas, fenômeno denominado de citólise. O glicogênio é usado pelos lactobacilos como substrato para produção de ácido lático.(7)
A produção de ácidos orgânicos pelos lactobacilos mantém o pH vaginal em torno de 3,8 a 4,2, criando um ambiente inóspito para os patógenos e favorecendo a fixação dos lactobacilos no epitélio vaginal.(8) A microbiota lactobacilar vaginal também é capaz de oxidar carboidratos por uma via metabólica, cujo produto final é o H2O2, que se acumula na ausência de peroxidase. O excesso de peróxido de hidrogênio é capaz de inibir ou matar outros microrganismos, principalmente os grupos com carência ou baixa produção de peroxidase.(9) Além disso, a microbiota lactobacilar na vagina pode impedir a adesão e o crescimento de patógenos através da competição por nutrientes, produção de bacteriocinas e através da competição pelos receptores de ligação das células.(10)
Quanto à citólise gerada pelos lactobacilos, pode ser considerada fisiológica ou não, dependendo do grau de lise, e quando ocorre de forma exagerada pode causar sintomas parecidos com a candidíase, como prurido e ardor, por isso a importância do correto diagnóstico e diferenciação entre as duas situações.(11) O fenômeno citolítico tem sido um achado comum em amostras cervicais pelo Papanicolaou, cuja anamnese das doentes geralmente relata história de consumo de vários tipos de medicamentos antifúngicos,(7) em função de erro de diagnóstico clínico.(12)
Para um correto diagnóstico de vaginose citolítica (VC), há necessidade de elevado nível de suspeita clínica, principalmente nos casos de recorrência aos especialistas de várias áreas pela mesma queixa, sintomatologia sistematicamente refratária a vários antifúngicos/antibióticos ou diagnóstico de candidíase complicada. A lactobacilose com aumento do tamanho do bacilo, mas acompanhado de modesto aumento do número de carga bacteriana sem citólise, também é uma alteração que mimetiza a vaginose citolítica.(12)
O diagnóstico laboratorial de VC apresenta elevação do número de lactobacilos com citólise e menos de 10 polimorfonucleares por campo microscópico em aumento de 1.000X.(7)
Trabalhos que avaliaram alterações reativas celulares pelo método de Papanicolaou verificaram, além da presença de citólise, binucleação,(13) assim como de edema nuclear em amostras que apresentavam exclusivamente microbiota lactobacilar.(14)
Este trabalho tem por objetivo identificar as alterações reativas celulares predominantes frente ao morfotipo lactobacilar vaginal.
MATERIAL E MÉTODOS
Este foi um estudo descritivo quantitativo, com estatística por frequência simples. As diferenças entre as variáveis foram calculadas pelo teste Qui-quadrado, com significância de p<0,05.
A população alvo desta pesquisa foram 476 mulheres na faixa etária entre 18 e 65 anos, que realizaram o exame preventivo do câncer do colo uterino, no ano de 2017, no projeto de pesquisa “Adequabilidade das amostras cervicovaginais de mulheres atendidas no projeto de extensão “Prevenção e educação na atenção à saúde da mulher: coleta e exame Papanicolaou””, no município de Ponta Grossa-PR, das quais foram selecionadas 198 amostras pela utilização dos critérios de exclusão, que foram amostras contendo somente microbiota vaginal lactobacilar.
Foram realizados esfregaços em lâmina de material coletado de raspado cervicovaginal com espátula de Ayre e escovinha cervical para pesquisa citológica pelo método de Papanicolaou e de secreção de fundo de saco vaginal, coleta com swab para pesquisa da microbiota vaginal pelo método de Gram.
A bacterioscopia pelo Gram foi analisada em aumento de 1.000X e a citologia pelo Papanicolaou em aumento de 400X. Foram incluídas no estudo apenas amostras contendo lactobacilos, pelo método de Gram, excluindo-se aquelas amostras que apresentaram outras bactérias na microbiota vaginal.
O sistema de quantificação microscópica de lactobacilose infiltrado inflamatório pela coloração de Gram, numa média de 15 a 20 campos microscópicos, pelo sistema de cruzes foi: ausente, 1+ com 1 a 9 lactobacilos/leucócitos por campo de imersão, 2+ com 10 a 20 por campo de imersão, 3+ com 21 a 30 por campo de imersão e 4+ quando predomínio ³ 31 lactobacilos/leucócitos por campo de imersão.
A fagocitose de lactobacilos pelo método de Gram foi quantificada, por esfregaço corado em aumento de 1.000X como: ausente, escassa com até três fenômenos em todo o esfregaço, moderada com quatro a seis, acentuada com sete a nove e exacerbação com dez leucócitos apresentando lactobacilo fagocitado.
A quantificação de lactobacilos pelo Papanicolaou em aumento de 400X com leitura em todo o esfregaço cervical foi considerada como: ausente, escassa com um a dez por campo, moderada 11 a 49 por campo, acentuada 50 a 99 e exacerbação com mais de 100 lactobacilos por campo.
A avaliação do infiltrado inflamatório nos esfregaços cervicovaginais pelo Papanicolaou foi realizada no aumento de 400X, com leitura em todo o esfregaço cervical, com a seguinte classificação: ausente, escasso com presença de um a três leucócitos por célula escamosa, moderada com quatro a oito leucócitos por célula, acentuada com nove a vinte leucócitos por célula e exacerbação com mais de 21 leucócitos por célula.
Quanto à presença de alterações reativas celulares, foram investigadas a presença de citólise, edema nuclear, cariomegalia, paraqueratose, binucleação e presença de micronúcleo em aumento de 400X. A quantificação dessas alterações foi realizada em toda a extensão do esfregaço e deu-se da seguinte forma: escassa na presença de uma célula em vinte campos, moderada na presença de uma célula em dez campos, acentuada na presença de uma célula a cada cinco campos e exacerbação com a presença de uma célula a cada três campos microscópicos analisados pelo método de Papanicolaou. A quantificação de citólise pelo Papanicolaou, por campo, analisando toda a extensão do esfregaço cervical, foi: presença de um a dois núcleos desnudos por campo (escassa), três a seis (moderada), sete a nove (acentuada) e dez ou mais (exacerbação). Os critérios de exclusão foram determinados pela ausência de material na lâmina ou obscurecimento em mais de 75% do esfregaço por sobreposição de leucócitos, e/ou hemácias e/ou células de descamação que impedissem a perfeita visualização da preparação.
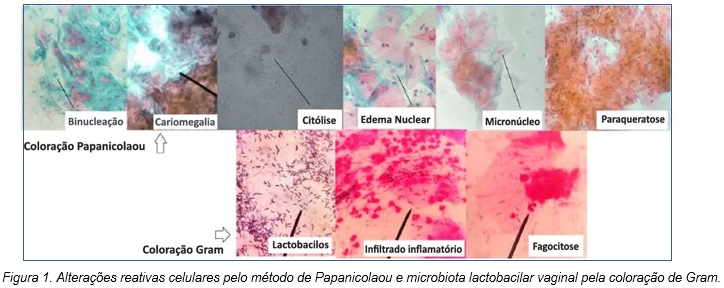
Morfologicamente, os critérios seguidos para relatar as alterações reativas celulares foram: paraqueratose em células escamosas superficiais com densas partículas alaranjadas ou eosinofílicas no citoplasma, vistas isoladamente, em folhas ou em verticilos, com formato redondo, oval, poligonal ou em forma de fuso, núcleos pequenos (aproximadamente 10 mm), densos e picnóticos. Uma alteração reativa celular sem caráter neoplásico; citólise na presença de um fundo citolítico com restos celulares e núcleos desnudos de células intermediárias; edema nuclear na presença de um aumento nuclear moderado, em até duas vezes o tamanho de um núcleo normal, sem quaisquer anormalidades significativas da cromatina; cariomegalia com presença de núcleo com aumento duas vezes e meia a três vezes o tamanho normal, com leve irregularidade no contorno nuclear, mínima hipercromasia e irregularidade na distribuição da cromatina, ou seja, lesão compatível com células escamosas atípicas de significado indeterminado, possivelmente não neoplásicas (ASC-US); binucleação em células binucleadas com distribuição normal de cromatina em células escamosas; micronúcleo com presença de inclusão intracitoplasmática derivada de fragmentos de cromatina ou cromossomos, um reflexo de aberração cromossômica durante a mitose celular.
Ética
A população alvo desta pesquisa foram mulheres que realizaram o exame preventivo do câncer do colo uterino, no ano de 2017, no projeto de pesquisa “Adequabilidade das amostras cervicovaginais de mulheres atendidas no projeto de extensão “Prevenção e educação na atenção à saúde da mulher: coleta e exame Papanicolaou””, aprovado pelo Comitê de Ética e Pesquisa da Universidade Estadual de Ponta Grossa, com parecer consubstancial nº 1.614.753.
RESULTADOS
Das 198 amostras analisadas pelo método de Gram, a forma curta de lactobacilos em 186 (93,9%) amostras foi a mais frequente observada, e longos em 12 (6,1%). Pelo método de Papanicolaou, os lactobacilos foram avaliados em relação à frequência com 81 (40,91%) amostras quantificadas como escassez e moderada em 75 (37,87%) amostras.
O infiltrado inflamatório pelo Gram foi avaliado pela presença de leucócitos (polimorfonucleares, linfócitos, macrófagos e eosinófilos) e foi escasso em noventa (45,45%) amostras. Pelo Papanicolaou, os leucócitos foram escassos em 82 (41,04%) amostras.
O fenômeno de fagocitose pelo Gram foi escasso em 51 (25,76%) amostras. A única amostra em que a fagocitose apresentou-se acentuada foi na presença de escassos bacilos curtos, moderado edema nuclear e paraqueratose e escassa cariomegalia.
As alterações reativas celulares oriundas de inflamação em células cervicovaginais pelo Papanicolaou apresentaram a seguinte quantificação: citólise escassa em 47 (23,74%), edema nuclear moderado em 71 (35,86%), cariomegalia escassa em 27 (13,64%), binucleação escasso em 70 (35,35%), micronúcleo escasso em cinco (2,52%) e paraqueratose moderada em 47 (23,74%) amostras (Quadro 1 e Figura 1).
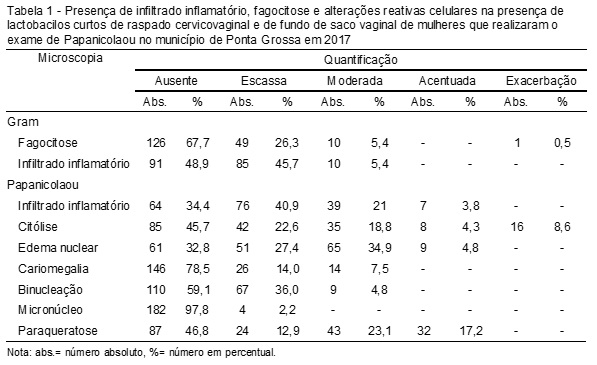
A presença de lactobacilos curtos pelo Gram foi exacerbada na maioria das preparações, 111 (59,7%) com presença moderada em 34 (18,3%), acentuada em 26 (14%) e escassa em 15 (8,1%). A fagocitose foi mais frequente com escassez em 49 (26,3%), assim como o infiltrado inflamatório em 85 (45,7%) pelo Gram. No método de Papanicolaou, na presença de lactobacilos curtos, o infiltrado inflamatório mais frequente foi escasso em 76 (40,9%), e as alterações reativas celulares apresentaram-se mais frequentemente em escassez na citólise 42 (22,6%), edema nuclear moderado em 65 (34,9%), cariomegalia escassa em 26 (14,0%), binucleação escassa em 67 (36,0%), micronúcleo escasso em quatro (2,2%) e paraqueratose moderada em 43 (23,1%) amostras (Tabela 1).
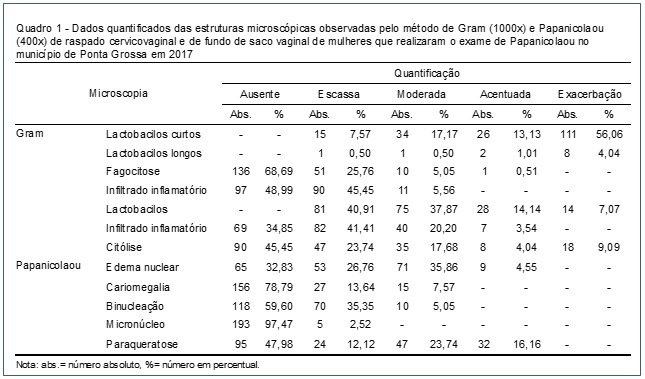
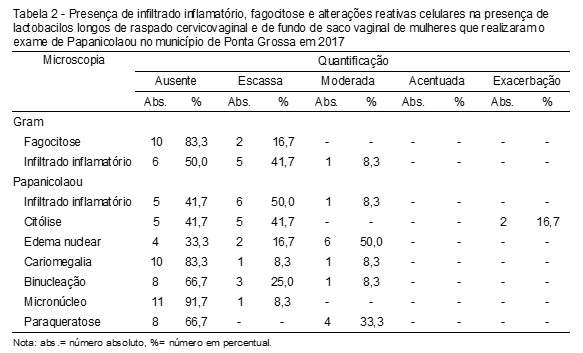
Os lactobacilos longos, na análise pelo Gram, foram exacerbados na maioria das preparações, oito (66,7%), acentuados em duas (16,7%), moderados e escassos em uma (8,3%), com escassez no infiltrado inflamatório em cinco (41,7%) e fagocitose em duas (16,7%). Pelo método de Papanicolaou, o infiltrado inflamatório foi escasso em maior frequência em seis (50,0%) amostras, o edema nuclear moderado em seis (50%), a citólise escassa em cinco (41,7%), cariomegalia escassa e moderada em uma (8,3%), binucleação escassa em três (25%), micronúcleo escasso em uma (8,3%) e paraqueratose moderada em quatro (33,3%) amostras (Tabela 2).
Das alterações reativas celulares foi observada a presença exclusiva de citólise em seis (3,0%), de edema nuclear em oito (4,0%), binucleação em duas (1,0%) e paraqueratose em 22 (11%) amostras.
Duas alterações simultâneas num mesmo esfregaço cervical foram observadas com citólise e edema nuclear em 18 amostras (9,08%), citólise e binucleação em duas (1,0%), citólise e paraqueratose em 11 (5,55%), edema nuclear e cariomegalia em três (1,5%), edema nuclear e binucleação em nove (4,5%), edema nuclear e paraqueratose em 31 (15,6%), binucleação e paraqueratose em cinco (2,5%) e micronúcleo com paraqueratose em uma (0,5%) amostra.
Três tipos simultâneos de alterações reativas celulares foram observados com citólise, edema nuclear e cariomegalia em três (1,15%) amostras; citólise, edema e binucleação em 13 (6,56%); citólise, edema e paraqueratose em 15 (7,56%); edema nuclear, cariomegalia e binucleação em quatro (2,0%); edema nuclear, cariomegalia e paraqueratose em três (1,5%) e com micronúcleo, paraqueratose e edema nuclear em duas (1,0%) amostras.
Quatro tipos de alterações reativas celulares simultâneas numa mesma preparação citológica foram citólise, edema nuclear, cariomegalia e binucleação em 14 (7,1%); citólise, edema nuclear, cariomegalia e paraqueratose em três (1,5%); edema nuclear, cariomegalia, binucleação e paraqueratose em quatro (2,0%); e com micronúcleo, paraqueratose, citólise e edema nuclear em uma (0,5%) amostra.
Cinco alterações reativas celulares simultâneas foram observadas com citólise, edema nuclear, cariomegalia, binucleação e paraqueratose em oito (4,0%) e micronúcleo, paraqueratose, citólise, edema nuclear e binucleação em uma (0,5%) amostra.
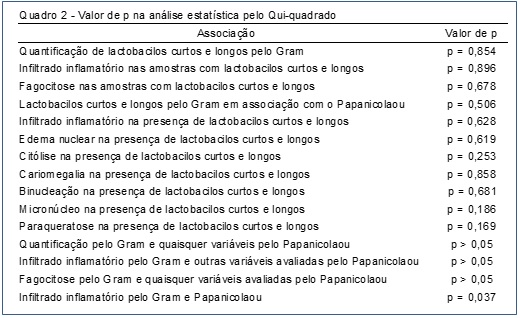
A análise estatística pelo Qui-quadrado demonstrou associação significativa entre a quantificação de infiltrado inflamatório pelo Gram e Papanicolaou com p=0,037 (Quadro 2).
DISCUSSÃO
Dada a relevância apresentada em vários trabalhos científicos sobre desenvolvimento da VC e sobre a relação entre a presença de lactobacilos produtores de L/D-lactato na facilitação da persistência do Papilomavírus Humano (HPV), principal fator de risco para câncer cervical, seguirá a discussão dos resultados obtidos neste estudo.(15,16)
Este estudo utilizou metodologias simples e de fácil aplicação em qualquer porte de laboratório clínico, sendo elas as colorações de Gram e Papanicolaou, e observou maior frequência do morfotipo lactobacilar curto.
Os lactobacilos que habitam o ambiente vaginal têm função de proteção contra patógenos externos, acidificando o pH vaginal, inibindo a proliferação de bactérias anaeróbias e a ocorrência de quadros infecciosos. Contudo, causam secreção vaginal fisiológica branca, inodora, cuja quantidade varia com o ciclo hormonal da mulher.(17)
Um estudo realizado em mulheres brasileiras isolou e identificou por métodos moleculares dez espécies de lactobacilos vaginais sendo os mais frequentes o L. crispatus (30,1%), L. jensenii (26,5%), L. gasseri (22,9%) e L. vaginalis (8,4%), além dos L. delbrueckii, L fermentum, L. reuteri e L. rhamnosus, L. mucosae e L. salivarius. As espécies L. crispatus, L. jensenii e L. gasseri atingiram os menores valores de pH (próximos a 4,0) e apresentaram melhor produção de H2O2, características importantes para proteção contra infecções.(6)
Nos Estados Unidos, Japão e Europa, pesquisas demonstraram que são frequentes também a presença de L. iners, com características distintas dos demais lactobacilos pela grande variedade morfológica e tintorial, descrita como bacilos curtos relativamente a Gram-negativos,(18) não produtor de ácido D-lático, apenas quantidades limitadas de peróxido de hidrogênio, com produção incomum da citotoxina aerolisina, que oferece proteção limitada contra a disbiose vaginal e infecções sexualmente transmissíveis com prognóstico desfavorável na gravidez.(19)
Mulheres americanas assintomáticas em idade reprodutiva apresentaram o ambiente vaginal com prevalência de L. crispatus, L. iners, L. jensenii e L. gasseri. Apresentaram microbiota vaginal dominada por lactobacilos em 80,2% as asiáticas, 89,7% as brancas, 59,6% as hispânicas e 61,9% as negras, donde especula-se a possibilidade dessa diferença ser determinada por particularidades genéticas entre os hospedeiros.(20)
Na avaliação de Ravel e cols., o L. iners foi o mais frequente na população feminina por eles estudada, seguida do L. crispatus, L. jensenii e L. gasseri. Utilizando sequenciamento de genes 16S RNA, Ravel e cols. apresentaram uma proposta de classificação que diferencia o microbioma vaginal em cinco tipos diferentes denominados Community State Types (CST), com os tipos I, II, III e V dominados por L. crispatus, L. gasseri, L. iners e L. jensenii respectivamente com pouca heterogeneidade microbiana, e subdividiu o tipo CST IV em A e B, estes associados a maior diversidade, onde o CST IV-A apresenta baixa quantidade de lactobacilos, coabitando com bactérias estritamente anaeróbias ou facultativas como Anaerococcus, Corynebacterium, Finegoldia e Streptococcus, e CST IV-B praticamente desprovido na totalidade de lactobacilos, sendo os componentes mais abundantes os gêneros Atopobium, Prevotella, Parvimonas, Sneathia, Gardnerella, Mobiluncus e Peptoniphilus, habitualmente associados à vaginose bacteriana, e relata que o CST-IV é mais prevalente em mulheres africanas e latinoamericanas.(21)
Os lactobacilos produzem substâncias antimicrobianas (H2O2 e bacteriocinas) e inibem a aderência de fungos às células vaginais, assim como competem por receptores e nutrientes. Sua depleção está associada à doença pélvica, infecção pós-cirúrgica, infecção pelo vírus da imunodeficiência humana, corioamnionites e displasia cervical.(22) Contudo, algumas mulheres podem apresentar proliferação anômala de lactobacilos, de etiologia desconhecida, com aumento excessivo no número de lactobacilos, que promovem extensa citólise nas células intermediárias do epitélio escamoso vaginal, nominado de vaginose citolítica (VC), com grande produção de ácido lático e consequente pH mais baixo que o normal. As células intermediárias do epitélio escamoso vaginal produzem glicogênio/glicose e por isso são mais acometidas pela citólise por favorecer o sobrecrescimento de lactobacilos em sua superfície, cujo predomínio se dá na fase pré-menstrual, na gravidez e no início da menopausa, e como o estrogênio influencia nessa produção de glicogênio sugere-se influência hormonal na fisiopatologia da VC.(7)
Existem evidências da formação de dois tipos de ácido lático no ecossistema vaginal: o ácido láctico-levógiro (AL-L) e o ácido láctico-dextrógiro (AL-D). O AL-L não só mantém a acidez vaginal como ativa a subclasse Th17 dos linfócitos T, estimula as células escamosas vaginais a liberar citocinas pró-inflamatórias na presença de ARN viral e é um potente inibidor das bactérias associadas à vaginose bacteriana. Produz AL-D L. crispatus, L. gasseri e L. jensenii e teoriza-se que o ratio AL-L/AL-D pode regular a produção local de um indutor da metaloproteinase da matriz extracelular (EMMPRIN) pelas células epiteliais, um cofator essencial no transporte de monocarboxilato-1, receptor responsável pela regulação dos níveis intracelulares de ácido láctico e prevenção da morte celular mediada pelo ácido.(23)
Na VC o nível de AL-L está elevado, mas os níveis de AL-D não, sugerindo que a citólise seria devida ao excesso de AL-L que, na ausência de um aumento concomitante de AL-D, levaria a uma redução do pH intracelular e à indução de necrose celular.(23) A prevalência de VC é estimada entre 1%-7% com pico de incidência na idade reprodutiva.(7) Pesquisadores concluíram que mulheres com menos relações sexuais por semana têm mais casos de VC em oposição às trabalhadoras do sexo com microbiota vaginal formada por outros tipos de bactérias sem diagnóstico de VC.(2) Uma patologia que mimetiza a VC é a lactobacilose, uma entidade rara que apresenta um aumento modesto da carga bacteriana lactobacilar por morfotipo longo, sem citólise com menos de dez polimorfonucleares por campo em microscopia, enquanto que a VC é causada por elevação no número de lactobacilos, com citólise e a mesma quantificação de polimorfonucleares que na lactobacilose.(7)
Os sintomas de VC e sua intensidade podem ser cíclicos, mais pronunciados na fase lútea, com ausência de dor vulvar, com corrimento vaginal abundante, esbranquiçado, sem odor, leitoso e grumoso e pH vaginal inferior a 4,2.(7) Os sinais e sintomas são insuficientes para estabelecer um diagnóstico correto de VC, o que explica os erros diagnósticos frequentes. Assim, o diagnóstico laboratorial de VC dá-se pela presença exclusiva de numerosa microbiota lactobacilar sem outro tipo de microrganismo, com citólise constatada e lactobacilos aderentes aos fragmentos das células que podem ser confundidos com clue cells típicas de vaginose bacteriana.(7)
Constatou-se que trinta (15%) mulheres que participaram deste estudo enquadraram-se no diagnóstico laboratorial de VC, com presença acentuada de lactobacilos, e, destes, 93% apresentando morfotipo curto pelo Gram, escassa presença de polimorfonucleares na presença de citólise pelo Papanicolaou.
Em se tratando do câncer cervical, o papilomavírus humano (HPV) é o fator ambiental responsável pelo desenvolvimento desse tumor. A probabilidade de uma mulher adquirir uma infecção pelo HPV ao longo da vida é de 80%, contudo, mais de 90% destas infecções resolvem-se espontaneamente através do sistema imunitário inato. Assim, uma pequena proporção de mulheres desenvolve lesões precursoras ou malignas.(15)
O pico de incidência da infecção por HPV ocorre aos 20 anos de idade, talvez devido à maior imaturidade do epitélio cervical em adolescentes e jovens adultas,(15) podendo contribuir para a maior susceptibilidade à persistência da infecção, a Gardnerella Vaginalis nos microbiomas do tipo CST IV.(16) Parece evidente a importância do microbioma vaginal como fator de proteção ou persistência do HPV com consequentes lesões e desenvolvimento do câncer cervical.(15)
Um maior ratio do isómero L em relação ao isómero D nos CST III e IV provoca uma indução de uma metaloproteinase da matriz extracelular (EMMPRIN) e ativação da metaloproteinase da matriz (MMP-8) com efeitos danoso à integridade do epitélio cervical, vindo a aumentar a permissividade dos queratinócitos basais à invasão pelo HPV.(16)
Já o CST-II associa-se à maior rapidez na resolução da infecção pelo HPV, a qual é rica em L. gasseri,(16) responsável pela produção de gasserina, uma bacteriocina com atividade protetora contra bactérias Gram-positivas e Gram-negativas.(15,16) L. crispatus e L. reuteri também produzem gasserina,(15) assim como as bacteriocinas, lactocinas e crispasinas.(21)
Microbiota vaginal dominada por L. crispatus apresenta o pH vaginal mais baixo, por ser esta espécie uma das maiores produtoras de ácido láctico,(21) inibindo a colonização por outras espécies, por isso está associado a menores taxas de infecções sexualmente transmissíveis (ISTs), incluindo o HPV.(15,16)
Mulheres HPV positivas apresentam maior diversidade bacteriana em relação a mulheres sem HPV, além de menor proporção de lactobacilos,(15,16) assim como consideram a possibilidade da espécie Sneathia ser um marcador microbiológico da infecção por HPV.(15,16)
Mitra e cols constataram que portadoras de lesão intraepitelial de baixo grau (LSIL), lesão intraepitelial de alto grau (HSIL) e carcinoma invasivo/invasor apresentam incidência duas, três e quatro vezes maior de CST-IV, respectivamente quando comparadas com mulheres saudáveis,(15,16) com associação concomitantemente à maior gravidade das lesões a ausência de CST-I, fator que pode ser indício de ação protetora deste CST contra o HPV.(15,16) Ainda o mesmo estudo identificou maior risco para o desenvolvimento de lesões precursoras na combinação entre a presença de Anaerococcus vaginae, Gardnerella vaginalis e Lactobacillus iners com a ausência de Lactobacillus crispatus.(24)
Risco seis vezes superior ao normal de aquisição de LSIL e HSIL associado à escassez de Lactobacillus crispatus e com presença intensa de Atopobium vaginae foi apresentada por Oh e cols.(24)
São crescentes as evidências que associam a maior diversidade microbiana e a redução dos gêneros de lactobacilos, à exceção de Lactobacillus iners à predisposição e à persistência da infecção pelo HPV e à maior gravidade das lesões.(15,16)
Lesões pré-cancerosas e o câncer cervical em estágio inicial ou avançado são pesquisados pelo método de Papanicolaou, que também é útil e importante no reconhecimento das alterações inflamatórias designadas pelo Sistema Bethesda, como alterações celulares reativas,(25) possibilitando avaliar a intensidade da reação inflamatória, acompanhar sua evolução e, em certos casos, determinar o agente causal, (25) assim acrescentando importantes informações que, em algumas circunstâncias, são cruciais para o estabelecimento do diagnóstico.
Sob o efeito persistente de infecções microbianas e reações inflamatórias, tanto as células escamosas quanto colunares podem sofrer alterações degenerativas, geralmente mudanças inespecíficas, mas que auxiliam na interpretação adequada de alterações celulares mais sérias.(25)
As alterações celulares reativas encontradas neste estudo na presença exclusiva de lactobacilos foram a citólise (55%), edema nuclear (67%), cariomegalia (21%), binucleação (40%), micronúcleo (2,5%) e paraqueratose (52%). Esse trabalho quantificou as alterações reativas e considerou como positiva a presença das mesmas, mesmo que em forma bastante escassa, provavelmente o motivo que justifica percentuais elevados em relação à maioria das publicações na área.
A citólise é o resultado da morte celular quando da proliferação incompleta do epitélio escamoso vaginal (células intermediárias), devido ao excesso de lactato presente no microbioma vaginal na presença de lactobacilos. Cerca de 50% das amostras deste estudo apresentaram citólise, e, destes, 63% dessa alteração reativa ocorreu na presença exacerbada de lactobacilos, e em 6% com escassez de microbiota lactobacilar constatou-se exacerbada citólise, fato incomum na rotina laboratorial.
O edema nuclear apresenta o núcleo de uma a duas vezes aumentado em tamanho, porém, às vezes, pode apresentar-se maior, geralmente observadas em células escamosas do tipo superficial ou intermediária. Apesar do aumento do tamanho nuclear, a cromatina é finamente e uniformemente granular e, por não se fazer acompanhar de hipercromasia ou irregularidade da membrana nuclear, não representa uma lesão escamosa significativa para a avaliação de neoplasias.(26) Neste estudo, o edema nuclear apresentou-se com mais frequência associado a outras alterações reativas e apenas em oito (4%) de forma isolada.
Este estudo considerou cariomegalia as células que apresentaram alterações classificadas como ASC-US por Bethesda, que são alterações celulares mais pronunciadas do que as alterações reativas benignas, com marcante aumento nuclear, apresentando variação nuclear e binucleação; contudo, são quantitativas e qualitativamente menos evidentes que LSIL e HSIL, não sendo suficientes para um diagnóstico de neoplasia intraepitelial.(27) Esta alteração não foi observada isoladamente neste estudo, mas concomitantemente a outras alterações celulares.
Binucleação é o resultado da divisão nuclear sem a divisão celular que pode ocorrer quando da regeneração tissular rápida. Considerada como um critério não clássico em citologia para identificação do HPV,(28) neste estudo foi mais frequente concomitante a outras reações celulares, ocorrendo de forma isolada em 1% das amostras.
Em relação ao micronúcleo, estudos ocasionais têm demonstrado aumento da frequência dessa alteração reativa celular no câncer cervical invasivo, sendo sugerido a possibilidade de um score do micronúcleo na esfoliação de células cervicais como um critério adicional para o estabelecimento de risco de câncer.(29) O micronúcleo tem sido usado como biomarcador de dano em cromossomos, instabilidade do genoma e risco de câncer, integrando mutações adquiridas e susceptibilidade genética para mutações.(29) Este estudo verificou a presença de micronúcleo em cinco (2,52%) amostras, o qual não se deu de forma isolada, mas na presença de outras alterações como paraqueratose, edema nuclear, cariomegalia e binucleação.
A paraqueratose é uma alteração reativa benigna causada por irritação crônica, onde as células escamosas aparecem queratinizadas(26) e, às vezes, é observada em associação com infecções por HPV, considerado um achado importante em casos sem fundo inflamatório, caracterizado pela presença de núcleos frequentemente picnóticos e hipercromáticos com citoplasma eosinofílico escuro, geralmente associado a um epitélio escamoso relativamente maduro.
Casos de paraqueratose ou hiperqueratose devem ser reexaminados, pois podem sobrepor uma alteração anormal, como displasia ou carcinoma de células escamosas.(30) Neste estudo foi observado com mais frequência a paraqueratose concomitante com outras alterações celulares como binucleação, cariomegalia, micronúcleo e edema nuclear.
O exame citológico cervical pelo Papanicolaou tem sido a melhor estratégia de saúde pública para a detecção de lesões pré-neoplásicas e neoplásicas e na identificação de alterações citomorfológicas relacionadas ao HPV. Atualmente existe grande preocupação em torno da detecção citológica precoce desta infecção e também com a melhoria do diagnóstico citológico, pois em países em desenvolvimento a triagem citológica vem falhando em promover a redução na incidência de câncer cervical, sendo uma das causas a limitação de sensibilidade do método. Com isto, tem-se estudado a introdução de novos critérios morfológicos denominados não clássicos ou secundários para diagnóstico citológico de HPV.(25)
As alterações celulares reativas não clássicas, de natureza benigna são: aumento nuclear (cariomegalia); binucleação ou multinucleação, ocasionalmente; nucléolos únicos ou múltiplos; o citoplasma pode apresentar policromasia, vacuolização ou halos perinucleares. Muitas vezes um núcleo benigno pode assumir proporções gigantescas com aumento do conteúdo de cromatina, porém sem critério conspícuo de malignidade.(25)
O achado de quatro ou mais dos critérios não clássicos pode ser suficiente para concluir infecção por HPV. Collaço e Pinto preconizam que, para se confirmar a presença do HPV, existe a necessidade de pelo menos dois critérios, sendo que um deles deve ser clássico.(31) Quando observados mais de três critérios não clássicos, pode ser relatada a presença do vírus. (31)
Este estudo verificou a presença de critérios não clássicos de natureza benigna: o edema nuclear, a binucleação e a cariomegalia; além disso, a paraqueratose, que tem sido implicada na presença de HPV, assim como a presença de micronúcleo. A presença de critérios não clássicos, de micronúcleo e de paraqueratose se fizeram presentes em amostras com dois critérios simultaneamente em cinquenta (25%), com três alterações reativas simultâneas em oito (4,0%) e com quatro alterações reativas celulares em quatro (2,0%).
O aprimoramento no diagnóstico citológico de infecção cervical por HPV é de grande importância. As dificuldades diagnósticas e o fato de uma parte das infecções por HPV ser assintomática dificultam as estimativas de prevalência,(26) o que torna recomendável a introdução de critérios não clássicos de HPV a fim de aumentar a sensibilidade do exame citológico.(32)
Franco relata que, com a utilização dos critérios não clássicos associados aos clássicos na leitura de esfregaços cervicovaginais, a detecção de HPV aumentou sensivelmente, sendo que 80,7% dos NIC I, 84,6% dos NIC II, 66,6% dos NIC III e 52,1% dos carcinomas cervicais passaram a apresentar estigmas que sugeriam associação com HPV. (33)
Como a citologia é um método que se baseia nas alterações celulares usualmente associadas à infecção por HPV, às vezes não suficientemente específicas para este agente, casos da infecção viral podem não diferir morfologicamente de reações não específicas ou alterações inflamatórias. (30) Deve-se com isto relacionar que um número razoável de casos previamente selecionados como inflamatórios podem ser considerados, aplicando-se os critérios não clássicos, como infecção subclínica ou latente por HPV.(34)
A tendência mundial é realizar o rastreio do câncer cervical pelo teste HPV com citologia reflexiva nos casos de HPV positivo, e neste caso a inserção dos critérios não clássicos para avaliação dos esfregaços HPV positivo pode aumentar a sensibilidade do teste citológico no acompanhamento clínico.
CONCLUSÃO
Este estudo avaliou amostras cujo microbioma vaginal esteve constituído exclusivamente por lactobacilos na coloração de Gram, tidos como protetores contra agentes agressores externos ao ambiente vaginal. Contudo, a presença de alterações reativas celulares não clássicas foi observada em percentual significativo das amostras trabalhadas.
As alterações reativas celulares consideradas critérios não clássicos pra HPV encontradas nesse trabalho foram edema nuclear, cariomegalia, binucleação e paraqueratose.
Certamente estudos longitudinais se fazem necessários a fim de preencher as lacunas deste estudo, contudo, a reavaliação do valor dos critérios não clássicos a fim de aumentar a sensibilidade dos testes citológicos no rastreio câncer cervical, principal no advento da citologia reflexiva nos teste HPV é digno de reflexão.
Abstract
Objective: Identify predominant cells reactive changes against the inflammatory infiltrate and the lactobacillary vaginal morphotype. Methods: Qualitative descriptive study, calculated by chi-square with 198 samples. Cervicovaginal scrapings were realized by the Papanicolaou, and vaginal pouch fundus secretion to investigate the vaginal microbiota by Gram. Results: Short form of lactobacilli in 186 (93.9%) samples and long in 12 (6.1%). Inflammatory infiltrate by Gram, scarce in 90 (45.45%) and Papanicolaou in 82 (41.04%). Fagocytosis by Gram, scarce in 51 (25.76%). Papanicolaou cells reactive changes: scarce cytolysis (23.74%), moderate nuclear swelling (35.86%), scarce caryomegaly (13.64%), scarce binucleation (35.35%), scarce micronucleus (2.52%) and moderate parakeratosis (23.74%). Significant chi-square between the quantification of inflammatory infiltrate by Gram and Papanicolaou with p = 0.037. 30 (15%) were in the laboratory diagnosis of CV. Non-classical criteria, and micronucleus and parakeratosis present in samples with two criteria simultaneously in 25%, three simultaneous in 4.0% and four simultaneous in 2.0%. Conclusion: Non-classical criteria may increase the sensitivity of cytological tests in the advent of refletive cytology in the HPV tests.
Keywords
Microbiota; Lactobacillus; Papanicolaou test
REFERÊNCIAS
- Andrist LC. Vaginal health and infections. J Obstet Gynecol Neonatal Nurs. 2001 May-Jun;30(3):306-15.
- Hutti MH, Hoffman C. Cytolytic vaginosis: an overlooked cause of cyclic vaginal itching and burning. J Am Acad Nurse Pract. 2000;12 (2):55-7. DOI: 10.1111/j.1745-7599.2000.tb00284.x
- Giraldo PC, Feitoza SBN, Gonçalves AKS, Cornetta MCM, Junior JE, Tristão AR. Resposta imune celular da mucosa vaginal às vulvovaginites. DST – J bras Doenças Sex Transm. 2006;18(4): 263-265.
- Martína R, Soberóna N, Vázquez F, Suáreza JE. La microbiota vaginal: composición, papel protector, etecção y perspectivas terapêuticas. Enferm Infecc Microbiol Clin 2008;26(3):160-7.
- Brolazo EM, Simões JÁ, Nader MSJ, Gregoracci GB, Marconi C. Prevalência e caracterização de espécies de lactobacilos vaginais em mulheres em idade reprodutiva sem vulvovaginite. Rev. Bras. Ginecol. Obstet. [Internet]. 2009 Apr;31(4):189-195. Available from: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100-72032009000400006&lng=en.
- Araújo SR. Citologia Cérvico-Vaginal Passo a Passo: Atlas fotográfico com mais de 690 imagens. 1ª ed. Curitiba: Associação Paranaense de Patologia APP; 2010.
- Cibley LJ, Cibley LJ. Cytolytic vaginosis. Am J Obstet Gynecol. 1991 Oct;165(4 Pt 2):1245-9. DOI: 10.1016/s0002-9378(12) 90736-x
- French JI, McGregor JA. Bacterial vaginosis infections diseases in women. In: Faro S, Soper DE, editors. Infectious diseases in women. Philadelphia: WB Saunders; 2001; 221-39.
- Reddy G, Altaf M, Naveena BJ, Venkateshwar M, Kumar EV. Amylolytic bacterial lactic acid fermentation: a review. Biotechnol Adv. 2008; 26(1): 22-34. DOI: 10.1016/j.biotechadv.2007.07.004
- Brooks GF, Carroll KC, Butel JS, Morse SA, Mietzner TA. Microbiologia médica de Jawetz, Melnick e Adelberg. 25ª. Ed. Porto Alegre: Editora AMGH; 2012.
- Soares R, Vieira-Baptista P, Tavares S. Vaginose citolítica: uma entidade subdiagnosticada que mimetiza a candidíase vaginal. Acta Obstet Ginecol Port [Internet]. 2017 Jun;11(2):106-112. Disponível em: http://www.scielo.mec.pt/scielo.php?script=sci_arttext&pid= S1646-58302017000200007&lng=pt&nrm=iso
- Cerikcioglu N, Beksac MS. Cytolytic vaginosis: misdiagnosed as candidal vaginitis. Infect Dis Obstet Gynecol. 2004;12(1):13-16. doi: 10.1080/10647440410001672139
- Neves JJ, Felczak C, dos Santos KMB, Ito CMS, Machado EP. Prevalência de citólise em preparados cervicovaginais no exame Papanicolaou. In: Anais do 14º CONEX – Conversando sobre Extensão; 2016 jul; Ponta Grossa; Brasil Ponta Grossa: UEPG; 2016.
- Yoshizawa DH, Anjos JF, Machado EP. A presença de binucleação na citopatologia cervical frente à microbiota vaginal. In: Anais do 16º CONEX – Conversando sobre Extensão; 2018 jul; Ponta Grossa; Brasil Ponta Grossa: UEPG; 2018.
- Kyrgiou M, Mitra A, Moscick AB. Does the vaginal microbiota play a role in the development of cervical cancer? Transl Res. 2017 Jan;179:168-182. doi: 10.1016/j.trsl.2016.07.004
- Mitra A, MacIntyre DA, Marchesi JR, Lee YS, Bennett PR, Kyrgiou M. The vaginal microbiota, human papillomavirus infection and cervical intraepithelial neoplasia: what do we know and where are we going next? Microbiome. 2016 Nov 1;4(1):58.
- Shimp L. A vaginal and vulvovaginal disorders. In: Berardi RR, De Simone EM, Newton GD et al. Handbook of nonprescription drugs. 13ª ed. Washington: American Pharmaceutical Association; 2002; 129-147.
- Boyd MA, Antonio MA, Hillier SL. Comparison of API 50 CH strips to whole-chromosomal DNA probes for identification of Lactobacillus species. J Clin Microbiol. 2005 Oct; 43(10): 5309-11. doi: 10.1128/JCM.43.10.5309-5311.2005
- Vaneechoutte M. Lactobacillus iners, the unusual suspect. Res Microbiol. 2017 Nov-Dec;168(9-10):826-836. doi: 10.1016/j.resmic. 2017.09.003.
- Mendes-Soares H, Suzuki H, Hickey RJ, Forney LJ. Comparative functional genomics of Lactobacillus spp. reveals possible mechanisms for specialization of vaginal lactobacilli to their environment. J Bacteriol. 2014 Apr;196(7):1458-70. doi: 10.1128/JB.01439-13
- Ravel J, Gajer P, Abdo Z, Schneider GM, Koenig SS, McCulle SL, et al. Vaginal microbiome of reproductive-age women. Proc Natl Acad Sci USA. 2011;108 Suppl 1:4680-7. doi: 10.1073/pnas. 1002611107.
- de Castro-Sobrinho JM, Rabelo-Santos SH, Figueiredo-Alves RR, Derchain S, Sarian LO, Pitta DR, et al. Bacterial vaginosis and inflammatory response showed association with severity of cervical neoplasia in HPV-positive women. Diagn Cytopathol. 2016 Feb; 44(2):80-6. doi: 10.1002/dc.23388.
- Beghini J, Linhares IM, Giraldo PC, Ledger WJ, Witkin SS. Differential expression of lactic acid isomers, extracellular matrix metalloproteinase inducer, and matrix metalloproteinase-8 in vaginal fluid from women with vaginal disorders. BJOG. 2015;122 (12):1580-5. doi: 10.1111/1471-0528.13072.
- Oh HY, Kim BS, Seo SS, Kong JS, Lee JK, Park SY, et al. The association of uterine cervical microbiota with an increased risk for cervical intraepithelial neoplasia in Korea. Clin Microbiol Infect. 2015 Jul;21(7):674.e1-9. doi: 10.1016/j.cmi.2015.02.026.
- Nayar R, Wilbur DC. The Bethesda System for reporting cervical cytology: definitions, criteria and explanatory notes. 3ª. Ed. Springer editors; 2015.
- Cibas ES, Ducatman BS. Cytology: diagnostic principles and clinical correlates. 4ª Ed. Elsevier; 2014.
- Koss GL, Gompel C. Introdução à citopatologia ginecológica com correlações histológicas e clínicas. 1ª Ed. São Paulo: Rocca; 2006; 66-67.
- Jordão AV, Ruggeri LS, Chiucheta, GIR, Piva S, Consolaro MEL. Importância da aplicação de critérios morfológicos não-clássicos para o diagnóstico citológico de papilomavírus humano. J Bras Patol Med Lab. Rio de Janeiro. 2003;39(1):81-89.
- Nersesyan AK. Possible role of the micronucleus assay in diagnostics and secondary prevention of cervix cancer: a mini review. Cytol. Genet. (2007) 41: 317. https://doi.org/10.3103/S0095452707050106
- Bibbo M, Wilbur DCW. Comprehensive cytopathology: The Bethesda System for Reporting Cervical Cytology. 3ª. Ed. WB. Saunders; 2008.
31.Forney LJ, Ravel J. Community Ecology and the Vaginal Microbiome. Microbial Ecology in States of Health and Disease: Workshop Summary. {livro na internet} (acesso em 15 de out 2018) Disponível em https://www.nap.edu/read/18433/chapter/13
- Vince A, Ivanisevic M, Harni V, Skalko D, Jeren T. Molecular detection of human papillomavirus in women with minor grade cervical cytology abnormalities. J Clin Virol. 2001;20(1-2):91-4.
- Franco EL. Epidemiologia do câncer mamário ginecológico. In: Arao, FS. Tratado de Oncologia Genital e Mamária. São Paulo: Roca; 1995; 3-16.
- Carvalho JJL, Oyakawa NI. Consenso Brasileiro de HPV. 1ª ed. São Paulo: BG Cultural; 2000; 49-57.
Correspondência
Juliane Jagas Neves
Av. General Carlos Cavalcanti, 4748, bairro Uvaranas
84030-900 – Ponta Grossa-PR, Brasil
