Análise qualitativa do teste de fragilidade osmótica para amostras processadas a fresco ou após 24 horas de incubação a 37ºC
Qualitative analysis of the osmotic fragility test for samples processed fresh or after 24 hours of incubation at 37ºC
Alene de Oliveira Quadros1
Lacy Cardoso de Brito Junior2
1 Biomédica, Mestre pelo Programa de Pós-graduação em Análises Clínicas, Universidade Federal do Pará (UFPA).
2 Biomédico, Doutor, Professor Associado III do Instituto de Ciências Biológicas da Universidade Federal do Pará (UFPA).
Instituição: Universidade Federal do Pará (UFPA), Belém, Pará, Brasil.
Recebido em 11/04/2020
Aprovado em 25/06/2021
DOI: 10.21877/2448-3877.202101979
INTRODUÇÃO
O Teste de Fragilidade Osmótica (F.O.) ou Curva de Fragilidade Osmótica ainda hoje é um método de triagem laboratorial muito utilizado para avaliar a resistência ou fragilidade (lise) dos eritrócitos quando submetidos a variações de concentrações osmóticas em cloreto de sódio.(1-9) Principalmente quando outros métodos mais modernos, como o de citometria de fluxo,(10-13) não estão disponíveis de forma ampla em todo o território nacional. Assim, a utilização do teste de F.O., ainda hoje, baseia-se no fato de se tratar de um método simples e de baixo custo, porém que também apresenta pouca precisão em função das muitas variáveis em sua execução, que vão desde erros operacionais na diluição das soluções de cloreto de sódio até a transferência de amostras trocadas no momento da leitura em espectrofotômetro. Além do tempo de execução da técnica, que é exclusivamente manual e exige operador dedicado.(1-4)
Esses são alguns dos fatores determinantes para que muitos laboratórios de rotina brasileiros tenham deixado de oferecer esse teste em seu rol de exames(9,14-16). Assim, uma parcela importante de pacientes deixou de ser assistida de triagem e diagnóstico(7-9,14,15) para anemias de caráter genético (esferocitose hereditária, epilocitose hereditária, estomatocitose hereditária e piropoiquilocitose hereditária)(14,15,17-21) que são associadas a deficiências, qualitativas ou quantitativas, de proteínas de ligação membrana celular e citoesqueleto (complexo juncional), como por exemplo nas anemias por deficiência das proteínas: banda 3, espectrina alfa, espectrina beta, anquirinas, banda 4.1, banda 4.2, demantina, actina, aducina, banda 6 e banda 7.(14,15,17-19,22) Deficiências essas que interferem na integridade, flexibilidade, permeabilidade e/ou deformidade dos eritrócitos quando submetidos a concentrações osmolares diferentes.(14,23)
Nessas condições de deficiência de proteínas do complexo membrana celular/citoequeleto o teste de F.O. pode se apresentar aumentado em anemias, como na esferocítica hereditária,(17-19,21,22) anemia hemolítica não-esferocítica hereditária(2,12,15,19,20,22) e nas hemolíticas adquiridas após envenenamento,(4,6-9,23) por exemplo. Por outro lado, o mesmo teste pode apresentar-se diminuído, por exemplo, nas anemias ferropriva, talassemias,(16,24) doença falciforme e doença da hemoglobina C. Contudo, durante a investigação dessas anemias o teste de F.O. é apenas mais um indicador para a conclusão diagnóstica, sendo necessários outros parâmetros laboratoriais para auxiliar nessa interpretação, como: o hemograma completo onde se observam alterações na concentração de hemoglobina, no hematócrito, no volume corpuscular médio (VCM), na concentração de hemoglobina corpuscular média (CHCM), na amplitude de distribuição dos eritrócitos (RDW) e ainda na análise morfológica do esfregaço sanguíneo, com a presença de diversas formas dos eritrócitos (poiquilocitose); e a contagem de reticulócitos que se apresenta aumentada (reticulocitose).(11,25,26)
Nesse sentido, entre as anemias por deficiência de proteínas do complexo membrana celular/citoequeleto, a mais frequente é a esferocitose hereditária, que apresenta aumento da lise de eritrócitos no teste de F.O., reticulocitose, hemoglobina entre 8 e 13g/dL, VCM < 82fl, CHCM>25g/dL e esferócitos na hematoscopia.(11,12,17-19,21,22,25,26) Assim, nosso objetivo foi analisar de forma qualitativa para qual tipo de processamento de amostras, a fresco ou após incubação a 37oC por 24 horas, o teste de fragilidade osmótica é mais eficiente para uso na rotina de laboratórios de análises clínicas.
MATERIAL E MÉTODOS
Amostras biológicas
Foram incluídos nesse estudo 20 amostras de sangue periférico de pacientes com idades entre 3 meses e 75 anos que foram referenciados a um laboratório de análises clínicas particular de Belém-Pará, no período de agosto e setembro de 2018, para a realização de teste de Fragilidade Osmótica (F.O.) após consulta com seu médico hematologista que, diante das condições clínico-laboratoriais apresentadas em consulta, deliberou pela complementação diagnóstica com a solicitação do teste de F.O. isoladamente (n=6) ou em associação com o hemograma (n=14). Sem, contudo, quaisquer informações clínicas adicionais. Cada amostra era composta por dois tubos com 5,0mL cada de sangue periférico anticoagulados com heparina, para posterior procedimento operacional padrão (POP).
Aspectos éticos
Como o estudo foi realizado apenas com amostras da rotina de Teste de Fragilidade Osmótica de pacientes que procuraram espontaneamente o laboratório, sem o contato direto ou aplicação de qualquer questionário aos sujeitos da pesquisa, os autores da pesquisa assinaram um termo de responsabilidade de guarda e sigilo dos dados junto à direção do referido laboratório, conforme prevê a Resolução 466/2012 do Conselho Nacional de Saúde do Ministério da Saúde do Brasil.
Teste de fragilidade osmótica
Para o teste de fragilidade osmótica, as soluções de uso de cloreto de sódio (NaCl) foram confeccionadas a partir de uma solução estoque de NaCl, concentrada a 10% e tamponada em tampão fostato à pH 7,4, da qual foram feitas diluições, em água deionizada, para a confecção dos 13 frascos de 100mL de soluções de NaCl nas concentrações de 0,90%; 0,80%; 0,75%; 0,65%; 0,60%; 0,55%; 0,50%; 0,45%; 0,40%; 0,35%; 0,30%, 0,20%; e 0,10%.
Para a verificação da diferença qualitativa entre as amostras do teste de F.O. foram identificados 13 tubos secos de vidro (medindo 16×100), em duplicata, aos quais foram incluídos 5mL de solução de NaCl em diferentes concentrações seguido da adição de 20µL da amostra por tubo de cada paciente, tanto para as amostras a fresco como para as amostras processadas após incubação a 37°C em banho-maria por 24 horas. Posteriormente, esses tubos foram homogeneizados e postos em repouso por 30 minutos, em seguida centrifugados por 5 minutos a 3.000rpm. O sobrenadante de cada tubo foi transferido para cubetas para leitura em espectrofotômetro de luz com filtro de 540nm de comprimento de onda, para obtenção das concentrações do grau de hemólise de cada tubo e confecção das curvas de fragilidade osmótica.
Hemograma
As amostras que apresentavam solicitação médica de teste de F.O. e hemograma (n=14) foram submetidas a análise no equipamento de automação em hematologia BC6000® da marca Mindray, com posterior confecção de esfregaços sanguíneos, coloração das lâminas com corante de May Grunwald®, da empresa Merck, e análise morfológica por microscopia de luz comum com objetiva de imersão por profissional especializado do referido laboratório.
Análise estatística
Todos os dados foram tabulados e submetidos a métodos de estatística descritiva para definições de média, desvio padrão, mediana, e valores de mínimo e máximo, além de teste não paramétrico, teste Extato de Fisher, para amostras independentes através do uso do software Bioestat 5.0. Considerou-se como significativo os valores de p ≤ 0,05.
RESULTADOS
Das 20 amostras analisadas, 17/20 (85%) eram de pacientes do gênero feminino. Quanto à idade, 5/20 (25%) tinham entre 3 meses e 7 anos; 1/20 (5%) tinha 13 anos; 6/20 (30%) tinham entre 25 a 41 anos; e 8/20 (40%) tinham idades entre 52 a 75 anos. Desses pacientes apenas 14/20 realizaram hemograma juntamente com o teste de F.O., onde observou-se que os mesmos apresentaram medianas de: 11,0g/dL de hemoglobina; 3.925×106/mm3 de eritrócitos; 86,0fl de VCM; e de 33,0fl de CHCM.
No que tange aos resultados dos testes de F.O. para as amostras desses pacientes observou-se que em 9/20 (45%) dos casos o teste de F.O. foi concordante ao mesmo tempo para amostras a fresco e após incubação a 37°C. Sendo 6/9 concordantes quanto à normalidade (Grupo 1); 1/9 concordantes quanto à resistência (Grupo 2); e 2/9 concordantes quanto à fragilidade (Grupo 3) dos eritrócitos submetidos às várias concentrações de NaCl (Quadro 1).
Para os demais 11/20 (55%) casos, os resultados do teste de F.O. foram discordantes quanto às amostras processadas a fresco ou após incubação a 37°C. Para essas amostras observou-se que: para 8/11 (72,7%) amostras houve resultado de fragilidade dos eritrócitos à hemólise no teste de F.O. processadas a fresco e curva normal (sem hemolise) para amostras processadas após incubação a 37oC por 24 horas. O mesmo foi observado para 3/11 (22,3%) amostras que apresentaram curva normal (sem hemólise) dos eritrócitos no teste com amostras processadas a fresco e resistência à hemólise dos eritrócitos para as mesmas amostras processadas após incubação a 37oC por 24 horas.
Diante desses resultados foi aplicado teste Extato de Fisher, o qual mostrou não haver diferença estatística (p =0,5743) entre os resultados das amostras processadas a fresco ou após incubação a 37°C para resultados iguais (normal ou alterado) ou discordantes. Na Figura 1 são apresentadas as curvas dos testes de F.O. para amostras a fresco ou incubadas a 37°C (linhas em vermelho) quanto à normalidade (1A e 1B), fragilidade (1C e 1D) ou resistência à hemólise dos eritrócitos testados (1E e 1F).
Quadro 1 – Quadro de distribuição dos pacientes submetidos a teste de fragilidade osmótica que tiveram resultados concordantes ou discordantes para amostras processadas imediatamente (a fresco) ou após incubação por 24 horas a 37ºC.
| Grupos | Pacientes | Hb
(g/dL) |
Eritroc
(X 106/mm3) |
VCM
(fl) |
CHCM
(fl) |
AF | 37° | |
| Concordantes
(n=9) |
Normal
(n=6) |
A-04 | 11,7 | 3.700 | 94,3 | 33,5 | N | N |
| A-05 | 11,0 | 3.720 | 86,3 | 34,3 | N | N | ||
| A-07 | 12,0 | 3.850 | 93,2 | 33,4 | N | N | ||
| A-08 | 11.8 | 4.250 | 82,1 | 33,8 | N | N | ||
| A-09 | – | – | – | – | N | N | ||
| A-13 | 11,3 | 3.930 | 83,2 | 34,6 | N | N | ||
| Resistentes (n=1) | A-06 | 11,7 | 5.220 | 71,6 | 32,0 | R | R | |
| Frágeis
(n=2) |
A-16 | – | – | – | – | F | F | |
| A-18 | 11,0 | 3.920 | 86,0 | 32,6 | F | F | ||
| Discordantes
(n=11) |
(n=8) | A-01 | – | – | – | – | F | N |
| A-02 | 9,0 | 3.050 | 90,2 | 32,7 | F | N | ||
| A-03 | 13,0 | 4.360 | 90,6 | 32,9 | F | N | ||
| A-11 | – | – | – | – | F | N | ||
| A-14 | 10,3 | 3.230 | 95,0 | 33,6 | F | N | ||
| A-15 | 10,7 | 3.580 | 89,4 | 33,4 | F | N | ||
| A-19 | – | – | – | – | F | N | ||
| A-20 | 12,3 | 4.180 | 81,6 | 36,1 | F | N | ||
| (n=3) | A-10 | 11,0 | 5.810 | 58,7 | 32,3 | N | R | |
| A-12 | 9,6 | 4.840 | 65,7 | 30,2 | N | R | ||
| A-17 | – | – | – | – | N | R | ||
Legenda: Amostra a fresco (AF); Amostra analisada após incubação por 24 horas a 37oC (37oC); Hemoglobina (Hb); Eritrócitos (Eritroc); Volume Corpuscular Médio (VCM); Concentração de Hemoglobina Corpuscular Médio (CHCM); gramas por decilitros (g/dL); fentolitros (fl); Teste de Fragilidade Osmótica: Normal (N), com eritrócitos frágeis (F), ou com eritrócitos resistentes (R) a hemólise
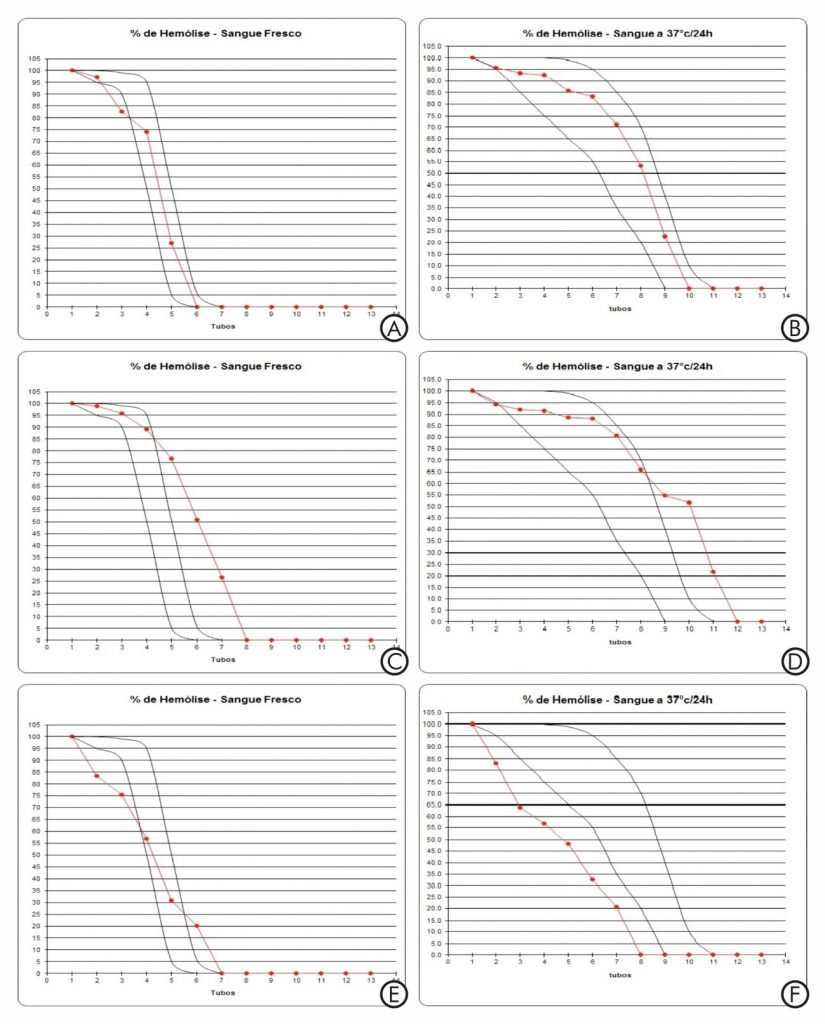
Figura 1. Curvas dos testes de fragilidade osmótica correspondentes a amostras normais (A e B), frágeis (C e D) e resistentes (E e F) processadas a fresco ou após incubação por 24 horas a 37°C.
Legenda: Curvas em preto (referência de normalidade); Curvas em vermelho (resultantes das amostras testadas); Escala do eixo X – concentrações crescentes de NaCl sendo (1) a menor concentração (0,1% de NaCl) e (13) a maior concentração de NaCl (0,9%); Escala do eixo Y – grau de hemólise.
As anemias hereditárias por deficiência de proteínas de ligação entre membrana celular e citoesqueleto, embora sejam mais frequentemente diagnosticadas na primeira infância, por vezes podem ser motivo de investigação em indivíduos adultos ou mesmo idosos, isso porque alguns desses pacientes podem passar parte da vida como assintomáticos ou portadores de quadros leves de anemia em um primeiro momento e em outro apresentar episódios hemolíticos graves, como ocorre na eliptose hereditária e a ovalocitose hereditária.(21) Em nosso estudo observamos que 40% (8/20) dos pacientes que realizaram o teste de F.O. para pesquisa desses tipos de anemias encontravam-se na faixa etária de 52 a 75 anos, sugerindo assim a importância de um prescritor experiente e atento à pesquisa dessas anemias mesmo em adultos ou idosos.
Em relação à técnica convencional para o teste de fragilidade osmótica(1-4) essa inclui a análise de uma amostra de sangue periférico processada a fresco e outra processada após incubação por 24 horas em banho-maria a 37oC, sendo essa última a que apresenta os melhores resultados na caracterização da hemólise em pacientes portadores de esferocitose hereditária, ou de outras formas de anemia hemolítica por alteração de proteínas de ligação do complexo juncional membrana celular e citoesqueleto, em função de expor os eritrócitos deficientes da amostra a estresse metabólico por 24 horas, em condições extracorpóreas, o que acentua as deficiências proteicas dos eritrócitos e facilita a interpretação da curva.(14,15,17-21)
Em nosso estudo também observamos que a análise das amostras após incubação a 37oC por 24 horas foi mais assertiva que a análise das amostras a fresco para o teste de fragilidade osmótica. Contudo, como já apresentado, não houve diferença estatística para as amostras processadas a fresco ou após incubação a 37°C.
A maior assertividade do teste de fragilidade osmótica para amostras analisadas após incubação por 24 horas em banho-maria a 37oC, contudo, ganha ainda maior importância quando analisada em associação com a concentração de hemoglobina, volume corpuscular médio (VCM) e coeficiênte de hemoglobina corpuscular médio (CHCM).(11,12,25,26) Principalmente quando ocorrem discordâncias entre os resultados do teste de F.O. para amostras analisadas a fresco ou após incubação por 24 horas a 37oC, como foi observado, por exemplo, nos pacientes A6, A10 e A12, os quais apresentavam redução de VCM e resistência dos eritrócitos nas amostras testadas ao teste de F.O. após incubação por 24 horas em banho-maria a 37oC. O mesmo foi observado para os pacientes que apresentavam VCM normal e teste de F.O. também normal após incubação por 24 horas em banho-maria a 37oC .
Ainda assim muitos interferentes são associados à técnica convencional do teste de F.O., de modo que muitos foram os esforços traçados ao longo da última década no sentido de criar uma metodologia que desse a esse teste maior especificidade e sensibilidade. Assim foi desenvolvida a metodologia de citometria de fluxo que utiliza eosina-5-maleimida, um corante fluorescente que reage covalentemente com a lisina-430 na primeira alça extracelular de domínio N-terminal da proteína banda-3, que por sua vez interage com a anquirina e a proteína 4.2 que interagem com o citoesqueleto celular através da espectrina e estabilizam a bicamada lipídica da membrana. Desta forma, essa metodologia mede a proporção de eritrócitos residuais após a indução de hemólise, por citometria de fluxo, a partir da ausência ou diminuição da expressão de proteínas da membrana dos eritrócitos que causa ruptura da rede proteica do citoesqueleto e a redução da expressão normal da proteína banda-3 na membrana dos mesmos resultando em redução da ligação da eosina-5-maleimida com a proteína banda-3 e, consequentemente, menor emissão de fluorescência, caracterizando assim a deficiência dessas proteínas.(10-13)
El Gendy, Hassab, Ghanem, Lewis e Nawar,(12) em seus estudos com portadores de esferocitose hereditária (ES), e utilizando o teste de F.O. convencional e por citometria de fluxo como metodologias diagnósticas, mostraram que: quando o teste de F.O. foi o convencional, 20% dos pacientes com ES foram negativos para amostras processadas a fresco e depois todos foram positivos após incubação de 24 horas, comprovando a importância da realização da incubação para melhorar a sensibilidade do teste; e que quando a execução do teste de F.O. foi por citometria de fluxo, houve maior vantagem no diagnóstico dos casos leves de EH, menor tempo de execução e resultado final da técnica (2 a 3 horas), e menor interferência no resultado do teste mesmo quando os eritrócitos estavam diminuídos de tamanho, mas sem deficiência de proteínas do complexo membrana celular/citoesqueleto, como por exemplo na deficiência de ferro.
Isto sugere, assim, que o teste de F.O. por citometria de fluxo pode ser usado como o primeiro teste de triagem para EH, desde que a morfologia eritrocitária e a história familiar também sejam levadas em consideração.(10-13) Contudo, a disponibilidade da técnica de citometria de fluxo para o diagnóstico de anemias por deficiência de proteínas do complexo membrana celular/citoequeleto não é a realidade de muitos laboratórios espalhados no imenso território brasileiro.
Assim, entendemos que mesmo o teste de F.O. convencional ainda apresentando limitações em relação à metodologia por citometria de fluxo, trata-se de um método simples, de baixo custo e de grande importância para triagem e diagnóstico de portadores de anemias por deficiência de proteínas do complexo membrana celular/citoesqueleto.(7-9,14,15,17-21) Contudo, na nossa opinião, de modo a agilizar o teste de F.O. convencional e melhorar a sua especificidade, a técnica deveria ser realizada apenas para amostras processadas após a incubação por 24 horas a 37oC em banho-maria.
CONCLUSÃO
O teste de F.O. convencional se mostrou mais eficiente, qualitativamente, quando a amostra testada foi analisada após incubação por 24 horas a 37oC em banho-maria. Contudo, não houve diferença estatística para resultados processados a fresco ou após incubação a 37°C. Ainda assim, nossa opinião é que o teste de F.O. para amostras a fresco deveria ser abolido da rotina dos laboratórios de análises clínicas, garantindo assim maior segurança e confiabilidade dos resultados.
AGRADECIMENTO
Ao Laboratório de Patologia Clínica Dr Paulo C. Azevedo pelo apoio logístico das Dras Camila Brito e Monyque Ribeiro pelas contribuições durante a realização deste estudo.
REFERÊNCIAS
- Ryall RG, Chittleborough AJ, Kane A. A microtechnique for measuring red cells osmotic fragility of infants. J. Clin. Pathol. 1978;31:878-882.
- Caire AC, Gileno MC. Padronização e aplicação da curva de fragilidade osmótica auxílio diagnóstico de anemias. Rev. Bras. Multidisciplinar. 2012; 15(2):49-58. doi.org/10.25061/2527-2675/ReBraM/2012.v15i2.88.
- Massaldi HA, Richieri GV, Mel HC. Osmotic Fragility Model For Red Cell Populations. Biophys. J. 1988;54:301-308.
- Walski T, Chludzinska L, Komorowska M, Witkiewicz W. Individual osmotic fragility distribuition: A new parameter for determination of the osmotic properties of human blood cells. Biomed Res Int, 2014, 2014:1-6. doi: 10.1155/2014/162102.
- Bactor FN, Dorion RP. Malaria and hereditary elliptocytosis. Am. J. Hematol. 2008;83(9):753.
- Maiworm AI, Presta GA, Santos-Filho SD, De Paoli S, Giani TS, Fonseca AS, Bernardo-Filho M. Osmotic and morphologic effects on red blood cell membrane: action of an aqueous extract of Lantana camara. Rev. Bras. Farmacogn. 2008;18(1):42-46.
- Duarte AE, Waczuk E, Roversi K, da Silva MA, Barros LM, da Cunha FA, de Menezes IR, da Costa JG, Boligon AA, Ademiluyi AO, Kamdem JP, Rocha JB, Burger ME. Polyphenolic composition and evaluation of antioxidant activity, osmotic fragility and cytotoxic effects of Raphiadon echinus (Ness & Mart.) Schauer. Molecules. 2016;21(1):2. doi.org/10.3390/molecules21010002
- Seibert CS, Guerra-Shinohara EM, Carvalho EG, Marques EE. Red blood cell parameters and osmotic fragility curve of Colossoma macropomum (Pisces, Osteichthyes, Mileinae) in captivity. Acta Scientiarum. 2001;23(2):515-520.
- Rodrigues HG, Batista MTA, Fonseca LC, Aversi-Ferreira TA. Efeitos de pesticidas sobre a fragilidade osmótica de eritrócitos – Uma breve revisão. Biotemas. 2009;22(1):7-16.
- Warang P, Gupta M, Kedar P, Ghosh K, Colah R. Flow cytometric osmotic fragility – An effective screening approach for red cell membranopathies. Cytometry Part B 2011; 80B: 186–90. https://doi.org/10.1002/cyto.b.20583
- Bolton-Maggs PH, Langer JC, Iolascon A, Tittensor P, King MJ; General Haematology Task Force of the British Committee for Standards in Haematology. Guidelines for the diagnosis and management of hereditary spherocytosis–2011 update. Br J Haematol. 2012;156(1):37-49. doi: 10.1111/j.1365-2141.2011.08921.x.
- El Gendy W, Hassab HM, Ghanem AM, Lewis IM, Nawar SM. The application of eosin maleimide-binding test in the diagnosis of hereditary spherocytosis among undiagnosed cases of chronic hemolytic anemia in children. Egypt J Haematol 2014; 39: 109-13. doi: 10.4103/1110-1067.148229
- Park SH, Park CJ, Lee BR, et al. Comparison study of the eosin-5′-maleimide binding test, flow cytometric osmotic fragility test, and cryohemolysis test in the diagnosis of hereditary spherocytosis. Am J Clin Pathol, 2014;142;474-484. doi: 10.1309/AJCPO7V4OGXLIIPP.
- Zaidi AU, Buck S, Gadgeel M, Herrera-Martinez M, Mohan A, Johnson K, Bagla S, Johnson RM, Ravindranath Y. Clinical Diagnosis of Red Cell Membrane Disorders: Comparison of Osmotic Gradient Ektacytometry and Eosin Maleimide (EMA) Fluorescence Test for Red Cell Band 3 (AE1, SLC4A1) Content for Clinical Diagnosis. Front Physiol. 2020. 19;11:636. doi: 10.3389/fphys.2020.00636.
- An X, Mohandas AND. Disorders of red cell membrane. British J. Haematol. 2008;141(3):367-75.
- Penman BS, Gupta S, Weatherall DJ. Epistasis and the sensitivity of phenotypic screens for beta thalassemias. British J. Haematol. 2015;169(1):1117-1128.
- Da Costa L, Galimand J, Fenneteau O, Mohandas N. Hereditary spherocytosis, and other red cell membrane disorders. Blood Rev. 2013;27(4):167-78.
- Reis DB, Eid KAB, Pinto LM, Neumann MMA. Esferocitose hereditária no período neonatal: relato de caso e revisão de literatura. Rev. Cien. Med. 1996;5(3):119-23.
- Barcellini W, Bianchi P, Fermo E, Imperiali FG, Marcello AP, Vercellati C, Zaninoni A, Zanella A. Hereditary red cell membrane defects diagnostic and clinical aspects. Blood Transfus. 2011;9(3):274-77.
- Narla J, Mohandas N. Red cell membrane disorders. Int. J. Lab. Hem. 2017;39(1):47-52. doi: 10.1111/ijlh.12657.
- Denadai R, Capelluppi-Tófano VA. Eliptocitose hereditária diagnosticada em paciente idosa. Relato de caso. Rev. Soc. Bras. Clin. Med. 2012;10(5):450–454.
- Pinto WJ, Marialva JE, Cardoso SMG, Areas MA. Topologia das principais proteínas da membrana e do citoesqueleto eritrocitário. Rev. Ciênc. Med. Biol. 2013;12(1):106-120.
- Khoshbin AR, Mohamadabadi F, Vafaeian F, Babania A, Akbarian S, Khandozi R, Sadrebazaz MA, Hatami E, Joshaghani HR. The effect of radiotherapy and chemotherapy on osmotic fragility of red blood cells and plasma levels of malondialdehyde in patients with breast cancer. Rep. Pract. Oncol. Radiother. 2015;20(4):305-308.
- Kattamis C, Efremov G, Pootrakul S. Effectiveness of one tube osmotic fragility screening in detecting beta-thalassaemia trait. J. Med. Genet. 1981;18(4):266–70.
- King MJ, Zanella A. Hereditary red cell membrane disorders and laboratory diagnostic testing. Int J Lab Hematol 2013; 35: 237-43.
- Crisp RL, Gammella D, Solari L, Rapetti MC, Schvartzman G, Donato H. Utilización de sangre capilar: Un aporte para el diagnóstico precoz de esferocitosis hereditaria. Hematología 2013; 17: 8-14.
Correspondência
Prof Dr Lacy Cardoso de Brito Júnior
Universidade Federal do Pará
Instituto de Ciências Biológicas
Laboratório de Patologia Geral –
Imunopatologia e Citologia (sala 303).
Av. Augusto Corrêa n°1.
CEP – 66075900, Bairro Guamá.
Belém, Pará, Brasil
Tel.:55 91 3201 71 02
