Avaliação comparativa entre os novos métodos e os métodos tradicionais de diagnósticos laboratoriais para as hemofilias: revisão integrativa
Comparative evaluation between the new methods and the current methods of laboratory diagnosis for hemophilia: integrative literature review
Luiza de Marilac Leão Rodrigues1
Gabriela de Sousa Lobo1
Symara Rodrigues-Antunes2
Danielle Cristinne Azevedo Feio2
1Biomédica. Faculdade Metropolitana da Amazônia – Belém-PA, Brasil.
2Biomédica. Doutora em Neurociências e Biologia Celular pela Universidade Federal do Pará. Professora – Faculdade Metropolitana da Amazônia- Belém- PA, Brasil.
Instituição: Faculdade Metropolitana da Amazônia – Belém-PA, Brasil.
Recebido em 19/05/2018
Artigo aprovado em 23/08/2018
DOI: 10.21877/2448-3877.201800706
Resumo
A hemofilia é uma coagulopatia hereditária ligada ao cromossomo X, causada pela deficiência dos fatores VIII (hemofilia A) e IX (hemofilia B). Essa doença acomete cerca de 1:10.000 nascidos vivos do sexo masculino na hemofilia A e de 1:40.000 na hemofilia B no mundo. Este estudo buscou avaliar os métodos atuais e os novos métodos de diagnóstico laboratoriais em fase de testes para detecção e acompanhamento dos pacientes com hemofilia. Realizou-se um estudo de revisão integrativa da literatura mediante busca de artigos indexados, utilizando as plataformas de dados PubMed e SciELO. A partir da pesquisa realizada foram selecionados oito artigos, categorizados em: Técnica Inovadora; Diagnóstico molecular; Método modificado e Potencialização de sensibilidade. Com essas novas técnicas serão possíveis, com maior especificidade, a quantificação do fator VIII, identificação e diferenciação de anticorpos inibidores de anticorpos não inibidores; análise dos genes FVIII, FIX e outros genes da hemostasia, por técnicas de Citometria de Fluxo e o Biossensor de Ressonância de Plasmon de Superfície; detecção de deleções, inserções e mutações conhecidas ou novas através do Sequenciamento de Nova Geração, podendo esses resultados serem correlacionados com outros testes para melhor definição dos fenótipos clínicos da doença.
Palavras-chave
Hemofilia; Diagnóstico; Inovação
INTRODUÇÃO
A hemofilia é uma doença genética recessiva ligada ao cromossomo X, que acomete principalmente os homens, sendo as mulheres principalmente portadoras desse distúrbio da coagulação sanguínea.(1) A hemofilia ocorre devido a mutações nos genes F8 e F9, responsáveis pela síntese dos fatores VIII (FVIII) e IX (FIX), respectivamente.(2) A ausência ou diminuição do fator VIII causa a hemofilia A (HA), que é dividida em hereditária ou adquirida (presença de autoanticorpos), enquanto que a deficiência do fator IX é responsável pela hemofilia B (HB).(3)
As manifestações clínicas da doença podem ser classificadas em leve, moderada ou grave, dependendo do nível dos fatores VIII ou IX.(4) Cerca de 30% dos pacientes com hemofilia A, na sua forma grave, acabam desenvolvendo anticorpos inibidores contra o FVIII, o que pode consequentemente levar a complicações significativas para o tratamento dos hemofílicos.(5)
O diagnóstico atual das hemofilias baseia-se na quantificação da atividade coagulante dos fatores VIII (FVIII:C) e IX (FIX:C) pelo método coagulométrico e quantificação do FVIII:C pelo método cromogênico.(6) O ensaio Bethesda por Nijmegen(7) é realizado para verificar se há presença de aloanticorpos ou autoanticorpos, porém esses métodos para o diagnóstico das hemofilias proporcionam sensibilidade limitada, visto que há uma determinada barreira diante da quantificação dos níveis dos fatores VIII ou IX e dos anticorpos inibidores. Muitos métodos vêm sendo testados, como, por exemplo, o Biossensor de Ressonância de Plasmon de Superfície (SPR) e a Citometria de Fluxo (CF), usados para análise de anticorpos inibidores, e o Sequenciamento de nova geração (NGS), que serve para analisar e detectar possíveis alterações nos genes dos fatores VIII e IX.(8-12)
Por este motivo reconhece-se a necessidade de revisão sobre o tema, realizando-se um cuidadoso levantamento sobre os métodos diagnósticos disponíveis para a hemofilia. Sendo assim, o objetivo deste trabalho foi realizar um levantamento bibliográfico com posterior avaliação dos métodos diagnósticos, comparando-os com os diagnósticos atuais, a fim de apontar possíveis técnicas laboratoriais mais promissoras para detecção e acompanhamento dos hemofílicos.
MATERIAL E MÉTODO
O presente estudo constitui-se de uma revisão integrativa da literatura, norteada pela seguinte pergunta “Quais são os possíveis novos métodos de diagnóstico para hemofilia”? O levantamento de dados ocorreu no mês de janeiro de 2017, incluindo artigos publicados nos últimos seis anos (2011-2016). As bases de dados científicas utilizadas foram PubMed e SciELO (Scientific Eletronic Library Online), utilizando os descritores em português: “diagnóstico; técnicas; hemofilias; novas; anti-FVIII”, e os descritores em inglês: “diagnostic; techniques; haemophilia; new, anti-FVIII“, organizados em “novas técnicas diagnóstico hemofilia”, “diagnóstico hemofilia anti-FVIII”, “new techniques diagnostic haemophilia” e “diagnostic haemophilia anti-FVIII“.
A busca e a seleção dos artigos foram realizadas por dois revisores de forma independente e um terceiro revisor, sempre que não houvesse consenso na inclusão/exclusão de algum trabalho.
Os parâmetros para inclusão de trabalhos seguiram os seguintes critérios: trabalhos que abordassem sobre novos métodos de diagnóstico para as hemofilias; métodos de diagnósticos em fase de testes laboratoriais e clínicos; artigos que avaliassem os métodos de diagnósticos atuais para as hemofilias; artigos completos e estudos realizados em humanos. Já como critérios de exclusão foram adotados os seguintes parâmetros: artigos publicados há mais de seis anos ou que não apresentassem novos métodos de diagnóstico, não estivessem em fase de testes laboratoriais, artigos de revisão e em outros idiomas, além do português e inglês.
RESULTADOS
A partir da pesquisa realizada nas bases de dados, foram encontrados os seguintes resultados no PubMed, utilizando os diferentes descritores: “novas técnicas diagnóstico hemofilia” e “diagnóstico hemofilia anti-FVIII” 0 artigos; “new techniques diagnostic haemophilia” 116 artigos; “diagnostic haemophilia anti-FVIII” 22 artigos, que somaram 138 artigos, sendo três repetidos e, no final, totalizando 135 artigos. Na base de dados SciELO não foram encontrados artigos com esses descritores supracitados.
Após aplicação dos critérios de inclusão e exclusão, foram selecionados para esta revisão oito artigos, todos de perfil de ensaio clínico. Destes, dois abordavam o diagnóstico molecular, um utilizava método de diagnóstico modificado, três fizeram uso de mais de uma técnica para avaliar a sensibilidade do teste e dois artigos abordavam a aplicação de técnicas inovadoras.
Os artigos foram distribuídos a partir da classificação dos testes nas seguintes categorias: Técnica Inovadora; Diagnóstico molecular; Método modificado e Potencialização de sensibilidade, como pode ser observado na Figura 1.
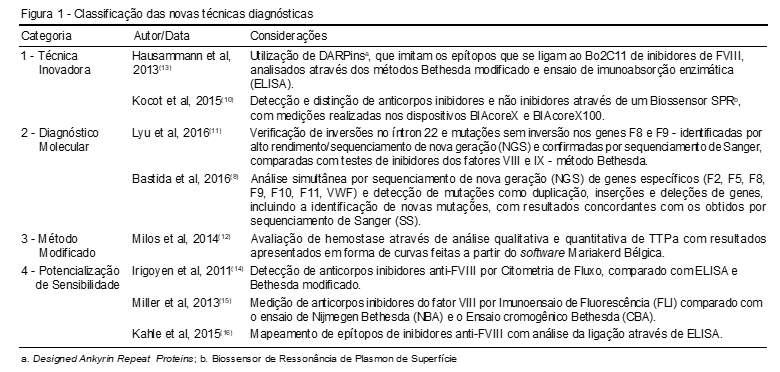
A distribuição percentual dos artigos nos novos possíveis métodos de diagnóstico, como visto na classificação de categorias, foi de 12,5% para o método modificado, 25% tanto para técnicas inovadoras como para o diagnóstico molecular e 37,5% para a potencialização de sensibilidade.
DISCUSSÃO
Devido à necessidade de se desenvolverem testes diagnósticos com maior sensibilidade para a detecção e acompanhamento de portadores e indivíduos doentes com hemofilia, esta revisão buscou reunir estudos em fase de testes clínicos que abordem novas técnicas de diagnóstico. Essas técnicas abordadas buscam identificar anticorpos inibidores, avaliar os genes da hemostasia e criar marcadores para os antígenos ligados ao FVIII e epítopos ligados aos anticorpos anti-FVIII.
Indivíduos que possuem hemofilia A adquirida ou hereditária podem desenvolver anticorpos inibidores contra o fator VIII de coagulação.(17) Os anticorpos inibidores são responsáveis por neutralizar a atividade pró-coagulante do FVIII, e isso ocorre devido ao bloqueio funcional dos epítopos da proteína, comprometendo o tratamento dos pacientes hemofílicos.(18) Para melhor compreensão dos estudos selecionados, estes foram subdivididos em categorias, sendo eles discutidos entre si e com os métodos atualmente utilizados para diagnóstico das hemofilias nas seções seguintes do presente artigo.
Categoria 1: Técnica Inovadora
Kocot et al.(10) desenvolveram o Biossensor de Ressonância de Plasmon de Superfície (SPR), que avalia a presença de aloanticorpos e de autoanticorpos. Para realização do teste, o FVIII foi colocado na superfície do Biossensor, depois a amostra do paciente e em seguida adicionou-se o fator IX ou fator Xa ativado (FXa), formando o complexo Tenase. A não ocorrência da ligação significa que há presença de anticorpos inibidores na amostra do paciente. O estudo foi realizado em 16 pacientes com anticorpos inibidores (positivo nos testes de ELISA e Bethesda modificado), cinco pacientes com anticorpos não inibidores (positivo no ELISA e negativo no Bethesda modificado) e 12 pacientes controles saudáveis. As medições foram realizadas a partir dos dispositivos BIAcoreX e BIAcoreX100. O FIX apresentou sensibilidade e especificidade diagnóstica de 100%, enquanto que o FXa apresentou sensibilidade de 88,2% e especificidade de 100%. Ao comparar com o método de ELISA, este apresentou sensibilidade de 87,5% e especificidade de 76,6%, utilizando-se como método de referência o Bethesda modificado.
Em busca de aumentar a sensibilidade na detecção de anticorpos inibidores, Hausammann et al.(13) substituíram o antígeno FVIII por proteínas de ligação artificiais, conhecidas como DARPins (Designed Ankyrin Repeat Proteins), que foram selecionadas através do Ribosome Display. Bibliotecas N2C e N3C DARPin foram utilizadas para encontrar ligantes à região Bo2C11 do anticorpo anti-FVIII. Os DNAs codificadores de DARPin foram purificados, sequenciados e as reações de PCR (Polymerase Chain Reaction) analisadas com o software de Análise de Sequência v5.2. A resistência de ligação de DARPins purificados foi analisada por Ressonância de Plasmon de Superfície (SPR) no Biacore X100, onde se observou que os DARPins diméricos apresentaram aumento de ligação em cerca de mil vezes em relação aos DARPins monoméricos. Quando analisadas por ELISA, observou-se aumento de ligação a Bo2C11 dos DARPins diméricos eBo01-38 e eBo38-38 em relação aos DARPins monoméricos eBo01 como eBo38. Conclui-se que os DARPins podem imitar epítopos de FVIII utilizando o anticorpo monoclonal inibitório humano anti-FVIII na região Bo2C11. Os DARPins monoméricos podem neutralizar a ligação de Bo2C11 a FVIII e os DARPins diméricos apresentam uma neutralização cem vezes maior.
O método dos DARPins tem como objetivo isolar os epítopos permitindo a criação de assinaturas dos anticorpos anti-FVIII de pacientes com hemofilia A, visto que a ligação pode ser observada tanto pelo SPR quanto pelo método de ELISA. A neutralização da ligação de Bo2C11 pelos DARPins também deve ser alvo de novos estudos. Essa nova técnica poderá no futuro fazer a distinção de anticorpos inibidores de não inibidores. O formato molecular dos DARPins pode ser livremente escolhido, criando uma ampla série de proteínas de fusão e conjugados, podendo ser aglutinantes para o desenvolvimento de novos sistemas de detecção diagnóstica, ou até mesmo substituir anticorpos em ensaios clínicos; logo, características de especificidade podem ser definidas de acordo com a patologia a ser diagnosticada. Os DARPins apresentam produção de baixo custo e rápida geração em bactérias.(19)
Assim como o método de DARPins, o Biossensor SPR realiza medições capazes de identificar anticorpos inibidores, porém apenas o Biossensor realiza a diferenciação entre esses anticorpos dos não inibidores. O teste de ELISA, por sua vez, detecta esses anticorpos, entretanto não é capaz de fazer a distinção entre eles, podendo gerar resultados falso-positivos para anticorpos inibidores. Já o Bethesda realiza a detecção apenas de anticorpos inibidores, todavia há dificuldades na quantificação através desse teste em baixas titulações.(20)
O Biossensor SPR é um método capaz de detectar, quantificar e avaliar a atividade inibidora de autoanticorpos ou aloanticorpos, utilizando um pequeno volume de amostra de <200µL, com duração de análise de menos de uma hora.(21) Desta forma, as duas metodologias apresentadas na categoria de técnicas inovadoras mostram-se promissoras como possíveis novos métodos de diagnóstico dos anticorpos inibidores de não inibidores associados às hemofilias, em relação aos métodos atuais.
Categoria 2: Diagnóstico molecular
Lyu et al.(11) realizaram a técnica de sequenciamento de alto rendimento nos genes F8 e F9, também conhecida como sequenciamento de nova geração (NGS), em pacientes com hemofilia A (29 famílias), B (11 famílias) e seus parentes do sexo feminino, para verificar se neste último grupo existiam portadoras da doença. Os pacientes em estudo foram submetidos aos testes padrões para quantificação da atividade coagulante dos fatores FVIII: C e FIX: C, teste de Bethesda para verificação da presença ou ausência de inibidores e testes confirmatórios para PCR e sequenciamento de Sanger (SS).
Os resultados no NGS estavam de acordo com testes padrões e detectaram novas mutações em relação ao sequenciamento Sanger. No grupo de pacientes com HA foram encontradas três mutações novas: c.5724G>A (p.Trp1908*), c.6116-1_6120delGAGTGTinsTCC (p.Lys2039 Ilefs*13) e c.5220-2A>C, três pacientes apresentaram o inibidor de FVIII; nesses pacientes foram detectados a presença de duas mutações e um íntron de inversão correspondente a um éxon de deleção. Já no grupo de pacientes com HB foram detectadas oito mutações recorrentes (seis missense e dois nonsense), dois pacientes apresentaram a mutação c.1183T>C (p.Phe395Leu), porém apenas um deles apresentava inibidor de FIX.(11)
Bastida et al.(8) examinaram vinte pacientes com fenótipos de distúrbios de coagulação hemorrágico hereditário (IBCDs), confirmados previamente e validados pelo sequenciamento de Sanger. O objetivo era analisar a aplicabilidade de um painel com 23 genes associados à hemostasia utilizando a NGS na plataforma IlluminaMiSeq para detecção de variantes. Nos resultados demonstrou-se a deficiência do FVIII como a mais comum (oito pacientes), seguida da deficiência na produção do fibrinogênio (três pacientes), deficiências de FIX, FX, FXIII (três pacientes), redução do FII e FXI e DvW com dois casos cada.
O painel de 23 genes proporcionou identificar as variantes associadas aos genes que codificam os fatores de coagulação da via intrínseca F8, F9 e F11 e genes da via extrínseca F2 e F5. Foram encontradas 21 variantes patogênicas, incluindo seis novas mutações (c.5803delT (p.Tyr1935Ilefs*10); c.197A>T (p.Lys66Ile); c.1653delT (p.Gly552Alafs*16); c.680G>A (p.Gly227Asp); c.424G>A, c.1351A>C (p.Glu142Lys, p.Ile451Leu); c.553delT (p.Tyr185Met)), sendo 18 missense e três alterações frameshift devido a microdeleções. A hemofilia A foi confirmada em sete dos oito pacientes, sendo um caso grave. Uma mulher com suspeita de ser portadora sintomática de hemofilia foi identificada com a doença de von Willebrand 2N (DvW-2N) após a aplicação do painel, onde se verificou ser homozigótica de pArg854Gln, que é uma variante do Fator de von Willebrand (FvW) mais comum na mutação de DvW-2N.(8)
A hemofilia A e a Doença de von Willebrand podem muitas vezes ser confundidas por apresentarem deficiência do FVIII. Em função disso, diversos estudos vêm sendo desenvolvidos ao longo dos anos em busca de métodos que ofereçam resultados com maior sensibilidade e especificidade. O NSG é um método que vem sendo empregado no diagnóstico de doenças em várias áreas da saúde, como na análise de genes relacionados a diversos tipos de câncer e, mais recentemente, em patologias hematológicas.(22) Os estudos descritos(8,11) demostraram que, com a técnica de NGS, é possível realizar um diagnóstico da doença no âmbito molecular em todos os indivíduos e a identificação de novas mutações.
A técnica de NGS apresenta alta precisão, alta sensibilidade, além de permitir o rápido sequenciamento de grandes sequências de pares de bases de DNA abrangendo genomas inteiros, refletindo na identificação de novas mutações, detecção de grandes mutações de inserção, deleção e outros rearranjos. Outras técnicas de sequenciamento fazem a leitura de um número restrito de pares de base em um tempo maior comparados ao NGS, que pode ler um painel com muitos genes em algumas horas; o custo-benefício do NGS acaba sendo maior, visto que se pode analisar um painel inteiro de genes de forma simultânea diferente de outros sequenciadores.(23,24)
Outra vantagem é a capacidade de escolher os genes alvos para formação do painel, diferente de alguns sequenciadores que já vêm com a matriz genética pronta. No caso de hemofilias, esta caracterização poderia potencialmente ajudar a prever a probabilidade de desenvolvimento de inibidores e antecipar a resposta à indução de tolerância imunológica. O NGS possibilita a análise simultânea de vários genes envolvidos em IBCDs, mostrando-se uma técnica sensível e eficiente no diagnóstico molecular, podendo auxiliar principalmente no diagnóstico pré-natal e no aconselhamento genético.(23,24)
Categoria 3: Método modificado
Milos et al.(12) desenvolveram um teste modificado da análise de tromboplastina parcial ativada (TTPa) em onda quantitativa, através de três parâmetros quantitativos (delta, ratio-1 e ratio-2) comparando-o com a atividade do fator VIII, com o objetivo de comparar e quantificar pacientes com o fenótipo clínico grave e não grave com os parâmetros do TTPa em onda, além de verificar a associação destes valores com eventos hemorrágicos. Participaram desse estudo 81 pacientes com a doença Hemofilia A (classificados em 37 grave, 7 moderada e 37 leve). As análises foram feitas por coagulômetros fotópticos modernos que recolheram os dados durante toda a formação dos coágulos usando o programa MedCald, versão 9.3.2.0 para Windows software Mariakerd Bélgica para análise estatística.
O TTPa modificado é um método que serve para avaliar a hemostasia, com o benefício da análise em forma de onda quantitativa, no qual se tem a comparação dos resultados obtidos em várias fases; portanto, o teste mostra informações sobre o processo de coagulação em situações específicas. Essa onda de forma quantitativa é uma ferramenta de laboratório para avaliação de coagulações globais, já que obteve resultados superiores aos métodos que são considerados padrões nos laboratórios. Outra importância desse teste é a simplicidade, além do custo-benefício da medição de rotina, tornando o TTPa uma ferramenta tanto prática como promissora para avalição de coagulação nos pacientes com hemofilia A. Esse estudo obteve resultados em diferentes formas de curvas de reação no TTPa dos pacientes.(12,25)
Categoria 4: Potencialização de sensibilidade
O Bethesda modificado é um método diagnóstico considerado o padrão ouro para detecção de anticorpos inibidores do FVIII, porém apresenta baixa sensibilidade, havendo a necessidade de se desenvolverem técnicas mais sensíveis, como os imunoensaios.(27)
Irigoyen et al.(14) buscaram comparar a técnica imunológica da Citometria de Fluxo (CF) com o Bethesda modificado e com a técnica de ELISA. Esses métodos analisam a presença de anticorpos inibidores em pacientes com hemofilia A grave, após o tratamento para reposição de fator VIII (FVIII). Os testes foram realizados antes e após a administração da terapia de reposição de FVIII, participando do estudo trinta pacientes hemofílicos, sendo que 13 foram detectados com anticorpos inibidores pelo método de Bethesda modificado. Os pacientes que apresentavam anticorpos inibidores tiveram resultado positivo nos métodos Bethesda modificado, ELISA e CF, porém seis pacientes apresentaram resultado fracamente positivo em apenas um teste (CF ou ELISA). Essa positividade está relacionada com a presença de anticorpos não inibidores.
Miller et al.(15) fizeram uma comparação entre os testes: Ensaio Nijmegen-Bethesda (NBA), Ensaio de Bethesda Cromogênico (CBA) e Imunoensaio de Fluorescência (FLI) baseados no coágulo para a medição dos inibidores de FVII. Os indivíduos que participaram do estudo apresentavam hemofilia A e Hemofilia B, com fatores VIII e IX baixos, respectivamente, em centros de tratamentos para a doença.
Entre os espécimes com NBA positivo e CBA negativo, 58,1% eram FLI negativos, 12,9% tinham evidência de anticoagulante lúpico e 35,5% tinham inibição não dependente do tempo. CBA e FLI foram positivos em 72,4% e 100% de 1,0-1,9 espécimes NBU e 43,1% e 50,0% de 0,5-0,9 espécimes NBU. A FLI detectou anticorpos em 98,0% de CBA-positivos e 81,6% de NBA positivos. Entre os pacientes previamente positivos com 0,5-1,9 NBU, 7/25 (28%) não foram CBA ou FLI positivo. FLI foi positivo em 36/169 NBU-negativo espécimes (21,3%). Quando comparados todos os métodos, mostram-se resultados tanto para o NBA, CBA, e FLI positivos para o NBU, até 100% dos espécimes positivos para o CBA, (98,5%) FLI positivos para NBU (72,4%) positivos para CBA e 100% foram FLI positivos. No caso do CBA e FLI foram considerados positivos em 43,1% e 50% dos espécimes. Apenas 4% dos espécimes apresentaram discordância entre os resultados da NBA e CBA. O FLI detectou anticorpos em 98,0% dos espécimes CBA-positivos, mas apenas 81,6% dos espécimes NBA-positivos. A especificidade do FVIII não foi demonstrada em 26% dos inibidores menor em 2,0 NBU detectados no NBA alterado.(15)
Kahle et al.(16) desenvolveram um estudo para identificação de epítopos de anticorpos anti-FVIII em pacientes com hemofilia A, através de fagos, com ligações confirmadas pelo ELISA. Três etapas foram seguidas: seleção de peptídeos específicos de anticorpos de apresentação de fagos; identificação de resíduos de peptídeos de ligação e anticorpos essenciais por análise mutacional, e resíduos peptídeos essenciais ao FVIII e sua verificação. Bibliotecas de peptídeos apresentadas por fagos (PDPLs) foram pesquisadas para o anticorpo monoclonal murino (mAb) 2-76. O mapeamento de epítopos detalhado mostrou sítios de ligação nos domínios A2, A3, C2, uma preferência para os domínios A2 e C2, podendo esses ligantes peptídicos específicos ser uma abordagem para identificação de sítios antigênicos em FVIII. A análise resultou na predição de dois epítopos dentro da região A2 (484-508), que contém o epítopo funcional, e o mapeamento identificou os resíduos R489, V495 e/ou F501 como essenciais para a ligação de mAb 2-76. Os fagos específicos de anticorpo apresentam ligantes em que peptídeos imitam os locais de ligação ao anticorpo. Os resultados apresentados mostraram que esses epítopos de anticorpos específicos para o FVIII são vistos por meio de seleção de ligantes peptídeos específicos de anticorpos.
A concordância nos resultados da CF com o Bethesda modificado e com os resultados do método de ELISA nos pacientes torna a CF uma alternativa na detecção e quantificação de anticorpos anti-FVIII de baixo nível em pacientes hemofílicos, apresentando uma sensibilidade alta na avaliação de pacientes com baixa resposta (<5BU mL),(14) visto que o método Bethesda modificado apresenta como ponto negativo uma baixa sensibilidade na detecção e quantificação desses anticorpos e uma elevada variabilidade entre laboratórios.(27) A CF é uma técnica de realização rápida e fácil, seus resultados podem ser obtidos em algumas horas e utiliza uma pequena quantidade de amostra do paciente, podendo ser realizada no plasma ou soro. Porém, o aparelho de CF é caro, devendo-se avaliar o custo-benefício dessa técnica.(28)
Comparativamente, a técnica de apresentação de fagos precisa ser melhorada, pois é necessário utilizar um grande tempo para a sua execução, porém a capacidade de identificar ligantes de anticorpo ajudará a desenvolver novas ferramentas de diagnósticos e terapia para as hemofilias, auxiliando em uma compreensão melhor da resposta imunitária de FVIII.(16,29) A FLI é capaz de realizar a análise de diversas amostras em um tempo curto, apresenta sensibilidade elevada e boa especificidade com baixo custo, em comparação com métodos cromatográficos.(15,30)
A detecção dos inibidores é muito importante para o acompanhamento do tratamento feito através da reposição dos fatores deficientes, porém algumas dessas técnicas necessitam ser melhoradas, para futuramente poderem ser utilizadas como forma de identificação dos epítopos presentes nos anticorpos inibidores e neutralização dos mesmos. A análise molecular de determinados genes ao mesmo tempo permite entender as alterações presentes nesses genes e traçar um perfil genótipo-fenótipo de pacientes com hemofilia, diferenciando-a das demais coagulopatias e confirmando o diagnóstico do paciente.(24)
Essas novas técnicas diagnósticas têm demonstrado grande importância, visto que a presença de anticorpos inibidores dos fatores acaba por dificultar o tratamento dos hemofílicos, o que pode até causar complicações significantes. Isso influencia principalmente na realidade da saúde brasileira, já que, de acordo com os dados publicados em 2015 pela Federação Mundial de Hemofilia, dentre os 111 países pesquisados, o Brasil tem a quarta maior população de pacientes com hemofilia, depois apenas dos Estados Unidos, Índia e China.(26) Portanto, a grande maioria dos trabalhos buscou a detecção desses anticorpos, e a possível adoção destes novos métodos no Brasil pode contribuir para o desenvolvimento de um diagnóstico mais preciso, o que reflete na importância destes para o tratamento, e, consequentemente, na qualidade de vida dos pacientes.
CONCLUSÃO
Os métodos padrão de diagnósticos laboratoriais atualmente utilizados para a detecção e acompanhamento das hemofilias proporcionam resultados limitados devido às dificuldades como quantificação de baixos níveis de anticorpos inibidores e diferenciação da hemofilia com as demais coagulopatias. As novas técnicas estão sendo testadas e melhoradas para realizar com maior especificidade funções como: a quantificação do fator VIII, identificação da presença e diferenciação de anticorpos inibidores; anticorpos não inibidores; análise dos genes F8 (HA) e F9 (HB) junto com outros genes da hemostasia, para detecção de deleções, inserções e mutações conhecidas ou novas; esses resultados podem ser correlacionados com outros testes para melhor definição dos fenótipos clínicos da doença. Com a aplicação dessas novas técnicas será possível realizar um diagnóstico mais preciso das hemofilias, para posteriormente auxiliarem na escolha da melhor forma de tratamento, monitorização e prevenção dos agravos associados à evolução da patologia.
Abstract
Hemophilia is a hereditary coagulopathy linked to the X chromosome, caused by the deficiency of factors VIII (hemophilia A) and IX (hemophilia B). This disease affects about 1: 10.000 live male births in hemophilia A and 1: 40.000 in hemophilia B in the world. This study aimed to evaluate current methods and new laboratory diagnostic methods being tested for the detection and follow-up of patients with hemophilia. An integrative review of the literature was carried out by searching indexed articles using the PubMed and SciELO data platforms. From the research carried out, only 8 articles were selected, categorized in: Innovative Technique; Molecular diagnosis; Modified method and Sensitivity enhancement. With these new techniques will be possible with greater specificity factor VIII quantification, identification and differentiation of non-inhibitory antibody inhibitor antibodies; analysis of the FVIII, FIX and other genes of hemostasis by Flow Cytometry techniques and the Surface Plasmon Resonance Biosensor; detection of deletions, insertions and mutations known or new through New Generation Sequencing, these results being correlated with other tests to better define the clinical phenotypes of the disease.
Palavras-chave
Hemophilia; Diagnosis; Innovation
REFERÊNCIAS
- Saito H, Matsushita T, Kojima T. Historical perspective and future direction of coagulation research. J Thromb Haemost. 2011 Jul;9 Suppl 1:352-63. doi: 10.1111/j.1538-7836.2011.04362.x.
- Seo JY, Jang MA, Kim HJ, Lee KO, Kim SH, Kim HJ. Sequence variation data of F8 and F9 genes in functionally validated control individuals: implications on the molecular diagnosis of hemophilia. Blood Res. 2013 Sep;48(3):206-10. doi: 10.5045/br.2013.48.3.206.
- Ceresetto JM, Duboscq C, Fondevila C, Tezanos PM. Hemofilia adquirida (inhibidor adquirido del factor VIII). Medicina (B. Aires). 2015 Ago;75(4):231-8.
- Mansouritorghabeh H. Clinical and Laboratory Approaches to Hemophilia A. Iran J Med Sci. 2015 May;40(3):194-205.
- Batsuli G, Deng W, Healey JF, Parker ET, Baldwin WH, Cox C, et al. High-affinity, noninhibitory pathogenic C1 domain antibodies are present in patients with hemophilia A and inhibitors. Blood. 2016 Oct 20;128(16):2055-2067. doi: 10.1182/blood-2016-02-701805.
- Silva TPS. Avaliação da qualidade de vida relacionada à saúde em pacientes com hemofilias A e B atendidos na fundação HEMOMINAS – Minas Gerais, Brasil. Dissertação [Mestrado em Saúde Coletiva, Área de concentração: Epidemiologia] -Centro de Pesquisas René Rachou, Belo Horizonte, 2015.
- Bonar RA, Favaloro EJ, Marsden K. External Quality Assessment of Factor VIII Inhibitor Assays. Semin Thromb Hemost. 2013 Apr;39(3):320-6. doi: 10.1055/s-0033-1334464.
- Bastida JM, Del Rey M, Lozano ML, Sarasquete ME, Benito R, Fontecha ME, et al. Design and application of a 23-gene panel by next-generation sequencing for inherited coagulation bleeding disorders. Haemophilia. 2016 Jul;22(4):590-7. doi: 10.1111/hae.12908.
- De Brasi C, El-Maarri O, Perry DJ, Oldenburg J, Pezeshkpoor B, Goodeve A. Genetic testing in bleeding disorders. Haemophilia. 2014 May;20 Suppl 4:54-8. doi: 10.1111/hae.12409.
- Kocot C, Schindler AR, Le Blanc A, Schmalenberg M, Miesbach W, Spannagl M, et al. Biomimetic biosensor to distinguish between inhibitory and non-inhibitory factor VIII antibodies. Anal Bioanal Chem. 2015 Jul;407(19):5685-93. doi: 10.1007/s00216-015-8751-x.
- Lyu C, Xue F, Liu X, Liu W, Fu R, Sun T, et al. Identification of mutations in the F8 and F9 gene in families with haemophilia using targeted high-throughput sequencing. Haemophilia. 2016 Sep; 22(5):e427-34. doi: 10.1111/hae.12924.
- Milos M, Coen Herak D, Zupancic-Salek S, Zadro R. New quantitative aPTT waveform analysis and its application in laboratory management of haemophilia A patients. Haemophilia. 2014 Nov;20(6):898-904. doi: 10.1111/hae.12492.
- Hausammann S, Vogel M, Kremer Hovinga JA, Lacroix-Desmazes S, Stadler BM, Horn MP. Designed Ankyrin Repeat Proteins: A New Approach to Mimic Complex Antigens for Diagnostic Purposes? PLoS One. 2013 Apr 23;8(4):e60688. doi: 10.1371/journal. pone. 0060688.
- Irigoyen MB, Primiani L, Felippo M, Candela M, Bianco RP, De Bracco MM, et al. A flow cytometry evaluation of anti-FVIII antibodies: correlation with ELISA and Bethesda assay. Haemophilia. 2011 Mar; 17(2):267-74. doi: 10.1111/j.1365-2516. 2010.02406.x.
- Miller CH, Rice AS, Boylan B, Shapiro AD, Lentz SR, Wicklund BM, et al. Comparison of clot-based, chromogenic and fluorescence assays for measurement of factor VIII inhibitors in the US Hemophilia Inhibitor Research Study. J Thromb Haemost. 2013 Jul;11(7):1300-9. doi: 10.1111/jth.12259.
- Kahle J, Orlowski A, Stichel D, Becker-Peters K, Kabiri A, Healey JF, et al. Epitope mapping via selection of anti-FVIII antibody-specific phage-presented peptide ligands that mimic the antibody binding sites. Thromb Haemost. 2015 Feb;113(2):396-405. doi: 10.1160/TH14-01-0101.
- Janbain M, Leissinger CA, Kruse-Jarres R. Acquired hemophilia A: emerging treatment options. J Blood Med. 2015 May 8;6:143-50. doi: 10.2147/JBM.S77332. eCollection 2015.
- Grosbois SS, Brionne MF, De Longcamp AL, Gautier P, Kaveri VS, Borel-Derlon A, et al. Hydrolysis of factor VIII mediated by catalytic antibodies occurs in haemophilia A patients with or without factor VIII inhibitors. Haemophilia. 2013 Mar;19(2):322-9. doi: 10.1111/hae.12067.
- Pluckthun A. Designed Ankyrin Repeat Proteins (DARPins): Binding Proteins for Research, Diagnostics, and Therapy. Annu Rev Pharmacol Toxicol. 2015;55:489-511. doi: 10.1146/annurev-pharmtox-010611-134654.
- Duncan E, Collecutt M, Street A. Nijmegen-Bethesda Assay to Measure Factor VIII Inhibitors. Methods Mol Biol. 2013;992:321-33. doi: 10.1007/978-1-62703-339-8_24.
- Damborsky P, Svitel J, Katrlik J. Optical biosensors. Essays Biochem. 2016 Jun 30;60(1):91-100. doi: 10.1042/EBC20150010.
- Liang J, She Y, Zhu J, Wei L, Zhang L, Gao L, et al. Development and validation of an ultra-high sensitive next-generation sequencing assay for molecular diagnosis of clinical oncology. Int J Oncol. 2016 Nov;49(5):2088-2104. doi: 10.3892/ijo.2016.3707.
- Pezeshkpoor B, Zimmer N, Marquardt N, Nanda I, Haaf T, Budde U, et al. Deep intronic ‘mutations’ cause hemophilia A: application of next generation sequencing in patients without detectable mutation in F8 cDNA. J Thromb Haemost. 2013 Sep;11(9):1679-87. doi: 10.1111/jth.12339.
- Vijay P, Mcintyre AB, Mason CE, Greenfield JP, Li S. Clinical Genomics: Challenges and Opportunities. Crit Rev Eukaryot Gene Expr. 2016;26(2):97-113. doi: 10.1615/Crit Rev Eukaryot Gene Expr. 2016015724.
- Matsumoto T, Nogami K, Shima M. A combined approach using global coagulation assays quickly differentiates coagulation disorders with prolonged aPTT and low levels of FVIII activity. Int J Hematol. 2017 Feb;105(2):174-183. doi: 10.1007/s12185-016-2108-x.
- World Federation of Hemophilia. Annual Global Survey 2015; 2016. pp. 68. [acesso em 03 jan 2017]. Disponível em: http://www1.wfh.org/publications/files/pdf-1669.pdf.
- Verbruggen B, Dardikh M, Polenewen R, Van Duren C, Meijer P. The factor VIII inhibitor assays can be standardized: results of a workshop. J Thromb Haemost. 2011 Oct;9(10):2003-8. doi: 10.1111/j.1538-7836.2011.04479.x.
- Moskalensky AE, Chernyshev AV, Yurkin MA, Nekrasov VM, Polshchitsin AA, Parks DR, et al. Dynamic quantification of antigen molecules with flow cytometry. J Immunol Methods. 2015 Mar; 418:66-74. doi: 10.1016/j.jim.2015.02.001.
- Tan Y, Tian T, Liu W, Zhu Z, J Yang C. Advance in phage display technology for bioanalysis. Biotechnol J. 2016 Jun;11(6):732-45. doi: 10.1002/biot.201500458.
- Zakarija A, Harris S, Rademaker AW, Brewer J, Krudysz-Amblo J, Butenas S, et al. Alloantibodies to factor VIII in haemophilia. Haemophilia. 2011 Jul;17(4):636-40. doi: 10.1111/j.1365-2516. 2010.02468.x.
Correspondência
Danielle Cristinne Azevedo Feio
Avenida Visconde de Sousa Franco, N° 660
66053-000 – Belém, PA, Brasil
e-mail: [email protected]
