Avaliação do conteúdo de hemoglobina do reticulócito em pacientes anêmicos sob tratamento dialítico
Prevalence of respiratory and allergic diseases in Caxias do Sul-RS
Cássia Cristian Oliveira1
Thaís Resende Batista2
Danyelle Romana Alves Rios3
1Estudante. Universidade Federal de São João del-Rei (UFSJ). São João del-Rei – MG, Brasil.
2Mestre. Universidade Federal de São João del-Rei (UFSJ). São João del-Rei – MG, Brasil.
3Ph.D. Docente. Universidade Federal de São João del-Rei (UFSJ). São João del-Rei – MG, Brasil.
Instituição: Universidade Federal de São João del-Rei (UFSJ.) São João del-Rei – MG, Brasil.
Recebido em 04/04/2019
Artigo aprovado em 08/08/2019
DOI: 10.21877/2448-3877.201900836
INTRODUÇÃO
A anemia é caracterizada pela diminuição da massa eritrocitária e da hemoglobina sanguínea, e essa condição acarreta o desabastecimento de oxigênio em órgãos e tecidos causando hipóxia. Os fibroblastos peritubulares renais são responsáveis pela produção de eritropoetina, que tem ação estimulatória na síntese e diferenciação de eritroblastos.(1)
Em pacientes com doença renal crônica (DRC) é comum o desenvolvimento de anemia, uma vez que a síntese e liberação de eritropoetina, pelos fibroblastos renais, é prejudicada devido à fibrose renal. (1-3) Outras causas de anemia em pacientes com DRC são infecções e a perda absoluta de sangue, levando à deficiência de ferro. Esta perda de sangue inclui sangramentos gastrointestinais com perda de sangue oculto nas fezes, sangue retido na circulação extracorpórea durante a diálise, retiradas de sangue para os exames laboratoriais, hemólise, deficiência de vitamina B12 e ácido fólico, hiperparatireoidismo, hemoglobinopatias e neoplasias. Além disso, a anemia na DRC está associada à diminuição dos níveis séricos de ferro devido ao processo inflamatório crônico comum nesta comorbidade.(4-6)
Na DRC, em virtude da lesão glomerular, bem como do tratamento dialítico no estágio final da DRC, ocorre ativação do sistema imune e, consequentemente, liberação de fatores inflamatórios.(7) Tem-se a ação de diversas citocinas, entre elas o interferon gama (IFN-g), que estimulará a expressão do transportador de metal bivalente (DMT-1) nos macrófagos, causando o aumento na captação de ferro no seu estado ferroso (Fe2+), além de causar a diminuição da expressão da ferroportina. Adicionalmente, a interleucina 10 (IL-10) aumenta a expressão dos receptores de transferrina dos monócitos e, com isso, a captação de ferro ligado à transferrina, diminuindo a concentração de ferro sérico.(8,9)
Outro fator inflamatório de ação estimulatória é a interleucina 6 (IL-6), que promove a liberação da hepcidina, que se liga ao DMT-1, bloqueando a absorção de ferro pelo enterócito. A hepcidina age também através de sua ligação à ferroportina, formando um complexo que será internalizado, degradando assim a ferroportina. Isso causa o acúmulo celular de ferro e, consequentemente, a diminuição do índice de saturação da transferrina (IST); logo, tem-se diminuição da liberação de ferro para a eritropoese, contribuindo para a anemia mesmo com reservas normais de ferro, caracterizando a deficiência funcional do mesmo.(8,10) Além disso, o fator de necrose tumoral a (TNF-a), o IFN-g e a interleucina 1 (IL-1) inibem diretamente a diferenciação e a proliferação de células progenitoras eritroides (Figura 1).(8,11,12)
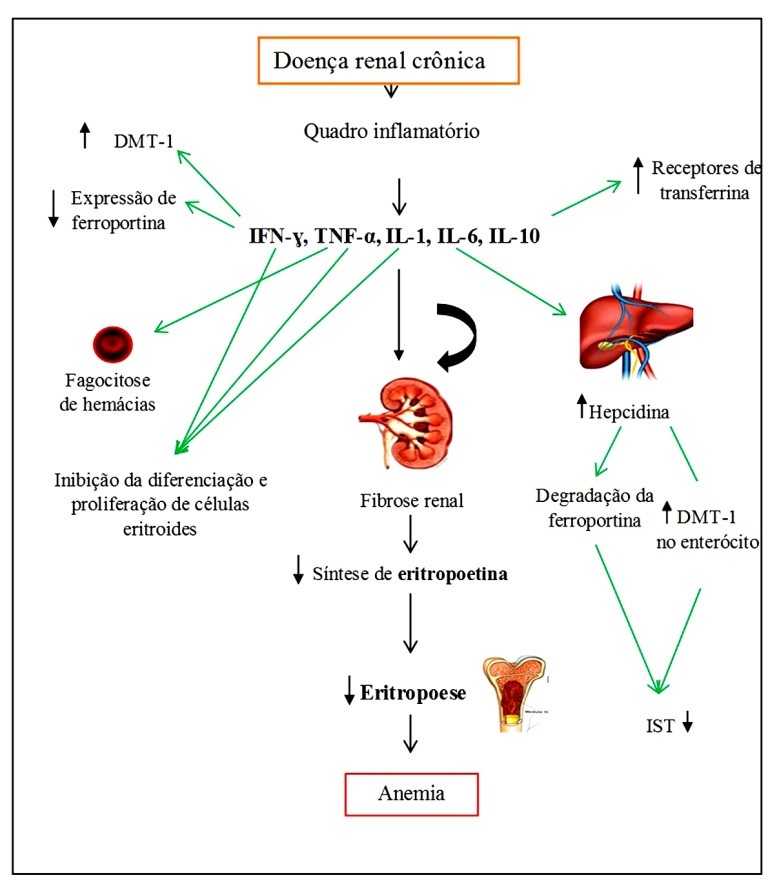
Figura 1. Mecanismo fisiopatológico da anemia na doença renal crônica.
DMT-1: Transportador de metal divalente; IFN-g: Interferon gama; TNF-a: Fator de necrose tumoral; IL-1: Interleucina 1; IL-6: Interleucina 6; IL-10: Interleucina 10; IST: índice de saturação da transferrina.
Atualmente, as principais diretrizes europeias,(13-15) entre elas a Kidney Disease Improvement Global Outcomes (KDIGO)(16) e a diretriz brasileira,(17) que tratam do manejo da anemia na DRC, determinam que seu diagnóstico nestes pacientes seja realizado por meio de hemograma completo para avaliação do número de eritrócitos, e da concentração de hemoglobina por meio dos parâmetros hematimétricos, volume corpuscular médio (VCM), concentração de hemoglobina corpuscular média (CHCM) e amplitude de distribuição dos eritrócitos (RDW), bem como para a avaliação dos leucócitos. Preconiza-se ainda a avaliação do IST (Infecções Sexualmente Transmissíveis), que avalia a quantidade de ferro circulante disponível para a eritropoese, e de ferritina, que fornece uma medida das reservas de ferro nas células.(17) Entretanto, todos esses parâmetros apenas permitem a detecção da anemia no paciente com DRC após o quadro já instalado. Além disso, a ferritina e o IST sofrem influência de condições não relacionadas ao metabolismo do ferro, como a desnutrição e a inflamação, situações recorrentes em pacientes com DRC; logo, a sensibilidade e a especificidade tornam-se insatisfatórias.(1,3)
O aumento da ferritina apresentado no processo inflamatório deve-se ao aumento de sua produção hepática, dando-lhe a característica de proteína de fase aguda positiva. Em contrapartida, a produção hepática de transferrina se encontra diminuída, sendo assim considerada uma proteína de fase aguda negativa, fato este que interfere diretamente na obtenção do IST.(8,10,18)
Tendo em vista que a progressão da DRC quase sempre acarreta o desenvolvimento de anemia, a qual se associa com declínio da capacidade cognitiva e diminuição da atividade cardíaca, bem como ao aumento de comorbidades, especialmente as cardiovasculares, que impactam na perda da qualidade de vida e sobrecarga para o sistema público de saúde, torna-se essencial a busca por novos marcadores hematológicos que permitam seu diagnóstico precoce, visando o controle e melhora dos resultados terapêuticos.(1,17,19)
Neste contexto, emergiram-se novos parâmetros hematológicos, dentre eles um parâmetro que avalia a quantidade de hemoglobina contida nos reticulócitos, que são liberados da medula óssea para o sangue periférico e permanecem um a dois dias antes de se tornarem eritrócitos maduros. Este parâmetro parece fornecer uma medida indireta do ferro funcional disponível para a produção de hemoglobina dos eritrócitos nos últimos dois a quatro dias, conferindo-lhe maior sensibilidade e especificidade em refletir a disponibilidade de ferro medular, sem que haja interferência de processo inflamatório, bem como um resultado precoce frente à terapia de ferro intravenoso (IV) e tratamento com eritropoetina recombinante humana (rHuEPO).(13,20,21)
A avaliação da hemoglobina contida no reticulócito é realizada através da medida do volume e concentração de hemoglobina de cada reticulócito, representando assim o valor médio de massa de hemoglobina em cada célula. Esta avaliação pode ser determinada por diferentes analisadores, sendo expressa por denominações diferentes. O Advia 2120 (Siemens, Tarrytown, NY) fornece este parâmetro como CHr (conteúdo de hemoglobina do reticulócitos); o Sysmex XE e XN (Sysmex, Lincolnshire, IL) expressa como Ret-He (equivalente de hemoglobina do reticulócitos); o analisador Cell-Dyns Sapphire (Abbott Diagnostics, Santa Clara, CA, EUA) na forma de HCMr (hemoglobina corpuscular média dos reticulócitos) e o ABX Pentra XLR (Horiba Medical, Montpellier, France), como CHRc (conteúdo de hemoglobina do reticulócito calculado).(22,23) Embora o mesmo parâmetro possa ser expresso por diferentes denominações, todos determinam a hemoglobina presente no reticulócito; logo, podem ser utilizados alternadamente na prática clínica.(24)
Estudos têm investigado a associação da hemoglobina contida no reticulócito com a anemia em pacientes com DRC. As diretrizes europeias,(13-15) bem como a KDIGO,(16) recomendam o conteúdo de hemoglobina do reticulócito para determinação da disponibilidade de ferro, embasando-se na sua precocidade e precisão em demonstrar a disponibilidade de ferro medular. No entanto, os resultados têm se mostrado conflitantes e, apesar da facilidade relativa de obtenção desses índices, seu uso na prática clínica ainda é limitado pela falta de conhecimentos pelos profissionais de saúde e ausência de padronização de procedimentos de mensuração e interpretação de resultados. Dessa forma, o presente estudo teve por objetivo revisar na literatura estudos que investigaram a associação entre o conteúdo de hemoglobina contida nos reticulócitos com a anemia em pacientes com DRC em tratamento dialítico e gerar evidências da importância do mesmo na prática clínica.
Foi realizada a busca de artigos nas bases de dados eletrônicas: Medline e Web of Science. O período de busca definido foi de janeiro de 1997 a dezembro de 2017. A triagem dos artigos foi realizada por dois pesquisadores em momentos distintos, sendo utilizados os operadores OR e AND para as combinações dos seguintes descritores: (reticulocyte hemoglobin content OR reticulocyte hemoglobin concentration OR content of reticulocyte hemoglobin OR RET-HE OR CHr OR MCHr OR RHe OR RHCc) AND (anemia of chronic disease OR anemia of chronic kidney disease OR anemia inflammation).
Conteúdo de hemoglobina do reticulócito na avaliação da suplementação de ferro IV
Capone e colaboradores,(25) em um estudo observacional retrospectivo, com 32 pacientes com idades de 70 a 73 anos, submetidos à hemodiálise em tratamento com sacarato de hidróxido férrico IV (duas administrações de 500 mg ou cinco de 200 mg) e rHuEPO, compararam a utilidade do CHr, avaliada pela relação HCM/CHr versus ferritina, a fim de otimizar a suplementação de ferro nestes pacientes. Os pacientes selecionados para o estudo foram divididos em dois grupos: grupo A, com ajuste de dose de ferro IV e rHuEPO baseado nos parâmetros Hb e HCM/CHr, sendo que, para esta relação, um valor <1,0 indica disponibilidade fisiológica de ferro e valores >1,0 indicam necessidade de suplementação. Para o outro grupo (grupo B), o ajuste de dose foi realizado com base na Hb e ferritina de acordo com o Guia da Sociedade Italiana de Nefrologia, considerando ferritina de 300 µg/L a 400 µg/L para disponibilidade fisiológica de ferro. O valor da relação HCM/CHr foi menor que 1 em ambos os grupos, indicando disponibilidade fisiológica de ferro. Com isso, como no grupo A utilizou-se a relação HCM/CHr para ajuste da dose, este grupo requereu uma dose menor de ferro IV. Já o grupo B, como o ajuste da dose foi feito para atingir níveis de ferritina entre 300 µg/L a 400 µg/L, este grupo requereu doses maiores de ferro quando comparado ao grupo A. Cumpre ressaltar que os níveis de Hb e índice de produção de reticulócitos (IPRI) foram semelhantes entre os grupos A e B. Dessa forma, os autores concluíram que a relação HCM/CHr poderia evitar a dose excessiva de ferro IV, que pode levar ao seu acúmulo, causando lesão celular e perda de função de órgãos e tecidos através da potencialização do processo oxidativo já presente nos pacientes em hemodiálise.(26,27)
Em um ensaio clínico randomizado controlado, Kaneko e colaboradores(28) analisaram 183 participantes com DRC submetidos à hemodiálise, com idade média de 57,6 ± 13,3 anos, por um período de 16 semanas, com o objetivo de comparar a eficácia do CHr e IST como indicadores no tratamento da deficiência de ferro. Os pacientes que apresentaram CHr menor que 32,5 pg ou IST menor que 20% foram selecionados para receber suplementação com 40 mg de coloide de ferro IV com sulfato de condroitina (Bluort®, Dainippon Pharmaceutical, Tóquio, Japão) administrados duas vezes por semana ao final de cada sessão de hemodiálise. Após o início da suplementação, o CHr apresentou melhora na 4ª semana, enquanto que o IST teve seu aumento somente a partir da 13ª semana. Concluíram que o CHr reflete a mudança no estado de ferro mais precocemente quando comparado à IST, demostrando assim maior sensibilidade em detectar mudanças na cinética do ferro.
Dalimunthe e colaboradores,(29) em um estudo de intervenção com 15 pacientes submetidos à hemodiálise, com idades entre 40 e 50 anos, avaliaram a capacidade do Ret-He em detectar precocemente a resposta frente à suplementação de ferro IV. Os pacientes selecionados tinham anemia por deficiência de ferro (Hb£10 g/dL ou HcT £30% associado a ferritina <100 ng/mL e/ou IST<20%) e receberam 100 mg de sacarato de hidróxido férrico IV durante cada sessão de diálise (duas vezes por semana) por quatro semanas. Os parâmetros Hb, HcT e Ret-He foram medidos antes e após o término do tratamento. Após quatro semanas de tratamento houve uma melhora de 1,33 g/dL para Hb, 3,7% para HcT e 2,6 pg para Ret-He. Este achado indica que o Ret-He pode ser associado ao monitoramento da terapia de ferro IV na prática clínica, na avaliação da resposta eritropoética, melhorando a eficácia terapêutica, além de evitar possíveis complicações causadas pelo tratamento excessivo com ferro IV.
Mittman e colaboradores,(30) em um estudo de intervenção, compararam o CHr com IST e ferritina para avaliar a suplementação com ferro em 79 pacientes com idade média de 63 anos. Os pacientes que apresentavam ferritina <100 ng/mL e IST<20% foram selecionados para receber 500 mg de ferro dextrano IV. Uma melhora nos valores de CHr foi observada após 48 horas da administração; em contrapartida, a elevação da ferritina e IST foi observada após 96 horas do início do tratamento. Associada a este resultado foi encontrada uma fraca correlação entre CHr e os parâmetros IST e ferritina. No entanto, correlações positivas foram encontradas entre CHr e os parâmetros Hb e HcT (p<0,01), sugerindo que, após o início do tratamento, há uma elevação concomitante destes parâmetros, indicando uma resposta eritropoética.
Urrechaga e colaboradores,(31) em um estudo de intervenção, avaliaram quarenta pacientes com idade média de 70,3 anos, submetidos à hemodiálise em terapia com rHuEPO, com o objetivo de determinar valores de corte para Ret-He para uma resposta adequada ao suplemento de ferro IV. Os parâmetros de monitoramento hematológico e de ferro foram medidos antes e após o tratamento. Os pacientes selecionados receberam 100 mg de sacarato de hidróxido de ferro IV em cada sessão de diálise por quatro semanas. Pacientes que apresentaram aumento de pelo menos 1 g/dL após a administração de ferro foram classificados como respondedores, e aos que não apresentaram aumento classificou-se como não respondedores. Uma melhora de 3,1 pg e 1,1 pg no Ret-He foi observada para o grupo de respondedores e não respondedores, respectivamente (p<0,001). Entretanto, ao se avaliarem a ferritina e IST, estas não foram estatisticamente diferentes (p= 0,888 e 0,522, respectivamente) entre os dois grupos, demonstrando-se que ambas não possibilitam a avaliação quanto à resposta do tratamento administrado. Para se identificar a eficiência do Ret-He na determinação da resposta frente o tratamento, analisou-se o valor de corte de 30,8 pg através da curva ROC, baseando-se na ferritina como padrão ouro. A análise da curva ROC demonstrou uma AUC de 0,84, com uma sensibilidade de 78,7% e especificidade de 87,2%. Portanto, pacientes que apresentarem Ret-He ³30,8 pg podem ser classificados como respondedores ao tratamento, evitando assim a sobrecarga de ferro bem como complicações associados ao seu acúmulo no organismo do paciente.
Conteúdo de hemoglobina do reticulócito no diagnóstico diferencial da deficiência absoluta e funcional de ferro
Dalimunthe e colaboradores,(29) em um estudo de intervenção com 54 pacientes submetidos à hemodiálise, com idades entre 40 e 50 anos, avaliaram o valor diagnóstico de Ret-He quando comparado à ferritina na identificação de deficiência absoluta de ferro. Utilizaram-se, para classificação da deficiência absoluta de ferro, os parâmetros Hb £10 g/dL ou HcT £30%, com ferritina <100 ng/mL e/ou IST<20%. Dos 54 pacientes, 16 apresentaram deficiência de ferro; destes pacientes, sete apresentaram ferritina <100 ng/mL e/ou IST<20% e foram classificados com deficiência absoluta de ferro e nove apresentaram ferritina >500 ng/mL e/ou IST <20%, sendo classificados com deficiência funcional de ferro, e 38 pacientes não apresentaram deficiência absoluta nem funcional de ferro. O desempenho diagnóstico do Ret-He na identificação da deficiência absoluta de ferro foi avaliado por meio de curva ROC, tendo a ferritina como método de referência. O valor de corte de 31,65 pg para o Ret-He obteve uma AUC de 0,818, sensibilidade de 81,5% e especificidade de 61,1%. Consequentemente, pacientes que apresentarem Ret-He <31,65 pg podem ser classificados com deficiência absoluta de ferro, sem que haja interferência do processo inflamatório, fornecendo uma informação mais precisa da disponibilidade de ferro medular.
Em um estudo de intervenção, Mittman e colaboradores(30) compararam o CHr com IST e ferritina para a detecção da deficiência funcional de ferro em 79 pacientes submetidos à hemodiálise com idade média de 59 anos. Dos 79 pacientes, 47 apresentaram anemia por deficiência de ferro (ferritina <100 ng/mL ou IST<20%) e receberam o tratamento com 500 mg de ferro dextrano IV por duas semanas. Resultados de CHr <28 pg e aumento de 1% ou mais no índice de reticulócitos corrigido (IRC) após terapia de ferro caracterizaria deficiência funcional de ferro. Após as duas semanas da terapia de ferro IV não houve alterações nos níveis de ferritina, IST e ferro sérico, entretanto, nove pacientes apresentaram IRC superior a 1%. Dos nove pacientes, sete apresentaram CHr <28 pg, sendo diagnosticados com deficiência funcional de ferro com uma sensibilidade de 78% e especificidade de 71%. Por outro lado, ao se utilizar o IST <20%, este demonstrou uma sensibilidade de 50% e 60% de especificidade na detecção da deficiência funcional de ferro, enquanto que ferritina <100 ng/mL apresentou uma sensibilidade de 38% e 53% de especificidade no diagnóstico da deficiência funcional de ferro. Estes achados demostram que o CHr detecta com maior especificidade e sensibilidade a deficiência funcional de ferro.
Davidkova e colaboradores,(32) em um estudo de coorte retrospectivo, avaliaram 45 pacientes em hemodiálise e diálise peritoneal, com idade inferior a 18 anos, para investigação da utilidade e adequação do Ret-He em relação aos marcadores tradicionais da cinética do ferro no diagnóstico da anemia por deficiência absoluta ou funcional de ferro. A deficiência absoluta de ferro foi definida como Hb <10 g/dL para menores de 6 meses e Hb <11 g/dL para maiores de 6 meses, associado a ferritina <100 mcg/L e IST <20%. A deficiência funcional de ferro foi definida por Hb inferior a 10 g/dL para menores de 6 meses e Hb <11 g/dL para os maiores 6 meses, apresentando um IST <20% e ferritina >200 mcg/L. Foi determinado um valor de corte para Ret-He de 28,9 pg para a detecção da anemia por deficiência absoluta de ferro, sendo que a análise da curva ROC foi feita utilizando a ferritina como método de comparação. A área sob a curva obtida foi de 0,87, com uma sensibilidade de 90% e especificidade de 75%. Para detecção da anemia por deficiência funcional do ferro, a análise da curva ROC considerou um IST<20% e ferritina de 200 mg a 500 mg, considerando 27,7 pg como valor de corte para o Ret-He, obtendo-se uma sensibilidade de 55% e especificidade de 83. Considerando apenas o IST <20% e Hb <10g/dL, e atribuindo ao Ret-He o valor de corte de 28,8 pg, o mesmo obteve sensibilidade de 63% e especificidade de 79,5% na detecção da anemia por deficiência funcional de ferro.
Zupan e colaboradores,(33) em um estudo transversal com 39 pacientes submetidos à hemodiálise, com idades entre 40 a 89 anos, avaliaram a significância do CHr quando comparado ao IST e ferritina na detecção da deficiência de ferro em pacientes submetidos à hemodiálise em tratamento com rHuEPO. A deficiência de ferro foi definida por IST <20%, ferritina <100 ng/mL e CHr <26,0 pg. Dos 39 pacientes avaliados, quando foi considerado CHr <26,0 pg, a IST <20% e a ferritina <100 ng/mL, três (7,7%) foram detectados com deficiência de ferro. O CHr correlacionou-se de forma moderada com o IST (r = 0,39; p = 0,013) e não apresentou correlações com a ferritina. Este fato pode ser explicado devido ao aumento na concentração de ferritina e diminuição do ferro sérico durante o processo inflamatório, causando interferência na obtenção do IST, fornecendo assim resultados em desacordo com a real condição do suprimento do ferro para a síntese de hemoglobina em precursores hematopoiéticos.(18,34)
Urrechaga e colaboradores,(36) em um estudo transversal, estabeleceram a sensibilidade e especificidade do Ret-He na avaliação da eritropoese e disponibilidade de ferro. O Ret-He foi avaliado em indivíduos saudáveis (n=90), pacientes com DRC (n=85), pacientes submetidos à hemodiálise (n=65) e pacientes com anemia por deficiência de ferro (n=91). Estes pacientes preenchiam os critérios para diagnóstico de anemia por deficiência de ferro: ferro sérico <7,5 µmol/L, IST <20%, ferritina <30 µg/L, Hb <11g/dL e PCR <5 mg/L e foram incluídos antes do tratamento com ferro. Os pacientes com DRC e aqueles submetidos à hemodiálise faziam terapia com ferro IV e rHuEPO. Ao se analisarem os grupos com DRC e submetidos à hemodiálise, estes apresentaram Ret-He acima de 30 pg, demostrando boa disponibilidade de ferro em virtude do tratamento recebido. Ao se analisar a ferritina, esta esteve elevada (entre 200 µg/L a 400 µg/L) para ambos os grupos, o que pode ser devido ao quadro inflamatório associado a estes pacientes. Os pacientes com anemia por deficiência de ferro apresentaram valores médios de ferritina de 18 µg/L, IST<6% e Ret-He 23,9 pg, indicando baixa disponibilidade de ferro para a eritropoese. A curva ROC foi utilizada para avaliar o Ret-He no diagnóstico da deficiência funcional de ferro, tendo como método de comparação a dosagem do receptor solúvel de transferrina >21 nM. Utilizando-se o valor de 29,8 pg como ponto de corte obteve-se como resultado uma AUC de 0,935, com sensibilidade de 90% e especificidade de 83,1%.
Em um estudo retrospectivo, Ageeli e colaboradores(35) avaliaram 260 pacientes com idades entre 40 e 50 anos submetidos à hemodiálise, com o objetivo de avaliar o CHr na detecção da deficiência de ferro. Os pacientes foram classificados em anemia por doença crônica apresentando sinais de inflamação (Proteína C reativa (PCR) > 5 mg/L; IST <20%; Hb <11,0 g/dL e ferritina ³100 ng/mL), anemia por deficiência absoluta de ferro (IST<20% e ferritina <100 ng/mL) e anemia por DRC (IST<20%; Hb<11,0 g/dL e ferritina ³100 ng/mL) e foram comparados a um grupo controle (indivíduos saudáveis).
No grupo com anemia por deficiência de ferro, observou-se uma diminuição significativa dos valores de CHr em comparação com os controles (22,9 pg ± 2.9 vs 30,9 pg ± 1,3; p<0,001), sendo que o CHr foi significativamente correlacionado com ferritina, IST e ferro sérico (p<0,001) confirmando a confiabilidade do CHr em detectar baixos níveis na reserva de ferro para diagnóstico da anemia por deficiência absoluta de ferro.
Para o grupo com anemia por doença crônica, o CHr apresentou-se menor quando comparado ao grupo controle (25,1 pg ± 4,8 vs 30,9 ±1.3 p<0,001) e correlacionou-se de maneira modesta com ferritina (r=0,271; p=0,036) e IST (r=0,394; p=0,002) e apresentou uma correlação negativa com PCR, indicando que o mesmo não sofre influência do processo inflamatório, tornando-se assim um marcador confiável na determinação do estado de ferro para diagnóstico da anemia de doença crônica.
Ao se analisar o grupo com DRC, o CHr foi significativamente menor quando comparado ao grupo controle (24,8 pg ± 2,0 vs 30,9 ± 1,3; p<0,001), porém a ferritina foi significativamente superior quando comparado ao grupo controle (52,6 µg/L ± 31,6 vs 9,7 µg/L ± 1.2; p< 0,001). O CHr apresentou ainda uma fraca correlação com a ferritina, (r = 0,228, p = 0,023), que pode ser explicada pelo fato de que os pacientes incluídos neste grupo apresentavam ferritina já elevada, que pode ser devido à presença de um processo inflamatório, comumente associado a anemia na DRC, interferindo assim na determinação da real situação do estado de ferro. De forma semelhante aos achados do grupo com anemia por doença crônica, o CHr também foi inversamente correlacionado com PCR (r = 0,633, p < 0,001), indicando que o mesmo não sofre interferência do processo inflamatório.(21)
Considerações finais
Foram descritos nesta revisão da literatura estudos que investigaram o conteúdo de hemoglobina do reticulócito na avaliação da resposta eritropoética ante a terapia de ferro IV, bem como na identificação da deficiência funcional e absoluta de ferro em pacientes com DRC em tratamento dialítico.
Os protocolos trazem como recomendações para o diagnóstico da deficiência funcional e absoluta de ferro e avaliação da resposta à terapia de ferro a utilização dos marcadores IST e ferritina. Entretanto, estes marcadores sofrem interferência direta dos mediadores liberados durante o processo inflamatório comumente associado à DRC. Neste contexto, emerge-se o conteúdo de hemoglobina do reticulócito que, embora possa ser expresso através de denominações diferentes, a depender do tipo de analisador, comprovadamente pode ser utilizado alternadamente na prática clínica.(24,37)
Os artigos avaliados demostraram que o conteúdo de hemoglobina do reticulócito reflete precocemente a disponibilidade de ferro para os precursores eritropoéticos frente à terapia IV de ferro quando comparado aos marcadores IST e ferritina. Seu desempenho diagnóstico foi analisado por meio da comparação com ferritina e IST e da determinação de valores de corte. Na avaliação da disponibilidade de ferro, o valor de corte para o conteúdo de hemoglobina do reticulócito que apresentou melhor desempenho ao detectar uma resposta frente ao tratamento de ferro IV foi 30,8 pg, demonstrando uma sensibilidade de 78,7% e especificidade de 87,2%.(31)
Este parâmetro apresentou desempenho diagnóstico considerável no diagnóstico diferencial da deficiência funcional e absoluta de ferro. Os estudos relatados nesta revisão demonstraram através da análise da curva ROC, utilizando ferritina e IST como padrão de comparação, que um valor de corte para o conteúdo de hemoglobina do reticulócito menor que 28,9 pg possibilita a identificação da deficiência absoluta de ferro em pacientes com anemia na DRC, com uma sensibilidade de 90% e especificidade de 75%.(32) Para a detecção da deficiência funcional de ferro, o valor de corte que demostrou melhor performance foi 29,8 pg com sensibilidade de 90% e especificidade de 83,1%.(36)
Dessa forma, a avaliação deste parâmetro pode auxiliar de maneira satisfatória o acompanhamento da resposta eritropoética perante o tratamento com ferro intravenoso e eritropoetina, bem como na avaliação da deficiência de ferro nos pacientes submetidos à hemodiálise.
Embora este parâmetro se apresente vantajoso, sua utilização na prática clínica ainda é limitada, em virtude da ausência de padronização das metodologias de obtenção deste parâmetro, bem como para interpretação de resultados por ele fornecidos. O uso limitado deste parâmetro pode também ser atribuído à falta de conhecimento, uma vez que este parâmetro é liberado, juntamente com os índices hematimétricos do hemograma, somente por alguns modelos de analisadores hematológicos das empresas Siemens, Abbott Labotatories, Horiba e Sysmex, demonstrando a necessidade da divulgação de estudos que demostraram sua superioridade frente aos parâmetros tradicionais de avaliação do estado de ferro.
Abstract
Anemia is an important complication in chronic kidney disease (CKD), culminating with the increase in morbidity and mortality, making it fundamental to search for hematological markers that allow its early diagnosis. This review aimed to review in the literature studies that investigated the association between hemoglobin content in reticulocytes and anemia in patients with CKD in dialysis and to generate evidence of its importance in clinical practice. The hemoglobin content of the reticulocytes evaluates the hemoglobin contained in the reticulocytes, which, after release of the bone marrow, remain in the peripheral blood 1 to 4 days before their maturation completes, giving it greater specificity in reflecting the availability of iron to the reticulocytes. Hematopoietic precursors, in addition to providing an early assessment of the erythropoietic response to IV iron treatment. The articles selected in this review have demonstrated that the reticulocyte hemoglobin content in addition to early reflection of the availability of iron to the hematopoietic precursors does not suffer interference from inflammatory cytokines, making it an effective marker in the monitoring of iron kinetics in dialysis patients.
Keywords
Anemia; chronic kidney failure; dialysis; reticulocytes
REFERÊNCIAS
- Tomasello S. Anemia of chronic kidney disease. J. Pharm. Pract 2008; 21(3):181-195. DOI: 10.1177/0897190008315906.
- Cases A, Egocheagab MI, Tranchec S, Pallarésd V, Ojedaa R, Górriza JL, et al. Anemia en la enfermedad renal crónica: protocolo de estudio, manejo y derivación a Nefrología. Rev de la Soc Espan de Nefrol 2018; 38(1):8-12. https://doi.org/10.1016/j.nefro. 2017.09.004
- Kalantar-Zadeh K, Rodriguez RA, Humphreys MH. Association between serum ferritin and measures of inflammation, nutrition and iron in haemodialysis patients. Nephrol Dial Transplant. 2004 Jan;19 (1):141-9.
- Babitt JL, Lin HY. Molecular mechanisms of hepcidin regulation: implications for the anemia of CKD. Am J Kidney Dis. 2010 Apr;55 (4):726-41. doi: 10.1053/j.ajkd.2009.12.030.
- Babitt JL, Lin HY. Mechanisms of Anemia in CKD. J Am Soc Nephrol. 2012 Oct;23(10):1631-4. DOI: 10.1681/ASN.2011111078.
- Barros F, Neto R, Vaz R, Pestana M. Anemia in Chronic Kidney Disease: from facts to clinical practice. Acta Med Port. 2011 Dec;24 Suppl 4:869-74. [Article in Portuguese].
- Vianna HR, Soares CM, Tavares MS, Teixeira MM, Silva AC. Inflammation in chronic kidney disease: the role of cytokines. J Bras Nefrol. 2011;33(3):351-64. DOI: 10.1590/s0101-280020 1100 0300012. [Article in Portuguese].
- Weiss G, Goodnough LT. Anemia of chronic disease. N Engl J Med 2005;352(10):1011-23. DOI: 10.1056/NEJMra041809
- de Oliveira Júnior WV, Sabino Ade P, Figueiredo RC, Rios DR. Inflammation and poor response to treatment with erythropoietin in chronic kidney disease. J Bras Nefrol. 2015;37(2):255-63. doi: 10.5935/0101-2800.20150039. [Article in English, Portuguese].
- Grotto HZW. Metabolismo do ferro: uma revisão sobre os principais mecanismos envolvidos em sua homeostase. Rev. Bras. Hematol. Hemoter. 2008;30(5):390-397. Acessível em: http://www. scielo.br/scielo.php?script=sci_arttext&pid=S1516-84842008000500012&lng=en
- Abensur H, Bastos MG, Cansiani MEF. Aspectos atuais da anemia na doença renal crônica. J Bras Nefrol 2006; 28(2):104-107.
- Porto G, Oliveira S, Pinto JP. Hepcidina: a molécula-chave na regulação do metabolismo do ferro. J Port Gastrenterol. [Internet]. 2012; 19(1):26-32. Disponível em: http://www.scielo.mec.pt/scielo. php?script=sci_ arttext&pid=S0872-8178201200010000 5&lng =pt.
- KDOQI. Clinical Practice Guideline and Clinical Practice Recommendations for Anemia in Chronic Kidney Disease. 2007 Update of Hemoglobin Target. Am J Kidney Dis 2007;50(3):471-530. DOI: 10.1053/j.ajkd.2007.06.008.
- Vaage-Nilsen O. Revised European Best Practice Guidelines for the management of anaemia in patients with chronic renal failure, part III.2: treatment of anaemia with iron. Nephrol Dial Transplant. 2005 Jul;20(7):1512-3; author reply 1513-4. DOI: 10.1093/ndt/gfh976.
- Mikhail A, Brown C, Williams JA, Mathrani V, Shrivastava R, Evans J, et al. Renal association clinical practice guideline on Anaemia of Chronic Kidney Disease. BMC Nephrol. 2017 Nov 30;18(1):345. doi: 10.1186/s12882-017-0688-1.
- KDIGO. Clinical Practice Guideline for Anemia in Chronic Kidney Disease. Kidney Inter. Suppl. 2012; 2: 279–335.
- Brasil. Ministério da Saúde. Protocolo clínico e diretrizes terapêuticas: Anemia na doença renal crônica. Portaria SAS/MS nº 365 de 15 de fevereiro de 2017 [Internet] 2017. Brasília: Ministério da Saúde [acessado 2018 jun 07]. Disponível em: http://portalarquivos 2. saude.gov.br/images/pdf/2018/marco/19/Portaria-SAS-365–PDCT–Anemia-na-DRC-15-02-2017-anexo-retificado.pdf.
- Grotto HZW. Diagnóstico laboratorial da deficiência de ferro. Rev Bras Hematol Hemoter 2010; 22-28.
- Bastos MG, Kirsztajn GM. Doença renal crônica: Importância do diagnóstico precoce, encaminhamento imediato e abordagem inter-disciplinar estruturada para melhora do desfecho em pacientes ainda não submetidos à diálise. J Bras Nefrol. 2011;33(1)93-108.
- Mast AE, Blinder MA, Dietzen DJ. Reticulocyte hemoglobin content. Am J Hematol 2008;83(4):307-310. DOI: 10.1002/ajh.21090.
- Parodi E, Giraudo MT, Ricceri F, Aurucci ML, Mazzone R, Ramenghi U. Absolute reticulocyte count and reticulocyte hemoglobin content as predictors of early response to exclusive oral iron in children with iron deficiency anemia. Anemia. 2016;1-6. doi: 10.1155/2016/7345835.
- Peerschke EL, Pessin MS, Maslak P. Using the hemoglobin content of reticulocytes (RET-He) to evaluate anemia in patients with cancer. Am J Clin Pathol. 2014;142(4):506-12. doi: 10.1309/AJCPCVZ5 B0BOYJGN.
- Piva E, Brugnara C, Spolaore F, Plebani M. Clinical utility of reticulocyte parameters. Clin Lab Med. 2015;35(1):133-63. doi: 10.1016/j.cll.2014.10.004.
- Wirawan R, Ailinda TT, Henrika F, Lydia A. Concordance between Reticulocyte Hemoglobin Equivalent and Reticulocyte Hemoglobin Content in CKD Patients Undergoing Hemodialysis. Acta Med Indones. 2017;49(1):34-40.
- Capone D, Cataldi M, Vinciguerra M, Mosca T, Barrett S, Ragosta A, et al. Reticulocyte Hemoglobin Content Helps Avoid Iron Overload in Hemodialysis Patients: A Retrospective Observational Study. In Vivo. 2017 Jul-Aug;31(4):709-712. DOI: 10.21873/invivo.11118.
- Pedruzzi LM, Cardozo LF, Medeiros RF, Stockler-Pinto MB, Mafra D. Association between serum ferritin and lipid peroxidation in hemodialysis patients. J Bras Nefrol. 2015;37(2):171-6. doi: 10.5935/0101-2800.20150028. [Article in English, Portuguese].
- Ward R. An update on disordered iron metabolism and iron overload. Hematology. 2010 Oct;15(5):311-7. doi: 10.1179/102453310X1264 7083621164.
- Kaneko Y, Miyazaki S, Hirasawa Y, Gejyo F, Suzuki M. Transferrin saturation versus reticulocyte hemoglobin content for iron deficiency in Japanese hemodialysis patients. Kidney Int 2003; 63(3):1086-93.
- Dalimunthe NN, Lubis AR. Usefulness of reticulocyte hemoglobin equivalent in management of regular hemodialysis patients with iron deficiency anemia. Rom J Intern Med. 2016 Jan-Mar;54(1):31-6.
- Mittman N, Sreedhara R, Mushnick R, Chattopadhyay J, Zelmanovic D, Vaseghi M, Avram MM. Reticulocyte hemoglobin content predicts functional iron deficiency in hemodialysis patients receiving rHuEPO. Am J Kidney Dis. 1997 Dec;30(6):912-22. DOI: 10.1016/s0272-6386(97)90104-9.
- Urrechaga E, Boveda O, Aguayo FJ, de la Hera P, Munoz R I, Gallardo I, et al. Percentage of hypochromic erythrocytes and reticulocyte hemoglobin equivalent predictors of response to intravenous iron in hemodialysis patients. Int J Lab Hematol. 2016 Aug;38(4):360-5. doi: 10.1111/ijlh.12496.
- Davidkova S, Prestidge TD, Reed PW, Kara T, Wong W, Prestidge C. Comparison of reticulocyte hemoglobin equivalent with traditional markers of iron and erythropoiesis in pediatric dialysis. Pediatr Nephrol 2016;31(5):819-26. doi: 10.1007/s00467-015-3284-2.
- Zupan IP, Varl J, Kovac D, Cernelc P, Mlakar U, Andoljsek D, et al. Indices of iron status in patients treated by chronic haemodialysis. Pflugers Arch. 2001;442(6 Suppl 1):R202-3. DOI: 10.1007/s004240100025
- Hayes W. Measurement of iron status in chronic kidney disease. Pediatr Nephrol. 2019;34(4):605-613. doi: 10.1007/s00467-018-3955-x.
- Ageeli AA, Algahtani FH, Alsaeed AH. Reticulocyte hemoglobin content and iron deficiency: a retrospective study in adults. Genet Test Mol Biomarkers. 2013 Apr;17(4):278-83. doi: 10.1089/gtmb.2012.0337
- Urrechaga E, Borque L, Escanero JF. Erythrocyte and reticulocyte indices in the assessment of erythropoiesis activity and iron availability. Int J Lab Hematol. 2013 Apr;35(2):144-9. doi: 10.1111/ijlh.12013.
- Maconi M, Cavalca L, Danise P, Cardarelli F, Brini M. Erythrocyte and reticulocyte indices in iron deficiency in chronic kidney disease: comparison of two methods. Scand J Clin Lab Invest. 2009;69(3):365-70. doi: 10.1080/00365510802657673.
Correspondência
Danyelle Romana Alves Rios
Campus Centro Oeste Dona Lindu
Universidade Federal de São João Del-Rei
Rua Sebastião Gonçalves Coelho, 400 – Chanadour
35501-296 – Divinópolis-MG, Brasil
