Biomarcadores de gravidade em pacientes oncológicos hospitalizados com e sem COVID-19
Severity biomarkers in hospitalized oncological patients with and without COVID-19
Mauren Isfer Anghebem1,2, Isabela Marquezini Rovel1, Luma Carolina Vieira1, Izabella Castilho Ribeiro dos Santos-Weiss2, Jeanine Marie Nardin3, Geraldo Picheth2, Fabiane Gomes de Moraes Rego2, Júlio Cezar Merlin1
1 Pontifícia Universidade Católica do Paraná, Brasil., Escola de Medicina e Ciências da Vida. Curitiba, PR, Brasil.
2 Universidade Federal do Paraná, Departamento de Análises Clínicas. Curitiba, PR, Brasil.
3 Hospital Erasto Gaertner. Curitiba, PR, Brasil.
Recebido em 24/03/2023
Aprovado em 24/03/2023
DOI: 10.21877/2448-3877.202300114
INTRODUÇÃO
Em 31 de dezembro de 2019, uma pneumonia de causa não identificada foi reportada à Organização Mundial de Saúde – OMS, na China. Este foi o primeiro relato de infecção por uma nova cepa de coronavírus, denominada coronavírus 2 da síndrome respiratória aguda grave (ou SARS-CoV-2, da sigla em inglês), causadora da doença coronavírus-19, COVID-19. Menos de um mês após o primeiro caso, o número de infectados pelo COVID-19 aumentou significativamente na China e em outros países. Estes fatos levaram a OMS a declarar Emergência em Saúde Pública de Interesse Internacional, em 30 de janeiro de 2020.(1,2)
No Brasil, o primeiro caso foi identificado em São Paulo, em 21 de fevereiro de 2020; e até 24 de março de 2023 o país acumula mais 37,2 milhões de casos e mais de 699 mil mortes por COVID-19.(3,4)
A pandemia ocasionada pelo SARS-CoV-2 desafiou profissionais de saúde, já que a COVID-19 apresenta espectro clínico variado e desfechos incertos.(5,6)
Acredita-se que a rápida disseminação do SARS-CoV-2 esteja associada à ligação da proteína de superfície Spike (proteína S), presente no envelope do vírus, ao receptor humano transmembrana do tipo ECA-2 (enzima conversora de angiotensina 2). Depois de ligar o receptor ECA-2, proteases do hospedeiro clivam a proteína S; a primeira clivagem é feita pela protease furina e depois a serina protease transmembranar 2 (TMPRSS2) faz a clivagem adicional da proteína S e internalização do vírion.(7)
ECA e ECA-2 são proteínas que, embora homólogas, exercem funções distintas no organismo. O angiotensinogênio é produzido no fígado e liberado na corrente sanguínea. A renina, secretada pelo aparelho justaglomerular, cliva o angiotensinogênio em angiotensina I (ANG I), que é posteriormente convertida à angiotensina II (ANG II) pela ECA, produzida principalmente nos pulmões. ANG II se liga aos receptores AT1 e AT2 para regular a pressão arterial e a inflamação.(8,9)
Paralelamente, a ECA-2 celular é clivada pela metaloprotease ADAM17 e a forma ativa da ECA-2 é liberada no ambiente extracelular. ECA-2 converte a ANG II em ANG 1-7, que se liga ao receptor Mas para mediar os efeitos opostos de ANG II. ECA-2 tem também a função de degradar a ANG II em ANG 1-7, que age na via do receptor Mas, ocasionando respostas anti-inflamatórias.(8-10)
A Figura 1 ilustra a entrada do SARS-CoV-2 na célula humana, a interação com ECA-2 e as consequências da ativação dos receptores AT1, AT2 e receptor Mas.
Os casos graves de COVID-19 parecem ter relação com comorbidades relacionadas a quadros sistêmicos de inflamação, como a hipertensão, diabetes e doenças cardiovasculares, embora diversos aspectos sobre a fisiopatologia da doença, a evolução clínica e o padrão de resposta imunológica ainda não tenham sido totalmente elucidados.(11,12)
Pessoas com câncer também apresentam maior risco de infecção por COVID-19, e neste grupo a COVID-19 tem sido associada a piores desfechos.(13,14)
Sob o ponto de vista clínico-laboratorial, os casos assintomáticos ou leves de COVID-19 se apresentam com pouca ou nenhuma alteração laboratorial. Já os marcadores hematológicos e bioquímicos dos pacientes com quadros clínicos graves apresentam alterações laboratoriais marcadas, em diversas populações. Quanto mais evidente for a alteração laboratorial, pior é o prognóstico, indicando o comprometimento multissistêmico causado pela COVID-19.(5,6,15–20)
As evidências científicas têm destacado algumas alterações laboratoriais nos pacientes hospitalizados com COVID-19. A relação aumentada neutrófilo/linfócito, a elevação do D-dímero, a redução da albumina plasmática e o aumento de diversos marcadores bioquímicos, como a proteína C-reativa, procalcitonina, ferritina, interleucinas (IL-6 e IL-10, entre outras), LDH e transaminases são encontradas em casos graves. Além destas alterações, os marcadores cardíacos, pancreáticos e renais estão sendo considerados bons preditores de gravidade e mortalidade na COVID-19.(21–25)
À medida que a pandemia de COVID-19 avança, a identificação de biomarcadores precoces de prognósticos e de gravidade em grupos de risco, como pacientes oncológicos, é uma necessidade urgente para a Saúde Pública, pois auxilia a tomada de decisão médica e direciona o manejo do paciente. Somado a isso, dados populacionais são fundamentais para a construção de bases epidemiológicas. Com base nestas premissas, o objetivo deste trabalho foi avaliar o perfil laboratorial de pacientes oncológicos com e sem COVID-19 internados em hospital de referência em câncer na Região Sul do Brasil em busca de biomarcadores que identifiquem a presença de COVID-19 neste grupo ou estratifiquem a gravidade da infecção.
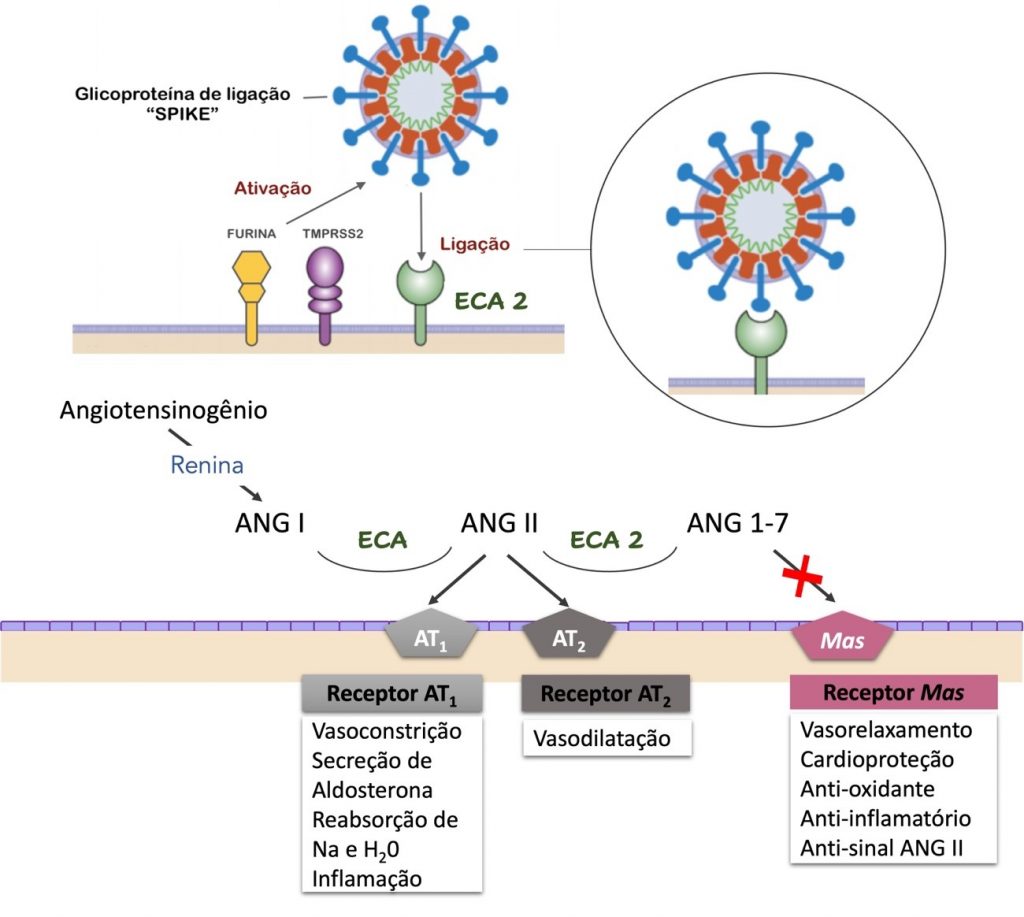
Figura 1
A entrada do vírus SARS-CoV-2 nas células humanas que expressam a ECA-2 (representada em verde) é mediada pela glicoproteína Spike (S) do envelope viral, representada em azul ao redor de todo o envelope viral. Depois de ligar o receptor ECA-2, proteases do hospedeiro clivam a proteína S. A primeira clivagem é feita pela protease furina (representada em amarelo) e, na sequência, a serina protease transmembranar 2 (TMPRSS2), representada em roxo, faz a clivagem adicional da proteína S e a internalização do vírion. Na parte inferior da imagem destacam-se as ações da angiotensina 1-7 (ANG 1-7), subproduto da angiotensina I, e as consequências do seu bloqueio, causado pela redução da atividade enzimática da ECA-2 devido a ligação da proteína S do SARS-CoV-2. AT1 = receptor da angiotensina II tipo 1; AT2 = receptor da angiotensina II tipo 2; Mas = receptor Mas da angiotensina 1-7. Fonte: Autores.
MATERIAL E MÉTODOS
Este é um estudo retrospectivo e transversal com pacientes oncológicos internados com suspeita de COVID-19 em hospital de referência em câncer na Região Sul do Brasil. O estudo foi aprovado pelo Comitê de Ética e Pesquisa da Liga Paranaense de Combate ao Câncer (CAAE 31592620.4.1001.009).
Foram incluídos pacientes oncológicos com idade igual ou maior que 18 anos hospitalizados entre abril de 2020 e setembro de 2021 no Hospital Erasto Gaertner.
A infecção por SARS-CoV-2 foi confirmada laboratorialmente através de pesquisa de antígeno viral positiva ou de teste molecular Reação em Cadeia da Polimerase da Transcrição Reversa em Tempo Real – qRT-PCR (do inglês, Real-Time Quantitative Reverse Transcription Polymerase Chain Reaction) detectável.
Foram excluídos deste estudo, a fim de reduzir vieses metodológicos, os pacientes oncológicos com diagnóstico laboratorial de COVID-19 que apresentaram contagem total de leucócitos inferior a 1.000/mL ou superiores a 50.000/mL e contagem de plaquetas superior a 700.000/mL, uma vez que estas alterações poderiam ser decorrentes do quadro neoplásico ou do tratamento oncológico. Também foram excluídos pacientes com tumores hematológicos.
Após a aplicação dos critérios de inclusão e exclusão, foram selecionados, aleatoriamente, 170 pacientes oncológicos hospitalizados, os quais foram divididos em dois grupos, conforme a presença ou não da COVID-19: Grupo Controle: pacientes com câncer e sem COVID-19, e Grupo Caso: pacientes com câncer e com COVID-19.
Os dados clínicos, antropométricos e laboratoriais foram obtidos do prontuário médico dos pacientes, após assinatura de Termo de Consentimento Livre e Esclarecido.
A escolha dos biomarcadores laboratoriais avaliados neste estudo foi baseada na característica inflamatória da COVID-19, na revisão de literatura e na disponibilidade dos resultados. Os parâmetros laboratoriais avaliados foram: contagem total de leucócitos, contagem absoluta de neutrófilos, contagem absoluta de linfócitos, relação neutrófilos/linfócitos (RNL), ferritina, creatinina e ureia, proteína C-Reativa (PC-R) e lactato.
Os ensaios laboratoriais bioquímicos foram realizados em sistema automatizado Vitros XT (Orthoclinical Diagnostics), e o hemograma, no analisador hematológico XN 2000 (Sysmex Co), empregando-se reagentes, calibradores e controles recomendados pelos fabricantes.
O tratamento estatístico foi realizado com o software Statistica 8.0 (StatSoft Inc, OK, USA). A normalidade das variáveis contínuas foi determinada pelo teste de Kolmogorov-Smirnov. Variáveis contínuas com distribuição normal foram expressas em média (± 1-desvio padrão) e os grupos comparados com o teste t de Student (independente, bidirecional). Variáveis sem normalidade foram apresentadas como mediana (intervalo interquartil; 25% a 75%) e comparadas com o teste U de Mann-Whitney.
Variáveis discretas foram comparadas com o teste do Qui-quadrado. Uma probabilidade P inferior a 0,05 (P<0,05) foi considerada significativa em todas as análises.
RESULTADOS E DISCUSSÃO
Dos 170 pacientes oncológicos selecionados de forma randômica, 96 não tinham COVID-19 e foram classificados como Controle, e 74 tinham COVID-19, sendo classificados como Caso. A Figura 2 ilustra a caracterização da amostra estudada.
A Tabela 1 sumariza as características antropométricas e laboratoriais dos grupos em estudo.
A estratégia de levar em consideração alguma variável de confusão já no delineamento do estudo é denominada pareamento. Idade e gênero são, em geral, consideradas variáveis que estão intimamente associadas à possibilidade de exposição e desenvolvimento de doenças. O pareamento dos casos e controles por gênero e idade torna os grupos mais comparáveis e minimiza potenciais distorções dos resultados na avaliação de riscos.(26)
Embora os participantes deste estudo tenham sido recrutados de forma aleatória, sem pareamento, a média da idade e a quantidade de homens e mulheres não foram diferentes entre os grupos (P=0,442 e P= 0,645, respectivamente), conforme descrito na Tabela 1, indicando homogeneidade em relação a estes parâmetros.
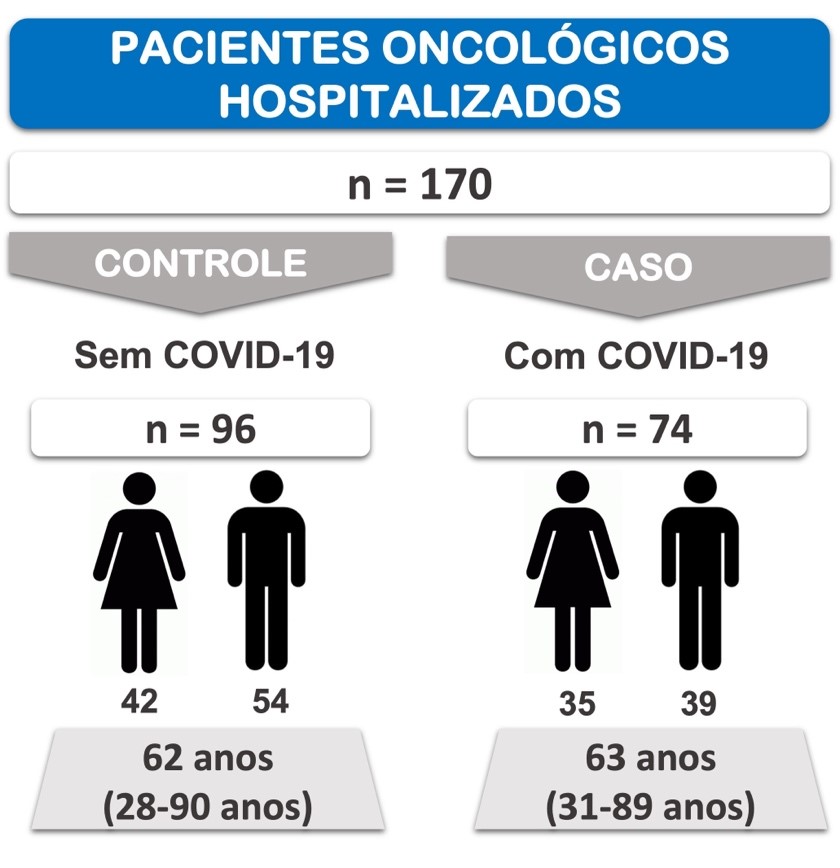
Figura 2
Caracterização da amostra estudada. Os grupos foram formados a partir da seleção aleatória de pacientes oncológicos internados em hospital de referência em câncer no Sul do Brasil. Fonte: Autores.
Tabela 1
Características antropométricas e laboratoriais dos grupos em estudo
| Parâmetros | n | Controle | n | Caso | P |
| Gênero (Homens/Mulheres) | 96 | 54/42 | 74 | 39/35 | 0,645** |
| Idade (anos) | 96 | 62±13 | 74 | 63±12 | 0,442 |
| Leucócitos Totais / µL | 96 | 9,5 (6,6-13,3) | 74 | 7,7 (5,3-13,2) | 0,436* |
| Neutrófilos / µL | 96 | 8.163 (4.808-11.100) | 74 | 6.891 (4001-11811) | 0,502* |
| Linfócitos / µL | 96 | 757 (401-1.251) | 74 | 799 (454-1.379) | 0,858* |
| Neutrófilos/Linfócitos (NLR) | 96 | 10,8 (5,0-17,8) | 74 | 9,85 (4,7-22,5) | 0,122* |
| Ferritina (ng/mL) | 58 | 464 (172-998) | 42 | 759 (382-1.440) | 0,052* |
| Creatinina (mg/dL) | 96 | 0,7 (0,5-1,1) | 73 | 0,7 (0,4-1,4) | 0,594* |
| Ureia (mg/dL) | 90 | 50,5 (35-84) | 74 | 54,5 (30-94) | 0,880* |
| PCR (mg/dL) | 75 | 16 (8,9-23,9) | 59 | 12,7 (9,4-20,8) | 0,751* |
| Lactato, mmol/L | 71 | 1,8 (1,4-2,8) | 58 | 1,7 (1,2-2,5) | 0,219* |
Os resultados para as variáveis são apresentados como: Média±1-DP, Mediana (intervalo interquartil, 25% a 75%) e n (número de dados). Probabilidade (P), Teste t de Student (bidirecional) para variáveis independentes; *teste U de Mann-Whitney ou **teste do Qui-quadrado. Normalidade verificada com teste de Kolmogorov-Smirnov. NLR: relação neutrófilo/linfócito. PC-R: proteína C-reativa.
Os parâmetros bioquímicos e hematológicos avaliados (leucócitos totais, neutrófilos, linfócitos, relação neutrófilos/linfócitos, ferritina, creatinina, ureia, PC-R e lactato) não foram estatisticamente diferentes entre os grupos (P>0,05), conforme demonstrado na Tabela 1.
A população leucocitária (monócitos, linfócitos e neutrófilos) desempenha um papel crucial na resposta inflamatória sistêmica à infecção grave, lesão, politrauma e choque, e é utilizada como indicador de gravidade da resposta imune. Pacientes com quadros graves de COVID-19 apresentam leucocitose, neutrofilia e linfopenia mais acentuadas do que aqueles com doença leve e moderada.(27,28)
Os dados apresentados na Tabela 1 mostram que os pacientes avaliados neste estudo apresentaram média de valores de leucócitos totais, neutrófilos e linfócitos dentro do valor de referência; portanto, estes parâmetros laboratoriais não foram capazes de estratificar ou diferenciar os grupos com e sem COVID-19. Uma explicação plausível para este achado é a possibilidade destes pacientes estarem em situação oncológica estável e com quadros leves de COVID-19, dados estes não disponíveis para análise.
A relação neutrófilo/linfócito (do inglês Neutrophil Lymphocyte Ratio) é calculada como a contagem absoluta de neutrófilos dividida pela contagem absoluta de linfócitos; e 95% dos adultos saudáveis têm uma relação entre 0,78 e 3,53.(29)
A RNL tem sido apontada como um biomarcador independente para avaliar a gravidade da doença, a hospitalização e a gravidade da COVID-19,(27,30) valendo ressaltar que a estreita associação entre a inflamação sistêmica e a progressão do câncer também destaca a RNL como um potencial biomarcador de prognóstico de câncer.(28)
Por ser um marcador de disfunção endotelial, hipoteticamente a RNL poderia ser útil na identificação de pacientes oncológicos hospitalizados com COVID-19, em que a infecção pelo SARS-CoV-2, pelo seu caráter inflamatório exacerbado, seria o fator de risco para um pior prognóstico.(31)
Todavia, os resultados encontrados no presente estudo não demonstraram diferença entre os grupos (P=0,122, Tabela 1). As medianas da RNL estavam acima dos valores considerados normais em ambos os grupos. Uma possível explicação seria o fato da RNL fornecer um índice indireto do estado inflamatório do paciente, condição frequente em pacientes com COVID-19, mas também em portadores de tumores sólidos.(30)
Somado a isso, o estudo não levou em consideração o tipo de tumor e o estadiamento; neoplasias em estádio avançado poderiam induzir maior processo inflamatório e camuflar uma RNL aumentada em virtude da resposta imune à COVID-19. Portanto, em pacientes oncológicos com COVID-19, a RNL pode não identificar a piora do quadro clínico decorrente da COVID-19.
As evidências acumuladas têm mostrado que a ferritina sérica é um biomarcador de gravidade nas infecções por SARS-CoV-2.(32–34)
A ferritina é uma proteína de fase aguda sintetizada pelo fígado para estocar o ferro dentro de células, inclusive dentro dos macrófagos. Várias citocinas, como a interleucina-6 (IL-6) e o fator de necrose tumoral alfa (TNF-alfa, do inglês Tumor Necrosis Factor-alpha), estimulam a liberação de ferritina na corrente sanguínea.(33)
Com o processo inflamatório exacerbado presente na COVID-19, ocorre ativação dos macrófagos e maior captação de ferro. Por consequência, há maior síntese hepática de ferritina para que este ferro possa ser estocado nas células. De fato, pacientes com COVID-19 em estado grave apresentam concentrações plasmáticas de ferritina significativamente superiores àqueles com quadros não graves, destacando esta proteína como marcador de falência de órgãos na COVID-19.(34,35)
Uma vez que a liberação de ferritina no plasma é estimulada por citocinas inflamatórias, explicam-se as altas concentrações observadas em condições inflamatórias variadas, inclusive em quadros cancerígenos.(32,33)
No presente trabalho, ambos os grupos apresentaram concentrações medianas de ferritina acima do valor de referência, indicando que em quadros inflamatórios sistêmicos, como COVID-19 e câncer, há maior liberação de ferritina. Não houve diferença estatística entre os grupos, embora o valor de probabilidade tenha sido próximo da significância (P=0,052). Logo, a interpretação dos resultados de ferritina em pacientes com COVID-19 e outras comorbidades associadas requer cautela, mas é possível que a ferritina possa ser um biomarcador para COVID-19 promissor em pacientes oncológicos em estudos com maior tamanho amostral.
Os parâmetros creatinina e ureia são usualmente dosados como marcadores renais. No contexto da COVID-19, ambos foram apontados como biomarcadores de comprometimento renal e gravidade da doença. Pacientes com COVID-19 que apresentam valores aumentados destes marcadores na admissão hospitalar têm maior risco de mortalidade.(36)
No presente estudo, as concentrações medianas de creatinina e ureia de ambos os grupos estavam dentro dos valores de referência e não diferiram entre os grupos (P=0,594 e P= 0,880, respectivamente; Tabela1).
Proteínas de fase aguda, como a proteína C-reativa (PC-R), são marcadores inespecíficos de processos inflamatórios e infecciosos. É de se esperar que em condições onde ocorra uma resposta imune acentuada, como na COVID-19 e em processos tumorais, a PC-R se encontre aumentada.(37,38)
Os dados encontrados neste trabalho corroboram esta situação. Ambos os grupos estudados apresentaram valores de PC-R acima do valor de referência, mas sem diferença significativa entre controles e casos (P=0,751, Tabela 1).
O lactato é o produto final mais importante do metabolismo anaeróbico, formado na via glicolítica. A redução na oferta de oxigênio para a célula (hipóxia) normalmente leva à hiperprodução de lactato, pois o piruvato não pode mais ser oxidado no ciclo de Krebs pela falta de oxigênio, e é, portanto, convertido em lactato.(39)
O aumento de lactato no sangue é denominado hiperlactatemia e tem sido associado a maior risco de morte em pacientes hospitalizados.(40)
A COVID-19, em sua forma grave, pode culminar em síndrome do desconforto respiratório agudo grave.(39,41)
A hipóxia ocorre também em outras condições patológicas como infecções, isquemia, inflamação e tumores.(41)
Nosso estudo não demonstrou diferença significativa na concentração do lactato entre os grupos (P=0,219, Tabela 1) e os valores medianos estavam dentro do valor de referência. Temos como hipótese que os pacientes estudados não apresentavam comprometimento respiratório importante e/ou tenham recebido oxigenoterapia; e, ainda, o quadro neoplásico não estava causando hipóxia suficiente para ativação da via glicolítica.
Este estudo apresenta limitações. É um estudo retrospectivo e de centro único, e não foram considerados o tipo e o estadio da doença oncológica. Dependendo do órgão afetado pelo tumor e do estadiamento da doença, os marcadores laboratoriais avaliados poderiam sofrer menor ou maior alteração, mesmo no grupo Controle (sem COVID-19). A classificação clínica da COVID-19 (moderada ou grave) também não foi realizada no grupo Caso. Sabe-se que pacientes com casos leves de COVID-19 geralmente não apresentam alterações laboratoriais significativas.(9)
A utilização de biomarcadores laboratoriais tem demonstrado relevância e objetividade na avaliação clínica de pacientes com COVID-19, tanto na determinação da gravidade da doença, quanto no monitoramento e prognóstico. Os marcadores que usualmente estratificam bem a gravidade da COVID-19, como RNL, ferritina, creatinina, ureia, PC-R e lactato, não discriminaram pacientes com câncer com e sem COVID-19. A hipótese construída com esta base factual considera que a amostra em estudo não contempla maioria de casos de COVID-19 em sua forma clínica grave, em que as alterações dos biomarcadores são exuberantes e possivelmente permitiriam uma discriminação entre os grupos em estudo.
Outro elemento a ser considerado é a complexidade das alterações dos pacientes com diferentes tipos e estágios de câncer, destacando as alterações metabólicas e respostas às terapias. Neste caso, seria relevante que novos estudos, com grupos categorizados quanto ao tipo de câncer e seu estádio para proporcionar maior homogeneidade nas análises, fossem realizados.
A busca de biomarcadores para identificar as alterações metabólicas associadas à COVID-19 é relevante e deve ser continuada. Estas moléculas têm potencial para identificar o risco aumentado da gravidade da infecção viral e, consequentemente, auxiliar na projeção do quadro clínico e no prognóstico evolutivo da viremia.
CONCLUSÃO
Os biomarcadores avaliados neste estudo não diferenciaram a presença de COVID-19 em pacientes com diferentes tipos de câncer.
REFERÊNCIAS
- Rothan HA, Byrareddy SN. The epidemiology and pathogenesis of coronavirus disease (COVID-19) outbreak. J Autoimmun. 2020;109:102433. doi: 10.1016/j.jaut.2020.102433.
- Gralinski LE, Menachery VD. Return of the Coronavirus: 2019-nCoV. Viruses. 2020;12(2):135. doi: 10.3390/v12020135.
- BRASIL. Coronavirus Brasil. [Internet]. Ministério da Saúde. 2022 [citado 5 de maio de 2022]. Disponível em: https://covid.saude.gov.br/
- Rodriguez-Morales AJ, Gallego V, Escalera-Antezana JP, Méndez CA, Zambrano LI, Franco-Paredes C, et al. COVID-19 in Latin America: The implications of the first confirmed case in Brazil. Travel Med Infect Dis. 2020; 35:101613. doi: 10.1016/j.tmaid.2020.101613.
- Dietrich CG, Hübner D, Marx G, Bickenbach J, Bootsveld A. Primary presentation of COVID-19 solely with gastrointestinal symptoms: a problem for the containment of the disease. Eur J Gastroenterol Hepatol. 2020; 32(11):1475-1478. doi: 10.1097/MEG.0000000000001922.
- Pongpirul WA, Wiboonchutikul S, Charoenpong L, Panitantum N, Vachiraphan A, Uttayamakul S, et al. Clinical course and potential predictive factors for pneumonia of adult patients with Coronavirus Disease 2019 (COVID-19): A retrospective observational analysis of 193 confirmed cases in Thailand. PLoS Negl Trop Dis. 2020;14(10):e0008806. doi: 10.1371/journal.pntd.0008806.
- Clerkin KJ, Fried JA, Raikhelkar J, Sayer G, Griffin JM, Masoumi A, et al. COVID-19 and Cardiovascular Disease. Circulation. 2020;141(20):1648-1655. doi: 10.1161/CIRCULATIONAHA.120.046941.
- Anghebem MI, Rego FG de M, Picheth G. COVID-19 e Diabetes: a relação entre duas pandemias distintas. Rev Bras Análises Clínicas. 2020;52(2):154-9. doi: 10.21877/2448-3877.20200001.
- Anghebem MI, Picheth G, Rego FG de M. Alterações em biomarcadores laboratoriais associados a COVID-19. Newslab. 2020;152:16-37.
- Brandão SCS, Godoi ETAM, Ramos J de OX, Melo LMMP de, Sarinho ESC. COVID-19 grave: entenda o papel da imunidade, do endotélio e da coagulação na prática clínica. J Vasc Bras. 2020;19:e20200131. doi.org/10.1590/1677-5449.200131.
- Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020 Mar 28;395(10229):1054-1062. doi: 10.1016/S0140-6736(20)30566-3.
- Guo W, Li M, Dong Y, Zhou H, Zhang Z, Tian C, et al. Diabetes is a risk factor for the progression and prognosis of COVID-19. Diabetes Metab Res Rev. 2020;36(7):e3319. doi: 10.1002/dmrr.3319.
- Lee KA, Ma W, Sikavi DR, Drew DA, Nguyen LH, et al. COPE consortium. Cancer and Risk of COVID-19 Through a General Community Survey. Oncologist. 2021;26(1):e182–5. doi: 10.1634/theoncologist.2020-0572.
- Grivas P, Khaki AR, Wise-Draper TM, French B, Hennessy C, Hsu CY, et al. Association of clinical factors and recent anticancer therapy with COVID-19 severity among patients with cancer: a report from the COVID-19 and Cancer Consortium. Ann Oncol. 2021;32(6):787-800. doi: 10.1016/j.annonc.2021.02.024.
- Bode B, Garrett V, Messler J, McFarland R, Crowe J, Booth R, et al. Glycemic Characteristics and Clinical Outcomes of COVID-19 Patients Hospitalized in the United States. J Diabetes Sci Technol. 2020;14(4):813-821. doi: 10.1177/1932296820924469.
- Sepulchre E, Pittie G, Stojkovic V, Haesbroek G, Crama Y, Schyns M, et al. Covid-19: contribution of clinical characteristics and laboratory features for early detection of patients with high risk of severe evolution. Acta Clin Belg. 2022;77(2):261-267. doi: 10.1080/17843286.2020.1822078.
- Vargas-Vargas M, Cortés-Rojo C. Ferritin levels and COVID-19. Rev Panam Salud Publica. 2020;44:e72. doi: 10.26633/RPSP.2020.72.
- Xiao L, Sakagami H, Miwa N. ACE2: The key Molecule for Understanding the Pathophysiology of Severe and Critical Conditions of COVID-19: Demon or Angel? Viruses. 2020;12(5):491. doi: 10.3390/v12050491.
- Young BE, Ong SWX, Kalimuddin S, Low JG, Tan SY, et al.; Singapore 2019 Novel Coronavirus Outbreak Research Team. Epidemiologic Features and Clinical Course of Patients Infected With SARS-CoV-2 in Singapore. JAMA. 2020;323(15):1488-1494. doi: 10.1001/jama.2020.3204.
- Yousaf Z, Al-Shokri SD, Al-Soub H, Mohamed MFH. COVID-19-associated SIADH: a clue in the times of pandemic! Am J Physiol Endocrinol Metab. 2020;318(6):E882-E885. doi: 10.1152/ajpendo.00178.2020.
- Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497-506. doi: 10.1016/S0140-6736(20)30183-5.
- Lippi G, Plebani M. The critical role of laboratory medicine during coronavirus disease 2019 (COVID-19) and other viral outbreaks. Clin Chem Lab Med. 2020;58(7):1063-1069. doi: 10.1515/cclm-2020-0240.
- Bhandari S, Sharma S, Bhargava A, Keswani P, Sharma R, Shekhawat A. Inflammatory Markers in COVID-19. Ann Acad Med Singap. 2020;49(6):393-397.
- Perricone C, Bartoloni E, Bursi R, Cafaro G, Guidelli GM, Shoenfeld Y, et al. COVID-19 as part of the hyperferritinemic syndromes: the role of iron depletion therapy. Immunol Res. 2020;68(4):213-224. doi: 10.1007/s12026-020-09145-5.
- Majure DT, Gruberg L, Saba SG, Kvasnovsky C, Hirsch JS, et al; Northwell Health COVID-19 Research Consortium. Usefulness of Elevated Troponin to Predict Death in Patients With COVID-19 and Myocardial Injury. Am J Cardiol. 2021; 138:100-106. doi: 10.1016/j.amjcard.2020.09.060.
- Kleinbaum D, Kupper L, Morgenstern H. Epidemiologic research. Principles and quantitative methods. Belmont CA: Lifetime Learning Publications; 1982.
- La Torre G, Marte M, Massetti AP, Carli SM, Romano F, et al; COVID-Collaborative group. The neutrophil/lymphocyte ratio as a prognostic factor in COVID-19 patients: a case-control study. Eur Rev Med Pharmacol Sci. 2022;26(3):1056-1064. doi: 10.26355/eurrev_202202_28017.
- Cupp MA, Cariolou M, Tzoulaki I, Aune D, Evangelou E, Berlanga-Taylor AJ. Neutrophil to lymphocyte ratio and cancer prognosis: an umbrella review of systematic reviews and meta-analyses of observational studies. BMC Med. 2020;18(1):360. doi: 10.1186/s12916-020-01817-1.
- Forget P, Khalifa C, Defour JP, Latinne D, Van Pel MC, De Kock M. What is the normal value of the neutrophil-to-lymphocyte ratio? BMC Res Notes. 2017;10(1):12. doi: 10.1186/s13104-016-2335-5.
- Şener G, Bayrak T, Coşkun C, Bayrak A. Neutrophil Lymphocyte Ratio, Monocyte Lymphocyte Ratio, Platelet Lymphocyte Ratio in Covid-19 Patients. Clin Lab. 2022;68(3). doi: 10.7754/Clin.Lab.2021.210639.
- Jimeno S, Ventura PS, Castellano JM, García-Adasme SI, Miranda M, Touza P, et al. Prognostic implications of neutrophil-lymphocyte ratio in COVID-19. Eur J Clin Invest. 2021 Jan;51(1):e13404. doi: 10.1111/eci.13404.
- Kaushal K, Kaur H, Sarma P, Bhattacharyya A, Sharma DJ, Prajapat M, et al.. Serum ferritin as a predictive biomarker in COVID-19. A systematic review, meta-analysis and meta-regression analysis. J Crit Care. 2022; 67:172-181. doi: 10.1016/j.jcrc.2021.09.023.
- Mahroum N, Alghory A, Kiyak Z, Alwani A, Seida R, Alrais M, et al. Ferritin – from iron, through inflammation and autoimmunity, to COVID-19. J Autoimmun. 2022; 126:102778. doi: 10.1016/j.jaut.2021.102778.
- Lin Z, Long F, Yang Y, Chen X, Xu L, Yang M. Serum ferritin as an independent risk factor for severity in COVID-19 patients. J Infect. 2020; 81(4):647-679. doi: 10.1016/j.jinf.2020.06.053.
- Qeadan F, Tingey B, Gu LY, Packard AH, Erdei E, Saeed AI. Prognostic Values of Serum Ferritin and D-Dimer Trajectory in Patients with COVID-19. Viruses. 2021; 13(3):419. doi: 10.3390/v13030419.
- Liu YM, Xie J, Chen MM, Zhang X, Cheng X, Li H, et al. Kidney Function Indicators Predict Adverse Outcomes of COVID-19. Med. 2021; 2(1):38-48.e2. doi: 10.1016/j.medj.2020.09.001.
- Bivona G, Agnello L, Ciaccio M. Biomarkers for Prognosis and Treatment Response in COVID-19 Patients. Ann Lab Med. 2021; 41(6):540-548. doi: 10.3343/alm.2021.41.6.540.
- Alshammary AF, Al-Sulaiman AM. The journey of SARS-CoV-2 in human hosts: a review of immune responses, immunosuppression, and their consequences. Virulence. 2021;12(1):1771-1794. doi: 10.1080/21505594.2021.1929800.
- Carpenè G, Onorato D, Nocini R, Fortunato G, Rizk JG, Henry BM, et al. Blood lactate concentration in COVID-19: a systematic literature review. Clin Chem Lab Med. 2021; 60(3):332-337. doi: 10.1515/cclm-2021-1115.
- Thomas-Rueddel DO, Poidinger B, Weiss M, Bach F, Dey K, et al.; Medical Education for Sepsis Source Control and Antibiotics Study Group. Hyperlactatemia is an independent predictor of mortality and denotes distinct subtypes of severe sepsis and septic shock. J Crit Care. 2015;30(2):439.e1-6. doi: 10.1016/j.jcrc.2014.10.027.
- Eades L, Drozd M, Cubbon RM. Hypoxia signalling in the regulation of innate immune training. Biochem Soc Trans. 2022;50(1):413-422. doi: 10.1042/BST20210857.
Correspondência
Júlio Cezar Merlin
E-mail: [email protected]
