Caracterização dos distúrbios da regulação : uma abordagem didática e intuitiva
Characterization of acid-base regulation disorders: a didactic and intuitive approach
Fabiane Gomes de Moraes Rego1,4
Mauren Isfer Anghebem1,2
Izabella Castilhos Ribeiro dos Santos-Weiss1
Vivian Rotuno Moure1,4
Guilherme Fadel Picheth2,3
Waldemar Volanski4
Glaucio Valdameri1,4
Geraldo Picheth1,4
1Universidade Federal do Paraná (UFPR), Departamento de Análises Clínicas. Curitiba-PR, Brasil.
2Pontifícia Universidade Católica do Paraná (PUCPR). Escola de Ciências da Vida. Curitiba-PR, Brasil.
3Programa de Pós-Graduação em Microbiologia, Parasitologia e Patologia da Universidade Federal do Paraná (UFPR). Curitiba-PR, Brasil.
4Programa de Pós-Graduação em Ciências Farmacêuticas – Universidade Federal do Paraná (UFPR). Curitiba-PR, Brasil.
Instituição: Universidade Federal do Paraná (UFPR). Curitiba-PR, Brasil.
Recebido em 24/11/2020
Aprovado em 10/12/2020
DOI: 10.21877/2448-3877.20200020
INTRODUÇÃO
O objetivo deste trabalho é oferecer uma estrutura e opção didático-pedagógica para a compreensão e ensino das alterações do equilíbrio para estudantes e profissionais da área da saúde.
Os processos fisiológicos e metabólicos do corpo humano dependem do equilíbrio entre o meio intra e extracelular. O balanço e a regulação do pH (“p” significa logaritmo negativo da concentração de prótons ou H+) que reflete a concentração de íons prótons ou íons H+ ([H+]) são cruciais para manutenção desta homeostase.(1-4) A Figura 1 resume a geração do H+ e os sistemas tampões.
Os órgãos e tecidos humanos estão adaptados a pH entre 7,35-7,45 ([H+] 45-35 nmol/L) usualmente próximo de pH 7,40 ou [H+] 40 nmol/L e fortemente controlado. Dependendo do grau de desvio de pH fora desta faixa estreita, várias respostas homeostáticas são ativadas em um esforço para restaurar o estado ácido-básico normal ou fisiológico.(5)
O íon H+ é muito reativo e interage com proteínas e membranas, alterando suas estruturas e funções, razão pela qual necessita de rígido controle.(6) Como consequência, o “desbalanço” ou desequilíbrio na concentração de H+, pode afetar a atividade catalítica das enzimas, a natureza de processos de transporte celular, as propriedades contráteis musculares e a oxigenação dos tecidos.(7-9) Isto justifica a importância da avaliação da regulação , as necessidades de rápida identificação e manejo clínico adequado dos processos patológicos que promoveram o distúrbio.(6)
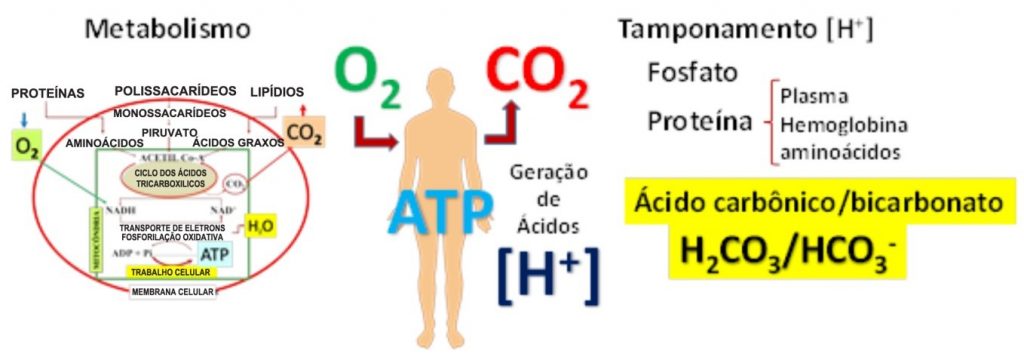
Figura 1. Metabolismo celular, geração de [H+] e tamponamento.
Macromoléculas são convertidas em suas unidades fundamentais, aminoácidos, monossacarídeos e ácidos graxos, que são oxidados com auxílio de oxigênio (O2) gerando energia celular (ATP) e produzindo dióxido de carbono (CO2). O CO2 e outros produtos do metabolismo gerados são ácidos, representados pelo íon H+. O próton é tamponado no meio intracelular (fosfato e hemoglobina) e extracelular (proteínas plasmáticas e bicarbonato/ácido carbônico). O tampão H2CO3/HCO3– é o mais importante e efetivo do meio extracelular
O pH e a concentração de prótons [H+]
A concentração de prótons usualmente é expressa em termos de pH, ou seja, o logaritmo de base 10 da recíproca da concentração de H+ (Figura 2). Embora generalizado, o uso da escala de pH requer cuidado nas análises devido em parte à escala logarítmica empregada.(10,11) A concentração de prótons expressa nesta escala pode encobrir ou mascarar dois fatores críticos: a concentração muito pequena de prótons em relação a outros íons circulantes e a magnitude das mudanças na concentração de H+. Por exemplo, a alteração de uma unidade no pH representa uma alteração de 10 vezes na concentração de prótons. A concentração de H+ no sangue é pequena, sendo expressa em nano moles por litro (nmoles/L).(12) A Figura 2 mostra a relação entre pH e [H+] em valores de interesse diagnóstico.
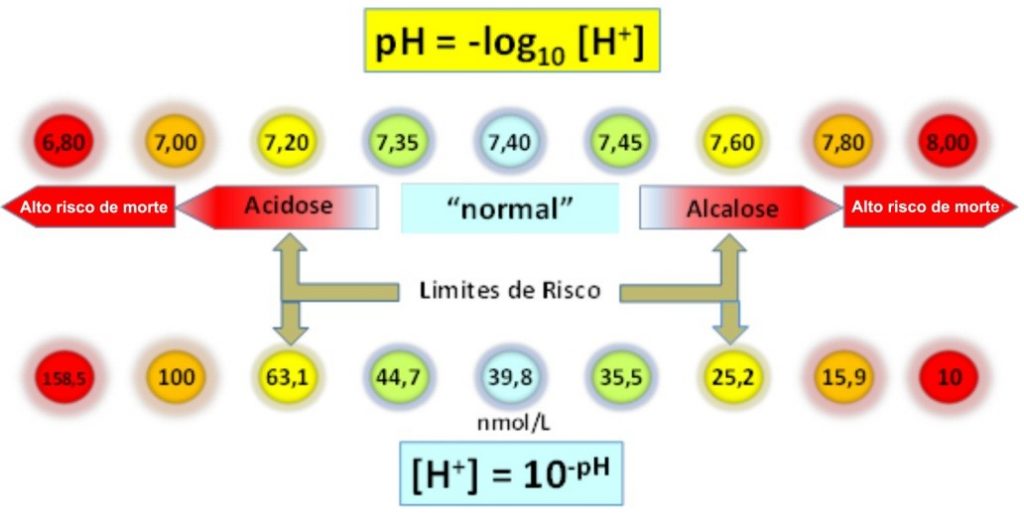
Figura 2. Relação entre pH e concentração de [H+] no sangue.
No sangue arterial o pH fisiológico (7,35-7,45) é correspondente a uma concentração de [H+] de 45-35 nmol/L. Destacados os critérios de acidose e alcalose, e limites de risco a vida (7,20 e 7,80). pH sanguíneo abaixo de 7,0 ou acima de 7,8 está associado a altíssimo risco de morte. A variação de uma unidade de pH (de 7 para 8) reflete uma variação em [H+] de 100 a 10 nmol/L, ou seja, 10 vezes.
Transformações calculadas com https://www.omnicalculator.com/chemistry/ph
Tampão ácido carbônico/bicarbonato
A manutenção do pH sanguíneo estável, próximo a pH 7,40, é tarefa complexa e integrada dos transportes de oxigênio e dióxido de carbono no sangue, desvio dos cloretos, sistemas tampão com ênfase no ácido carbônico/bicarbonato e funções cardíaca, pulmonar e renal.(13,14)
No contexto deste trabalho, abordamos apenas o sistema tampão bicarbonato, pelas implicações diretas deste sistema na identificação das alterações .
No pH fisiológico, a proporção entre as concentrações de HCO3- e H2CO3 é de 20:1, mostrando que o sistema é mais efetivo para resistir à acidificação do que à alcalinização.(15) A Figura 3, sumariza a reação de transporte de dióxido de carbono e a equação de Henderson-Hasselbalch para o tampão bicarbonato.
O equilíbrio entre produção e excreção de ácidos no organismo é controlado por sistemas de tampões, que têm efeito imediato, e pelas funções respiratórias e renais.(16)
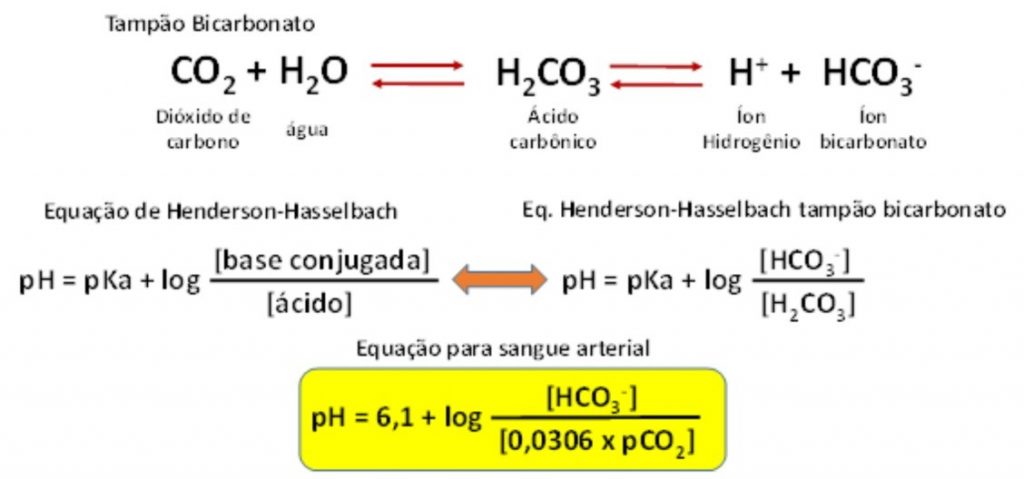
Figura 3. O tampão bicarbonato e a equação de Henderson-Hasselbalch.
O dióxido de carbono (CO2) produzido no metabolismo celular é hidratado produzindo ácido carbônico (H2CO3–), em reação catalisada pela enzima anidrase carbônica. O ácido carbônico no sangue se dissocia nos íons bicarbonato (HCO3–) e íon hidrogênio (H+). As concentrações de bicarbonato e ácido carbônico apresentadas na equação são molares, no caso do sangue, expressas em milimolar (mmol/L).
Aplicando-se a equação de Henderson-Hasselbalch ao tampão bicarbonato, o pKa (constante de dissociação) para o tampão é 6,10. A concentração de H2CO3 é reflexo da dissolução do CO2 no sangue (pCO2). O fator 0,0306 é o coeficiente de solubilidade do CO2 no sangue arterial a 37ºC, e adicionalmente converte a pCO2 (em mmHg) em H2CO3 (em mmol/L).
O tampão bicarbonato constitui um sistema aberto, o que o torna eficiente no controle do pH sanguíneo. Neste tampão, a adição de H+ faz diminuir a concentração da base conjugada (HCO3-), mas não aumenta a concentração de ácido conjugado, já que a concentração de CO2 se ajusta rapidamente à pressão parcial deste gás (pCO2) na atmosfera.(15)
O aumento da frequência respiratória elimina rapidamente o dióxido de carbono, alcalinizando o sangue; e a redução da frequência respiratória (ou dificuldade na troca de gases) promove o acúmulo de CO2, o que acidifica o sangue.(17)
O sistema renal regula o próton (H+) e a concentração do bicarbonato, excretando ou retendo estes íons.(18) Portanto, processos patológicos que afetem as funções do pulmão ou dos rins podem concorrer com alterações do equilíbrio .(13)
A Figura 4 representa de forma didática a relação entre o bicarbonato e o ácido carbônico e seus mecanismos de controle.
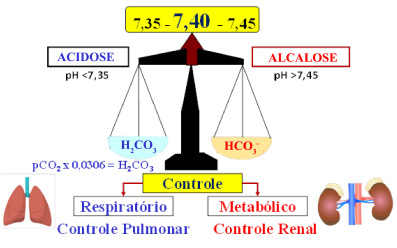
Figura 4. Relação entre os componentes do tampão ácido carbônico/bicarbonato e o equilíbrio.
O equilíbrio , representado pela balança, onde um dos pratos contempla a parte ácida do tampão (H2CO3, pCO2) e, no outro, a parte alcalina (base, HCO3–) e o fiel da balança em equilíbrio está em pH 7,40, quando a proporção HCO3–/H2CO3 é de 20:1. O dióxido de carbono (CO2) tem controle primário pelo pulmão e o bicarbonato pelos rins, sendo que ambos os órgãos atuam de forma harmônica. Processos patológicos que alteram o pH promovem a acidose (pH <7,35) ou alcalose (pH >7,45). O fiel da balança para o lado ácido (Acidose; pH<7,35) pode ser resultante de aumento de “peso” no lado ácido (alteração respiratória) ou retirada de “peso” do lado básico (alteração metabólica). De forma similar, quando o fiel da balança se move, o lado básico (Alcalose, pH>7,45) pode ser resultante de aumento de “peso” no lado básico (alteração Metabólica) ou retirada de “peso” do lado ácido (alteração respiratória).
Distúrbios do equilíbrio
A caracterização do equilíbrio e suas alterações é realizada pelas quantificações do pH e pCO2 no sangue arterial, realizada em equipamento dedicado, usualmente conhecidos como gasômetros. A concentração do bicarbonato é obtida através da equação de Henderson-Hasselbalch para o tampão bicarbonato como descrito na Figura 3.
Outros parâmetros são apresentados nos resultados de pH e gases sanguíneos (gasometria arterial). Entre estes, a medida da pO2 (pressão parcial de Oxigênio) é um indicador da oxigenação do sangue. Outros parâmetros usuais são o “Excesso de Base” ou BE (base excess), a “Base Tampão” ou BB (buffer base) e a satO2 (sO2, saturação de Oxigênio) que são estimados e não serão abordados no contexto deste estudo.
Múltiplos e diversos processos patológicos podem concorrer com alterações do equilíbrio .(19) Insuficiências do músculo cardíaco, das funções pulmonares e renais, alterações metabólicas do diabetes descontrolado ou de diarreias profusas são causas primárias de alterações do pH sanguíneo.
Acidose (pH <7,35) e alcalose (pH >7,45) são classificadas em respiratória e metabólica segundo a alteração do processo patológico primário, ou seja, as concentrações de pCO2 ou HCO3-, respectivamente.(19)
Estabelecida a alteração primária do pH, o organismo inicia processos para compensar a alteração, na busca de fazer com que o pH retorne à concentração normal. A resposta às alterações do processo que levou ao desequilíbrio é designada compensação.(13,18)
Os processos compensatórios que dependem da pCO2, regulada pela frequência respiratória (pulmões), são rápidos e iniciam minutos após o sistema tampão ter sido vencido. A compensação através do sistema renal (compensação metabólica) é lenta, demorando muitas horas ou dias após o início do processo primário.(18)
A Figura 5 caracteriza as alterações primárias e os eventos compensatórios principais.
Os intervalos de referência para os parâmetros associados à determinação das alterações , bem como outros parâmetros associados como concentrações de eletrólitos, hemoglobina, lactato e ânion gap, estão apresentados na Tabela 1.
Uma relação entre os distúrbios primários do equilíbrio de maior frequência e suas características são apresentados na Tabela 2. A Tabela 2 deve ser associada aos elementos da Figura 5, à qual é complementar.
A compensação respiratória por um distúrbio metabólico primário ocorre muito mais rapidamente do que a compensação metabólica (renal) por um distúrbio respiratório primário. No segundo caso, a compensação ocorre ao longo de dias, em vez de horas.(13)
Se a compensação resultar no retorno do pH ao normal, é dito que o distúrbio está “totalmente compensado”. Mas, em muitos casos, a compensação retorna o pH próximo ao “normal” sem realmente atingir o intervalo de referência (pH 7,35-7,45), situação definida como “parcialmente compensada”.(13)
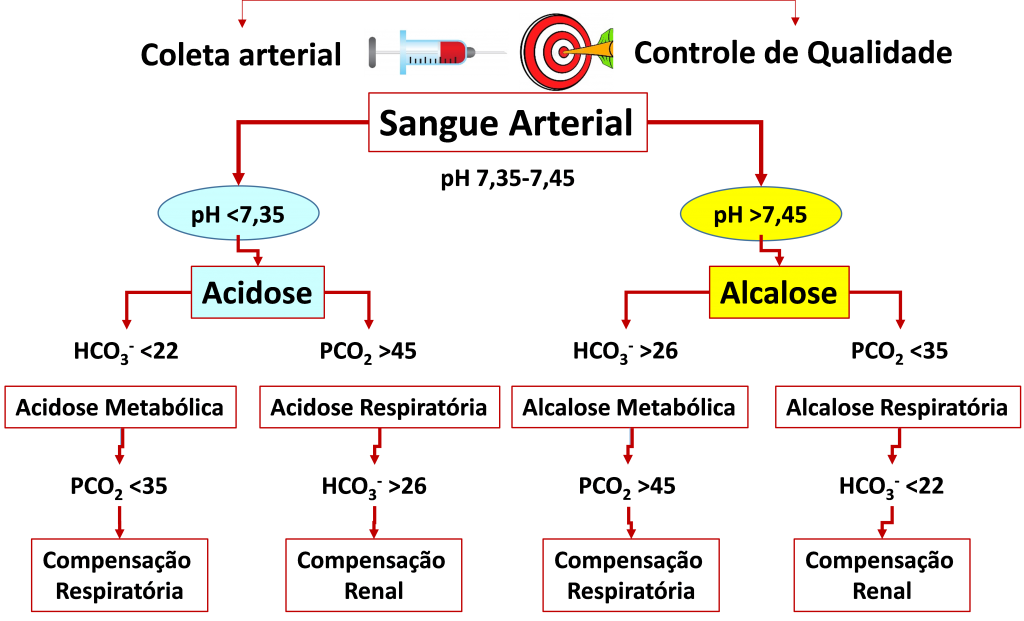
Figura 5. Caracterização das principais alterações do equilíbrio .
Amostra de sangue total heparinizada, coletada de forma apropriada e controle de qualidade da coleta e equipamento envolvidos, possibilitam com a medição do pH classificar em acidose e alcalose as alterações do equilíbrio . As concentrações da pressão parcial de dióxido de carbono (PCO2) e o cálculo do bicarbonato (HCO3–) subclassificam as alterações em respiratória e metabólica. A resposta compensatória à alteração, propicia, quando o pH volta à referência (ou “normal”), a compensação.
Adaptado de https://www.sciencedirect.com/topics/medicine-and-dentistry/acid-base-imbalance
Tabela 1. Intervalos de referência para pH e gases sanguíneos em sangue arterial e venoso.
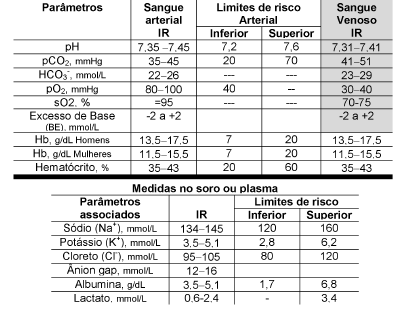
IR, Intervalo de Referência: gasometria arterial (20) e venosa (21), Limites de risco: caracterizam concentrações que ultrapassadas indicam maior severidade ou risco de morte ao paciente.(22)
Em Tietz, 2018(22) e Wargo e Centor(23), a referência para o bicarbonato arterial é 22-28 mmol/L. Conversão mmHg x 0,1333 = kilopascal (kPa), unidade do sistema SI para pCO2 e pO2. (usando aplicativo web disponível em: https://convertlive.com/pt/u/converter/mil%C3%ADmetros-demerc% C3%BArio/em/quilopascal#40). Unidades do sistema SI, pCO2, 4,7 6,0 kPa; pO2,10,6 3,3 kPa; pH (7,35 7,45) em concentração de [H+], 35 45 nmol/L. sO2, saturação do Oxigênio. Ânion gap (Na+ – Cl– + HCO3–). Lactato em sangue total.(19)
Observação. Os intervalos apresentados podem ser utilizados como orientação na análise dos distúrbios do equilíbrio . Para recém-natos, crianças e idosos, bem como amostras de sangue capilar, os intervalos de referência são diferentes dos apresentados. Intervalos de referência para diferentes idades podem ser consultados em Acute care testing handbook.(24)
Tabela 2. Características do pH e gases sanguíneos em distúrbios do balanço
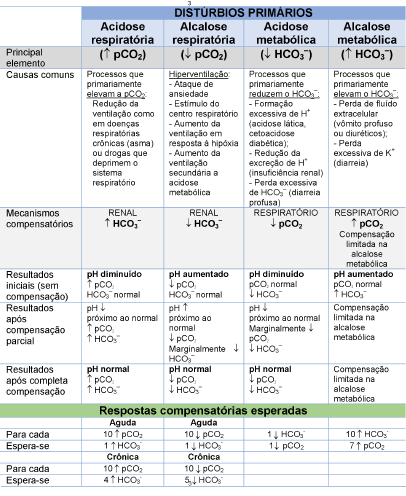
Abreviações: CO2, dióxido de carbono; pCO2, pressão parcial de CO2 HCO3–, concentração de bicarbonato; H+, concentração de prótons.
O termo “normal” é empregado para designar concentrações dentro do intervalo de referência.
Adaptado de Higgins e colaboradores,(13) Hamilton e colaboradores(19) e Al-Khadra.(18)
Pelas razões descritas, a alcalose metabólica raramente é totalmente compensada.(13)
Distúrbios sistêmicos são incapazes de compensação completa.(25) Em teoria, a compensação completa poderia ocorrer em uma doença sistêmica, mas quase sempre a compensação é incompleta.(26-33)
Na acidose metabólica, a compensação pulmonar esperada é uma queda de ~1 mmHg da pCO2 para a redução de cada 1 mmol/L na concentração de bicarbonato.(34) Na alcalose metabólica, por outro lado, a compensação pulmonar aumenta a pCO2 em 7 mmHg para a elevação de cada 10 mmol/L na concentração de bicarbonato.(30,31)
Em distúrbios respiratórios, os mecanismos compensatórios são bifásicos: a primeira fase é aguda e dominada por mecanismos de tamponamento químico, enquanto que a segunda, a fase crônica, é dominada por respostas renais. Na acidose respiratória aguda, a concentração do bicarbonato sérico aumenta 1 mmol/L para o aumento de cada 10 mmHg na pCO2, enquanto que esta proporção aumenta para 4 mmol/L para 10 mmHg na acidose respiratória crônica. Esta última compensação renal é o resultado da neutralização dos H+, inicialmente pela excreção de fosfato e posteriormente de amônio.(33,35) É essencial reconhecer que a resposta renal é rigidamente regulada, em que o fornecimento de bicarbonato medicinal resulta na excreção urinária do excesso de álcali sem alteração do HCO3- ou pH plasmático.(35)
Na alcalose respiratória aguda, a concentração de bicarbonato cai 2 mmol/L para diminuição de cada 10 mmHg do pCO2, enquanto que esta relação torna-se 5 mmol/L para cada 10 mmHg na alcalose respiratória crônica.(32,36) Este declínio na concentração de bicarbonato é alcançado pela diminuição da reabsorção de bicarbonato urinário e excreção de amônio.(29)
Pode-se presumir da discussão acima que todos os pacientes com distúrbio sofrem de apenas uma das quatro categorias de equilíbrio . Este pode muito bem ser o caso, mas em circunstâncias particulares os pacientes podem apresentar mais de um distúrbio. Por exemplo, considere o paciente com doença pulmonar crônica, como enfisema, que apresenta acidose respiratória de longa data parcialmente compensada. Se este paciente também fosse um diabético que não tivesse tomado sua dose normal de insulina e, como resultado, estivesse em um estado de cetoacidose diabética, o resultado da gasometria arterial iriam refletir o efeito combinado da acidose respiratória e da acidose metabólica. Esses distúrbios mistos não são raros e podem ser difíceis de desvendar com base apenas nos resultados da gasometria arterial.(13) Neste trabalho não são abordados distúrbios do equilíbrio ácido básico de maior complexidade como distúrbios mistos.
Identificação dos distúrbios do Equilíbrio Ácido-Básico (EAB)
As formas de caracterização dos distúrbios são múltiplas, envolvendo gráficos,(37) análises tradicionais da equação de Henderson-Hasselbalch para o tampão bicarbonato(18) e, modernamente, utilizando softwares incluindo apps para dispositivos móveis.(38)
Neste artigo, apresentamos duas formas de identificar as alterações primárias do EAB centradas em elementos simples, didáticos e de fácil compreensão: o “sistema balanço-elevador” e o sistema “jogo da velha” (tic tac toe)
O Sistema “balanço-elevador”
Esta forma didática de identificar as alterações do EAB está fundamentada nas relações do pH com CO2 (“balanço” ou “see-saw”) e do pH com o HCO3- (“elevador”), como representado na Figura 6.
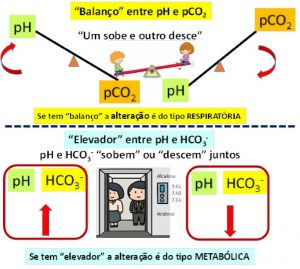
Figura 6. Sistema “balanço-elevador” para caracterização das alterações primárias do equilíbrio.
Adaptado de Singh et al. 2013.(20)
Utilizando esta imagem mnemônica e didática, analise o racional do processo, que está dividido em quatro etapas, considerando determinações do pH e gases no sangue arterial:
1a Etapa: avalie o resultado do pH, e classifique:
( ) pH “normal” (7,35-7,45)
( ) pH “baixo” (<7,35) à ACIDOSE
( ) pH “alto” (>7,45) à ALCALOSE
2a Etapa: avalie o “efeito balanço” e classifique.
( ) pH sobe e pCO2 desce ou pH desce e pCO2 sobe à RESPIRATÓRIA
( ) não tem “balanço”
3a Etapa: avalie o “efeito elevador” e classifique.
( ) pH sobe e HCO3- sobe ou pH desce e HCO3- desce à METABÓLICA
( ) não tem “elevador”
4a Etapa: avalie a pO2 (Oxigenação) e classifique (24).
( ) Hiperoxemia marcante (pO2 ³150 mmHg)
( ) Hiperoxemia (pO2 ~120 mmHg)
( ) Oxigenação “normal” (pO2 80 – 100 mmHg)
( ) Hipoxemia leve (pO2 ~70 mmHg)
( ) Hipoxemia moderada (pO2 ~60 mmHg)
( ) Hipoxemia severa (pO2 < 45 mmHg)
Diagnóstico da alteração primária
Junte os resultados obtidos nas quatro etapas, que resultam na alteração do equilíbrio: pH (Acidose ou Alcalose) + “balanço/elevador” (Respiratória ou Metabólica) e oxigenação (normal ou alterada).
A Figura 7 mostra um exemplo da aplicação do sistema “balanço-elevador”.
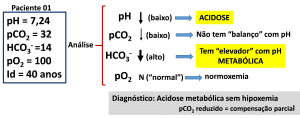
Figura 7. Caracterização da alteração do EAB com sistema “balanço-elevador”.
Paciente de 40 anos, respirando ar ambiente, sem ajuda de aparelhos, apresenta no sangue arterial pH 7,24, pCO2 32 mmHg, HCO3– 14 mmol/L e pO2
100 mmHg.
Limitações do processo
À medida que o processo patológico avança promovendo a alteração do equilíbrio, mecanismos compensatórios se intensificam (“compensação”).
Nas condições de “compensação” total ou parcial, o sistema “balanço-elevador” proposto pode apresentar dificuldades, em especial se o profissional que analisa os dados não tiver disponíveis informações do histórico do paciente e da patologia de base.
Nossa experiência mostra que o sistema “balanço-elevador” é eficaz na ampla maioria dos casos e excelente como ferramenta didática no ensino de estudantes e profissionais da área da saúde. Os discentes, ao compreenderem a lógica do sistema “balanço-elevador”, rapidamente incorporam os elementos de maior complexidade das alterações compensadas e dos distúrbios mistos.
O sistema do “jogo da velha”
Outro processo didático para caracterizar os distúrbios , designado “jogo da velha” (tic tac toe, em língua inglesa), posiciona as concentrações dos parâmetros pH, pCO2 e HCO3- em colunas, como apresentado na Figura 8, que lembra o antigo e conhecido jogo. Vídeos didáticos da Radiometer descrevem este processo (https://youtu.be/ODjBaldXBTY).
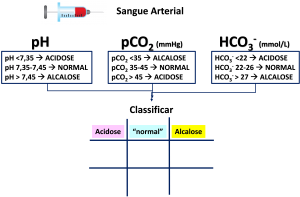
Figura 8. Caracterização das alterações do EAB utilizando o sistema do “jogo da velha” (tic tac toe).
Processo gráfico para identificar alterações do equilíbrio (EAB) e os intervalos de referência associados aos parâmetros utilizados.
A Figura 9 mostra um exemplo da forma de aplicar o “jogo da velha” na caracterização dos distúrbios do equilíbrio .
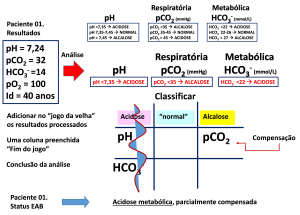
Figura 9. Exemplo da aplicação do sistema “jogo da velha” na identificação do EAB.
Aplicando-se os critérios apresentados na parte superior da figura, os resultados do paciente são analisados. Definidas as posições na tabela, preenchida uma coluna o jogo encerra (linha ondulada na acidose). No exemplo, o alinhamento do pH e HCO3–, na coluna “acidose”, caracteriza o status do pH. Sendo o HCO3– o componente “metabólico” presente na coluna com alinhamento, fica determinado o tipo da alteração, metabólica no caso. A pCO2, isolado, no campo da alcalose indica que o processo de compensação está em curso. Como o pH está fora do “normal”, a compensação é parcial.
Em outro exemplo (Figura 10), um paciente com dificuldades respiratórias é acompanhado no momento da internação, com manifestações agudas dos sintomas e após sete e quinze dias do início do processo.
Ferramentais digitais na interpretação do equilíbrio
Diferentes programas para computadores, incluindo gratuitos, estão disponíveis para auxílio na interpretação dos resultados do equilíbrio.
A Figura 11 mostra o exemplo de dois programas, onde são digitados os resultados de pH, pCO2 e HCO3-, a interpretação do resultado é apresentada na tela. O programa também emite mensagens de erros na entrada dos dados, caso estes não tenham consistência com o equilíbrio de Henderson-Hasselbalch, ou a presença de distúrbios mistos (não contemplados neste estudo).
De forma similar aos programas de computador, também estão disponíveis aplicativos para telefones celulares com Sistema Android e IOS, gratuitos e pagos.
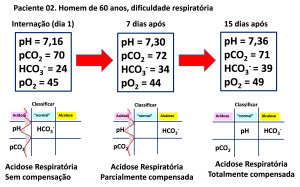
Figura 10. Exemplo de análise do perfil de pH e gases de paciente no momento da internação e acompanhamento do processo.
Abaixo dos resultados, o “jogo da velha” para a caracterização do EAB utilizando os critérios apresentados na Figura 09 (anterior). Paciente internado com dificuldade respiratória a definir, apresenta gasometria arterial caracterizando acidose respiratória sem nenhuma compensação com hipoxemia severa. Após uma semana, o sistema renal recupera o bicarbonato e, persistindo a acidose respiratória agora parcialmente compensada com o incremento do HCO3-. Após 15 dias, o mesmo paciente apresenta pH dentro da faixa “normal”, indicando que a elevação do bicarbonato foi suficiente para restaurar o EAB de forma totalmente compensada.
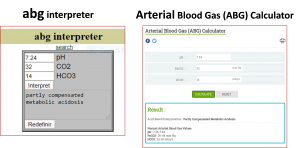
Figura 11. Exemplos de programas para computador que oferecem auxílio na interpretação dos resultados do equilíbrio.
Página web dos programas alimentados com os dados da Figura 9. A interpretação para pH 7,24; pCO2 32 mmHg e HCO3- 14 mmol/L foi classificada pelos programas como uma alteração do tipo “acidose metabólica parcialmente compensada”.
abg interpretor, obtido em: https://www.manuelsweb.com/abg.htm; Arterial Blood Gas (ABG) Calculator, obtido em: https://www. pediatriconcall .com/calculators/arterial-blood-gas-abg-calculator.
A Figura 12 apresenta a tela de entrada de dados do aplicativo “ABG Pro Acid Base Calculator” que pode ser obtido gratuitamente (PlayStore e AppleStore). O aplicativo oferece na interpretação do equilíbrio duas entradas. Uma básica somente com os dados essenciais, e outra com a opção adicional de dados de eletrólitos (Na+ e Cl-) e albumina para o cálculo do ânion gap, o que amplia as informações na interpretação dos resultados da gasometria.
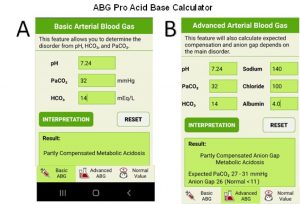
Figura 12. Tela principal do aplicativo ABG Pro Acid Base Calculator.
Na Figura 12A está apresentada a opção básica e na Figura 12B a opção avançada com a introdução de dados de eletrólitos e albumina, sendo todos os elementos apresentados em língua inglesa. Os dados nas telas são os mesmos da Figura 9, tendo como resultado “acidose metabólica parcialmente compensada”, e Figura 12B, mostra que no exemplo, o ânion gap está aumentado, o que auxilia na discriminação das causas desta acidose. Uma aba do aplicativo, “normal value” oferece ao usuário o intervalo de referência dos parâmetros associados ao EAB.
Considerações finais
As alterações do equilíbrio estão frequentemente associadas a processos patológicos graves. É necessário que os profissionais de saúde que fazem as análises e interpretam o EAB tenham sólido conhecimento destes processos, em especial quando decisões rápidas precisam ser tomadas para a manutenção da vida dos pacientes.
Este trabalho oferece uma revisão dos principais processos envolvidos nas alterações e na classificação dos distúrbios primários do EAB. Programas de computador e aplicativos para telefonia móvel, como apresentados, auxiliam de forma automática a identificação de alterações do EAB. No entanto, o uso mecânico e extensivo destes programas pode promover um distanciamento do profissional de saúde, do contexto do quadro clínico e seu status.
A ênfase deste artigo, no entanto, está na apresentação dos sistemas de interpretação dos resultados de pH e gases sanguíneos com os sistemas “balanço-elevador” e “jogo-da-velha”. A abordagem didática com estes sistemas oferece ao discente e profissional de saúde uma forma prática e atrelada aos conceitos fisiológicos envolvidos na manutenção do pH sanguíneo. Este aprendizado, uma vez solidificado permanece e facilita sobremaneira a evolução para o incremento de alterações de maior complexidade nos distúrbios do EAB.
Abstract
In humans, blood pH is kept in a narrow range, between 7.35 to 7.45. Different biochemical mechanisms, in a harmonic way, act to maintain the physiological pH. Multiple pathological processes can promote changes in pH and blood gases, characterizing acidosis (pH <7.35) or alkalosis (pH> 7.45). The rupture of pH homeostasis is identified by measuring pH, partial pressure of carbon dioxide (pCO2), bicarbonate concentration (HCO3–) and, in addition, with the pressure of oxygen (pO2) in arterial blood, a process described as gasometry arterial. This article reviews the main elements associated with the understanding of acid-base changes and aims to present a didactic and intuitive approach to the characterization of these disorders; and also comments on digital tools for the interpretation of alterations in arterial blood gases are also covered, such as programs for computers in a web environment and applications for mobile phone.
Keywords
Acid-base disorders; laboratory interpretation; blood gas analysis; reference ranges; digital tools.
REFERÊNCIAS
- Greenbaum J, Nirmalan M. Acid-base balance: The traditional approach. Current Anaesthesia & Critical Care. 2005;16(3):137-42. doi.org/10.1016/j.cacc.2005.03.009.
- Story DA, Kellum JA. Acid-base balance revisited: Stewart and strong ions. Seminars in Anesthesia, Perioperative Medicine and Pain. 2005;24(1):9-16.
- Greenbaum J, Nirmalan M. Acid-base balance: Stewart’s physicochemical approach. Current Anaesthesia & Critical Care. 2005;16(3):133-5. DOI: 10.1016/j.cacc.2005.03.010.
- Moe OW, Fuster D. Clinical acid-base pathophysiology: disorders of plasma anion gap. Best Pract Res Clin Endocrinol Metab. 2003 Dec;17(4):559-74. doi: 10.1016/s1521-690x(03)00054-x.
- Hamm LL, Nakhoul N, Hering-Smith KS. Acid-Base Homeostasis. Clin J Am Soc Nephrol. 2015 Dec 7;10(12):2232-42. doi: 10.2215/CJN.07400715.
- Gomez H, Kellum JA. Understanding Acid Base Disorders. Crit Care Clin. 2015;31(4):849-60. doi: 10.1016/j.ccc.2015.06.016
- Christensen HN. Exploiting amino acid structure to learn about membrane transport. Adv Enzymol Relat Areas Mol Biol. 1979; 49:41-101. doi: 10.1002/9780470122945.ch2
- Garrard LJ, Bui QT, Nygaard R, Raushel FM. Acid-base catalysis in the argininosuccinate lyase reaction. J Biol Chem. 1985 May10; 260(9):5548-53.
- Hampson NB, Jobsis-VanderVliet FF, Piantadosi CA. Skeletal muscle oxygen availability during respiratory acid-base disturbances in cats. Respir Physiol. 1987;70(2):143-58. doi: 10.1016/0034-5687(87)90046-6.
- Rahn H, Howell BJ. The OH-/H+ concept of acid-base balance: historical development. Respir Physiol. 1978;33(1):91-7. doi: 10.1016/0034-5687(78)90087-7.
- Stewart PA. Independent and dependent variables of acid-base control. Respir Physiol. 1978;33(1):9-26. doi: 10.1016/0034-5687(78)90079-8.
- Patience JF. A review of the role of acid-base balance in amino acid nutrition. J Anim Sci. 1990;68(2):398-408. doi: 10.2527/1990.682398x
- Higgins C. An introduction to acid-base balance in health and disease [Internet]. acutecaretesting.org. 2004 [cited 12/05/2020].
- Seifter JL, Chang HY. Disorders of Acid-Base Balance: New Perspectives. Kidney Dis (Basel). 2017;2(4):170-86. doi: 10.1159/000453028.
- Marzzoco A, Torres BB. Bioquímica Básica. 4a ed. Rio de Janeiro: Guanabara Koogan; 2015.
- Tan S, Campbell M. Acid-base physiology and blood gas interpretation in the neonate. Paediatrics and Child Health. 2008;18(4):172-7. DOI:10.1016/J.PAED.2007.12.013
- Pierce NF, Fedson DS, Brigham KL, Mitra RC, Sack RB, Mondal A. The ventilatory response to acute base deficit in humans. Time course during development and correction of metabolic acidosis. Annals of internal medicine. 1970;72(5):633-40. doi: 10.7326/0003-4819-72-5-633.
- Al-Khadra E. Disorders of the Acid-Base Status. In: Kiessling SG, Goebel J, Somers MJG, editors. Pediatric Nephrology in the ICU. Berlin, Heidelberg: Springer; 2009.
- Hamilton PK, Morgan NA, Connolly GM, Maxwell AP. Understanding Acid-Base Disorders. Ulster Med J. 2017;86(3):161-6.
- Singh V, Khatana S, Gupta P. Blood gas analysis for bedside diagnosis. Natl J Maxillofac Surg. 2013;4(2):136-41. doi: 10.4103/0975-5950.127641.
- Higgins C. Central venous blood gas analysis https://acute care testing.org/en/articles/central-venous-blood-gas-analysis2011 [
- Rifai N, Horvath AR, Wittwer CT. Tietz Textbook of Clinical Chemistry and Molecular Diagnostics. 6aed. St. Louis: Elsevier; 2018.
- Wargo KA, Centor RM. ABCs of ABGs: A Guide to Interpreting Acid-Base Disorders. Hospital Pharmacy. 2008;43(10):808-18. https://doi.org/10.1310/hpj4310-808
- Seeger C, Higgins C. Acute care testing handbook https://www.radiometer.com/en/knowledge-center/handbooks/acute-care-testing-handbook: Radiometer Medical ApS; 2014 [
- Madias NE, Schwartz WB, Cohen JJ. The maladaptive renal response to secondary hypocapnia during chronic HCl acidosis in the dog. J Clin Invest. 1977 Dec;60(6):1393-401. doi: 10.1172/JCI108900.
- Albert MS, Dell RB, Winters RW. Quantitative displacement of acid-base equilibrium in metabolic acidosis. Ann Intern Med. 1967 Feb;66(2):312-22. doi: 10.7326/0003-4819-66-2-312
- Arbus GS, Herbert LA, Levesque PR, Etsten BE, Schwartz WB. Characterization and clinical application of the “significance band” for acute respiratory alkalosis. N Engl J Med. 1969 Jan 16;280(3): 117-23. doi: 10.1056/NEJM196901162800301.
- Brackett NC Jr , Cohen JJ, Schwartz WB. Carbon Dioxide Titration Curve of Normal Man. Effect of Increasing Degrees of Acute Hypercapnia on Acid-Base Equilibrium. N Engl J Med. 1965 Jan 7;272:6-12. doi: 10.1056/NEJM196501072720102
- Gennari FJ, Goldstein MB, Schwartz WB. The nature of the renal adaptation to chronic hypocapnia. J Clin Invest. 1972 Jul;51(7):1722-30. doi: 10.1172/JCI106973.
- Javaheri S, Kazemi H. Metabolic alkalosis and hypoventilation in humans. Am Rev Respir Dis. 1987;136(4):1011-6. doi: 10.1164/ajrccm/136.4.1011.
- Javaheri S, Shore NS, Rose B, Kazemi H. Compensatory hypoventilation in metabolic alkalosis. Chest. 1982;81(3):296-301. doi: 10.1378/chest.81.3.296.
- Krapf R, Beeler I, Hertner D, Hulter HN. Chronic respiratory alkalosis. The effect of sustained hyperventilation on renal regulation of acid-base equilibrium. N Engl J Med. 1991;324(20):1394-401. doi: 10.1056/NEJM199105163242003
- Van Yperselle de S, Brasseur L, De Coninck JD. The “carbon dioxide response curve” for chronic hypercapnia in man. N Engl J Med. 1966 Jul 21;275(3):117-22. doi: 10.1056/NEJM196607212750301.
- Bushinsky DA, Coe FL, Katzenberg C, Szidon JP, Parks JH. Arterial PCO2 in chronic metabolic acidosis. Kidney Int. 1982 Sep;22(3):311-4. doi: 10.1038/ki.1982.172.
- Polak A, Haynie GD, Hays RM, Schwartz WB. Effects of chronic hypercapnia on electrolyte and acid-base equilibrium. I. Adaptation. J Clin Invest. 1961 Jul;40(7):1223-37. doi: 10.1172/JCI104353.
- Arbus GS, Hebert LA, Levesque PR, Etsten BE, Schwartz WB. Potassium depletion and hypercapnia. N Engl J Med. 1969 Mar 20;280(12):670.
- Prieto de Paula JM, Franco Hidalgo S, Mayor Toranzo E, Palomino Doza J, Prieto de Paula JF. Alteraciones del equilibrio . Dial Traspl. 2012; 33 (1): 25-34.
- Obiols J, Bardo P, Garnier JP, Brouard B. [Smartphone application for blood gas interpretation]. Ann Biol Clin (Paris). 2013 Sep-Oct;71(5):593-8. French. doi: 10.1684/abc.2013.0874. [Article in French].
Correspondência
Mauren Isfer Anghebem
Escola de Ciências da Vida
Pontifícia Universidade Católica do Paraná
Departamento de Análises Clínicas – UFPR
Rua Prefeito Lothário Meissner, 632, Jardim Botânico
80210-170 – Curitiba-PR, Brasil
