Comparação das metodologias óptica e de impedância para a determinação de parâmetros hematológicos no analisador Sysmex-XN
Comparison of optical and impedance methodologies for the determination of hematological parameters on the Sysmex-XN analyzer
Jennifer Tassoni Staehler1
Luana Moro2
Gabriel Giron Corrêa1
Luciana Scotti2
Iuri Vicente Camargo Morkis3
Carine Ghem4
1 Graduação em Farmácia/Unidade de Bioquímica Clínica, Serviço de Diagnóstico Laboratorial – Hospital de Clínicas de Porto Alegre. Porto Alegre, RS, Brasil.
2 Mestrado em Ciências Biológicas/Unidade de Bioquímica Clínica, Serviço de Diagnóstico Laboratorial – Hospital de Clínicas de Porto Alegre. Porto Alegre, RS, Brasil.
3 Mestrado no Programa de Pós-Graduação em Saúde da Criança e Adolescente/Unidade de Bioquímica Clínica, Serviço de Diagnóstico Laboratorial – Hospital de Clínicas de Porto Alegre. Porto Alegre, RS, Brasil.
4 Doutorado em Ciências da Saúde/Unidade de Bioquímica Clínica, Serviço de Diagnóstico Laboratorial – Hospital de Clínicas de Porto Alegre. Porto Alegre, RS, Brasil.
Recebido em 08/04/2021
Aprovado em 27/09/2021
DOI: 10.21877/2448-3877.202102133
INTRODUÇÃO
Um hemograma é determinado por um conjunto de testes realizados em laboratório que estabelece aspectos qualitativos e quantitativos das células do sangue, sendo de grande importância no diagnóstico de diversas doenças.(1) Em um hemograma é possível avaliar as três linhagens de células presentes na corrente sanguínea: células vermelhas ou eritrócitos; células brancas ou leucócitos e as plaquetas.(2)
A análise relacionada à série vermelha do sangue é chamada de eritrograma, e nela se encontram os índices hematimétricos que determinam o perfil hematológico das células vermelhas. São eles: contagem total de eritrócitos (RBC), concentração de hemoglobina (HGB), concentração de hemoglobina corpuscular média (CHCM), hematócrito (HT), volume corpuscular médio (VCM), hemoglobina corpuscular média (HCM), estimativa de anisocitose (RDW). Além disso, é feita a avaliação morfológica das hemácias a partir da microscopia(1)
A determinação analítica de células sanguíneas e parâmetros hematológicos de interesse pode ser realizada através de analisadores hematológicos automatizados, cujo princípio de detecção baseia-se no método elétrico (impedância elétrica) ou óptico.(1) Com base nos parâmetros medidos do hemograma (RBC, HGB e VCM) é possível obter por cálculo indireto o CHCM, índice que avalia a saturação de hemoglobina nos eritrócitos.(3) Algumas situações podem levar a uma medida errônea dos eritrócitos e, consequentemente, gerar índices calculados incorretamente, especialmente o CHCM.(4)
Resultados errôneos de RBC ou HGB podem ser causados por alguma anormalidade dos eritrócitos (aglutinação) ou por interferentes do plasma (lipemia, icterícia, hemólise) e, assim, gerar um aumento espúrio do CHCM.(5) A contagem anormal de eritrócitos pode estar relacionada à presença de crioaglutininas na amostra, as quais causam a aglutinação dos eritrócitos em temperaturas menores que 37°C, e geralmente a presença desses autoanticorpos são associados clinicamente à anemia hemolítica autoimune.(6) Além das crioaglutininas, desordens que desregulam o volume eritrocitário, tanto hereditárias quanto adquiridas (p. ex.: esferocitose, anemia falciforme) também levam a um aumento do CHCM.(7) Portanto, na rotina laboratorial, a elevação do índice CHCM deve ser avaliada cuidadosamente, a fim de determinar se a alteração do CHCM está relacionada a uma patologia, ou apenas a algum artefato da amostra.
Recentemente, vem sendo descrito na literatura a separação espontânea dos eritrócitos aglutinados no canal óptico.(4) Isso se deve ao fato da amostra de sangue ser aquecida a 41°C durante um minuto no momento de transferência da amostra para a câmara de leitura.(8) Essa particularidade torna o canal óptico uma alternativa interessante ao protocolo realizado atualmente nas amostras que apresentam o CHCM alto.
Na rotina laboratorial, a correção da contagem dos eritrócitos, bem como a dos índices eritrocitários calculados indiretamente como o CHCM, pode ser revertida através do pré-aquecimento do sangue.(9) Amostras que apresentam o valor de CHCM superior a 37,5g/dL (valor sugerido no manual do fabricante)(10) são incubadas em banho-maria na temperatura de 37°C durante 60 minutos e, posteriormente, um novo hemograma é realizado no equipamento. Nas situações em que o pré-aquecimento da amostra não seja capaz de reverter o aumento do CHCM devido ao alto grau de aglutinação ou outros interferentes, o procedimento indicado é a realização do micro-hematócrito por microcentrifugação e liberação de um hemograma sem os índices hematimétricos. Em casos de amostra lipêmica, os índices derivados da HGB não são liberados em razão da interferência na reação colorimétrica.
Sendo assim, este trabalho tem o propósito de comparar as metodologias para contagem de RBC pela metodologia de impedância e método óptico, com a finalidade de utilizar o canal óptico presente no equipamento Sysmex XN como forma de correção da contagem de RBC nos casos de pacientes que apresentam o índice de CHCM acima do ponto de corte. Além disso, a implementação da metodologia da contagem de RBC através do canal óptico diminuiria o tempo estimado para liberação do hemograma.
MATERIAL E MÉTODOS
Tipo de estudo
Estudo transversal prospectivo no período de novembro de 2019 a agosto de 2020 na unidade de Bioquímica Clínica do Hospital de Clínicas de Porto Alegre.
População e amostra
Para comparação das metodologias em indivíduos saudáveis do ponto de vista hematológico, que possuem CHCM na faixa normal, foram avaliados resultados de amostras de indivíduos adultos de ambos os sexos, utilizadas diariamente em nossa rotina para controle interno de qualidade do equipamento Sysmex XN. Também foi verificada a estabilidade dos parâmetros com amostras de controle interno de qualidade, e para essa avaliação a mesma amostra de controle interno diário foi processada nos turnos manhã, tarde e noite.
Além da comparação em indivíduos normais, realizamos a análise dessa metodologia em pacientes que apresentaram o índice CHCM elevado. Foram incluídos todos os pacientes que realizaram exame de hemograma no laboratório com primeira dosagem de CHCM maior que 37,5g/dL. Aqueles que não possuam volume suficiente de sangue total para uma terceira dosagem foram excluídos do estudo.
Todas as amostras utilizadas nesse estudo foram coletadas em tubo com anticoagulante K2EDTA e processadas dentro do período de oito horas após coleta.
Para avaliação da metodologia óptica em valores normais de CHCM, foram coletados os dados do controle interno da qualidade dos analisadores hematológicos, que consistem em indivíduos adultos com parâmetros hematológicos normais. As amostras com valores de CHCM normais foram dosadas através da metodologia por impedância elétrica e por citometria de fluxo e os valores obtidos através das duas metodologias foram comparados e avaliados.
A rotina do laboratório estabelece que todas as amostras com resultado de CHCM maior que 37,5g/dL sejam incubadas em banho-maria a 37 ºC por 60 minutos, para realizar uma segunda dosagem. Tal valor é sugerido no manual do fabricante como crítico e que gera flag de possível turbidez na amostra,(10) e sendo assim o aquecimento visa eliminar a interferência de crioaglutininas nos índices hematimétricos. Neste estudo, todas as amostras com CHCM maior que 37,5g/dL foram dosadas no canal óptico. Este canal utiliza a metodologia de citometria de fluxo com fluorescência para contagem de eritrócitos (RBC-O), incluindo também os reticulócitos. A hemoglobina (HB-O) é calculada a partir dos parâmetros RBC-O e do conteúdo de hemoglobina dos eritrócitos. Estes resultados foram comparados com os valores obtidos por impedância na dosagem após a incubação por uma hora a 37ºC. Todas as amostras foram revisadas por microscopia para avaliação da morfologia da série vermelha, bem como avaliação visual do plasma para verificação de turbidez e lipemia. Essa avaliação tem como objetivo agrupar as causas que elevam o índice CHCM (seja por interferentes, doenças eritrocitárias ou outras causas não identificadas) e analisar em quais situações a metodologia óptica pode ou não normalizar o valor do CHCM. Todas as avaliações referentes a esta pesquisa foram realizadas após a liberação dos resultados dos exames solicitados, sem interferência na rotina da unidade.
Para a avaliação da estabilidade dos parâmetros hematológicos, a mesma amostra com valores hematimétricos normais foi avaliada pelo equipamento Sysmex XN três vezes ao dia (manhã, tarde e noite), pelas metodologias de impedância elétrica e citometria de fluxo e os valores obtidos foram comparados para se observar as possíveis variações.
Todos os dados foram coletados diretamente do equipamento; nenhuma coleta em dados de prontuário foi realizada.
Análise estatística
A análise estatística foi realizada com o auxílio do programa estatístico SPSS 20.0 (Statistical Package for Social Sciences – Professional Statistics™). As variáveis numéricas estão descritas sob a forma de medianas e as variáveis categóricas estão descritas sob a forma de proporções. Para avaliar a correlação entre as duas metodologias foi utilizado o teste de Spearman e para avaliar a concordância foram utilizados os testes de Wilcoxon e McNemar. Para verificar a estabilidade da amostra ao longo do dia foi utilizado o teste de Kruskal-Wallis. Para todas as análises foi considerado um nível de significância de 5% (p ≤ 0,05).
Tamanho amostral
Para detectar um valor mínimo de p = 0,65 no teste de correlação em amostras de indivíduos saudáveis do ponto de vista hematológico, considerando hipótese nula p = 0,5 e os parâmetros para o cálculo de poder de 90% e de alpha (α) de 0,01, foi determinado o tamanho amostral de 293, utilizando o programa R 3.5.1.
A referência utilizada para o cálculo amostral dos indivíduos com CHCM elevado e para a avaliação do CHCM normal seguiu o protocolo estabelecido para validação de métodos de acordo com “Recomendações da Sociedade Brasileira de Patologia Clínica/Medicina Laboratorial” (SBPC/ML 2018), que prevê número amostral de no mínimo 120 amostras para comparação.(11)
Aspectos éticos
Este projeto foi encaminhado para aprovação ao Comitê de Ética em Pesquisa do Grupo de Pesquisa e Pós-Graduação do Hospital de Clínicas de Porto Alegre (Projeto no 2019-0293), e para a Plataforma Brasil (CAAE: 12894919.6.000.5327). O presente projeto envolve riscos mínimos relacionados à quebra de confidencialidade dos dados obtidos, portanto os pesquisadores assinaram o Termo de Compromisso de Utilização de Dados, no qual se comprometem a preservar a privacidade dos pacientes, o Termo de Compromisso para Utilização de Material Biológico e Informações Associadas e a carta de aprovação pelo Comitê de Ética do Hospital de Clínicas de Porto Alegre.
RESULTADOS
Foram avaliadas 293 amostras com valores de CHCM dentro da normalidade, onde observou-se que os parâmetros RBC, HGB e CHCM apresentaram uma boa e significativa correlação entre as metodologias avaliadas (Figura 1). Apesar das correlações se mostrarem significativas, utilizamos o teste de Wilcoxon para avaliar as diferenças entre as dosagens nas metodologias utilizadas. Verificamos que não houve diferença significativa para as medianas dos parâmetros HGB e CHCM, permitindo concluir que esses parâmetros são equivalentes nas metodologias analisadas (Tabela 1). Os dados também indicam que para RBC a hipótese nula foi rejeitada, demonstrando que os métodos não são equivalentes para esse parâmetro.
Na Figura 2 podemos observar a estabilidade das amostras ao longo do dia. As análises foram feitas nos três turnos e as medianas obtidas foram comparadas. Nas duas metodologias pode-se observar uma boa estabilidade para os parâmetros RBC e HGB, que não demonstraram oscilações significativas ao longo do dia, ao contrário do CHCM, que demonstrou maior variação com o passar do tempo.
As amostras com valores de CHCM alterado demonstraram uma correlação significativa entre RBC e HGB quando comparamos a metodologia por impedância após uma hora de banho a 37ºC e metodologia óptica (Figura 3), porém houve diferença significativa entre as medianas para esses parâmetros, verificado no teste de Wilcoxon. O parâmetro CHCM apresentou uma correlação fraca e inversamente proporcional, entretanto verificamos que não houve diferença significativa entre as medianas do CHCM no teste de Wilcoxon (Tabela 2).
Entre as amostras com valores espúrios de CHCM, as principais causas observadas que elevam o CHCM foram a presença de eritrócitos aglutinados, anemia falciforme, amostras de recém-nascidos (RN) e outras causas, que incluem leucemias, linfomas, tumores de órgãos sólidos, transplantes, infecções, hiperleucocitose, hipernatremia, lipemia e esferocitose. Pode-se observar que o protocolo de incubação a 37ºC seguido de repetição na metodologia por impedância obteve maior sucesso na correção do CHCM quando as amostras apresentavam aglutinação. Porém, nos demais grupos a metodologia óptica obteve mais sucesso na correção do CHCM (Tabela 3).
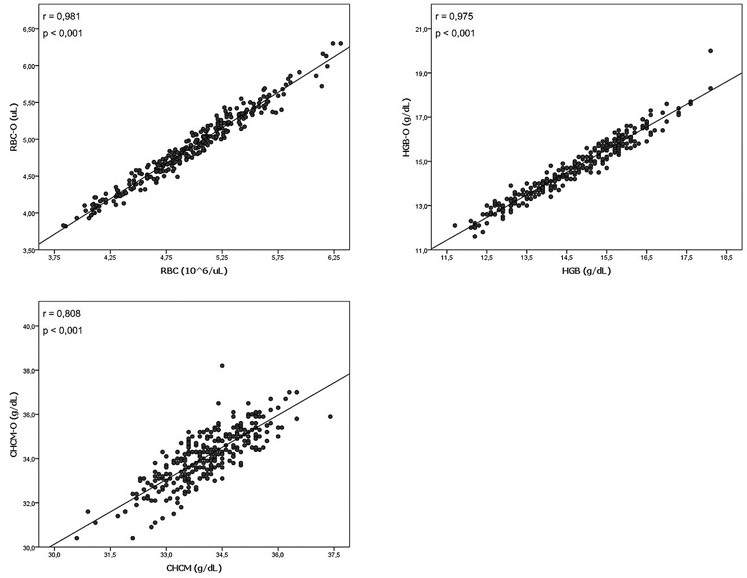
Figura 1. Correção entre as metodologias impedância e óptica em amostras com CHCM normal.
Tabela 1 – Comparação entre os parâmetros realizada nas metodologias de impedância e óptica em amostras com valores normais de CHCM.
| Parâmetros | Mediana (mín-máx) | p-valor |
| RBC-I | 5,00 (3,83 – 6,31) | < 0,001 |
| RBC-O | 4,88 (3,82 – 6,30) | – |
| HGB-I | 14,70 (11,70 – 18,10) | 0,526 |
| HGB-O | 14,70 (11,60 – 20,00) | – |
| CHCM-I | 34,10 (30,60 – 37,40) | 0,652 |
| CHCM-O | 34,20 (30,40 – 38,20) | – |
Teste de Wilcoxon
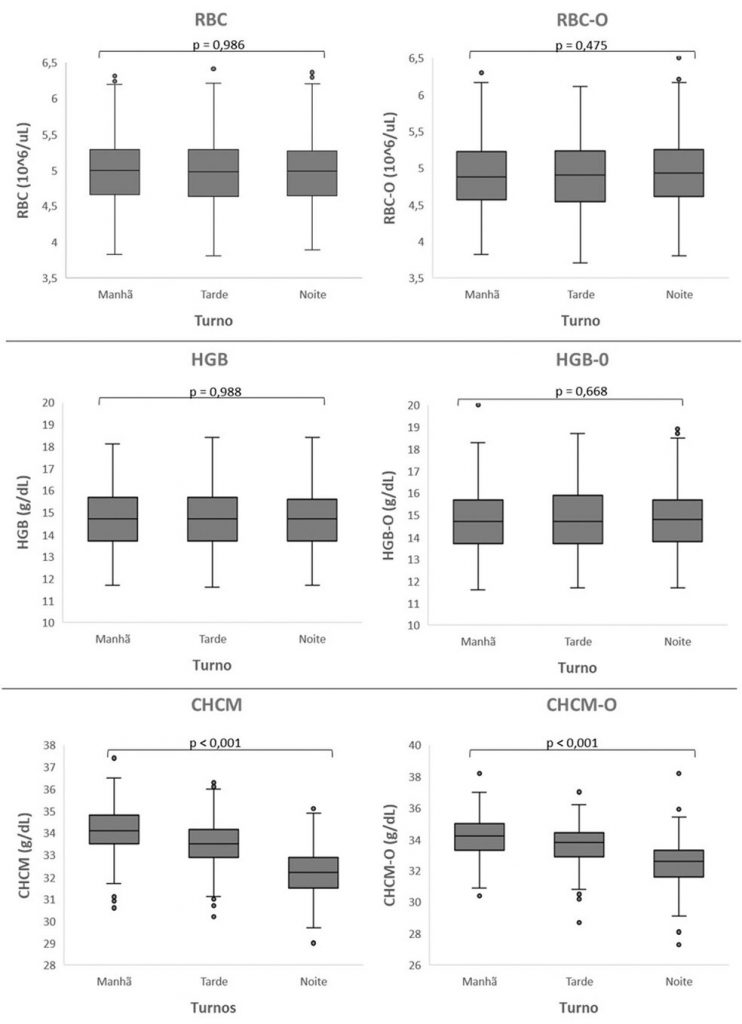
Figura 2. Representação da estabilidade dos parâmetros RBC, HGB e CHCM ao longo do dia na metodologia por impedância e óptica, realizado a partir do teste de Kruskal-Wallis.
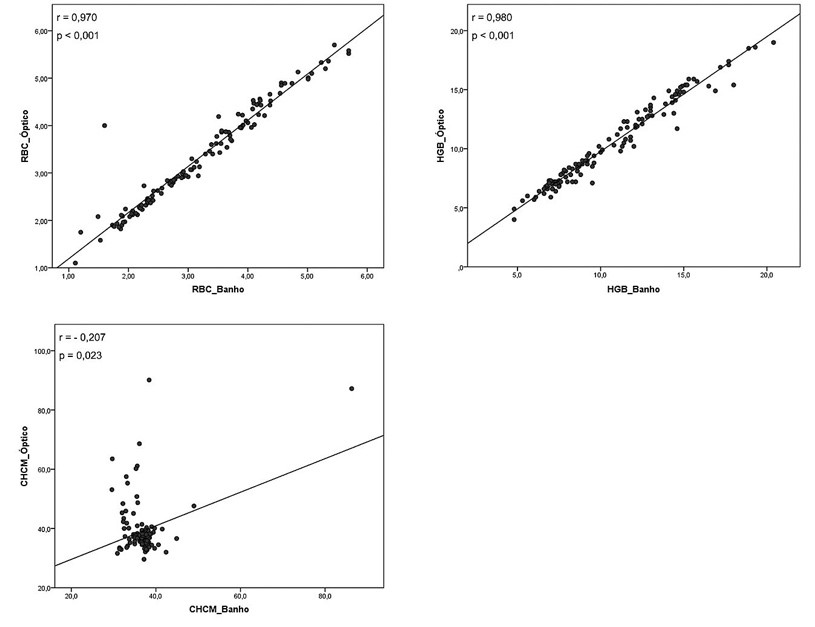
Figura 3. Comparação entre as metodologias impedância após banho-maria a 37oC por uma hora e óptica, em amostras com CHCM alterado.
Tabela 2 – Comparação entre os parâmetros, realizada nas metodologias impedância após banho-maria a 37ºC por uma hora e óptica em amostras com valores de CHCM alterados.
| Parâmetros | Mediana (mín-máx) | p-valor |
| RBC-B | 3,06 (1,11 – 5,69) | < 0,001 |
| RBC-O | 3,09 (1,10 – 5,70) | – |
| HGB-B | 10,30 (4,80 – 20,40) | 0,001 |
| HGB-O | 10,05 (4,00 – 19,00) | – |
| CHCM-B | 37,25 (29,60 – 86,30) | 0,811 |
| CHCM-O | 36,85 (29,60 – 90,10) | – |
Teste de Wilcoxon
Tabela 3 – Perfil de correção do CHCM de acordo com o interferente encontrado
| Banho n (%) | Óptico n (%) | p-valor | |
| Aglutinação (n = 30) | 24 (80) | 9 (30) | < 0,001 |
| Anemia falciforme (n = 21) | 3 (14,3) | 18 (85,7) | 0,001 |
| RN (n = 14) | 3 (21,4) | 12 (85,7) | 0,012 |
| Outros (n = 55) | 33 (60,0) | 38 (69,1) | 0,424 |
| Todos (n = 120) | 63 (52,5) | 77 (64,2) | 0,126 |
Teste de McNemar
DISCUSSÕES
A presença de interferentes na amostra tem sido associada a dificuldades na contagem de RBC, HGB e aos índices hematimétricos derivados desses, bem como o CHCM.(1) A principal causa que eleva os valores de CHCM e que está bem descrita na literatura é a presença de crioaglutininas; desordens na membrana dos eritrócitos, anemia falciforme e em recém-nascidos também já foram descritos.(12) Porém pode-se observar na rotina laboratorial o aumento dos valores de CHCM em casos que ainda não estão claros na literatura, como em pacientes acometidos por infecções virais, neoplasias, pacientes transplantados ou com distúrbios eletrolíticos, pacientes em uso de quimioterapia, imunossupressores ou em tratamento antirretroviral. Nesses casos há um estado transitório de CHCM alterado, em que não são observadas anormalidades nos eritrócitos ou outros interferentes analíticos.(5) Uma tabela com possíveis causas de alteração nos valores de CHCM pode ser vista na publicação de Alban Godon et al., de 2012.(13)
A principal técnica que vem sendo empregada na tentativa de corrigir valores errôneos de CHCM obtidos de amostras com interferentes é o banho-maria a 37ºC por uma hora, sugerido por Finland em 1945.(14) Entretanto, o uso do protocolo padrão do banho-maria nem sempre consegue corrigir a presença de interferentes e os índices hematimétricos calculados não são confiáveis, pois não podem ser considerados valores verdadeiros e não devem ser liberados no laudo. Recentemente, o avanço da tecnologia e o uso de equipamentos automatizados para a realização dos hemogramas permitiram que a metodologia óptica fosse estudada para substituir protocolo de incubação a 37ºC seguido de repetição na metodologia de impedância. No presente estudo a metodologia óptica demonstrou boa concordância com a metodologia por impedância quando comparadas em amostras sem alterações, de pacientes com valores dentro dos limites de referência. Esse achado possibilita seu uso como controle interno da metodologia e dos equipamentos analisadores em uso no laboratório e qualifica a metodologia como equivalente ao método padrão.
A metodologia óptica, utilizada no canal de reticulócitos, demonstrou também que pode ser utilizada na presença de certos interferentes, e conseguimos elucidar em quais casos a nova metodologia pode ser aplicada. Com esse estudo foi possível observar que, de forma geral, as duas metodologias empregadas não demonstram diferenças significativas, porém quando estratificamos os grupos, a metodologia óptica corrigiu os valores de CHCM alterado nos grupos de amostras de pacientes com anemia falciforme e RN. Esse achado pode ser justificado pelo aumento da densidade sanguínea causada pelos eritrócitos falcizados, que ao serem aquecidos, diminuem sua densidade e o valor de CHCM é corrigido. Em 1984, Embury et al. demonstrou que há associação diretamente proporcional entre o CHCM e a densidade dos eritrócitos falcizados.(15) Já Linderkamp et al. em 1982 concluiu que os eritrócitos em RN são menos maleáveis e mais densos do que eritrócitos de adultos, gerando um aumento no CHCM.(16)
Além disso, o grupo Outros, onde se encontram causas não tão bem descritas na literatura, apresentou resultados sem diferença significativa da metodologia padrão, e dessa forma podemos levar em consideração que o tempo de processamento da amostra é inferior na metodologia óptica, e que nesse caso poderíamos utilizar a nova metodologia na rotina laboratorial. A hipótese da densidade também se aplica aos pacientes desse grupo de estudos, pois hipernatremia, leucocitose e uso de alguns medicamentos podem causar essa mesma interferência nos valores de CHCM. Essa hipótese pode ser verificada utilizando o teste de osmolalidade, que reflete a concentração de substâncias presentes no sangue.
Diferentemente do esperado, o grupo de amostras com eritrócitos aglutinados demonstrou que o banho-maria por uma hora ainda é a melhor opção, portanto sugere-se que em casos de amostras muito agregadas deve-se manter a metodologia padrão.
Outros estudos foram realizados utilizando a metodologia óptica como forma de corrigir o CHCM, como Goia que demonstrou que amostras com aglutinação tiveram correção da contagem de RBC por desagregação dos eritrócitos após o aquecimento, levando à correção do CHCM.(17) Ferrero-Vacher demonstrou que o uso do canal de reticulócitos é importante nos casos de crioaglutininas, porém deve-se sempre prestar atenção aos flags reportados pelo aparelho como o de “RET Scattergram”, pois podem haver outros interferentes, como hemólise, e o resultado liberado, mesmo pela metodologia óptica, pode não ser confiável.(18)
A análise da estabilidade demonstrou que os parâmetros RBC e HGB se mantêm constantes ao longo de um dia e podem ser dosados dentro desse período caso seja necessário, porém o CHCM perde estabilidade e seu resultado passa a não ser confiável com o passar do tempo. Isso pode ser devido a esse parâmetro ser derivado do cálculo CHCM = HGB / (RBC/VCM), e o aumento do VCM gerado pela absorção de líquido extracelular pelos eritrócitos resulta na redução do CHCM ao longo do tempo.
Outros estudos vêm sendo realizados sobre o canal de reticulócitos com o intuito de utilizá-lo como ferramenta de monitoramento de pacientes ou até mesmo no uso cotidiano do laboratório de análises clínicas, em casos específicos de anemias, anemias hemolíticas e crioaglutininas. Susane Franck et al. mostrou potencial utilidade do canal de reticulócitos no diagnóstico de anemia por deficiência de ferro, em que foi possível observar correlação entre os parâmetros oferecidos por essa metodologia e a quantidade de hemoglobina nos reticulócitos, que é um indicador precoce de anemia por deficiência de ferro.(19) Outro estudo que corrobora com o achado anterior foi o de Mauro Butarello et al., mostrando que o uso do canal de reticulócitos pode ser utilizado como acompanhamento da terapia com administração de ferro.(20) E, ainda, Berda-Haddad et al. observou que o uso do canal de reticulócitos para contagem de RBC é possível em casos de crioaglutinação, e para a dosagem de HGB em casos de interferência óptica.
O presente estudo apresentou como limitação o número amostral na classificação dos interferentes, sendo necessários estudos com número amostral maior e com outros tipos de interferentes para que se possa elucidar as aplicações do canal de reticulócitos na rotina laboratorial, não gerando prejuízo nos resultados e com alta sensibilidade e especificidade. A determinação de um ponto de corte no uso da metodologia óptica para as amostras aglutinadas seria de grande valor, pois desta forma poderíamos estabelecer para quais casos a metodologia padrão ainda deve ser a escolhida na tentativa de corrigir o valor espúrio de CHCM. Além disso, mais testes que avaliam a densidade das amostras seriam úteis para correlacionar valores alterados de CHCM com outros interferentes que não a aglutinação, já que vários desses interferentes não estão bem descritos na literatura.
CONCLUSÕES
Foi possível observar que o canal de reticulócitos tem a capacidade de corrigir o valor de CHCM nos casos de anemia falciforme, para amostras de recém-nascidos e na presença de outros interferentes, porém o mesmo não pode ser dito em relação às amostras aglutinadas, já que os testes não foram conclusivos. Nossos resultados não corroboram aos já apresentados em outras pesquisas, e sendo assim mais estudos são necessários para elucidar a aplicação da metodologia óptica na rotina laboratorial. Entretanto, o uso da metodologia óptica presente no canal de reticulócitos dá uma excelente oportunidade de melhoria na rotina laboratorial, otimizando o tempo de liberação de resultado e fornecendo um hemograma completo com todos os índices hematimétricos.
SUPORTE FINANCEIRO
Este trabalho teve apoio financeiro da empresa Sysmex.
AGRADECIMENTOS
Agradecimentos a Sysmex que apoiou a execução desse trabalho e aos autores envolvidos na execução do mesmo.
REFERÊNCIAS
- Oliveira RAG. Hemograma: Como fazer e interpretar. 2nd ed. São Paulo, 2015.
- Online LT. Complete Blood Count (CBC)2015 Februrary 10th 2020. Available from: https://labtestsonline.org/tests/complete-blood-count-cbc.
- Ermens AA, et al. New erythrocyte and reticulocyte parameters on CELL-DYN Sapphire: analytical and preanalytical aspects. Int J Lab Hematol. 2012;34(3):274-82.
- Zandecki M, et al. Spurious counts and spurious results on haematology analysers: a review. Part II: white blood cells, red blood cells, haemoglobin, red cell indices and reticulocytes. Int J Lab Hematol. 2007;29(1):21-41.
- Berda-Haddad Y, et al. Increased mean corpuscular haemoglobin concentration: artefact or pathological condition? Int J Lab Hematol. 2017;39(1):32-41.
- Berentsen S e Tjonnfjord GE. Diagnosis and treatment of cold agglutinin mediated autoimmune hemolytic anemia. Blood Rev. 2012;26(3):107-15.
- Glogowska E e Gallagher PG. Disorders of Erythrocyte Volume Homeostasis. Int J Lab Hematol. 2015;37(0 1):85-91.
- La Gioia A, et al. Short preheating at 41 degrees C leads to a red blood cells count comparable to that in RET channel of Sysmex analysers in samples showing cold agglutination. J Clin Pathol. 2018;71(8):729-34.
- Costa BMB, et al. Interference of cold agglutinin autoantibodies in erythrogram interpretation: a case report and literature review. Jornal Brasileiro de Patologia e Medicina Laboratorial. 2018;54(4).
- Systems SX-SAH. Flagging Interpretaton Guide, 2017.
- Sumita NM, et al. Recomendações da Sociedade Brasileira de Patologia Clínica/Medicina Laboratorial (SBPC/ML). Automação laboratorial: histórico, seleção, implantação e gestão.: Manole; 2018.
- Failace R. Hemograma manual de interpretação. 6 ed ed. Porto Alegre, 2015.
- Godon A, et al. [Automated hematology analysers and spurious counts Part 3. Haemoglobin, red blood cells, cell count and indices, reticulocytes]. Annales de Biologie Clinique. 2012;70(2):155-68.
- Finland M, et al. Cold agglutinins. I. occurrence of cold isohemagglutinins in various conditions. The Journal of Clinical Investigation. 1945;24(4):451-7.
- Embury SH, et al. Concurrent sickle cell anemia and alpha-thalassemia. Effect on pathological properties of sickle erythrocytes. The Journal of Clinical Investigation. 1984;73(1):116-23.
- Linderkamp O, et al. Deformability of density separated red blood cells in normal newborn infants and adults. Pediatric Research. 1982;11:964-8.
- Goia AL. Eliminating or Minimizing the Effects of Cold Agglutinins on the Accuracy of Complete Blood Count Results. Annals os Laboratory Medicine. 2019;39(499-500).
- Ferrero-Vacher C, et al. [Erythrocytic parameters Sysmex in a case of severe haemolysis]. Biologie au Quotidien 2015;73(6):729-32.
- Franck S, et al. Potential utility of Ret-Y in the diagnosis of iron-restricted erythropoiesis. Clinical Chemistry. 2004;50(7):1240-2.
- Buttarello M, et al. The new reticulocyte parameter (RET-Y) of the Sysmex XE 2100: its use in the diagnosis and monitoring of posttreatment sideropenic anemia. American Journal of Clinical Pathology. 2004;121(4):489-95.
Correspondência
Jennifer Tassoni Staehler
Hospital de Clínicas de Porto Alegre
Ramiro Barcelos, 2350
Porto Alegre – RS CEP: 90630-000
E-mail: [email protected]
