Controle interno de qualidade em citopatologia: o dilema da subjetividade
Internal quality control in cytopathology: the subjectivity dilema
Ednéia Peres Machado1
Mirian Braga Moreira Alves2
Mary Mayume Taguti Irie2
Flávia Ferrari Zrzebiela3
Péricles Martim Reche4
Danielle Cristyane Kalva Borato1
1Professora assistente da Universidade Estadual de Ponta Grossa – Paraná, Brasil.
2Farmacêutico(a)-bioquímica, citologista do Laboratório do Hospital Santa Casa de Ponta Grossa – Paraná, Brasil.
3Farmacêutica.
4Professor Adjunto da Universidade Estadual de Ponta Grossa – Paraná, Brasil.
Instituição: Universidade Estadual de Ponta Grossa – Paraná, Brasil.
Recebido em 04/01/2018
Artigo aprovado em 06/11/2018
DOI: 10.21877/2448-3877.201800662
INTRODUÇÃO
No Brasil, os programas de controle de qualidade em patologia clínica foram introduzidos na década de 1970 e 1980 pelo Programa Nacional de Controle de Qualidade (PNCQ) da Sociedade Brasileira de Análises Clínicas (SBAC) e Programa de Excelência para Laboratórios Clínicos (PELM) da Sociedade Brasileira de Patologia Clínica (SBPC), culminando na Resolução de Diretoria Colegiada (RDC) 302/2005, que estabelece requisitos mínimos para a medicina diagnóstica, impondo parâmetros de qualidade analítica e de validação via procedimentos controlados, com vistas à melhoria contínua da precisão e exatidão das análises através de um sistema de gestão de qualidade.(1,2)
Como a maioria dos laboratórios de citopatologia executam exames de forma artesanal e subjetiva, o monitoramento interno da qualidade ocorre por meio de um conjunto de ações sistematizadas, executado regularmente a fim de monitorar a adequabilidade da amostra, a observação do tempo de escrutínio, o controle da carga de trabalho do escrutinador, a revisão hierárquica dos esfregaços e a revisão dos esfregaços negativos.(3)
O método convencional de Papanicolaou é eficiente e de fácil aplicação, por isso foi eleito para uso nos programas de rastreamento do câncer do colo uterino,(4) porém tornou-se alvo de inúmeras críticas por altas taxas de resultados falso-negativos, acarretando ao sistema de saúde gastos sem resultados devido a erros de coleta, de escrutínio e de interpretação do diagnóstico.(3,5)
O erro de coleta ocorre pela não representatividade da junção escamo-colunar (JEC), sobreposição celular e hipocelularidade no esfregaço.(4) O erro de escrutínio dá-se pela não identificação e reconhecimento de células neoplásicas representadas no esfregaço, seja por falta de atenção e concentração, tempo insuficiente para analisar o esfregaço, fadiga mental ou pouca experiência do profissional. O erro de interpretação sucede quando as células neoplásicas são reconhecidas, mas são interpretadas como benignas ou subavaliadas e classificadas erroneamente, seja pela inexperiência do citopatologista ou por informações clínicas inadequadas.(6)
A inquirição de programas de rastreamento de base populacional relata ser a escala de produção um dado expressivo para a qualidade do exame citopatológico.(5) Assim, a Organização Mundial de Saúde (OMS) recomenda o processamento de 20 mil a 30 mil exames anuais para manter experiência aceitável.(7) O Colégio Americano de Patologistas (College of American Pathologists – CAP) detectou maiores taxas de erro no screening em laboratórios que realizam exames abaixo de 5 mil por ano,(3,5) o Reino Unido credencia para rastreamento laboratórios que processam pelo menos 15 mil exames anuais e, na América Latina, a Sociedade Peruana de Citopatologia não certifica laboratórios que processem menos que 5 mil exames anualmente.(3) No Brasil, o Ministério da Saúde, pela portaria nº 3.388, de 30 de Dezembro de 2013, recomenda a produção mínima de 15 mil exames por ano pelos laboratórios de citopatologia, com exceção de laboratórios vinculados aos hospitais habilitados como Unidades de Assistência de Alta Complexidade (Unacon) ou Centro de Alta Complexidade em Oncologia (Cacon) e hospitais universitários.(5,8)
Aliada à recomendação mínima de demanda, os métodos de revisão de esfregaços no controle interno de qualidade vislumbram a revisão aleatória de 10% dos esfregaços negativos, revisão de 100% dos esfregaços, revisão rápida de 100% dos esfregaços negativos e pré-escrutínio rápido de todos os esfregaços. Já para exames automatizados é recomendada a revisão dos esfregaços negativos.(6)
A revisão aleatória de 10% dos esfregaços negativos é o método mais utilizado, porém a maior porcentagem dos esfregaços não é revisada mostrando-se ineficiente para detectar lesões não diagnosticadas no escrutínio de rotina.(6) Recomendado como método padrão, a revisão de 100% dos esfregaços consiste no duplo escrutínio detalhado de todas as preparações, e, por ser um método mais minucioso, reduz erros de escrutínio na rotina.(9) A revisão rápida de 100% dos esfregaços negativos de escrutínio entre 30 e 120 segundos, todos os esfregaços interpretados como negativos ou insatisfatórios e os esfregaços identificados como suspeitos são submetidos a uma revisão posterior detalhada por profissional experiente que determina o diagnóstico final.(5) O método de pré-escrutínio rápido de todos os esfregaços tem por finalidade aumentar a sensibilidade do exame citopatológico, que realiza leitura rápida de todos os esfregaços em, no máximo, 120 segundos antes do escrutínio de rotina, porém acarreta alto índice de falso-positivos, por encaminhar maior número de esfregaços considerados suspeitos para revisão detalhada, mesmo assim, mostra-se como eficiente ferramenta para diminuir resultados falso-negativos.(5,6,10)
Na automação, os sistemas mais utilizados são o PapNet e AutoPap, cuja revisão dos esfregaços negativos mostra-se vantajoso para a detecção de células atípicas, mesmo quando escassas.(11) Apesar da automação ser capaz de detectar resultados falso-negativos devido a erro de escrutínio, não informa sobre erros de amostragem ou de interpretação.(6)
Este estudo teve como objetivo identificar resultados falso-negativos através do monitoramento interno de qualidade em citopatologia cervicovaginal em amostras coletadas em duplicata pelo SUS, no período de 2013 e 2014, pela revisão de 100% dos esfregaços, no qual utilizou os critérios de Bethesda.
MATERIAL E MÉTODOS
Por meio de estudo descritivo analítico foram analisados 313 esfregaços cervicovaginais pelo método convencional de Papanicolaou, nos anos de 2013 e 2014, aprovados pela Comissão de Ética em Pesquisa pela Universidade Estadual de Ponta Grossa com o Parecer Consubstanciado nº 1.614.753.
Essa pesquisa envolveu quatro Unidades Básicas de Saúde (Antônio Saliba, Cesar Milleo, Antero de Melo e Nilton Castro) do município de Ponta Grossa, Paraná, o Ambulatório da UEPG, que realiza coleta cervicovaginal para o SUS, e o projeto de extensão “Prevenção e educação na atenção à saúde da mulher: coleta de exame Papanicolaou (Projetopap) pela Universidade Estadual de Ponta Grossa (UEPG)”. As mulheres que procuraram espontaneamente o Sistema Único de Saúde (SUS) para a realização do exame preventivo do câncer do colo uterino concordaram em participar do estudo, assinando o termo de consentimento livre e esclarecido.
A coleta de material cervicovaginal foi realizada por enfermeiros, em duplicata, sendo a primeira amostra encaminhada normalmente para o SUS e a segunda amostra, que se caracterizou por um segundo esfregaço realizado com o resíduo de material cervicovaginal existente na espátula de Ayre e escovinha cervicovaginal, foi enviada para o laboratório de citologia do curso de Farmácia da UEPG.
As informações clínicas foram obtidas nas fichas de anamnese da paciente, segundo recomendação do Ministério da Saúde, a saber: hemorragia genital, pós-menopausa, sangramento ectocervical de contato, evidência de infecção sexualmente transmissível (IST), alterações macroscópicas ao exame especular, rádio ou quimioterapia, resultados anteriores com alterações atípicas de significado indeterminado, lesões pré-neoplásicas ou neoplásicas escamosas e/ou glandulares.
O método de controle interno de qualidade utilizado foi a revisão de 100% dos esfregaços, em microscópio óptico de luz comum, em objetiva de 10x e 40x. O escrutínio foi realizado pela técnica de Turret. As amostras que apresentaram resultados discordantes entre a análise citológica pelo Projetopap na leitura de escrutínio e na leitura do controle interno de qualidade foram reavaliadas por uma equipe de quatro citologistas experientes.
Também as amostras do Projetopap (controle interno) cujos resultados discordaram da primeira amostra enviada ao SUS foram reavaliadas pela equipe de citologistas revisores.
Os resultados discrepantes foram reavaliados e classificados segundo o sistema Bethesda, como a seguir: negativo para lesão intraepitelial ou malignidade (NILM); atipias celulares de significado indeterminado em células escamosas (ASC): escamosas possivelmente não neoplásicas (ASC-US) e escamosas onde não se pode excluir lesão intraepitelial de alto grau (ASC-H); lesão intraepitelial em células escamosas de baixo grau compreendendo o efeito citopático pelo HPV (LSIL); lesão intraepitelial em células escamosas de alto grau (HSIL); lesão intraepitelial em células escamosas de alto grau não podendo excluir microinvasão; carcinoma epidermoide invasor; atipias em células glandulares (AGC): células glandulares possivelmente não neoplásicas, células glandulares em que não se pode afastar lesão intraepitelial de alto grau e glandulares de origem indefinida, células glandulares de origem indefinida, possivelmente não neoplásicas, e células glandulares de origem indefinida em que não se pode afastar lesão intraepitelial de alto grau; adenocarcinoma in situ (AIS) e adenocarcinoma invasor (cervical ou endometrial). A avaliação estatística foi realizada por frequência simples.
RESULTADOS
Das 313 amostras analisadas pelo SUS (primeira amostra colhida), os resultados foram 100% NILM e nenhuma insatisfatória, e das amostras enviadas ao Projetopap (segunda amostra) 309 (98,8%) foram NILM, uma (0,3%) AIS e três (0,9%) insatisfatórias. Entre as leituras realizadas pelo SUS e pelo Projetopap houve oito (2,52%) discordantes (Figura 1).
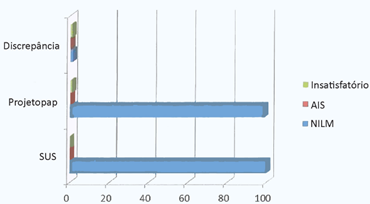
Figura 1. Comparação em porcentagem entre os resultados do SUS e Projetopap e a discrepância entre esses resultados nas amostras colhidas em duplicata.
Entre as discrepâncias houve um caso reconhecido como adenocarcinoma “in situ” na amostra enviada ao Projetopap relatada como NILM pelo SUS. O caso foi comprovado como positivo para AIS em biópsia.
Das amostras enviadas ao Projetopap, o resultado obtido no controle interno de qualidade pelo método de revisão de 100% dos esfregaços, foram: 260 (83,1%) NILM, 44 (14%) amostras insatisfatórias, sete (2,3%) ASC-US, uma (0,3%) LSIL e uma (0,3%) AIS. A discrepância entre a primeira leitura e o controle interno de qualidade foram em 49 resultados NILM, 41 amostras insatisfatórias, sete ASC-US e uma LSIL, num total de 98 (31,3%) de divergência de leitura relatada pelo controle interno de qualidade (Figura 2).
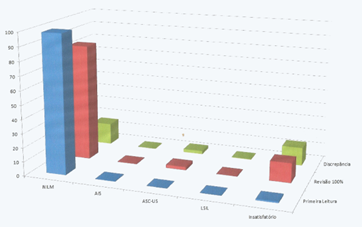
Figura 2. Comparação em porcentagem entre os resultados do Projetopap e controle interno de qualidade pelo método de 100% de revisão.
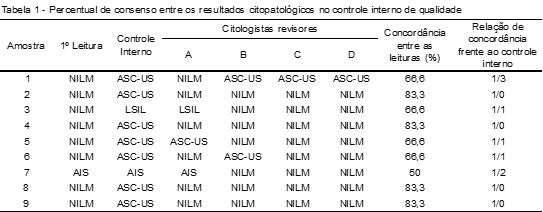
Das amostras que apresentam divergência de leitura entre a primeira (SUS) e segunda amostras (Projetopap) e o controle interno de qualidade, nove (2,9%) apresentaram atipias celulares, por isso foram revisadas por quatro citologistas experientes. Observou-se um consenso de leitura em 66,6% para ASC-US na amostra 1, 83,3% de NILM para as amostras 2, 4, 7, 8 e 9, 66,6% de NILM nas amostras 3, 5 e 6 e 50% de AIS na amostra 7. A relação de concordância entre a primeira leitura e os quatro citologistas frente ao controle interno de qualidade foi a seguinte: 1/3 na amostra 1, 1/0 nas amostras 2, 4, 8 e 9, 1/ 1 nas amostras 3, 5 e 6 e ½ na amostra 7 (Tabela 1).
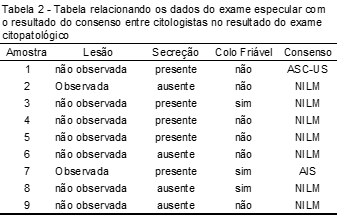
Quanto aos dados clínicos, durante o exame especular das amostras que apresentaram lesão celular, a enfermagem relatou presença de lesão visível no colo uterino em duas amostras, cinco amostras apresentaram leucorreia e três amostras colo friável (Tabela 2).
As amostras que apresentaram alteração no exame citopatológico na segunda amostra, realizada com resíduo de material cervicovaginal ratificada por quatro citologistas, apresentaram alguma alteração no exame especular, seja pela presença de secreção no caso de ASC-US ou na observação de lesão, presença de secreção e colo friável na presença de adenocarcinoma in situ.
Quanto à representatividade da junção escamo-colunar (JEC), não apresentaram células endocervicais 168 (53,78%) das amostras do SUS, e essa ausência foi observada em 206 (65,81%) amostras do Projetopap.
DISCUSSÃO
Esse trabalho, baseado em amostra cervicovaginal colhida em duplicata, utilizou a segunda amostra de esfregaço realizado com resíduos da espátula de Ayre e escovinha, com fundamento em estudos, demonstrando que, mesmo após ótima coleta, apenas 18% do total das células obtidas alcançam a lâmina por erro de transferência, pela retenção de células tumorais nas fibras da espátula ou da escovinha cervical, o que ocasiona a perda na coleta de lesões pequenas ou inacessíveis, fato que influencia significativamente taxas de falso-negativos.(11) Esse estudo detectou AIS em esfregaço residual, confirmado em biópsia.
O Ministério da Saúde preconiza que o percentual mínimo de amostras insatisfatórias deve perfazer no máximo 5% dos esfregaços.(5) Foram observadas amostras insatisfatórias em 0,9% na primeira leitura do esfregaço residual. No controle interno de qualidade foram observados 14% de esfregaços inadequados, um percentual maior que os insatisfatórios registrados pelo SUS, ressaltando que o percentual de discordância entre o SUS e Projetopap (esfregaço residual) foi pequeno (2,52%), favorecendo a tese da presença de grande quantidade de material residual nos instrumentos de coleta após a confecção de esfregaço. Isso possibilitou a comparação entre os resultados do SUS e a amostragem residual (Projetopap), e com esta a realização do controle interno de qualidade pela metodologia da revisão de 100% dos esfregaços.
A revisão de 100% dos esfregaços é o método mais minucioso para reduzir os erros de escrutínio de rotina. Consiste na dupla leitura microscópica detalhada de todos os esfregaços, por isso tem alto potencial para reduzir o maior número de resultados falso-negativos e alta capacidade de detectar esfregaços anormais, apesar de consumir maior tempo.(9,12) Neste estudo, ao se comparar o resultado do SUS com o primeiro escrutínio do Projetopap realizado com material residual, houve em torno de 98% de concordância entre os resultados, porém, na realização do controle interno de qualidade, a divergência entre as leituras do Projetopap foi expressiva, em torno de 30%, pela constatação de maior número de esfregaços insatisfatórios (hipocelularidade e sobreposição de células e/ou hemácias e/ou leucócitos), ASC-US e LSIL, interferindo na redução do número de NILM, portanto um número relevante de possíveis falso-negativos.
Esse percentual expressivo de discrepância entre a leitura do exame pelo Projetopap e o controle de qualidade deu-se pela quantidade de preparados classificados como insatisfatórios na revisão de amostras. Os critérios de satisfatoriedade pelo SUS baseiam-se na presença de células em quantidade representativa (sem valorizar a presença de células da junção escamo-colunar), bem distribuídas, fixadas e coradas de modo a permitir uma conclusão diagnóstica. O controle interno de qualidade do Projetopap aderiu ao Sistema Bethesda, considerando amostras satisfatórias, esfregaços contendo 8 mil a 12 mil células escamosas no esfregaço e, no mínimo, dez células endocervicais e/ou metaplásicas(13) aliado aos critérios de insatisfatoriedade, que são material acelular ou hipocelular com menos de 10% do esfregaço e/ou leitura prejudicada em mais de 75% do esfregaço com sobreposição por sangue, piócitos, artefatos de dessecamento, contaminantes externos ou intensa superposição celular.(14) Somente a adoção da normativa do Sistema Bethesda, a rigor, diminuiu o número de falso-negativos de forma expressiva.
Pela subjetividade da leitura, quanto menor o número de células no esfregaço e maior o número de células atípicas isoladas, a dificuldade do profissional em observar as anormalidades presentes aumenta, existindo um consenso no qual um esfregaço com menos de 200 células anormais aumenta a possibilidade de resultado falso-negativo. Quando o número de células no esfregaço cai para menos de 50, potencializa em 24 vezes o resultado falso-negativo. (12,15) Neste aspecto, a aplicação dos critérios de Bethesda na qualificação da amostra como insatisfatória aumenta a sensibilidade do teste.
Os resultados ASC-US, LSIL e AIS foram submetidos à avaliação por quatro citologistas experientes. Como a amostragem com resultados discrepantes e/ou alterados foi pequena, a análise estatística foi realizada por frequência simples.
ASC-US, termo que identifica processos inflamatórios, reativos ou reparativos, atípicos ou mais intensos, mas que não são suficientes para serem interpretados como displasia cervical (NIC).(16) A célula apresenta aumento nuclear em 2,5 a 3 vezes da célula intermediária, porém com discreto aumento na relação núcleo/citoplasma, podendo se fazer presente bi ou multinucleação, discreta hipercromasia, contorno nuclear geralmente regular com presença de anisocariose e pleomorfismo.(17) A classificação ASC-US é uma alteração problemática, pois reflete a incapacidade do citopatologista em estabelecer um diagnóstico definitivo. Bethesda preconiza que a frequência de ASC-US e/ou AGC deve ser inferior a 5% do total dos resultados e preconiza ainda que os resultados de ASC-US/AGC não devem ultrapassar o dobro das lesões de baixo grau (LSIL).(18)
LSIL representa alterações celulares em epitélio escamoso compatível com displasia leve, uma vez que as alterações citológicas ocorrem em células intermediárias. As células podem aparecer isoladas ou agrupadas, com citoplasma abundante, núcleo aumentado em pelo menos três vezes comparado com a célula intermediária normal, grau variável de hipercromasia, anisocariose, com presença de bi ou multinucleação, distribuição regular da cromatina, porém grosseiramente granular, nucléolos ausentes ou diminutos quando observados. Os núcleos apresentam contorno irregular e o citoplasma apresenta típica cavitação perinuclear (coilócito) sugestiva da presença do vírus HPV.(3)
O controle interno de qualidade registrou sete ASC-US, um LISL e um AIS, e, em consenso entre os citologistas, apenas uma amostra das sete amostras de ASC-US manteve-se nessa classificação LSIL; o consenso foi para NILM e AIS, sendo que apenas um revisor concordou com essa classificação, caso este confirmado em biópsia.
O consenso entre os escrutinadores deu-se em 83% em duas amostras e 66% em quatro amostras. A falta de unanimidade no resultado da leitura dos exames citológicos explicita a subjetividade e seus riscos, cujas medidas sugeridas para diminuir o impacto da avaliação subjetiva é o credenciamento por parte dos governos, de laboratórios cuja demanda seja alta, como forma de assegurar a experiência do profissional.
Outra forma de prognosticar a capacidade do escrutinador na avaliação de lesões celulares é o percentual de positividade. Assim, o Ministério da Saúde determina que o percentual de positividade no rastreamento do câncer do colo do útero no Brasil é considerado: muito baixa: abaixo de 2,0%; baixa: entre 2,0% e 2,9%; esperada: entre 3% e 10%; e acima da esperada acima de 10%.(19)
O monitoramento interno de qualidade em citopatologia embasado em critérios de avaliação e registro dos resultados encontrados permite a melhoria por direcionar medidas corretivas, seja detecção da identificação incorreta do material coletado a problemas relacionados aos procedimentos laboratoriais, desde a coloração, análise microscópica e emissão do laudo. Assim, identifica as causas de erros, avalia o desempenho, implementa ações de melhorias do desempenho diagnóstico.
CONCLUSÃO
O presente estudo ressalta a importância da adoção de uma sistema de controle de qualidade em citopatologia, evidenciada pelo aumento de amostras insatisfatórias entre a primeira leitura e a leitura do controle interno.
Visto que o exame citopatológico apresenta altas taxas de resultados falso-negativos, é necessário que se avalie o método mais eficiente de controle interno de qualidade. A revisão de 100% dos esfregaços negativos é considerada um método eficiente, pois permite a revisão de maior número possível de esfregaços.
A não classificação da amostra AIS, confirmada em biópsia, por parte dos citopatologistas experientes e do SUS, mostra a falta de monitoramento de qualidade. Resultados falso-negativos culminam em tratamento mais complicado, pois, quanto mais evoluído o adenocarcinoma e mais tarde diagnosticado, maior a dificuldade de reverter o caso.
Os indicadores analisados em laboratório podem evidenciar problemas em etapas antecedentes da leitura do esfregaço. É compromisso do laboratório a educação continuada de toda a equipe na busca de melhor qualidade, colaborando no planejamento e na implementação de ações corretivas e de melhoria.
Nesse sentido, o Projetopap iniciou a educação continuada da equipe de enfermagem das UBSs participantes do projeto, por meio de palestras e atividades práticas relacionadas à coleta de material durante o exame de Papanicolaou, mostrando os erros e ações corretivas a fim de proporcionar coleta e esfregaços adequados.
Agradecimentos
Agradecemos o apoio e colaboração da Secretaria de Saúde da cidade de Ponta Grossa-PR, na obtenção de dados para o desenvolvimento deste estudo.
Abstract
Objective: The aim of this study was to conduct internal monitoring of cervical cytopathology quality in samples collected in the period between 2013 and 2014 and to identify possible false-negative results, relating them to the tests obtained by the Unified Health System (SUS). Methods: 313 cervical smears were analyzed by Papanicolaou method in the years 2013 and 2014. The internal quality control was conducted by a 100% review’s of the smears. Samples with discordante results between the cytological analysis by Projetopap and internal quality control were re-evaluated by a team of four cytologists. Results: Of the 313 samples analyzed by SUS 100% were NILM, by Projetopap 309 (98,8%) were NILM, one (0,3%) AIS and three (0,9%) unsatisfactory. In the internal quality control were 260 (83,1%) NILM, 44 (14%) unsatisfactory samples, seven (2,3%) ASC-US, one (0,3%) LSIL and one (0,3%) AIS. Conclusion: The study shows the importance of a quality control system in cytopathology and alert to the possibility of false-negative reports issuing.
Keywords
Quality control; Papanicolaou test; Uterine cervical neoplasms
REFERÊNCIAS
- PNCQ – Programa Nacional de Controle de Qualidade. Histórico, 2016. Disponível em: <https://www.pncq.org.br/ Noticia/BR/Index/12>. Acesso em 15.07.2016.
- Lopes HJJ. Garantia e Controle da Qualidade no Laboratório Clínico. Assessoria Técnico-Científica da Gold Analisa Diagnóstica LTDA – 2003. Belo Horizonte.
- Bortolon PC, Silva MAF, Corrêa FM, Dias MBK, Knupp VMAO, Assis M, Claro IB. Avaliação da Qualidade dos Laboratórios de Citopatologia do Colo do Útero no Brasil. Revista Brasileira de Cancerologia. 2012; 58(3): 435-44.
- INCA – Instituto Nacional do Câncer. Diretrizes brasileiras para o rastreamento do câncer do colo do útero. Disponível em: <http://www1.inca.gov.br/inca/Arquivos/Diretrizes.PDF>. Acesso em 02.08.2016.
- INCA – Instituto Nacional do Câncer.. Manual de gestão da qualidade para laboratório de citopatologia. Disponível em: <http://www1.inca.gov.br/inca/Arquivos/livro_completo_manual_ citopatologia.pdf>. Acesso em 07.08.2016
- Tavares SBN, Amaral RG, Manrique EJC, Sousa NLA, Albuquerque ZBP, Zeferino LC. Controle da Qualidade em Citopatologia Cervical: Revisão de Literatura. Revista Brasileira de Cancerologia. 2007; 53(3): 355-364
- WHO – World Health Organization. Programmes and projects. Cancer: screening for cervical cancer Disponível em: <http://www.who.int/cancer/detection/cervical_cancer_screening/en/index.html>. Acesso em 02.08.2016
- Brasil. Ministério da Saúde. Controle dos cânceres do colo do útero e da mama Básica. Brasília: Ministério da saúde, 2013.
- Hutchinson ML. Assessing the costs and benefits of alternative rescreening strategies [Editorial]. Acta Cytol. 1996;40(1):4-8.
- Kaminsky FC, Burke RJ, Haberle KR, Mullins DL. An economic model for comparing alternative policies for cervical cytologic smear screening. Acta Cytol. 1995;39(2):232-8.
- Maeda MY, Shirata NK, Longatto Filho A, Cavaliére MJ. Influência da introdução da escova cervical para colheita de material cervicovaginal no programa de rastreamento de câncer ginecológico. RBM – Ginecologia e Obstetrícia, 2006; 4,2.
- Koss LG. The Papanicolaou test for cervical cancer detection. A triumph and a tragedy. JAMA. 1989;261(5):737-43.
- Kurman RJ, Solomon D, editors. The Bethesda system for reporting cervical/vaginal cytologic diagnoses. New York: Springer-Verlag; c1994.
- Shirata NL, Pereira SMM, Cavaliere MJ, Longatto FA, Utagawa, ML, et al. Celularidade dos esfregaços cervicovaginais: importância em programas de garantia de qualidade em citopatologia. J Bras Ginec. 1998;108(3):63-6.
- Brasil. Ministério da Saúde.Técnico em Citopatologia. Caderno de referência 1: Citopatologia Ginecológica. Brasília: Ministério da Saúde, 2012.
- Ergeneli MH, Duran EH, Ergin T, Dermirhan B, Erdogan M. Atypical squamous cells of indetermined significance. Clinical experience in a Turkish university hospital. Eur J Obstet Gynecol Reprod Biol. 2001;96(1):108-10.
- Morin C, Bairati I, Bouchard C, Fortier M, Roy M, Moore L, et al. Cytologic predictors of cervical intraepithelial neoplasia in women with an ASCUS Pap smear. Acta Cytol. 2000;44(4):576-86.
- Arbyn M, Schenck U. Detection of false negative Pap smears by rapid reviewing. A metaanalysis. Acta Cytol. 2000;44(6):949-57. Disponível em:<http://www.karger.com/Article/Abstract/328615>. Acesso em 15.09.2016
- Lonky NM, Sadeghi M, Tsadik GW, Petitti D. The clinical significance of the poor correlation of cervical dysplasia and cervical malignancy with referral cytologic results. Am J Obstet Gynecol. 1999;181(3):560-6.
Correspondência
Ednéia Peres Machado
Av. General Carlos Cavalcanti, 4748 – bloco M – Uvaranas
Departamento de Análises Clínicas e Toxicológicas
84030-900 – Ponta Grossa-PR, Brasil
