Correlação entre os métodos sorológico e molecular para detecção do HIV na triagem de doadores de sangue na Fundação HEMOPA
Correlation between sorological and molecular methods for HIV detection in blood donor screening in HEMOPA Foundation
Carlos Eduardo de Melo Amaral1
Luanne Rafaela Magalhães Cunha2
Valéria Lobato Macedo2
1 Doutor em Genética e Biologia Molecular/Universidade Federal do Pará (UFPA).
2 Graduado(a) em Biomedicina/Centro Universitário Metropolitano da Amazônia.
Instituição: Fundação Centro de Hemoterapia e Hematologia do Pará (HEMOPA). Belém, PA, Brasil.
Recebido em 19/10/2020
Aprovado em 23/09/2021
DOI: 10.21877/2448-3877.202102077
INTRODUÇÃO
Desde a década de 1980, o Human Immunodeficiency Vírus/Vírus da imunodeficiência humana (HIV/VIH) é alvo de estudos na população mundial por ser o agente etiológico causador da Acquired Immunodeficiency Syndrome/Síndrome da imunodeficiência humana adquirida (AIDS/SIDA), correspondendo a um grande impacto na saúde pública.(1)
O HIV pertence à família Retroviridae, gênero Lentivirus, e é classificado em dois tipos, HIV-1 e HIV-2. O vírus é constituído por duas fitas de RNA de cadeia simples, é um vírus envelopado e apresenta como glicoproteínas de superfície gp160, gp120 e gp41. Em relação ao seu capsídeo viral, contém as proteínas p6, p9, p17 e p24 assim como as enzimas integrase e protease que originam as proteínas p31 e p10, respectivamente. É fundamental o conhecimento dessas proteínas virais, pois elas contribuem para a detecção de anticorpos nos testes sorológicos.(2)
O Ministério da Saúde estabelece diferentes sequenciais de procedimentos para o uso das metodologias de diagnóstico para HIV, podendo ser testes para detecção de antígeno e/ou anticorpo, tendo como objetivo atender às diversas situações clínicas, a fim de uma conclusão segura no diagnóstico.(1) Em relação à transfusão em bancos de sangue, as metodologias empregadas para triagem do HIV estão em constante avanço, uma vez que se preza sempre pela segurança transfusional. Além disso, é evidenciada a triagem clínica nos bancos de sangue, além da triagem laboratorial, na qual é estabelecido, por meio da Portaria de consolidação nº 5, que os testes utilizados na triagem obtenham 100% de sensibilidade e maior que 99% de especificidade.(3)
A triagem para o HIV no Centro de Hemoterapia e Hematologia do Pará (Fundação HEMOPA) é realizada através da triagem sorológica-molecular, onde a triagem sorológica decorre de um imunoensaio de 4ª geração (quimioluminescência) que diminui a janela diagnóstica (tempo que decorre entre a infecção e a detecção de marcadores virais), sendo esta influenciada pela alta sensibilidade do teste.(3,4) Diferentemente da triagem molecular, que é realizada com o auxílio do Nucleic Acid Test (NAT), o qual detecta diretamente o ácido nucleico viral na revelação da detecção precoce de novos doadores ou doadores em soroconversão.(3,5)
Na Fundação HEMOPA, utiliza-se o ensaio Abbott Architect HIV Ag/Ab, no qual é empregada a metodologia de quimioluminescência, sendo esta uma metodologia de diagnóstico de alta sensibilidade. Dessa forma, são detectados qualitativamente e simultaneamente os anticorpos anti-HIV-1/2 assim como o antígeno HIV p24 em amostras de soro ou plasma.(6) A quantidade de antígenos e anticorpos presentes na amostra será determinada através de unidades relativas de luz (RLUs), sendo diretamente proporcionais. O resultado do teste sorológico é expresso a partir do sinal quimioluminescente como valores de uma relação sinal/ponto de corte (S/CO), estabelecido a partir da calibração do ensaio ARCHITECT HIV Ag/Ab Combo.(7,8)
Diante dos valores da relação S/CO é possível interpretar as amostras como reagentes e não reagentes. Quando uma amostra estiver com os valores da relação S/CO acima de 1,2 considera-se a amostra positiva. As amostras que obtiverem valores relação S/CO entre 0,8 até 1,2, são consideradas inconclusivas. Entretanto, segundo as informações do fabricante, pode-se considerar amostras reagentes que tenham sido positivas e inconclusivas. Quanto às amostras não reagentes, os valores da relação S/CO deve estar abaixo de 0,8.(7)
O teste molecular NAT foi introduzido na Fundação HEMOPA a partir de 2012, porém somente no ano de 2013 tornou-se obrigatório para testagem nos bancos de sangue, através da Portaria nº 2.712 de 2013.(9) O teste NAT HIV/HCV/HBV Bio-Manguinhos constitui uma metodologia multiplex de alta sensibilidade e especificidade baseada na detecção de ácidos nucleicos do agente infeccioso através da plataforma de PCR em tempo real, na qual detecta a infecção, diminuindo o tempo de janela diagnóstica de 30 dias para 10 a 12 dias (NAT-HIV) a partir do início da infecção, apresentando um papel essencial na identificação da viremia, principalmente quando encontrada em níveis baixos, resultando assim em um aumento da segurança transfusional.(5) Embora seja um teste baseado na reação em cadeia da polimerase (PCR), os resultados são expressos apenas qualitativamente como detectável e indetectável.(5,10)
Em alguns casos, é possível observar resultados discrepantes, onde as amostras das bolsas de sangue que resultaram na triagem sorológica como reagente ou inconclusiva, no NAT podem resultar como indetectável para HIV. Para esse fim, recomenda- se que a amostra seja encaminhada para realização do teste confirmatório. Apesar disso, mesmo que o resultado do teste confirmatório seja negativo, a bolsa de sangue que originou a amostra é descartada, pois apresentou um resultado alterado. Além disso, o provável doador se tornará inapto temporariamente, e poderá ser convocado para repetição do teste em uma nova amostra, a fim da mudança desta circunstância.(3)
Os testes sorológicos e moleculares que são utilizados em bancos de sangue têm uma grande importância para a sociedade, pois objetivam a identificação de forma precoce de indivíduos infectados, aumentando a segurança transfusional. Dessa forma, é possível observar que a utilização em conjunto desses testes na triagem contribui de forma significativa na identificação da infecção em um tempo mais curto.(11) Vale ressaltar que ao seguir a legislação que rege a segurança transfusional cabe aos bancos de sangue se responsabilizar pelo esclarecimento do resultado alterado, assim como levar à possibilidade de confirmação do mesmo com o intuito de garantir uma informação segura e auxiliar no acompanhamento de doadores inaptos.(3)
Diante disso, o presente estudo teve como objetivo buscar a correlação entre os métodos sorológico e molecular para detecção do HIV na triagem de doadores de sangue na Fundação HEMOPA, de forma que seja possível associar os valores da relação S/CO e a presença de RNA viral na detecção do HIV.
MATERIAL E MÉTODOS
Realizou-se um estudo retrospectivo, quantitativo e descritivo na Fundação Centro de Hemoterapia e Hematologia do Pará (HEMOPA), no laboratório de Biologia Celular e Molecular (GEBIM). Foi realizada a busca de dados no Sistema de Banco de Sangue (SBS Web e Progress) da Fundação HEMOPA, referente aos anos de 2015, 2016, 2017, 2018 e 2019.
Os sistemas informatizados do banco de sangue foram utilizados para o desenvolvimento da busca de resultados das amostras reagentes (inconclusivas e positivas) no teste sorológico (Quimioluminescência-ARCHITECT HIV Ag/Ab Combo), em seguida ocorreu a busca do resultado do teste molecular (NAT HIV Bio-Manguinhos) para cada amostra.
Adotou-se como critérios de inclusão: resultados de amostras provenientes de candidatos a doações de sangue; amostras reagentes na triagem sorológica durante o período de 2015 a 2019, na qual se apresentaram como inconclusivas (S/CO 0,8-1,2) e positivas (S/CO >1,2). E como critérios de exclusão: amostras que se apresentaram como não reagentes; amostras procedentes de pacientes; amostras sem resultado de S/CO; amostras sem resultado do NAT; e duplicatas de amostras.
Para análise estatística de dados, os resultados das amostras foram digitalizados para uma planilha no banco de dados no programa Statistical Package for Social Sciences (SPSS), versão 20, no qual foram organizados e contabilizados. Em seguida, foi realizada a estatística descritiva, determinando as frequências absolutas e percentuais das variáveis qualitativas (resultados sorológicos – positivos, inconclusivos ou negativos, moleculares detectáveis ou indetectáveis).
Para a análise da correlação dos valores da relação S/CO com a presença de RNA viral realizou-se o teste de Qui-quadrado (X²) com intervalo de confiança de 95% (p-valor menor ou igual a 0,05). Em relação às variáveis quantitativas (valores da relação S/CO) foram calculados os valores de média, desvio padrão e valores mínimos e máximos, de acordo com as características das variáveis em estudo. Realizou-se também o cálculo do ponto de corte do teste Quimioluminescência-ARCHITECT HIV Ag/Ab Combo, assim como as informações de sensibilidade, especificidade, valor preditivo positivo (VPP), valor preditivo negativo (VPN) e acurácia foram obtidas por meio da análise gráfica gerada pela curva Receiver Operating Characteristic (ROC).
ÉTICA
O referente estudo foi submetido à Plataforma Brasil, base nacional e unificada de registros de pesquisas envolvendo seres humanos e a todo o sistema Comitê de Ética e Pesquisa/Comissão Nacional de Ética em Pesquisa (CEP/CONEP), consistindo na aprovação pelo Comitê de Ética em Pesquisa da Faculdade Metropolitana da Amazônia – CEP/FAMAZ, sob o CAAE 26167219.70000.5701, com o Parecer nº 3.922.771 (anexo 1). Logo, foi autorizada a dispensa de aplicação do Termo de Consentimento Livre e Esclarecido (TCLE) devido serem analisados somente os resultados referentes às amostras de doadores de sangue, adquiridos por meio de relatórios gerais. Em momento algum as identificações e/ou informações confidenciais foi revelada.
RESULTADOS
Foram coletadas no Banco de Sangue da Fundação HEMOPA, durante o período de 2015 a 2019, 482.176 bolsas de sangue, que deram origem a amostras a serem triadas; 0,20% dessas amostras foram reagentes para HIV pelo método de Quimioluminescência (ARCHITECH HIV Ag/Ab Combo).
Ao aplicar os critérios de exclusão, sucederam para este estudo 910 amostras. Dessas 910 amostras reagentes obtidas, 75,60% (688/910) obtiveram resultado positivo (S/CO > 1,2) e 24,40% (222/910) inconclusivo (S/CO 0,8-1,2). Com a investigação dos resultados do NAT HIV de cada amostra, observou-se que 100% (222/222) das amostras inconclusivas no teste sorológico resultaram como NAT HIV indetectável. Quanto às amostras positivas, 66,38% (456/688) procederam como NAT HIV detectável e 33,62% (232/688) dessas resultaram como NAT HIV indetectável. Assim, na visão geral do estudo, pode-se observar que 50,10% (456/910) das amostras reagentes foram NAT HIV detectável e 49,90% (454/910) NAT HIV indetectável.
Dessa forma, ao realizar a estatística descritiva dos valores de S/CO das amostras detectáveis e indetectáveis no NAT, observou-se que o valor da mediana S/CO das amostras NAT detectável foi 503,93 (mín – máx, 1,64 – 9752,00). O valor da mediana S/CO das amostras indetectáveis foi de 1,22 (mín – máx, 0,80 – 820,42). Foi analisada a diferença entre a mediana S/CO entre NAT detectável e NAT indetectável. Os valores encontrados foram significativamente mais elevados entre os detectáveis (503,93 vs. 1,22; U de Mann-Whitney = 2908,000; p = 0,000).
Para demonstrar o perfil sorológico associado ao resultado do teste molecular, os valores da relação S/CO acima de 1,2 foram distribuídos em faixas, exibindo apenas valores de S/CO das amostras positivas, visto que já foi evidenciado o resultado do teste molecular das amostras inconclusivas. Os valores da relação S/CO das amostras positivas oscilou de 1,2 a 9752,000. À vista disso, a melhor distribuição dos valores de S/CO das amostras foi em 4 faixas (agrupamentos). A Tabela 1 demonstra a taxa de amostras detectáveis e indetectáveis no NAT de acordo com os agrupamentos dos valores da relação de S/CO.
A Curva Receiver Operating Characteristic (ROC) foi utilizada para determinar o melhor ponto de corte dos valores de S/CO das 910 amostras provenientes do ensaio ARCHITECH HIV Ag/Ab. Os resultados apresentaram uma curva estatisticamente significativa (AUC [Área sob a curva] = 0,986, EP [Erro padrão] = 0,004, p = 0,000; 95% CI [Intervalo de confiança] = 0,978 – 0,994), demonstrando que a escolha aleatória de valores de S/CO, 98,6% das amostras NAT HIV detectável apresentarão valores de S/CO maiores que os valores de amostras NAT HIV indetectáveis (Figura 1).
Foram consideradas como verdadeiro positivo e verdadeiro negativo as amostras que resultaram como NAT detectável e indetectável, respectivamente. O ponto de corte que maximizou a sensibilidade e a especificidade foi de 15,020, com sensibilidade de 97,6% e especificidade de 95,9%. O valor preditivo positivo (VPP) foi 95,89% e o valor preditivo negativo (VPN) foi 97,55%. A acurácia do teste foi de 96,80%. O ponto de corte apresentou maior capacidade de classificar quem tinha presença de viremia RNA HIV (97,6% dos casos) quando comparado a quem não tinha viremia RNA HIV (95,9% dos casos).
Com isso, se estabeleceu a correlação entre os valores de S/CO das amostras com seus respectivos resultados do NAT (Tabela 2), onde se demonstrou uma correlação estatisticamente significante entre os valores de S/CO e a presença de RNA viral na detecção do HIV no teste NAT.
Tabela 1- Taxa de detecção de NAT HIV detectáveis e indetectáveis de acordo com os agrupamentos de valores de S/CO ARCHITECH HIV Ag/Ab
| ARCHITECH HIV Ag/Ab
S/Co |
N° | NAT HIV
Detectável % (N°) |
NAT HIV
Indetectável % (N°) |
| ˃ 1,2 e ≤ 10 | 205 | 3% (6) | 97% (199) |
| ˃ 10 e ≤ 60 | 55 | 64% (35) | 36% (20) |
| ˃ 60 e ≤ 110 | 18 | 89% (16) | 11% (2) |
| ˃ 110 | 410 | 97,3 % (399) | 2,7% (11) |
| Total | 688 | 66,38% (456) | 33,62% (232) |
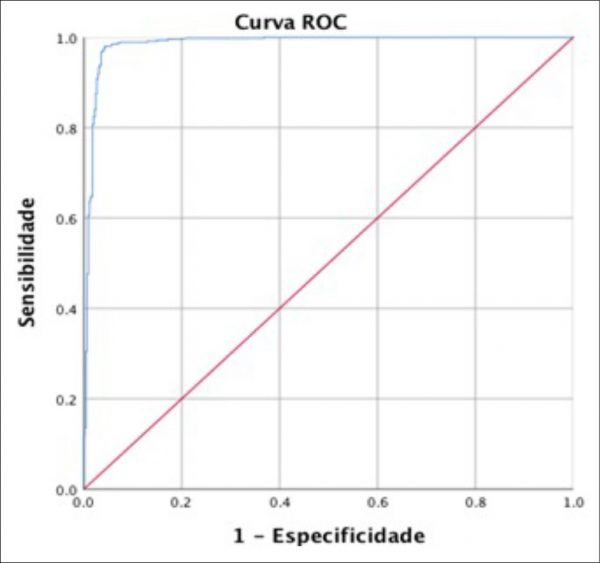
Figura 1. Curva (ROC) para os valores de S/CO das amostras reagentes na Quimioluminescência – ARCHITECH HIV Ag/Ab Combo
Tabela 2 – Correlação entre os valores S/CO de acordo com ponto de corte, e seus respectivos resultados do NAT.
|
ARCHITECH HIV Ag/Ab Ponto de corte |
N° | NAT Detectável % (N°) | NAT Indetectável % (N°) |
| S/CO > 15,020 | 463 | 95,90% (444) | 4,10% (19) |
| S/CO < 15,020 | 447 | 2,46% (11) | 97,54% (436) |
| Total | 910 | 455 (50%) | 456 (50%) |
Teste X² (p-valor < 0,005)
DISCUSSÃO
Os métodos de triagem sorológica (Quimioluminescência – ARCHITECT HIV Ag/Ab Combo) e molecular (NAT) realizados simultaneamente na Fundação HEMOPA para a detecção do vírus HIV são imprescindíveis para garantir uma boa segurança transfusional e a diminuição de resultados inconclusivos, evitando assim a transmissão de partículas virais através da transfusão sanguínea.(12,13) Embora haja muitos estudos que demonstrem a associação do NAT a um teste de quarta geração (Quimioluminescência e Elisa),(6,14,15) ainda são raros os que apresentam uma correlação notória e bem estabelecida.(11)
Para Jacociunas et al.,(12) a qualidade do sangue oferecido pelos bancos de sangue depende da correlação na interpretação entre os resultados de testes sorológicos (Quimioluminescência) e do NAT (NAT HIV-Bio-Manguinhos). Um estudo realizado na Índia expôs uma correlação bastante significante entre o método de sorologia (ARCHITECT HIV Ag/Ab Combo) e os resultados da metodologia NAT (eSAS Procleix Ultrio Assay) na triagem do HIV em relação ao vírus da Hepatite B e da Hepatite C nos anos de 2010 a 2012.(16)
No presente estudo, com quantitativo de 910 amostras reagentes (positivas e inconclusivas), foi possível notar que em 2015 o percentual de amostras foi maior (26,38%) no Progress em decorrência de não haver existência do sistema SBS Web que foi implantado a partir de julho de 2016, o que vem a justificar o percentual de amostras no mesmo sistema se apresentar alto.
Com o resultado de 910 amostras reagentes, observou-se que 222 amostras foram inconclusivas (0,8 – 1,2 S/CO), na qual 100% resultaram em NAT indetectável, corroborando com os achados de Alonso et al.,(17) onde apresentou em sua pesquisa o total de 69.471 amostras testadas pelo ensaio ARCHITECT Ab/Ag Combo, sendo que apenas sete resultaram como inconclusivas, constatando que 100% das amostras inconclusivas obtiveram resultado negativo em dois testes confirmatórios: pelo NAT (kPCR Versant HIV-1 Plataforma de RNA) e pelo RIBA – Recombinant Immunoblot Assay/ Ensaio de Imunotransferência Recombinante (Geenius HIV 1/2 Teste de confirmação [Bio-Rad, Marnes-la-Coquette, France]).
As amostras positivas com NAT detectável (456) do presente estudo tiveram valor de S/CO acima de 1,2 pelo ARCHITECT Ab/Ag Combo, semelhantemente ao de Roy et al.(18) e Chacón e Mateos(14) que consideraram amostras positivas com valor de S/CO acima de 1. No segundo estudo (RIBA), Chacón e Mateos(14) demonstraram que 96,6% de suas amostras (229) eram NAT detectável (kPCR).
Quanto à análise descritiva realizada, observou-se que o estudo de Alonso et al.,(17) demonstrou que a mediana das amostras positivas de S/CO foi 660,74 variando de 2,91 e 1392,12 (599 amostras), e a mediana obtida por uma pesquisa executada por Roy et al.(18) em Nova Deli foi de 405,28 variando entre 22,67 e 1639,12 (147 amostras). Em comparação ao presente estudo a mediana encontrada (503,93) se encaixa na variação de medianas identificadas por Roy et al.(17) e Alonso et al.,(18) respectivamente, ou seja, possibilitando demonstrar a aproximação das medianas descritas na literatura.
De acordo com a organização das amostras aos agrupamentos estabelecidos por meio dos valores de S/CO para a determinação do perfil sorológico, pode-se constatar que quanto maior o valor de S/CO, maior a possibilidade de as amostras resultarem como NAT detectável.
Entretanto, vale ressaltar que mesmo o alto percentual de detectáveis na última faixa (S/CO >110) não exclui a possibilidade de haver amostras indetectáveis (2,7%). Da mesma forma em que ocorre nas primeiras faixas, na qual foram obtidos valores de S/CO menores, tornando maior a possibilidade de as amostras dessas faixas serem NAT indetectável (ver Tabela 1). Assim como em nosso estudo, Alonso et al.(17) utilizaram o mesmo ensaio ARCHITECT Ag/Ab Combo, porém com a utilização de duas metodologias diferentes como teste confirmatório, sendo o RIBA utilizado como um teste confirmatório primário e o NAAT como teste confirmatório secundário. Com isso, foi possível observar que das amostras com S/CO ≥ 100 (603 amostras), o NAAT apresentou-se com resultado detectável para 7 das 9 amostras que obtiveram resultados negativos inicialmente pelo RIBA, dessa forma sustentando a utilização do NAAT na triagem, como o nosso estudo demonstrou.
Após a análise da curva ROC foi determinado o ponto de corte de 15,020 que evidenciou as amostras que apresentaram presença de RNA HIV e ausência de RNA HIV. Desse modo, uma pesquisa em Madri alcançou o ponto de corte de 32,7 com a realização da curva ROC atingindo uma sensibilidade de 97,4% e especificidade de 100%,(14) e diante disso Guarner(13) sugeriu que a sensibilidade poderia estar sendo reduzida pelo fato do antígeno p24 formar uma ligação com os anticorpos que o paciente já continha.
CONCLUSÃO
No presente estudo, estabelecemos que na triagem sorológica-molecular há uma correlação estatisticamente significante, na qual a presença de anticorpos e/ou antígenos no teste ARCHITECH HIV Ag/Ab Combo orienta a predição de viremia no NAT, isto é, na maioria dos casos. Portanto, torna-se necessário o constante avanço das metodologias utilizadas na triagem dos bancos de sangue, uma vez que o HIV possui uma clínica própria, daí ser imprescindível a busca da identificação precoce de doadores que possam estar infectados ainda que não tenham conhecimento de tal infecção.
AGRADECIMENTOS
Agradecemos à Fundação de Hemoterapia e Hematologia do Pará e a todos os docentes do curso de Biomedicina do Centro Universitário Metropolitano da Amazônia, em especial ao nosso orientador, Dr. Carlos Eduardo de Melo Amaral.
REFERÊNCIAS
- Secretaria de Vigilância em Saúde (SVS). Manual técnico para o diagnóstico da infecção pelo HIV em adultos e crianças. Brasília: Ministério da Saúde; 2018.
- Costa LJ, Arruda LB, Mendonça LM, Lucas CGO. Síndrome da Imunodeficiência Adquirida/AIDS. In: Santos NSO, Romanos MTV, Wigg MD. Virologia Humana. 3ª edição. Rio de Janeiro: Guanabara-Koogan; 2015. p. 498-531.
- Ministério da Saúde (Brasil). Portaria no. 5, de 28 de setembro de 2016. Consolidação das normas sobre as ações e os serviços de saúde do Sistema Único de Saúde. Anexo IV. Diário Oficial da União, 28 fev 2017; seção 1.
- Vallefuoco L, Mazzarella C, Portella G. Fourth generation assays for HIV testing. Expert Rev. Mol. Diagn. 2016 Mai;16(7):723-32. doi:10.1080/14737159.2016.1179115.
- Martins TS, Nóbrega JOT. Segurança transfusão no Brasil: dos primórdios ao NAT. Rev. Bras. Anal. Clin. 2018 Nov; 50(4):321-6. doi:10.21877/2448-3877.201800693.
- Wang L, Wang JY, Tian XD, Ruan JX, Yu Y, Yan F. Sample-to-cutoff ratios using Architect HIV Ag/Ab Combo: The influence with the results of supplemental tests and optimal cutoff value to predict HIV infection. J. Clin. Lab. Anal. 2019 Jan;33(5). doi:10.1002/jcla.22866.
- Cui C, Liu P, Feng Z, Xin R, Yan C, Li Z. Evaluation of the clinical effectiveness of HIV antigen/antibody screening using a chemiluminescence microparticle immunoassay. J. Virol. Methods. 2015 Ago;214:33-36. doi:10.1016/j.jviromet.2014.07.026.
- Zhao Y, Gou Y, Li D, et al. Performance evaluation of a new automated fourth-generation HIV Ag/Ab combination chemiluminescence immunoassay. Clin. Chem. Lab. Med. 2018 Abr;56(5):115-7.
- Ministério da Saúde (Brasil). Portaria no. 2.712, de 12 de novembro de 2013. Redefine o regulamento técnico de procedimentos hemoterápicos. Diário Oficial da União13 nov 2013; seção 6.
- Souza RLC. Avaliação tecnológica do teste molecular (NAT) para HIV, HCV e HBV na triagem de sangue no Brasil. São Paulo. Tese [Doutorado em Ciências] Universidade de São Paulo; 2018.
- Jacociunas LV, Davila TF, Santos DV, Brietzke CB. Avaliação da correlação de sorologia e teste de ácido nucleico em doadores de sangue reagentes para o Vírus da Imunodeficiência Humana. Clin. Biomed. Res. 2018 Dez;38(4):332-38. doi:10.4322/2357-9730.86556
- Mafirakureva N, Mapako T, Khoza S, Emmanuel JC, Marowa L, Mvere D, et al. Cost effectiveness of adding nucleic acid testing to hepatitis B, hepatitis C, and human immunodeficiency virus screening of blood donations in Zimbabwe. Transfusion. 2016 Dez ;56(12):3101-11. doi:10.1111/trf.13858.
- Guarner J. Human immunodeficiency virus: Diagnostic approach. Semin Diagn Pathol. 2017 Jul;34(4):318-24. doi:10.1053/j.semdp.2017.04.008.
- Chacón L , Mateos ML , Holguín A. Relevance of Cutoff on a 4th Generation ELISA Performance in the False Positive Rate During HIV Diagnostic in a Low HIV Prevalence Setting. J Clin Virol. 2017 Jul;92:11-13. doi: 10.1016/j.jcv.2017.04.014.
- Muthukumar A, Alatoom A, Burns S, Ashmore J, Kim A, Bannister E, et al. Comparison of 4th-Generation HIV Antigen/Antibody Combination Assay With 3rd-Generation HIV Antibody Assays for the Occurrence of False-Positive and False-Negative Results. Lab Med. 2015 Mai;46(2):84-e29. doi:10.1309/LMM3X37NSWUCMVRS.
- Pandey P, Tiwari AK, Dara RC, Rawat GS, Negi A, Raina V. Confirmation and follow up of initial “NAT yields”: Prospective study from a tertiary healthcare center in India. Transfus Apher Sci. 2016 Abr;54(2):242-247. doi:10.1016/j.transci.2015.08.003.
- Alonso R, Pérez-García F, Gijón P, Collazos A, Bouza E. Evaluation of the Architect HIV Ag/Ab Combo Assay in a low-prevalence setting: The role of samples with a low S/CO ratio. J Clin Virol. 2018 Jun;103:43-47. doi:10.1016/j.jcv.2018.04.002.
- Roy P, Kapoor R, Rawat P, Aggarwal M, Gaur R, Anand M, et al. Occurrence of false positivity in a fourth generation (Ag/Ab) HIV screening assay: horns of a dilemma. Int J Res Med Sci. 2018 Jul;6(7):2423-29. doi: 10.18203/2320-6012.ijrms20182829.
Correspondência
Luanne Rafaela Magalhães Cunha
Fundação Centro de Hemoterapia e Hematologia do Pará
Tv. Padre Eutíquio, 2109 – Batista Campos
Belém – PA – CEP: 66033-000
E-mail: [email protected]
