A COVID-19 e o diagnóstico da aspergilose pulmonar invasiva
COVID-19 and the invasive pulmonary aspergillosis diagnosis
Paulo Murillo Neufeld1
1Professor da Faculdade de Farmácia da Universidade Federal do Rio de Janeiro (UFRJ). Rio de Janeiro-RJ, Brasil.
Instituição: Laboratório de Micologia Médica e Forense. Faculdade de Farmácia – Universidade Federal do Rio de Janeiro (UFRJ). Rio de Janeiro-RJ, Brasil.
Recebido em 03/08/2020
Artigo aprovado em 17/08/2020
DOI: 10.21877/2448-3877.20200019
DOENÇA PELO CORONAVÍRUS-19 (COVID-19)
No final do mês de dezembro de 2019, uma série de casos de pneumonia de origem desconhecida foi identificada na província de Hubei, em Wuhan, na China continental.(1) Um grande número de pacientes se dirigiu, de forma simultânea, a diversos hospitais da localidade, exibindo importante sintomatologia respiratória, que era semelhante a um quadro viral, com febre e tosse seca e imagens radiológicas incompatíveis com aquelas de uma pneumonia viral comum ou mesmo de uma pneumonia de origem bacteriana. Estudos epidemiológicos, que foram imediatamente levados a curso, vincularam esses casos a um mercado popular de alimentos e víveres de Hubei.(2) Tipicamente, esse mercado comercializava produtos de origem animal, não só de animais de produção, como bovinos, ovinos, caprinos, suínos, aves e ovos e pescados, mas também de animais exóticos e selvagens. Muitos desses animais, inclusive, eram comercializados vivos ou não processados.(3)
As primeiras investigações incriminaram alguns animais como possíveis portadores do vírus SARS-CoV-2 (família Coronaviridae), agente da COVID-19 (Coronavirus Disease 2019) que teria sido transmitido às pessoas que frequentavam o mercado, em decorrência das baixas condições higiênico-sanitárias do estabelecimento.(4) Inicialmente considerou-se a possibilidade de alguns tipos de serpentes serem o reservatório do vírus. No entanto, essa hipótese foi depois abandonada pela maioria dos autores porque não há comprovação científica de que répteis possam ser infectados ou servir de hospedeiro para o vírus, bem como, ao mesmo tempo, não há evidências de que esse vírus tenha hospedeiros que não sejam aves ou mamíferos.(3,4)
Atualmente considera-se que os morcegos sejam os hospedeiros primários do SARS-CoV-2 e que o vírus, antes de chegar aos seres humanos, passa por hospedeiros intermediários como o pangolim.(4) A razão para que esses animais sejam considerados os reservatórios do vírus encontra fundamento nas análises e comparações moleculares feitas com os Coronavírus isolados desses animais e o SARS-CoV-2. O resultado dessas investigações demonstraram uma identidade genômica elevada entre os vírus.(4)
Estudos moleculares têm indicado também que os morcegos são, da mesma forma, os hospedeiros primários dos Coronavírus agentes da Síndrome Respiratória Aguda Grave (SARS-CoV), que ocorreu em 2003, e da Síndrome Respiratória do Oriente Médio (MERS-CoV), que ocorreu em 2012.(5) Nessas duas síndromes, tanto o SARS-CoV quanto o MERS-CoV passaram, igualmente, por hospedeiros intermediários, como a civeta (SARS-CoV) e o dromedário (MERS-CoV), antes de infectarem os seres humanos. De acordo com os relatos iniciais dos pesquisadores chineses, nem todos os indivíduos identificados com sintomatologia de COVID-19 tinham relação com o mercado em Wuhan, já que dos 59 pacientes reportados apenas 27 tinham efetivamente contato direto com esse estabelecimento. Os outros pacientes eram, na sua maioria, familiares que tinham entrado em contato com pessoas enfermas no convívio doméstico. Esse fato pôs em perspectiva duas rotas de transmissão viral, uma animal-humano e outra humano-humano.(5) No mercado foi favorecida a interação animal-humano, onde o vírus pode saltar a barreira da espécie e contaminar o homem pelo contato com sangue, excreções, secreções e fluidos contaminados de animais vivos ou sem processamento. O mecanismo de transmissão humano-humano, por sua vez, segue um padrão semelhante, ocorrendo pelo contato com mãos, aerossóis e secreções de pessoas infectadas, bem como fômites contaminados. Em ambas as rotas de transmissão, a via aerógena é de extrema importância para a propagação do vírus. Uma via oral-fecal tem sido também observada.(3)
Em conformidade com o Comitê Internacional de Taxonomia de Vírus (ICTV), esse vírus se encontra classificado no super-reino Riboviria, ordem Nidovirales, família Coronaviridae, subfamília Orthocoronavirinae e gênero Betacoronavírus, que contém, então, a espécie SARS-CoV-2. Importa mencionar que a família Coronaviridae é composta ainda pelos gêneros Alphacoronavirus, Gammacoronavirus e Deltacoronavirus. Dentre esses gêneros, os únicos que são capazes de produzir infecção em homens e animais, ocasionando sintomas respiratórios, gastrointestinais, hepáticos e neurológicos, são os Betacoronavirus e os Alphacoronavirus.(4) Em decorrência das endemias e pandemias causadas por membros da família Coronaviridae, essa tem adquirido grande relevância em saúde pública.(2)
O SARS-CoV-2 é um vírus de RNA de cadeia simples (27 a 32 kilobases), não segmentado e com polaridade positiva, envolvido por um envelope bilipídico. Esse vírus exibe uma morfologia pleomórfica, habitualmente arredondada ou esférica, e dimensões de cerca de 50 nm a 200 nm. O envelope viral apresenta três proteínas estruturais em sua superfície, a proteína espicular S, a proteína da matriz/membrana M e a proteína de envelope E, que desempenham diferentes funções no processo de montagem viral e de infecção celular.(4) No envelope está presente ainda a enzima hemaglutinina-esterase que, igualmente, contribui com o processo infeccioso. No interior do vírus encontra-se a proteína nucleocapsídica N, que também é uma proteína estrutural e está associada à proteção do RNA.(3)
Uma vez que tenha ocorrido a inalação, ingestão, inoculação ou autoinoculação das partículas virais, o processo de infecção pode ter início. A incorporação do SARS-CoV-2 às células respiratórias do hospedeiro (pneumócitos tipo 2) ocorre quando o complexo proteína espicular S do envelope viral (domínios S1 e S2) entra em contato com seu receptor, a Enzima Convertedora de Angiotensina II (ECA2), presente na membrana celular.(2,4) Ao mesmo tempo, o complexo proteína S interage com a Proteinase Transmembranar Serina 2 (TMPRSS2), que também colabora decisivamente para a infecção. Resumidamente, a ECA 2 promove a fusão entre a superfície do vírus e a membrana plasmática e a TMPRSS2 facilita, na sequência, a entrada do RNA na célula alvo.(3,4) A penetração do vírus ocorre por endocitose ou formação de vesícula intracelular. Dentro da célula inicia-se a etapa de biossíntese com a transcrição, a tradução e a replicação do RNA viral, utilizando o maquinário enzimático do hospedeiro. Uma vez terminado o processo de síntese proteica e multiplicação genômica, as cópias virais passam a ser montadas no Retículo Endoplasmático e no Complexo de Golgi. Por fim, os vírus são liberados através de exocitose ou por ruptura da célula, iniciando, massivamente, novos ciclos infecciosos.(4)
Do ponto de vista fisiopatológico, a origem dos sintomas mais graves apresentados pelos pacientes com COVID-19 é explicada pela ativação do sistema imunológico conato. O SARS-CoV-2 pode desencadear uma resposta imunológica excessiva e desregulada com massivo recrutamento de macrófagos e polimorfonucleares e hiperativação e liberação de citocinas, quimiocinas e outros mediadores pró-inflamatórios (Tempestade de Citocina), que é ineficaz para a contenção do vírus, mas sendo, ao contrário, produtora de enorme dano tissular.(3) Esse processo inflamatório agressivo e aberrante pode causar a síndrome da angústia respiratória grave (SARG) [síndrome do desconforto respiratório agudo (SDRA) ou síndrome do desconforto respiratório grave (SDRG) ou síndrome da angústia respiratória aguda (SARA) ou ainda síndrome respiratória aguda grave (SARS)], que pode levar a um desfecho fatal.(6)
O curso clínico da COVID-19 pode ser distribuído em três fases. Na fase I, o vírus se replica na mucosa respiratória e ocorre viremia, os sintomas são aqueles de infecção respiratória, como tosse seca e febre, podendo ocorrer gastroenterite com vômito e diarreia. Uma linfopenia costuma aparecer. Na fase II, a infecção chega aos pulmões e continuam a tosse e a febre. A pneumonia pode ser leve ou se mostrar com sintomas mais graves (taquipneia, hipóxia). A linfopenia se acentua e pode haver uma elevação nos níveis de Dímero D.(3,4) A partir desse momento, a evolução pode ser favorável, com eliminação do vírus e progressivo desaparecimento dos sintomas, ou o doente pode entrar num estado crítico, que caracteriza a fase III. Nessa última fase ocorre extrema dificuldade respiratória (necessidade de ventilação assistida) e um quadro de resposta inflamatória sistêmica (SIRS) com hipotermia, taquipneia, taquicardia, hipotensão, podendo chegar a um choque séptico (hipotensão refratária, coagulação intravascular, isquemia de extremidades, falência múltipla dos órgãos). Marcadores de inflamação (proteínas de fase aguda, ferritina) podem estar também elevados nesse estágio da doença.(4)
COINFECÇÕES VIRAIS, BACTERIANAS E FÚNGICAS
A pandemia da COVID-19 é uma emergência global em saúde pública que tem sido aprendida em tempo real.(5) Na medida da passagem dos acontecimentos, vai se construindo um melhor entendimento acerca da história natural da doença.(5,7) Com isso, o controle e a prevenção da enfermidade, bem como o manejo dos pacientes acometidos vão se tornando mais efetivos. A COVID-19 é uma síndrome e diversas intercorrências surgem ao longo da evolução da doença, solicitando da comunidade científica, de forma urgente, posições resolutivas. Nesse contexto, uma das intercorrências que começam a ter maior destaque na literatura médica é aquela associada às coinfecções.(4,8,9)
Apesar da limitada experiência clínica com respeito às complicações decorrentes de infecções concomitantes por diferentes patógenos na COVID-19 pode-se esperar certa correlação com o que já foi descrito para outras pandemias como, por exemplo, aquela causada pelo vírus da influenza.(10) Na pandemia por influenza, Streptococcus pneumoniae e Staphylococcus aureus foram as bactérias copatogênicas mais prevalentes, contudo, Pseudomonas aeruginosa, Streptococcus pyogenes, Haemophilus infuenzae, Klebsiella pneumoniae e Mycoplasma pneumoniae foram também relatadas. Agentes virais como o Rinovírus (hRV), Metapneumovírus Humano (hMPV), Adenovírus (AdV), Vírus Sincicial Respiratório (RSV) e Coronavírus Humano (HCoV) já foram, igualmente, reportados em coinfecções. Relativamente aos fungos, Aspergillus fumigatus, Aspergillus niger, Candida albicans, Cryptococcus neoformans foram os mais isolados entre os casos de comorbidade infecciosa. Ainda com referência às doenças fúngicas secundárias, no surto causado pelo SARS-CoV-1, em 2003, foram também informados quadros de infecção invasiva determinados pelo Aspergillus spp., inclusive, com desfecho fatal.(11)
Na COVID-19, como era esperado, o relato de coinfecções tem se tornado cada vez mais recorrente. A presença de outros microrganismos como vírus, bactérias e fungos é sempre um fator crítico que pode aumentar as dificuldades para o diagnóstico, prognóstico e tratamento da doença pelo SARS-CoV-2, bem como agravar os sintomas e elevar as taxas de mortalidade.(12) Os estudos atuais informam coinfecções com o vírus da influenza A e B (FluA, FluB), hRV, AdV, Parainfluenza tipos1, 2, 3, 4 (PIV1, PIV2, PIV3, PIV4), Coronavírus HKU1 (HKU1), Coronavírus não-COVID-19, hMPV, RSV, M. pneumoniae e Chlamydia pneumoniae. Outros vírus como HIV, Hepatite e Citomegalovírus (CMV) têm sido observados. Acinetobacter baumannii, Actinomyces spp., K. pneumoniae, Legionella pneumophila, Rothia spp., Streptococcus spp. e Veillonella spp. são algumas das bactérias que aparecem em associação com a COVID-19.(12,13) Os patógenos fúngicos mais reportados são aqueles comumente encontrados em infecções oportunistas que acometem os pacientes imunocomprometidos como o Aspergillus spp., C. albicans, Candida glabrata, Candida dubliniensis, Candida parapsilosis sensu stricto, Candida tropicalis e Candida krusei.(12,14)
A taxa de coinfecção viral não é alta na COVID-19 e isso parece estar relacionada a uma certa vantagem competitiva que o SARS-CoV-2 exibe em relação aos outros vírus respiratórios.(14) As coinfecções por vírus estão geralmente associadas à necessidade de abordagens clínico-laboratoriais mais complexas, maior tempo de internação e elevado risco de desenvolvimento de SDRA. Não há dúvidas de que as coinfecções virais causam sérios danos ao sistema imunológico, levando a uma COVID-19 mais grave e destrutiva. Além de causar distúrbios na imunidade, outros mecanismos deletérios importantes sobre o sistema de defesa incluem lesões no epitélio das vias aéreas e redução da depuração mucociliar, o que favorece a implantação de novos vírus.(14,15)
Em relação à ocorrência de coinfecções bacterianas e fúngicas, essas têm sido observadas tanto em pneumonias virais, uma situação recorrente, como na COVID-19, quando os pacientes se encontram gravemente enfermos.(12) Dados clínicos, contudo, mostram uma baixa taxa de coinfecção por bactérias e fungos nas infecções pelo SARS-CoV-2, e isso pode ser devido à antibioticoterapia extensiva empregada na fase inicial da doença. As coinfecções bacterianas e fúngicas influenciam também no grau de inflamação sistêmica e, em consequência, na progressão e prognóstico da COVID-19, o que pode levar a um aumento dos cuidados intensivos do uso de antibióticos e das mortes ou, pelo menos, produzir um atraso no tempo de cura.(14,16)
Em pacientes graves com COVID-19, as citocinas pró-inflamatórias, especialmente IL-6, associadas à lesão pulmonar, têm sido bastante reportadas em diferentes estudos. A infecção por SARS-CoV-2 pode causar danos aos linfócitos, especialmente células B, células T e células NK, o que pode levar ao comprometimento do sistema imunológico durante o período da doença. A diminuição dos linfócitos e da função imunológica do hospedeiro pode ser uma das principais razões para as coinfecções por ambos os grupos de microrganismos, notadamente para fungos como o Aspergillus spp. e a Candida spp.(5) De fato, parece haver certa interação inflamatória entre as bactérias ou os fungos e o SARS-CoV-2. Além do status imunológico alterado e da antibioticoterapia prolongada, pacientes gravemente enfermos têm maior probabilidade de receber tratamentos com cateteres invasivos e serem submetidos à ventilação mecânica, resultando também em maior sensibilidade a infecções secundárias, principalmente por patógenos multirresistentes.(12,14)
A infecção do SARS-CoV-2 nas células intestinais pode levar a alterações da microbiota intestinal e a sintomas gastrointestinais. Coinfecções também podem alterar a homeostase intestinal, aumentando a intensidade da infecção e estimulando as células imunológicas a produzirem uma resposta inflamatória mais aguda.(17) A diversidade da microbiota intestinal de pacientes com COVID-19 se altera significativamente. O número relativo de agentes bacterianos e fúngicos oportunistas e patogênicos tende a ser maior, enquanto que a quantidade daqueles microrganismos benéficos claramente diminui. O desequilíbrio da microbiota pode ser de curso longo, e, no caso dos fungos, alterações intestinais podem ser observadas por até 12 dias após não se identificar mais o SARS-CoV-2 em amostras de nasofaringe. Na realidade, o que parece ocorrer é que a microbiota intestinal pode tanto regular quanto ser regulada por microrganismos invasores, induzindo, com isso, a efeitos estimuladores ou supressores, durante o curso da virose.(14,17)
DIAGNÓSTICO CLÍNICO-LABORATORIAL DA ASPERGILOSE PULMONAR INVASIVA ASSOCIADA À COVID-19
Nas últimas décadas, as infecções fúngicas têm sido associadas a importantes quadros de morbimortalidade, especialmente em indivíduos que apresentam grave comprometimento de seu sistema imunológico.(18) De acordo com a literatura, em torno de 1 bilhão de pessoas apresentam manifestações clínicas primárias e/ou secundárias relacionadas a infecções superficiais, subcutâneas e invasivas e cerca de 1,6 milhão morrem todos os anos, principalmente em decorrência de complicações determinadas por micoses sistêmicas.(3,4,19,20) Apesar das infecções invasivas por esses organismos apresentarem taxas de incidência mais baixas do que aquelas tegumentares, exibem percentuais de mortalidade extremamente elevados. Os principais agentes envolvidos em casos clínicos com desfecho fatal são o Aspergillus spp. (30%-95%), a Candida spp. (46%-75%), o Cryptococcus spp. (20%-70%), os membros da ordem Mucorales (30%-90%) e o Pneumocystis sp. (20%-80%).(18)
Desde que os hospedeiros se encontrem hígidos, os mecanismos de defesa compostos pela barreira cutâneo-mucosa, processo inflamatório e sistema imune são efetivos na proteção frente às infecções fúngicas. No entanto, essas infecções podem se estabelecer quando ocorrem rupturas das defesas dos pacientes por processos patológicos e/ ou iatrogênicos.(21) Doenças de base de origem microbiana, neoplásica, metabólica e degenerativa, além de intervenções e procedimentos médicos (cateterização, ventilação mecânica, cirurgias) e farmacológicos (antibioticoterapia, corticoterapia, cistostáticos) para suporte e tratamento podem tornar os indivíduos extremamente susceptíveis.(22) Dentre os agentes fúngicos secundários, o gênero Aspergillus spp. tem sido preponderante, cursando de forma grave, especialmente em casos de infecção pulmonar. Tomando-se em perspectiva a aspergilose pulmonar crônica, para uma rápida abordagem epidemiológica, tem sido relatada, para essa condição, uma frequência de 200 mil casos por ano e um total de 3 milhões de pessoas acometidas em todo o mundo. Após seu diagnóstico, pode-se ainda contabilizar mais de 15% de mortes nos primeiros seis meses de doença, o que representa, aproximadamente, cerca de 450 mil óbitos somente na fase inicial dessa enfermidade.(23) Importa mencionar também que, quando equívocos de diagnóstico ou demoras na definição da etiologia ocorrem, a aspergilose pulmonar invasiva pode atingir taxas de até 100% de mortalidade. Todavia, quando diagnosticada e tratada em tempo hábil pode exibir taxas de mortalidade mais favoráveis e inferiores a 50%.(24)
Em decorrência da criticidade das doenças pulmonares por Aspergillus spp., faz-se necessária uma aproximação conceitual com seus quadros mórbidos mais comuns. Do ponto de vista clínico, a aspergilose pulmonar e das vias aéreas pode ser dividida em formas distintas como a aspergilose broncopulmonar alérgica, o aspergiloma, a aspergilose pulmonar crônica, que é composta pela aspergilose cavitária crônica, aspergilose fibrosante crônica e aspergilose necrosante crônica (semi-invasiva ou invasiva subaguda), a aspergilose invasiva aguda e a traqueobronquite (colonizante ou obstrutiva, invasiva, ulcerativa e pseudomembranosa) e a rinossinusite alérgica e invasiva (crônica ou aguda). Dependendo da via de infecção, a aspergilose pode ser ainda classificada em não angioinvasiva, angioinvasiva ou broncoinvasiva (vias aéreas). Todas essas formas são produzidas, majoritariamente, pelo Aspergillus fumigatus, A. flavus, A. terreus, e A. niger, que são cosmopolitas e ubiquitários e têm na inalação de seus esporos (conídios) a principal via de acesso pulmonar.(24,25) Nos processos irritativos, observa-se uma reação de hipersensibilidade complexa, que é produzida pela colonização fúngica das vias aéreas, levando à obstrução bronquial, inflamação e impactação mucosa que determinam bronquiectasias, fibrose e comprometimento respiratório. O incremento da resposta Th2 dos linfócitos e a produção de interleucinas 4, 5 e 13 conduzem a uma eosinofilia e ao aumento de IgE sérica.(23) Nos tecidos, os conídios são eliminados por macrófagos alveolares que, além da fagocitose após o reconhecimento dos antígenos da parede celular dos elementos do Aspergillus spp., secretam mediadores inflamatórios que favorecem o recrutamento de neutrófilos e a ativação da imunidade celular, que é determinante para a eliminação de hifas.(25)
Como mencionado anteriormente, a aspergilose broncopulmonar alérgica é uma resposta imunológica exagerada do hospedeiro à colonização das vias aéreas mediada por reação de hipersensibilidade tipo I e II, que leva a danos às áreas acometidas. A maioria dos casos ocorre em pessoas com asma de longa duração ou fibrose cística. Clinicamente, evolui com tosse, febre, mal-estar, dor toráxica, expectoração com tampões mucosos escuros, hemoptise ocasional e sinais de obstrução. Os achados radiográficos exibem infiltrados parenquimatosos nos lóbulos superiores, atelectasias e bronquiectasias.(25)
O aspergiloma representa a colonização de uma cavidade pulmonar preexistente que esteja conectada a um bronquíolo. Não há invasão tecidual produzindo uma reação tissular leve. Do ponto de vista anatomopatológico, o aspergiloma é um agregado de hifas, mucina, fibrina e células inflamatórias. Normalmente são lesões únicas e observadas com maior frequência nos lobos superiores.(26) Em geral, os pacientes são imunocompetentes e as cavidades originadas previamente por tuberculose, sarcoidose e doença obstrutiva crônica entre outras etiologias. Essa condição pode ser assintomática ou apresentar hemoptise e, eventualmente, tosse e dispneia. As imagens radiológicas mostram uma massa sólida arredondada, ocupando parcialmente o interior de uma cavidade e separada de suas paredes por um anel de ar (sinal do crescente aéreo).(25) O aspergiloma pode ser móvel e a tomada de imagens em posições diferentes pode demonstrar a mobilidade da estrutura. Nódulos aspergilares não cavitários (<3 cm) podem ser incidentalmente observados também em achados radiográficos e sua importância reside no fato de poderem mimetizar lesões malignas até que biópsias revelem a real etiologia desses achados.(24)
A aspergilose pulmonar crônica inclui distintos quadros clínicos e sua diferença para a aspergilose pulmonar aguda é a duração dos sintomas normalmente superior a três meses. A doença costuma afetar tanto pacientes imunocompetentes quanto aqueles com um imunocomprometimento mais brando.(23,26) Uma de suas condições é a aspergilose cavitária crônica (aspergiloma complexo), que produz uma ou mais cavidades no parênquima pulmonar durante vários meses nas áreas superiores dos pulmões. Com a evolução dessas lesões podem ser desencadeados processos fibróticos que caracterizam a aspergilose fibrosante crônica. Comumente, essas formas acometem pacientes imunocompetentes, mas também indivíduos com tuberculose, tumores pulmonares, pneumotórax, doença obstrutiva crônica e aspergilose broncopulmonar.(26) A aspergilose necrosante crônica (semi-invasiva ou subaguda) corresponde a uma infecção invasiva local que cursa de maneira indolente, evoluindo ao longo de semanas ou meses. A doença é um processo invasivo e cavitário do parênquima pulmonar. Invasão vascular e disseminações para outros órgãos são pouco frequentes. Ocorrem tipicamente em indivíduos com baixo grau de imunocomprometimento ou com uma enfermidade crônica, ou certos fatores predisponentes (diabetes mellitus, alcoolismo, má nutrição, pneumoconiose, doença pulmonar obstrutiva crônica, enfarte do miocárdio, corticoterapia). Os pacientes quase sempre apresentam sintomas constitucionais (febre, mal-estar, fatiga, perda de peso) acompanhados de tosse produtiva crônica ou hemoptise. As imagens radiográficas mostram consolidação crônica ou múltiplos nódulos em um ou ambos os lobos superiores que tendem progressivamente a produzir cavitações. Classicamente, os achado radiológicos tendem a evoluir com o tempo.(23)
A aspergilose pulmonar invasiva é a manifestação clínica mais frequente da doença sistêmica causada por membros do gênero Aspergillus. A taxa de mortalidade em indivíduos imunocomprometidos pode variar entre 38% a 75%, alcançando percentuais de até 90% em pacientes submetidos a transplantes de medula óssea. Entre os fatores de risco para a aquisição dessa condição, a neutropenia é preponderante, sendo especialmente crítica em contagens de neutrófilos menores do que 500 células/mm3 por mais de dez dias. Uma forte correlação é observada entre a duração e o grau de neutropenia e o risco de desenvolvimento de infecção invasiva. O risco de infecção tem sido estimado em cerca de 1% ao dia nas três primeiras semanas e em torno de 4,3% nos dias subsequentes (24 a 36 dias).(23,25) Uma forma angioinvasiva pode estar ainda presente, principalmente nos pacientes neutropênicos, que exibem rápido curso com deterioração clínica, ocorrendo em algumas horas ou alguns dias. A invasão de hifas no endotélio dos vasos produz trombose com isquemia, necrose tissular e disseminação hematogênica. Outros processos associados à aspergilose pulmonar invasiva incluem transplantes de medula óssea e órgãos sólidos, terapias prolongadas e com altas doses de corticoides e citostáticos, tumores hematológicos e doença granulomatosa crônica. Pacientes imunocompetentes (ou não neutropênicos), mas gravemente enfermos, tais como aqueles com aguda influenza A e B, doença hepática ou doença pulmonar obstrutiva crônica têm se mostrado também susceptíveis. A aspergilose pulmonar invasiva pode cursar com uma sintomatologia inespecífica, mas, em geral, estão presentes febre resistente a antibioticoterapia, dor pleural e tosse. Dispneia, produção de escarro e hemoptise também são observadas.(25) As imagens de tórax costumam apresentar um ou múltiplos nódulos com ou sem cavitação, consolidação segmentar, infiltrado peribronquial ou derrame pleural. Em pacientes neutropênicos, os achados radiológicos iniciais podem revelar nódulos com um contorno atenuado ao seu redor com aspecto de “vidro fosco” e que representa hemorragia, necrose e edema alveolar circundante à lesão (sinal do halo). Apesar do sinal do halo ser um achado altamente sugestivo de aspergilose angioinvasiva, esse não é patognomônico de aspergilose invasiva, já que está presente em amplo espectro de outras doenças pulmonares.(23)
A traqueobronquite aspergilar é uma patologia quase que exclusiva de pacientes imunocomprometidos (transplantados de pulmão e HIV+), apesar de haver relatos da doença em indivíduos imunocompetentes. Esse processo é uma condição especial de aspergilose invasiva das vias aéreas (aspergilose broncoinvasiva) que inclui bronquite, bronquiolite broncopneumonia e pneumonia lobular e que não apresenta invasão vascular.(24,26) Em geral, com sintomas leves e inespecíficos, observam-se dispneia, tosse, dor toráxica, hemoptise e expectoração de moldes mucosos. Casos de pacientes assintomáticos, contudo, podem ocorrer. Diferentes padrões têm sido descritos: a traqueobronquite/bronquite obstrutiva está associada à formação de tampões mucosos decorrentes do crescimento de hifas nas vias aéreas, tem pouca produção de muco e nenhuma ou mínima invasão; a traqueobronquite pseudomembranosa se caracteriza por extensa inflamação e invasão da árvore brônquica e presença de membranas e detritos necróticos sobre a mucosa branquial; a traqueobronquite ulcerativa representa uma invasão focal da mucosa traqueobranquial por hifas do Aspergillus spp., geralmente nos pontos de sutura do transplante pulmonar. Os achados radiográficos não são específicos, mas podem mostrar colapso lobular ou segmentar e consolidações peribronquiais.(26,27)
Outros processos clínicos associados ao Aspergillus spp. são a bola fúngica sinusal, a sinusite alérgica e a sinusite invasiva. A bola fúngica dos seios nasais representa uma colonização fúngica sem invasão do espaço sinusal. A clínica mais frequente é a obstrução nasal, rinorreia e algia craneofacial. Achados radiográficos inespecíficos podem exibir microcalcificações intrassinusais. A doença alérgica, por sua vez, caracteriza-se por uma reação de hipersensibilidade crônica dos seios paranasais, com formação de pólipos, mas sem invasão óssea, asma, eczema ou rinite. Sintomas de cefaleia e obstrução podem estar presentes. Altos níveis de IgE podem ser detectados.(28) Uma doença invasiva dos seios paranasais também pode ser observada. Como na forma invasiva pulmonar, sinusites invasivas agudas e crônicas têm sido reportadas. A sinusite aguda é mais comum em pacientes neutropênicos graves e transplantados de medula óssea. A forma crônica ocorre em pacientes com graus leves de imunocomprometimentos ou imunocompetentes. Clinicamente, a doença aguda tem sintomas pouco específicos que incluem febre, tosse, epistaxe, descarga e obstrução nasal, tumefação orbital e dor facial. Essa condição pode ocorrer concomitantemente com a aspergilose pulmonar invasiva.(29) As imagens radiográficas, em geral, são pouco sensíveis ou específicas, contudo, mostram opacidade e destruição óssea. A sinusite crônica, igualmente, tem sintomas pouco específicos, porém, caracterizam-se por uma evolução lenta, durante meses, e que podem levar a transtornos visuais, cefaleia e sintomas neurológicos. As imagens radiográficas se assemelham àquelas da forma invasiva aguda.(29,30)
Importa mencionar que o diagnóstico de todos esses quadros clínicos associados aos fungos do gênero Aspergillus spp. se constitui em um enorme desafio médico e laboratorial, tendo em vista a condição de base dos pacientes ser geralmente crítica em decorrência da existência de diferentes comorbidades e fatores de risco consumptivos.(31,32) Nesse sentido, critérios apropriados de diagnóstico são fundamentais para o manejo e o tratamento de pacientes com infecções fúngicas sistêmicas, em particular para aqueles com aspergilose pulmonar de origem viral, eventualmente causada pelo vírus da influenza ou pelo SARS-CoV-2.(33) Atualmente, os critérios estabelecidos e recomendados pelo consórcio formado pela Organização Europeia para a Investigação e Tratamento do Câncer (EORTC) e pelo Grupo de Estudos de Micoses do Instituto Nacional de Alergia e Doenças Infecciosas dos Estados Unidos (MSG) são os mais aceitos e utilizados. Essas recomendações diagnósticas foram recentemente revisadas para incluir novos testes de diagnóstico, grupos particulares de agentes fúngicos e populações especiais de pacientes.(22)
De acordo com o grupo EORTC/ MSG, a doença fúngica pode ser classificada em doença provada (pacientes imunocomprometidos e imunocompetentes), doença provável (pacientes imunocomprometidos) e doença possível (pacientes imunocomprometidos). A definição dessas categorias é procedida após a análise de uma combinação de fatores relacionados ao paciente, tais como fatores do hospedeiro (doença de base e fatores predisponentes iatrogênicos), fatores clínicos (apresentação clínica e radiográfica) e fatores micológicos (determinações diretas e/ ou indiretas do elemento fúngico)(22,34) (Tabela 1).
O diagnóstico provado requer um alto grau de certeza, ou seja, uma evidência tecidual (exame direto, histopatologia, citopatologia e/ou biologia molecular) e cultural (incluindo hemocultura) incontestável de infecção por fungo filamentoso em amostras estéreis.(34) Já o diagnóstico provável baseia-se numa associação entre os fatores do hospedeiro, fatores clínicos e fatores micológicos. Nesse grupo, há um menor grau de certeza micológica, pois a visualização microscópica dos elementos fúngicos, o isolamento em cultura, a sorologia para antígenos e a biologia molecular são procedidos a partir de amostras não estéreis (escarro, lavado broncoalveolar, aspirado e escovamento brônquico).(22) O diagnóstico possível, por sua vez, é realizado apenas com base nos fatores do hospedeiro e nos fatores clínicos, tendo em vista a ausência dos fatores micológicos.(35)
De acordo com esses critérios, especialmente para uma aspergilose provada, hifas septadas hialinas e ramificadas em ângulo agudo e destruição tecidual associada deverão ser observadas, por exame micológico direto e/ ou histopatologia, realizados em amostras obtidas de forma asséptica de sítios estéreis clinica e radiologicamente anormais.(36) Além disso, deverá ser recuperado o Aspergillus spp. a partir da cultura dessas amostras clínicas. Provas moleculares (PCR e sequenciamento), se validadas e disponíveis, poderão ser ainda realizadas a partir de tecido formolizado e fixado em parafina.(22,37)
A aspergilose provável poderá ser considerada quando uma dessas condições relacionadas aos fatores do hospedeiro estiver presente: história recente de neutropenia profunda e por longo tempo (<500 células/mm3 por >10 dias), doença hematológica maligna, transplante alogênico de medula óssea, transplante de órgão sólido, corticoterapia prolongada (³ 3 mg/kg de corticoides por ³ 3 semanas em um período de sessenta dias), tratamento com outros imunossupressores de células T (em um período de noventa dias), tratamento com imunossupressores de células B, imunodeficiência aguda e doença aguda enxerto-contra-hospedeiro grau III e IV refratárias à corticoterapia.(22,36) Os aspectos clínicos para aspergilose pulmonar deverão incluir um dos quatro achados em tomografia computadorizada: lesões bem circunscritas e densas com ou sem sinal do halo, sinal do crescente aéreo, cavidades e consolidações lobulares ou segmentares em forma de cunha.(22,34) As evidências micológicas de aspergilose pulmonar deverão apresentar: detecção microscópica de elementos fúngicos em escarro, lavado broncoalveolar, aspirado ou escovamento brônquico, teste de galactomanana positivo: (soro/ plasma: ³ 1.0; ou lavado broncoalveolar: ³ 1.0; ou soro/ plasma: ³ 0,7; e lavado broncoalveolar: ³ 0,8; ou líquido cefalorraquidiano: ³ 1.0) PCR positivo (soro, plasma ou sangue total: 2 ou mais testes consecutivos; ou lavado broncoalveolar: 2 ou mais duplicatas; ou soro, plasma ou sangue total: 1; e lavado broncoalveolar: 1) e isolamento de Aspergillus spp. das amostras pulmonares não estéreis.(22,35)

Apesar dos critérios do Consórcio EORTC/ MSG se mostrarem adequados para a aspergilose provada em pacientes imunocomprometidos, tem havido controvérsias quanto à sua aplicação em pacientes imunocompetentes gravemente enfermos, mas não imunocomprometidos, e hospitalizados em UTI, bem como em casos de aspergiloses provável e possível.(34,35) Dentre alguns motivos, há pacientes que não exibem os fatores do hospedeiro como os recomendados, os achados radiográficos em pacientes com ventilação mecânica podem ser poucos específicos, o que entra em conflito com os critérios da EORTC/ MSG, a detecção de galactomanana no soro de pacientes não neutropênicos exibe pouco valor diagnóstico, e as amostras de biópsia de pulmão a céu aberto podem ser contraindicadas em pacientes com insuficiência pulmonar aguda ou com alterações da coagulação. Na realidade, faltam estudos epidemiológicos na população de pacientes imunocompetentes para a definição de fatores de risco para a aquisição de infecção fúngica nesse grupo.(36)
Em consequência disso, têm sido propostas diversas adaptações conceitualmente convergentes com o intuito de abranger outras situações clínicas não contempladas. Para pacientes de UTI (Critérios AspICU) com aspergilose pulmonar invasiva, um protocolo derivado do EORTC/ MSG, que considera a utilização da cultura positiva de aspirado endotraquial para Aspergillus spp. como critério de entrada, além dos fatores do hospedeiro, clínicos e micológicos, para a doença provável (ou putativa), foi validado e considerado adequado. A detecção de Aspergillus spp. em culturas de aspirado endotraquial em pacientes em terapia intensiva com ventilação mecânica é da ordem de 2%.(37) Tomando-se como referência esse alto percentual, é necessária a diferenciação entre infecção e colonização. Um resultado falso-negativo pode colocar em risco a sobrevivência dos pacientes porque uma aspergilose pulmonar invasiva pode ser letal na ausência de terapia antifúngica. Nesse sentido, é prudente considerar a cultura positiva para Aspergillus spp., na ausência de exame direto ou histopatologia, não como colonização, mas sim como falso-positivo, para que um tratamento seja estabelecido. A desvantagem desse algoritmo é requerer uma cultura positiva como critério de entrada, no entanto, não é incomum uma aspergilose pulmonar invasiva cursar na ausência desse achado laboratorial.(36,37)
Outra proposta trouxe, igualmente, mudanças no critério de aspergilose pulmonar invasiva provável do EORTC/ MSG, bem como daqueles Critérios AspICU.(22,37) Nessa proposta, conhecida como Critérios de Bulpa, há uma determinação menos estrita na dose/curso da corticoterapia e uma definição menos circunscrita das alterações radiológicas quando comparados com os outros dois critérios, permitindo a inclusão de um maior número de pacientes imunocompetentes na categoria de aspergilose provável. Esse fato é importante porque cerca de 30% a 70% dos pacientes internados em UTI ou sob cuidados intensivos não são gravemente imunocomprometidos, não apresentando, por isso, as condições requeridas para a determinação de doença provável, segundo os critérios do EORTC/ MSG.(37) Os Critérios de Bulpa sofreram também uma modificação nos fatores micológicos com a introdução da pesquisa de galactomanana em lavado broncoalveolar. Essa alteração foi procedida, pois um resultado positivo no teste de galactomanana surge, em geral, mais precocemente do que a cultura de aspirados endotraqueais (1 dia X 3,8 dias), além de permitir, do mesmo modo, a diferenciação entre colonização e infecção por Aspergillus spp.(22,35)
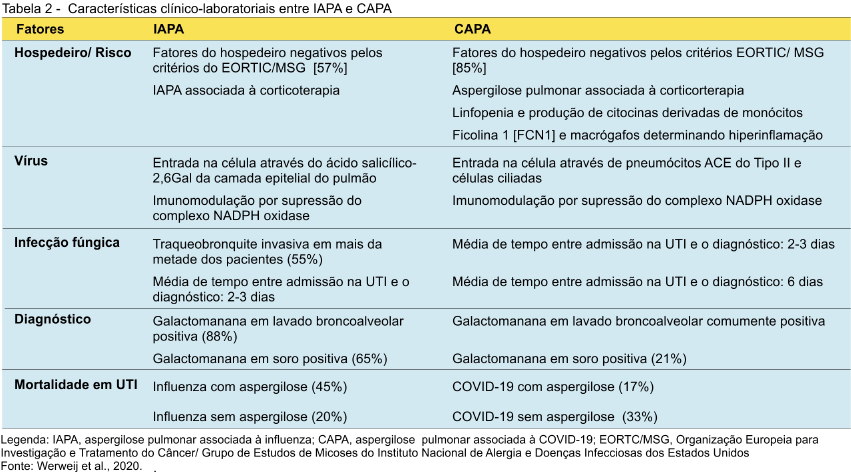
Não há dúvidas de que a aspergilose pulmonar e das vias aéreas é classicamente uma condição intercorrente a doenças pulmonares de base. Em termos de doença viral, a aspergilose invasiva é uma coinfecção emergente em pacientes com influenza grave que são admitidos em UTI. Aproximadamente 0,1% dos pacientes com influenza requer hospitalização, sendo que, desses, 5%-10% necessitam de cuidados intensivos. Dos pacientes internados em UTI, cerca de 4% a 20%-25% podem vir a óbito. A aspergilose pulmonar secundária é efetivamente uma das causas de morte, apresentando taxas de mortalidade em noventa dias de até 51%. Esses números revelam o risco a que estão expostos os pacientes com influenza dentro de uma UTI e o potencial de letalidade da doença fúngica.(37) A aspergilose pulmonar invasiva é uma condição que está estreitamente associada com os vírus da influenza (influenza A/H1N1 e influenza B) e que, eventualmente, pode apresentar quadros compatíveis com os critérios do Consórcio do EORTC/MSG, AspICU e Bulpa. Recentemente, inclusive, um estudo propôs a determinação de critérios baseados nas recomendações do EORTC/MSG e do AspICU para o diagnóstico de aspergilose pulmonar invasiva associada à influenza com extensões à COVID-19. Como a compreensão acerca da patogênese para essa virose causada pelo SARS-CoV-2 ainda é limitada, parece aceitável a aproximação de conceitos clínicos e diagnósticos da aspergilose pulmonar invasiva associada à influenza com aquela decorrente de COVID-19(35-37) (Tabela 2).
No referido estudo, para a definição dos casos de aspergilose pulmonar invasiva associada à influenza foram avaliadas quatro áreas já bem consolidadas, quais sejam, o critério de entrada, os fatores do hospedeiro, os aspectos clínicos e a evidência micológica de infecção. Em relação ao critério de entrada, foi estabelecido como sendo “um paciente que requer admissão em UTI por apresentar distúrbios respiratórios com uma PCR ou uma prova para antígeno positivas para influenza entre o período de uma semana antes da admissão e/ou 72-96 horas após seu ingresso”.(35)
Os fatores do hospedeiro foram aqueles considerados pelo grupo do EORTC/MSG e do AspICU. No entanto, para evitar a ocorrência de falso-positivos em pacientes com baixo risco de infecção fúngica, o que se propugna é o questionamento sobre se a doença está ou não presente, mais do que se o paciente tem ou não uma maior ou menor probabilidade de desenvolvê-la. Por isso, apesar da aspergilose pulmonar associada à influenza apresentar normalmente, pelo menos, uma das condições de base ou terapia com corticoesteroides, os fatores do hospedeiro são, em geral, relativizados nessa proposta.(35,37)
Além do atendimento aos critérios de entrada para a caracterização de doença provada, há a necessidade de evidências micológicas da presença do Aspergillus nos tecidos, como observado nas recomendações do EORTC/ MSG. Para tanto, biópsias de pulmão podem ser requeridas. Nos casos de traqueobronquites invasivas, uma clínica relacionada à aspergilose pulmonar invasiva associada à influenza, a visualização broncoscópica de elementos hifálicos típicos (hifas septadas hialinas e ramificadas em ângulo de 45 graus) nas pseudomembranas e a identificação morfológica e/ou molecular dos Aspergillus spp. isolados em cultura são consideradas critérios de provada aspergilose.(22,35)
Para a determinação de infecção provável existe também a necessidade de se atender aos critérios de entrada, porém, as evidências de infecção consideradas são outras. Uma galactomana sérica positiva (índice ³ 0,5) é uma indicação aceitável de aspergilose associada à influenza quando há imagens radiológicas de infiltrados pulmonares ou sinais broncoscópicos de traqueobronquite. É importante ponderar, contudo, que infiltrados pulmonares não são requeridos para o diagnóstico de traqueobronquite. Resultados positivos para galactomanana em lavados broncoalveolares ou para culturas de aspirado traqueal na presença de infiltrados pulmonares ou placas endobronquiais são consideradas evidências micológicas que suportam também um diagnóstico provável de infecção pulmonar associada à influenza.(35,36)
Na prática clínica, deve-se levar em conta que culturas de escarro positivas para Aspergillus spp. pode indicar doença pulmonar associada à influenza, todavia, devem-se realizar provas da galactomanana sérica ou em lavados broncoalveolares (índice ³ 0,1) ou ainda culturas de aspirados endotraqueais para a confirmação desse achado. É relevante reiterar que resultados discrepantes entre cultura positiva de escarro e teste de galactomanana negativo em lavados broncoalveolares têm baixa probabilidade de ser uma infecção pulmonar associada à influenza. Isolamentos sucessivos de Aspergillus spp. de amostras respiratórias podem ser evidências suficientes de doença pulmonar provável quando o paciente se encontrar dentro dos critérios de entrada e houver imagens de infiltrados cavitários. Outra questão refere-se ao não uso da PCR como primeira linha de ferramentas diagnósticas para a categorização em doença provável, devido à sua pouca disponibilidade e ao seu valor preditivo positivo. No entanto, está indicada para a doença provada por favorecer a identificação fúngica em amostras teciduais.(34,35)
Não obstante suas características particulares, comparações entre influenza e COVID-19 podem contribuir para um melhor entendimento sobre essa coronavirose, principalmente no que tange aos riscos associados.(35) Numa primeira análise, apesar de parecer haver uma elevada tendência na COVID-19 para o desenvolvimento de uma doença pulmonar invasiva por Aspergillus spp., existem diferenças importantes na patogenicidade, na clínica e no tratamento das doenças causadas pelo SARS-CoV-2 e pelo vírus da influenza. Na doença associada à influenza, há uma grande destruição tecidual, uma imunomodulação pela supressão do complexo enzimático NADPH oxidase e o uso de inibidores da neuraminidase (Oseltamivir) em seu tratamento.(3,35) O SARS-CoV-2 utiliza um receptor celular diferente daquele que utiliza o vírus da influenza para entrar na célula, normalmente menos encontrado nas vias aéreas. O risco de desenvolvimento de traqueobronquites também é menor na COVID-19. Uma outra questão é o fato de ainda não se conhecer bem a ação direta do SARS-CoV-2 sobre o sistema imunológico, mas, pelo que se observa, não é similar ao vírus da influenza, sugerindo um menor risco de desenvolvimento de aspergilose invasiva. No caso da influenza, a infeção é aguda e rapidamente fatal, com alta carga fúngica.(35) A aspergilose invasiva na COVID-19 não tem mostrado esse padrão. Ao contrário, casos de COVID-19 com e sem infecção fúngica secundária têm apresentado a mesma taxa de mortalidade. Diferentemente dos casos de aspergilose invasiva na influenza, muitos casos de COVID-19 têm sido negativos para galactomanana sérica, levando ao questionamento se há, de fato, uma infecção invasiva ou se ocorre apenas uma colonização com Aspergillus na COVID-19.(22,35,36) A partir desses dados, parece que a COVID-19 não é um risco para o desenvolvimento de infecção invasiva em si mesma e que diferentes fatores relacionados a condições de base específicos e à administração de corticoesteroides podem estar envolvidos.(35,37)
Outro estudo comparativo objetivou confrontar os métodos de diagnóstico para a infecção por Aspergillus spp. associada à influenza com a COVID-19.(38,39) Por esse estudo, a evidência micológica de Aspergillus spp. é dada pela cultura positiva de lavado broncoalveolar ou pelo resultado positivo para galactomanana sérica na ausência de histopatologia. De forma ideal, esses critérios devem combinar imagens de tomografia computadorizada do tórax (nódulos, sinal do halo, cavitações), bem como, eventualmente, outros testes para antígenos aspergilares ou PCR, permitindo a triagem de influenza e COVID-19.(38) Em termos práticos, é importante considerar que a ausência de achados clássicos na tomografia computadorizada não deve ser empregada para excluir a aspergilose pulmonar associada à COVID-19, tendo em vista que, analogamente, imagens típicas de aspergilose invasiva na tomografia podem não existir na doença fúngica associada à influenza. Uma outra questão a considerar é que apesar do teste para galactomanana no lavado broncoalveolar ter uma sensibilidade aceitável tanto na aspergilose pulmonar associada à influenza quanto naquela associada à COVID-19, a utilização de broncoscopia de rotina para a coleta de amostras broncoalveolares em pacientes com COVID-19 tem sido desencorajada pelo risco de produção de aerossóis durante a realização desse procedimento já que pode levar à contaminação dos profissionais de saúde e dos próprios pacientes.(40) Com o uso da broncoscopia restrito aos indivíduos que tenham cultura nasofaringeal negativa ou limitado a coletas de lavado broncoalveolar que, efetivamente, possam determinar mudanças na estratégia clínica, o teste de galactomanana sérica é tomado em perspectiva. No entanto, a performance desse teste parece ser inferior quando empregado para o diagnóstico de COVID-19.(38) De maneira semelhante aos achados tomográficos, resultados positivos no teste de galactomanana sérica contribuem para o diagnóstico de COVID-19, mas resultados negativos não podem ser critério de exclusão. O teste de PCR pode ser útil, entre outras coisas, para a determinação de marcadores clínicos e ambientais de resistência antifúngica. O teste para glucana sérica tem sido considerado também como ferramenta diagnóstica nas infecções fúngicas. O aumento dos níveis de glucana, contudo, pode estar relacionado a diferentes causas não relacionadas à aspergilose. Para aumentar a especificidade e a utilidade desse teste no diagnóstico de COVID-19, uma sequência de provas positivas é requerida.(38,39)
A complexidade e especificidade do diagnóstico de aspergilose pulmonar associada à COVID-19 tem sido bem relatada.(40) Está claro que isso decorre do comportamento singular do próprio vírus SARS-CoV-2, que determina importantes diferenças clínico-laboratoriais em relação às infecções pelos vírus da influenza, SARS-CoV e MERS-CoV.(3,14) Dentre essas diferenças, o emprego de broncoscopia na COVID-19 é crítico. Como discutido anteriormente, em face da recomendação da não utilização dessa técnica na rotina clínica, os pacientes suspeitos de aspergilose pulmonar devem ser, então, submetidos à coleta endotraquial e/ou a coletas indiretas de lavados broncoalveolares. Para otimizar os procedimentos laboratoriais nessa situação, um algoritmo para triagem e diagnóstico foi desenvolvido, tendo como critérios de entrada a deterioração respiratória e/ou presença de Aspergillus spp. no escaro e/ou cultura de aspirado traqueal(39) (Figura 1).
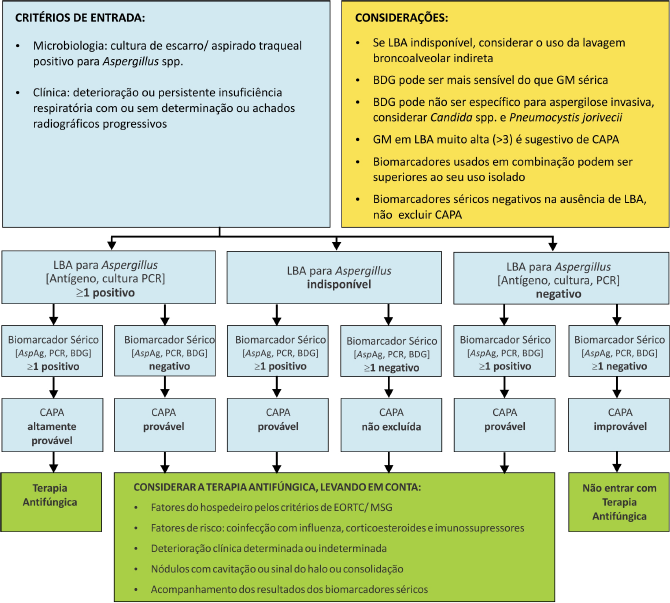
Figura 1. Proposta de algoritmo para triagem e diagnóstico para a COVID-19 associada à aspergilose pulmonar.
Legenda: LBA, lavado broncoalveolar; GM. galactomanana; BDG; 1-3-beta-glucana; AspAg; antígeno aspergilar; IAPA, aspergilose pulmonar associada à Influenza; CAPA, aspergilose pulmonar associada à COVID-19; EORTC/MSG, Organização Europeia para Investigação e Tratamento do Câncer/ Grupo de Estudos de Micoses do Instituto Nacional de Alergia e Doenças Infecciosas dos Estados Unidos. Fonte: Armstrong-James et al. 2020.
Mesmo que fatores de risco para o hospedeiro e as características clínicas de aspergilose pulmonar aplicadas à COVID-19 não sejam bem compreendidos, aqueles pacientes que preencham os critérios de provada e provável infecção devem ser tratados empregando-se os protocolos clássicos de manejo e tratamento.(41,42) Importa reiterar que, em relação ao tratamento da COVID-19, uma forte correlação entre o uso de imunoduladores para o controle da doença viral aguda e o desenvolvimento de aspergilose invasiva tem sido observada.(39)
Abstract
The diagnosis of COVID-19-associated pulmonary aspergillosis has proved to be a dilemma in surgical and medical clinic and laboratory medicine. The correct diagnosis is critical because co-infection with Aspergillus in patients with severe COVID-19 pneumonia leads to Acute Respiratory Discomfort Syndrome (SDRA). As specific protocols have not yet been produced for COVID-19, those used for the diagnosis of influenza-associated pulmonary aspergillosis have been adapted with the criteria of the Consortium formed by European Organization for Research and Treatment of Cancer (EORTC) and Mycoses Study Group of the National Institute of Allergy and Infectious Diseases of the United States (MSG) and the criteria for patients hospitalized in the ICU (AspICU). The establishment of definitions for the classification of patients with COVID-19-associated pulmonary aspergillosis to management and treatment represents an important challenge.
Keywords
COVID-19; Influenza; Invasive Aspergillosis; Diagnosis
REFERÊNCIAS
- Gardezi SAH, Ikram A. Application of biosafety principles in Laboratory 1. Palacios Cruz M., Santos E., Velázquez Cervantes M. A., M., León Juárez M. Revista Clínica Española. COVID-19, una emergencia de salud pública mundial.. Available online 20 March 2020. https://doi.org/10.1016/j.rce.2020.03.001.
- Sohrabi C, Alsafi Z, O’Neill N, Khan M, Kerwan A, Al-Jabir A, et al. World Health Organization declares global emergency: A review of the 2019 novel coronavirus (COVID-19). Int J Surg 2020 Apr;76: 71-76. doi: 10.1016/j.ijsu.2020.02.034.
- Corroza M, Naranjo L, Romero A, Schmauck T, Veja E. COVID-19 Aspectos biológicos, clínicos y sociológicos: uma revisón. Nullius in verba site. 2020;1-25.
- Ruiz-Bravo López A, Jiménez Valera M. SARS-CoV-2 y pandemia de síndrome respiratorio agudo (COVID-19). Ars Pharm, 61(2): 63-79 (2020). DOI: http://dx.doi.org/10.30827/ars.v61i2.15177.
- Mojica-Crespo R, Morales-Crespo MM. Pandemia COVID-19, la nueva emergencia sanitaria de preocupación internacional: una revisión. Semergen. 2020 Aug;46 Suppl 1:65-77. doi: 10.1016/j.semerg. 2020.05.010.
- Perez Abreu MR, Gomez Tejeda JJ, Dieguez Guach RA. Características clínico-epidemiológicas de la covid-19. Revista Habanera de Ciencias Médicas. 2020;19(2):1-15.
- Gangneux JP, Bougnoux ME, Dannaoui E, Cornet M, Zahar JRJ. Invasive fungal diseases during COVID-19: We should be prepared. J Mycol Med. 2020 Jun;30(2):100971. doi: 10.1016/j.mycmed.2020. 100971.
- Hughes S, Troise O, Donaldson H, Mughal N, Moore LSP. Bacterial and fungal coinfection among hospitalized patients with COVID-19: a retrospective cohort study in a UK secondary-care setting. Clin Microbiol Infect. 2020 Oct;26(10):1395-1399. doi: 10.1016/j.cmi.2020. 06.025.
- Nori P, Cowman K, Chen V, Bartash R, Szymczak W, Madaline T, et al. Bacterial and fungal coinfections in COVID-19 patients hospitalized during the New York City pandemic surge. Infect Control Hosp Epidemiol. 2020 Jul 24:1–5. doi:10.1017/ice.2020.368
- Vanderbeke L, Spriet I, Breynaert C, Rijnders BJA, Verweij PE, Wauters J. Invasive pulmonary aspergillosis complicating severe influenza: epidemiology, diagnosis and treatment. Curr Opin Infect Dis. 2018 Dec;31(6):471-480. doi: 10.1097/QCO.0000000000000 504.
- Wang HJ, Ding YG, Xu J, Li X, Li XF, Yang L, et al. Death of a SARS case from secondary aspergillus infection. Chin Med J (Engl) 2004;117(8):1278-80.
- Zhu X, Ge Y, Wu T, Zhao K, Chen Y, Wu B, et al. Co-infection with respiratory pathogens among COVID-2019 cases. Virus Res. 2020; 285:198005. doi: 10.1016/j.virusres.2020.198005.
- Clancy CJ, Nguyen MH. COVID-19, superinfections and antimicrobial development: What can we expect? Clin Infect Dis. 2020 May 1:ciaa524. doi: 10.1093/cid/ciaa524.
- Chen X, Liao B, Cheng L, Peng X, Xu X, Li Y, et al. The microbial coinfection in COVID-19. Appl Microbiol Biotechnol. 2020 Sep;104(18):7777-7785. doi: 10.1007/s00253-020-10814-6. Epub 2020 Aug 11.
- Lv Z, Cheng S, Le J, Huang J, Feng L, Zhang B, Li Y. Clinical characteristics and co-infections of 354 hospitalized patients with COVID-19 in Wuhan, China: a retrospective cohort study. Microbes Infect. 2020 May-Jun;22(4-5):195-199. doi: 10.1016/j.micinf. 2020.05.007.
- Garcia-Vidal C, Sanjuan G, Moreno-García E, Puerta-Alcalde P, Garcia-Pouton N, Chumbita M, et al. Incidence of co-infections and superinfections in hospitalized patients with COVID-19: a retrospective cohort study. COVID-19 Researchers Group. Clin Microbiol Infect. 2020 Jul 31:S1198-743X(20)30450-X. doi: 10.1016/j.cmi.2020.07.041. Online.
- Zuo T, Zhan H, Zhang F, Liu Q, Tso EYK, Lui GCY, et al. Alterations in Fecal Fungal Microbiome of Patients With COVID-19 During Time of Hospitalization until Discharge. Gastroenterology. 2020 Oct;159(4):1302-1310.e5. doi: 10.1053/j.gastro.2020.06.048
- Brown GD, Denning DW, Gow NA, Levitz SM, Netea MG, White TC. Hidden killers: human fungal infections. Sci Transl Med. 2012 Dec 19;4(165):165rv13. doi: 10.1126/scitranslmed.3004404.
- Ahamefula Osibe D, Lei S, Wang B, Jin C, Fang W. Cell wall polysaccharides from pathogenic fungi for diagnosis of fungal infectious disease. Mycoses. 2020;63(7):644-652. doi: 10.1111/myc.13101.
- Cole DC, Govender NP, Chakrabarti A, Sacarlal J, Denning DW. Improvement of fungal disease identification and management: combined health systems and public health approaches. Lancet Infect Dis. 2017;17(12):e412-e419. doi: 10.1016/S1473-3099(17) 30308-0.
- Choi SH, Kim T, Park KH, Kwak YG, Chung JW, Lee MS. Early administration of neuraminidase inhibitors in adult patients hospitalized for influenza does not benefit survival: a retrospective cohort study. Eur J Clin Microbiol Infect Dis. 2017 Sep;36(9):1673-1677. doi: 10.1007/s10096-017-2982-z.
- Donnelly JP, Chen SC, Kauffman CA, Steinbach WJ, Baddley JW, Verweij PE, et al. Revision and Update of the Consensus Definitions of Invasive Fungal Disease From the European Organization for Research and Treatment of Cancer and the Mycoses Study Group Education and Research Consortium. Clin Infect Dis. 2020;12; 71(6):1367-1376. doi: 10.1093/cid/ciz1008.
- Gao Y, Soubani A. Advances in the diagnosis and management of pulmonary aspergillosis. Adv Respir Med. 2019;87(6):231-243. doi: 10.5603/ARM.2019.0061.
- Kosmidis C, Denning DW. The clinical spectrum of pulmonary aspergillosis. Thorax. 2015;70(3):270-7. doi: 10.1136/thoraxjnl-2014-206291.
- Kousha M, Tadi R, Soubani AO. Pulmonary aspergillosis: a clinical review. Eur Respir Rev. 2011;20(121):156-74. doi: 10.1183/09059180.00001011.
- Fortún J, Meije Y, Fresco G, Moreno S. Aspergilosis. Formas clínicas y tratamento. Enferm Infecc Microbiol Clin. 2012;30(4):201–208. https://doi.org/10.1016/j.
- Cuervo-Maldonado SI, Gómez-Rincón JC, Rivas P. Actualización en Aspergilosis con énfasis en Aspergilosis invasora. Infectio. 2010; 14(S2):S131-S144. https://doi.org/10.1016/S0123-9392(10)70131-4.
- Oxilia HG, Oxilia RG, Morales LF, Falco F. Aspergilosis: una patología a considerar Rev. argent. Radiol. 2008;72(1): 55-60.
- Olaechea Astigarraga PM, Álvarez Lermab F, Zaldibar Enriqueza EZ. Invasive pulmonary aspergillosis in the non-neutropenic critical patient: future challenges. Med Intensiva. 2006 Nov;30(8):386-91. Spanish. doi: 10.1016/s0210-5691(06)74553-3. [Article in Spanish].
- Fernández LK, Charterina SA, Alcalá-Galiano Rubio A, Sánchez Nistal MA. Las diferentes manifestaciones de la aspergilosis pulmonar. Hallazgos en tomografía computarizada Multidetector. The different manifestations of pulmonary aspergillosis. Radiología. 2014;56(6): 96-504. https://doi.org/10.1016/j.rx.2013.09.007.
- Kozel TR, Wickes B. Fungal diagnostics. Cold Spring Harb Perspect Med. 2014 Apr 1;4(4):a019299. doi: 10.1101/cshperspect.a019299.
- Alanio A, Delliere S, Fodil S, Bretagne S, Megarbane B. High prevalence of putative invasive pulmonary aspergillosis in critically ill COVID-19 patients. MedRxiv preprint doi: https://doi.org/10.1101/2020.04.21.20064915.
- Vélez JD, Rosso-Suárez F. Protocolo de estudio y manejo de pacientes con aspergilosis. Infectio. 2012;46(Supl. 3):114-117.
- Rieger H, Lustig D, Barlow S, Ostermann H, Fiegl M, Peterson L, Rieger CT. Applicability of the EORTC/MSG criteria for IFD in clinical practice. Ann Hematol. 2015 May;94(5):847-55. doi: 10.1007/s00277-014-2282-y. Epub 2014 Dec 30.PMID: 25544029.
- Verweij PE, Rijnders BJA, Brüggemann RJM, Azoulay E, Bassetti M, Blot S, et al. Review of influenza-associated pulmonary aspergillosis in ICU patients and proposal for a case definition: an expert opinion. Intensive Care Med. 2020;46(8):1524-1535. doi: 10.1007/s00134-020-06091-6.
- Huang L, He H, Jin J, Zhan Q. Is Bulpa criteria suitable for the diagnosis of probable invasive pulmonary Aspergillosis in critically ill patients with chronic obstructive pulmonary disease? A comparative study with EORTC/ MSG and ICU criteria. BMC Infectious Diseases. 2017;17: 209. https://doi.org/10.1186/s12879-017-2307-y
- Blot SI, Taccone FS, Van den Abeele AM, Bulpa P, Meersseman W, Brusselaers N, et al; AspICU Study Investigators. A clinical algorithm to diagnose invasive pulmonary aspergillosis in critically ill patients. Am J Respir Crit Care Med. 2012;186(1): 56-64. doi: 10.1164/rccm.201111-1978OC.
- Schauwvlieghe AFAD, Rijnders BJA, Philips N, Verwijs R, Vanderbeke L, Van Tienen C, et al; Dutch-Belgian Mycosis study group. Invasive aspergillosis in patients admitted to the intensive care unit with severe influenza: a retrospective cohort study. Lancet Respir Med. 2018 Oct;6(10):782-792. doi: 10.1016/S2213-2600(18)30274-12600(18)30274-1.
- Armstrong-James D, Youngs J, Bicanic T, Abdolrasouli A, Denning DW, Johnson E, et al. Confronting and mitigating the risk of COVID-19 associated pulmonary aspergillosis. Eur Respir J. 2020 Oct 1;56(4):2002554. doi: 10.1183/13993003.02554-2020.
- Verweij PE, Gangneux JP, Bassetti M, Brüggemann RJM, Cornely OA, Koehler P, et al; European Confederation of Medical Mycology; International Society for Human and Animal Mycology; European Society for Clinical Microbiology and Infectious Diseases Fungal Infection Study Group; ESCMID Study Group for Infections in Critically Ill Patients. Diagnosing COVID-19-Associated pulmonary aspergillosis. Lancet Microbe. 2020 Jun;1(2): e53-e55. doi: 10.1016/S2666-5247(20)30027-6. Erratum in: Lancet Microbe. 2020 Jul;1(3):e108.
- Patterson TF, Thompson GR 3rd, Denning DW, Fishman JA, Hadley S, Herbrecht R, et al. Practice Guidelines for the Diagnosis and Management of Aspergillosis: 2016 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2016; 15;63(4):e1-e60. doi: 10.1093/cid/ciw326.
- Ullmann AJ, Aguado JM, Arikan-Akdagli S, Denning DW, Groll AH, Lagrou K, et al. Diagnosis and management of Aspergillus diseases: executive summary of the 2017 ESCMID-ECMM-ERS guideline. Clin Microbiol Infect. 2018; 24 (Suppl. 1): e1-e38. doi: 10.1016/j.cmi.2018.01.002.
Correspondência
Paulo Murillo Neufeld
Faculdade de Farmácia-UFRJ
Prédio do CCS, Bloco A2, Sala 029
21940-590 – Rio de Janeiro-RJ, Brasil
