Dez anos da RDC 302/2005: avaliação da implantação em laboratórios de análises clínicas do estado de Santa Catarina
Ten years of RDC 302/2005: evaluation of implantation in laboratories of clinical analysis of Santa Catarina state
Gustavo Henrique Lescowicz1
Roberto Ferreira de Melo2
Elayne Cristina de Morais Rateke3
Flávia Martinello2
1Estudante de Graduação em Farmácia, Universidade Federal de Santa Catarina – UFSC – Florianópolis-SC, Brasil.
2Professor (a) do Departamento de Análises Clínicas, Universidade Federal de Santa Catarina – UFSC – Florianópolis-SC, Brasil.
3Farmacêutica da Divisão de Análises Clínicas, HU-UFSC, Universidade Federal de Santa Catarina – Florianópolis-SC, Brasil.
Instituição: Departamento de Análises Clínicas, Universidade Federal de Santa Catarina– Florianópolis-SC, Brasil.
Recebido em 16/09/2018
Artigo aprovado em 23/08/2018
DOI: 10.21877/2448-3877.201800617
Resumo
Objetivo: Avaliar dez anos após a publicação se os laboratórios de análises clínicas do estado de Santa Catarina atendem aos requisitos da RDC 302/2005. A população de laboratórios foi obtida no CNES. Métodos: Como ferramenta de pesquisa foi elaborado um questionário baseado na RDC 302/2005 e enviado aos laboratórios. Resultados: Dos 523 laboratórios clínicos aptos a participar do estudo, o contato foi exitoso com apenas 198 e, desses, somente 20 participaram. Os participantes relataram que a RDC 302/2005 é essencial para o funcionamento dos laboratórios. O tempo para iniciar a implantação da RDC levou, em média, um ano, e o tempo para a conclusão delongou mais um ano. Doze laboratórios relataram cumprir todos os requisitos da resolução. No entanto, apenas dois laboratórios cumprem integralmente os 38 requisitos da RDC pesquisados. Os requisitos de rotulagem de reagentes, registro de temperatura de equipamentos, gerenciamento de resíduos, comunicação de valores críticos, arquivamento de laudos e dados brutos e notificação de resultados que indiquem doença notificável foram cumpridos por todos os laboratórios. O registro da temperatura de transporte das amostras foi o requisito menos cumprido pelos laboratórios. As principais dificuldades relatadas para implantação dos requisitos foram nas áreas de gestão e garantia de qualidade, aplicação dos conhecimentos de biossegurança e resistência dos colaboradores ao processo de mudança. Conclusão: A formação dos profissionais voltada para conceitos e ferramentas de gestão, de sistema de qualidade e padronização de processos se faz necessária para os laboratórios e pode ser o início da solução para as dificuldades apresentadas pelos laboratórios pesquisados.
Palavras-chave
Gestão de qualidade; Garantia da qualidade; Controle de qualidade; Qualidade total; Laboratório clínico
INTRODUÇÃO
A qualidade é definida como a conformidade às exigências do usuário e/ou clientes, referindo-se à satisfação das necessidades e expectativas dos mesmos. Assim, é de grande importância que o foco dos serviços de saúde seja nos indivíduos que os utilizam de forma direta ou indireta.(1) Contudo, a complexidade dos processos laboratoriais torna necessária a implantação de programas de qualidade, os quais buscam melhorar a qualidade do serviço, aumentar a produtividade e baixar o custo.(2)
O progresso da qualidade no laboratório clínico é decorrente e proporcional ao avanço tecnológico no setor laboratorial, permitindo a implantação de modernos conceitos e programas de qualidade, os quais incluem conceitos de controle da qualidade, garantia da qualidade e gestão total da qualidade, que envolvem todas as etapas do ciclo laboratorial desde a requisição do exame até a liberação do laudo.(2)
Essas estratégias permitem promover, estimular e aprimorar o senso de observação de causas e origens de não conformidades por todos os indivíduos envolvidos em qualquer organização.(3)
De acordo com Mendes,(4) gerenciar requer organização dos principais processos laboratoriais que envolvem:
- Gestão de pessoas;
- Infraestrutura;
- Tecnologia de informação;
- Gestão de equipamentos;
- Atendimento aos clientes;
- Produção de exames laboratoriais;
- Biossegurança;
- Gestão de Negócio;
- Logística;
- Gestão da Qualidade;
- Gestão Ambiental; e
- Gestão de Projetos.
A preocupação com a qualidade na área laboratorial tornou necessária a criação de padrões mínimos de organização para funcionamento desses estabelecimentos de saúde. Programas de certificação, acreditação e regulamentações foram desenvolvidos no decorrer do último século e novidades continuam a surgir.(2)
No Brasil, a Resolução de Diretoria Colegiada, RDC, que regulamenta o funcionamento de Laboratórios Clínicos é a RDC nº 302/2005(5). Esta resolução foi publicada em 30 de outubro de 2005, e os laboratórios clínicos e postos de coleta laboratorial deveriam, dentro do prazo de 180 dias (abril de 2006), se adequar ao estabelecido neste regulamento técnico.(5) Essa resolução teve alguns requisitos esclarecidos por meio da Nota Técnica Nº 039/2014 (GRECS/GGTES/Anvisa) e da RDC nº 30/2015.
A RDC 302/2005 regulamenta o funcionamento do laboratório clínico no que diz respeito às condições gerais de organização, recursos humanos, infraestrutura, equipamentos e instrumentos laboratoriais, produtos para diagnóstico de uso in vitro, gerenciamento de resíduos e biossegurança. Além disso, regulamenta os processos operacionais das fases analítica, pré e pós-analíticas, garantia e controle da qualidade e registros para rastreabilidade laboratorial.(5)
Nesse contexto, passados dez anos da publicação da referida resolução, este estudo tem o objetivo de avaliar as principais dificuldades que os laboratórios vivenciaram e ainda enfrentam para adequação e implementação da norma vigente.
Metodologia
Tipo de estudo
A pesquisa foi desenvolvida na forma de estudo observacional descritivo com abordagem qualitativa e quantitativa. A combinação dos métodos quantitativos e qualitativos produz a triangulação metodológica, que contribui para aumentar o conhecimento sobre determinado tema, alcançar os objetivos traçados, observar e compreender a realidade estudada.(6)
Sujeitos da pesquisa
As informações sobre os laboratórios de análises clínicas de Santa Catarina foram pesquisadas na plataforma do Cadastro Nacional de Estabelecimentos de Saúde (CNES).(7) A consulta foi realizada no campo Relatórios, em seguida Tipo de Estabelecimento, a seguir foi selecionado o estado de Santa Catarina, todos os municípios e a competência atual (a qual corresponde ao mês de janeiro 2016).
No campo Tipo de Estabelecimento foram selecionados quatros ítens que correspondem às atividades laboratoriais:
- a) Unidade de Apoio Diagnose e Terapia (Sadt Isolado);
- b) Laboratório Central de Saúde Pública – LACEN;
- c) Centro de Atenção Hemoterapia e Hematologia;
- d) Laboratório de Saúde Pública.
As informações obtidas na classificação “Unidade De Apoio Diagnose e Terapia (SADT)” foram verificadas uma a uma, pois havia estabelecimentos cadastrados que não eram relacionados às análises clínicas.
Ferramenta de pesquisa
Foi desenvolvido um questionário como ferramenta de pesquisa, baseado nos requisitos presentes na RDC nº 302/2005, com 129 perguntas agrupadas em 16 áreas:
- a) Condições gerais;
- b) Aspectos da implantação da RDC 302/2005;
- c) Recursos Humanos;
- d) Infraestrutura;
- e) Equipamentos e Instrumentos Laboratoriais;
- f) Materiais para Diagnóstico in vitro;
- g) Descarte de Resíduos;
- h) Biossegurança;
- i) Transporte de Material Biológico;
- j) Processos Operacionais – Fase Pré-analítica;
- k) Processos Operacionais – Fase Analítica;
- l) Processos Operacionais – Fase Pós-analítica;
- m) Registros;
- n) Garantia da Qualidade;
- o) Controle Interno da Qualidade;
- p) Controle Externo da Qualidade.
A validação do questionário foi realizada na Divisão de Análises Clínicas do Hospital Universitário Professor Polydoro Ernani de São Thiago.
Os dados foram tabulados em planilha do Microsoft Excel, os resultados demonstrados por tabelas e gráficos e análise estatística realizada no mesmo programa.
Aspectos éticos da pesquisa
Seguindo recomendações da Resolução do Conselho Nacional de Saúde n°466 de 12 de dezembro de 2012, o presente projeto foi submetido ao Comitê de Ética em Pesquisa (CEP) na Plataforma Brasil (CAAE: 51684915.3.0000.0121).
RESULTADOS E DISCUSSÃO
Caracterização dos laboratórios do estado de Santa Catarina, conforme dados obtidos no CNES
A pesquisa realizada em janeiro de 2016 na base de dados do Cadastro Nacional de Estabelecimentos de Saúde (CNES) indicava um total de 1.114 estabelecimentos de saúde cadastrados com possível atividade laboratorial em Santa Catarina (Tabela 1). Destes, 99,5% estavam cadastrados como estabelecimentos de Unidade de Apoio Diagnose e Terapia (SADT isolado).

No entanto, diversos outros estabelecimentos, os quais não são laboratórios, estão cadastrados na categoria SADT. Para definir o número de laboratórios do estado aptos a participar da pesquisa, cada estabelecimento cadastrado no SADT foi analisado individualmente em relação às atividades desempenhadas. Após a análise, foram encontrados 571 laboratórios no estado de Santa Catarina (Tabela 2).

Dos 571 laboratórios, 48 (8,4%) realizam apenas Citopatologia e foram excluídos do estudo. Contudo, dos 523 laboratórios considerados aptos a participar do estudo, alguns também realizam análises citopatológicas. No entanto, vários números de telefone, endereços e endereços eletrônicos (e-mail) estão desatualizados no CNES, o que dificultou o convite aos laboratórios para participarem do estudo. Algumas dessas informações foram acessadas em outras mídias dos próprios estabelecimentos. Nesse contexto, conseguiu-se contato com apenas 198 laboratórios (37,8%) e, desses, apenas 23 estabelecimentos, 11,6% dos contatados e 4,4% do total, aceitaram participar do estudo. Por fim, três laboratórios preencheram o questionário de forma incompleta e foram excluídos do estudo.
Muitos laboratórios ignoraram o contato, outros se recusaram a participar e alguns informaram que participariam mas não retornaram com as respostas. A falta de tempo, a falta de conhecimento sobre o assunto ou mesmo o receio de assumir o não cumprimento da RDC 302/2005 estão entre as possibilidades para a não participação no estudo.
Perfil dos laboratórios participantes quanto às condições gerais de organização, infraestrutura, recursos humanos e aspectos da implantação da RDC 302/2005
O laboratório participante com maior tempo de funcionamento foi fundado em 1969 e o mais novo em novembro de 2015, sendo a mediana de 22,5 anos de existência. Quanto à natureza da instituição, dois (10%) laboratórios participantes são públicos e 18 (90%) privados. Laboratórios com atendimento apenas ambulatorial representam 60% (12), 5,0%(1) apenas hospitalar e 35%(7) prestam serviço tanto ambulatorial quanto hospitalar.
Todos os vinte laboratórios pesquisados utilizam o serviço de laboratórios de apoio para a realização de parte dos exames. Em média, são utilizadas aproximadamente duas unidades de apoio por estabelecimento.
Todos os estabelecimentos pesquisados realizam análises nas áreas de Bioquímica, Hematologia, Parasitologia, Urinálise, Imunologia e Microbiologia. Análises na área de Micologia são realizadas em apenas nove (45%), Toxicologia em quatro (20%), Citologia em dois (10%) e Biologia Molecular em somente um (5%) dos laboratórios pesquisados. Esses números podem ser reflexo da baixa frequência de requisições para exames micológicos, o que não justifica a manutenção de infraestrutura necessária para a realização desses. Já a Citologia, além de requerer profissionais especializados para a execução, apresenta-se como área de atividade com grande inserção dos médicos especialistas, principalmente em laboratórios de citopatologia. Por fim, as análises toxicológicas e de biologia molecular são técnicas de alto custo e de baixa demanda.(8)
A existência de postos de coleta foi evidenciada em 55%(11) das instituições, sendo a mediana de um posto de coleta por laboratório.
A quantidade de exames realizados pelos laboratórios varia de 600 a 230 mil exames por mês. Nesse contexto, os laboratórios foram categorizados em grupos de acordo com a quantidade média de exames que realiza por mês (Tabela 3).

Grupo A – Laboratórios que realizam até 10 mil exames/mês;
Grupo B – Laboratórios que realizam de 10 a 50 mil exames/mês;
Grupo C – Laboratórios que realizam mais de 50 mil exames/mês.
A Tabela 3 também apresenta o número de laboratórios que, em resposta ao questionamento, afirmaram possuir acreditação, certificação e sistema de qualidade implantado. Nesse ponto parece haver confusão dos conceitos em gestão da qualidade por parte de um ou mais dos laboratórios de pequeno porte (Grupo A), pois o número de laboratórios que afirmaram ser certificados foi inferior ao número de laboratórios que relataram possuir sistema de qualidade implantado. Teoricamente, para um laboratório ser certificado é necessário que o mesmo tenha um sistema de qualidade implantado. Não foi observada relação entre o porte do laboratório e a estrutura organizacional da qualidade relatada pelos mesmos. No entanto, percebeu-se uma tendência de implantação de um sistema de qualidade quanto maior for o porte do laboratório. Por outro lado, pode-se inferir que os laboratórios menores encontraram maior facilidade para alcançar acreditação.
Entre as dificuldades mencionadas para a implantação de um sistema da qualidade ressalta-se o depoimento de um laboratório:
“A maior dificuldade foi passar para a equipe a ideia de gestão da qualidade, após algumas reuniões e esclarecimentos sobre o processo de qualidade, todos se engajaram e naturalmente foi acontecendo o preenchimento de documentos dos procedimentos e registros. Equipe e clientes perceberam a melhora já nos primeiros meses de implantação.” (Laboratório 3)
Quanto à fiscalização do serviço, todos os laboratórios relataram que a inspeção sanitária ocorre anualmente. Por outro lado, quanto à frequência da fiscalização pelos conselhos de classe profissional, dois (10%) laboratórios afirmaram que a inspeção ocorre mensalmente, seis (30%) trimestralmente, três (15%) semestralmente e sete (35%) anualmente. Em geral, a maioria dos laboratórios (19 (95%)) concorda com a frequência de ambas as fiscalizações. No entanto, cabe destacar a declaração de um laboratório:
“A fiscalização não é efetiva quanto ao exercício da função dos responsáveis técnicos, os laboratórios possuem dúvidas sobre qual órgão deveria averiguar se o farmacêutico/bioquímico está realizando as análises corretamente“. (Laboratório 11)
Quanto ao processo de adequação do laboratório à RDC 302/2005, de forma geral, 13 (65%) laboratórios não relataram resistência dos colaboradores às mudanças necessárias. Os demais, sete (35%), que afirmaram resistência dos envolvidos no início do processo, atualmente estão com a equipe engajada no processo de qualidade. É conhecido que todo processo de mudança naturalmente gera problemas em qualquer aspecto de vida, e em relação à atividade laboratorial esse ponto é crítico, principalmente com os colaboradores com maior tempo de empresa, onde envolve mudanças culturais, de hábitos e de percepção da situação.(9)
O tempo necessário para iniciar a implantação da RDC 302/2005 foi variável. Para três (15%) laboratórios o tempo foi zero, três (15%) ainda estão em processo de adequação, cinco (25%) delongaram seis meses para o início do processo, seis (30%) em torno de um ano, um (5%) dois anos, um (5%) três anos e um (5%) não informou. Contudo, as disposições transitórias da RDC 302/2005 definia o tempo de seis meses para que todos os laboratórios do país se adequassem. Alguns laboratórios relataram que foram alertados pela vigilância sanitária a iniciar as modificações imediatamente, o que provavelmente implicou os diferentes prazos. Cabe destacar que alguns laboratórios pesquisados iniciaram as atividades depois de 2005 e um deles em 2015, podendo este fato ter contribuído para a redução do tempo de implantação da referida resolução. Foram relatadas como dificuldades que as adequações demandam extensa burocracia, gastos e tempo.
O tempo para a adequação à RDC 302/2005 entre os laboratórios pesquisados foi bastante variado. Três (15%) laboratórios afirmaram cumprir todos os requisitos desde a fundação, três (15%) ainda estão em processo de adequação, três (15%) delongaram seis meses para finalizar, seis (30%) um ano, quatro (20%) dois anos e um (5%) mais de dois anos. Possivelmente esse prazo foi curto ou longo de forma dependente do número de adequações necessárias. Nesse sentido, a literatura relata o período mínimo de um ano e meio para implantação de um sistema da qualidade.(10) Sendo assim, a RDC 302/2005 teria sido muito exigente, para a realidade até então dos laboratórios, em relação ao prazo de seis meses para adequação.
Contudo, do total de vinte laboratórios pesquisados, apenas 12 (60%) consideram que atualmente atendem a todos os requisitos da RDC 302/2005. Esta informação é conflitante com o número (16) de laboratórios que afirmam possuir um sistema de qualidade implantado (Tabela 3). Entende-se que a implantação de um sistema de qualidade envolve, no mínimo, o cumprimento das normas vigentes. Tal fato pode representar uma confusão de entendimento tanto em relação ao atendimento dos requisitos da RDC quanto ao que é um sistema de qualidade.
Todavia, todos os laboratórios pesquisados concordam que a publicação da resolução foi essencial para regulamentar o funcionamento dos laboratórios clínicos e 17 (85%) consideram que os requisitos exigidos na resolução estão em consonância com as necessidades. Em relação às sugestões para atualização/modificação da RDC 302/2005, um (5%) laboratório afirmou que nada deve ser alterado, nove (45%) não responderam e dez (50,0%) sugeriram mudanças. Entre as sugestões para alteração da RDC foram englobados vários aspectos como especificar os requisitos de infraestrutura, atualizar de acordo com a evolução da tecnologia, orientar para o processo de acreditação, definir os profissionais que podem assinar laudos, esclarecer e tornar objetivos os requisitos, considerar os diferentes portes de laboratório, excetuar a exigência de controle interno da qualidade para analitos críticos de baixa estabilidade, definir requisitos relacionados à gestão de riscos e segurança do paciente, e reduzir a burocracia.
A gestão da qualidade foi considerada fundamental, sendo atribuída prioridade 10, em uma escala de 0 a 10, por 40%(8) dos laboratórios participantes, 09 por 10% (2), 08 por 35% e 07 por 15% dos pesquisados. Ficou claro que mesmo aqueles que não possuem a gestão da qualidade implantada reconhecem a importância de atender a este requisito. Porém, 40% (8) dos laboratórios relataram que não há profissionais no mercado com formação para a garantia da qualidade. Todos os laboratórios pesquisados afirmaram que os processos implantados resultaram em melhoria na qualidade do serviço laboratorial. A Tabela 4 apresenta as principais contribuições, entre as alternativas apresentadas, da Gestão da Qualidade para as atividades laboratoriais 4.
Tal fato pode ser observado no relato de um gestor:
“Qualidade no serviço representa resultados fidedignos de exames, contribuem para a saúde da população e evolução das atividades do estabelecimento, além de se proteger de toda repercussão que pode ocorrer em um município quando há um laboratório liberando resultados insatisfatórios. Mesmo reconhecendo a importância, as contribuições e a necessidade de gerenciar as atividades laboratoriais com qualidade, ainda há muito o que evoluir.” (Laboratório 11)
Quanto aos recursos humanos, 12 (60%) laboratórios possuem mais de uma responsabilidade e responsável técnico (RT) substituto. A falta de substituto pode acarretar em erros laboratoriais graves e pode refletir a esporadicidade das visitas de fiscalização dos respectivos conselhos de classe. Foi observada, em geral, a presença de um RT para cada três a quatro técnicos ou auxiliares de laboratório, sendo suficiente para exercer as atividades de um laboratório de pequeno porte. Contudo, ao verificar essas informações junto ao CNES, foi observado que um (5%) laboratório que afirma possuir mais de uma responsabilidade técnica apresenta apenas um responsável cadastrado. Tal fato coloca sob suspeita as respostas do questionário e o preenchimento inadequado ou desatualizado do CNES.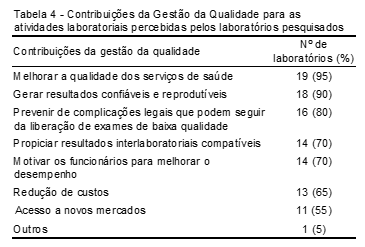
Em 17 (85%) laboratórios pesquisados há registro de vacinação e 18 (90%) possuem registro dos exames admissionais conforme a Norma Regulamentadora número 7 do Programa de Controle Médico de Saúde Ocupacional (PCMSO da NR-7). Todos os laboratórios pesquisados possuem registro de formação e qualificação dos profissionais. Dezoito (90%) laboratórios promovem treinamento inicial dos colaboradores, mas seis (30%) relataram dificuldade em realizá-lo. Os motivos relatados da dificuldade de treinamento inicial foram vários, alguns laboratórios afirmaram: 1) que há resistência e dificuldade de adaptação dos profissionais, 2) que é burocrático manter os arquivos de treinamento e 3) que é necessário ter disponibilidade de tempo para esta organização. Foi relatado também que muitos colaboradores contratados chegam com “vícios de trabalho” de experiências anteriores, costumam manter a padronização na execução de técnicas utilizadas em outros laboratórios e apresentam dificuldade para se adaptarem às novas metodologias.
Um terço dos estabelecimentos relatou dificuldades para promover a educação continuada dos colaboradores por motivos de resistência dos profissionais envolvidos, falta de interesse, custos e ausência de tempo disponível. Em muitos casos, não há tempo livre durante a jornada de trabalho para implantar este requisito. Dessa forma, incorre na necessidade de realizar atividades fora do horário de trabalho, o que, por conseguinte, gera custos com o pagamento de horas extras. Além disso, foi relatado que alguns colaboradores afirmam ser um processo desnecessário e que acreditam que já desempenham as funções de forma satisfatória, não necessitando de atualização.
Em relação ao requisito infraestrutura, a RDC 302/2005 estabelece como referência a RDC nº 50 de 21/11/2002(11) e suas atualizações. Nesse ponto foi observado que 55% (11) dos laboratórios estão situados em construções específicas e 45% em construções adaptadas. Em dez (50%) laboratórios, as áreas analíticas estão localizadas em uma mesma área física. Contudo, os setores de Microbiologia e Parasitologia estão em áreas exclusivas em praticamente todos os estabelecimentos (19). Isto ocorre provavelmente pelo nível de biossegurança (que de forma geral são dois em um laboratório clínico) requerido pelo setor de Microbiologia, que pode ser três quando realiza cultivo de micobactérias, por exemplo, e assim exige sala separada. A área reservada para o setor de Parasitologia possivelmente deve estar relacionada aos odores gerados pela manipulação das amostras de fezes. Em 15 (75%) laboratórios há área de classificação, triagem e distribuição das amostras, nos demais a triagem é realizada junto ao setor de coleta. Setorizar um laboratório foi considerado, por 13 (65%) laboratórios, que requer investimento elevado, nem sempre é possível devido a problemas de adaptação da sala já construída e que altera a dinâmica de trabalho promovendo resistência de alguns profissionais. Também foi registrado que a adequação à RDC 50/2002 é complexa para os laboratórios de serviços hospitalares que não podem parar suas atividades para realizar obras.
Perfil dos laboratórios quanto aos equipamentos, produtos para diagnóstico de uso in vitro,
gerenciamento de resíduos e biossegurança
Quanto à disponibilidade de manuais ou instruções de uso dos equipamentos laboratoriais, 95% dos participantes afirmaram dispor de tais documentos para todos os instrumentos em uso. Em relação às manutenções preventivas e corretivas dos equipamentos, foi relatada disponibilidade de instituições especializadas em manutenções, verificações, calibrações, e cursos de capacitação de profissionais do estabelecimento para realização de ações preventivas e corretivas. Tais processos geram custos, mas são essenciais para manter o padrão de qualidade. Contudo, dois (10%) laboratórios pesquisados não possuem registros de manutenções preventivas e corretivas. Essa taxa de não conformidade aumenta para 15% em relação ao processo de registro de verificação e calibração efetivamente realizadas.
Quanto ao controle dos reagentes, 12 (60%) laboratórios utilizam água apenas de ionização para obtenção da água reagente, cinco (30%) de ionização e osmose reversa, um (5%) destilação e osmose reversa, um (5%) apenas osmose reversa e um (5%) apenas ultrafiltração. Contudo, 15 (75%) estabelecimentos pesquisados fazem o controle físico-químico e microbiológico da água reagente produzida e apenas sete (35%) possuem registros do controle da qualidade da água usada no processo analítico. Apenas dois (10%) laboratórios afirmaram ter dificuldade de implantar o controle de qualidade da água, alegando os custos e falta de interesse dos profissionais em participarem desse processo.
Quanto à utilização dos materiais para diagnóstico in vitro, 18 (90%) laboratórios possuem registros de aquisição dos produtos, incluindo lote e informação dos fabricantes. Apenas um (5%) laboratório afirmou utilizar metodologias próprias – in house (validadas) no processo diagnóstico, nesse caso foi citada metodologia para biologia molecular.
Em relação à implantação do Plano de Gerenciamento de Resíduos (PGR), todos os laboratórios afirmaram realizar o manejo dos resíduos de acordo com a RDC 306/2004.(12) Contudo, foi relatado o descarte de corantes de Hematologia e Microbiologia diretamente na rede fluvial, o que pode sugerir um gerenciamento de resíduos fictício e não efetivo. Além disso, seis (30%) laboratórios afirmaram dificuldades na implantação do PGR, alegando ser um processo caro, burocrático, que exige espaço para o armazenamento interno, e que é necessária capacitação frequente dos funcionários.
Em 17 (85%) laboratórios pesquisados existe manual de Biossegurança, mas 13 (65%) não possuem mapas de risco nos setores. Embora todos os laboratórios possuam manual com instruções, disseminem conhecimentos sobre o assunto, disponibilizem equipamentos de proteção individual (EPI) e coletiva (EPC) para todos os funcionários, três (15%) laboratórios relataram que os profissionais não os utilizam efetivamente. Metade dos laboratórios afirmou ter dificuldades para implantar as práticas de biossegurança, alegando que os profissionais apresentam resistência quanto ao uso dos equipamentos. Como forma de proteção legal ao laboratório e manutenção da saúde dos profissionais, os gestores devem exigir que os funcionários, em ambiente de trabalho, sigam as normas e condutas da empresa, além de promover treinamento, atualizações e capacitação na área. Sugere-se que o colaborador assine um termo de familiaridade dos procedimentos de biossegurança e de recebimento dos EPI.
Perfil dos laboratórios quanto à gestão das fases analítica pré e pós-analíticas
O laboratório deve possuir instruções escritas e atualizadas para todos os processos operacionais e exames realizados. No entanto, apenas 14 (70%) laboratórios pesquisados cumprem esse requisito e apenas um (5%) não possui relação escrita dos exames realizados pelo laboratório e dos exames terceirizados, descumprindo o requisito 6.2.3 da RDC 302/2005.
Apenas três (15%) laboratórios afirmaram realizar testes laboratoriais remotos (TLR), e 2/3 destes possuem registro do controle da qualidade dos mesmos. Entre as dificuldades para cumprimento deste requisito foi relatada a alta demanda por capacitação frequente dos profissionais que o executam, devido à rotatividade dos mesmos. A literatura sobre TLR realmente evidencia a necessidade de educação, treinamento e supervisão das atividades desenvolvidas com estes equipamentos.(13,14)
Na fase pré-analítica dos processos operacionais, é essencial instruir corretamente o paciente para o preparo e coleta da amostra.(15) Apesar da RDC 302/2005 permitir que as orientações para a realização de exames sejam repassadas apenas verbalmente, este processo pode gerar esquecimento e confusão ao paciente. Dez (50%) laboratórios pesquisados fazem a orientação de forma verbal e escrita, cinco (25%) de forma verbal, escrita e on-line, três (15%) apenas verbalmente e dois (10%) fornecem orientações apenas escritas.
A rastreabilidade da amostra na fase pré-analítica também é um processo fundamental.(5) Dezoito (90%) laboratórios possuem rastreabilidade no recebimento e coleta da amostra, mas cinco (25%) estabelecimentos apresentaram dificuldades para implantar este requisito, afirmando que há resistência dos colaboradores e problemas para criar o interfaceamento. Todos os laboratórios possuem critérios de aceitação e de rejeição de amostra.
O transporte do material biológico é realizado de diversas formas pelos laboratórios pesquisados. A utilização de caixas térmicas é a principal forma de transporte de amostras, representando 13 laboratórios (65%), dois (10%) utilizam maletas, três (15%) caixas térmicas e maletas e dois (10%) laboratórios ainda fazem uso de caixas de isopor, as quais não são higienizáveis conforme requerido pela RDC 302/2005. A temperatura de transporte das amostras não é monitorada por oito (40%) laboratórios. Além disso, dez (50%) laboratórios não possuem registros da temperatura de transporte e 13 (65%) relataram dificuldades para implantar esse controle no transporte, alegando resistência dos profissionais, diversidade de envolvidos no processo e falta de regras para padronização do transporte.
Para a fase pós-analítica, o estabelecimento de valores críticos ou de alerta para analitos foi considerada importante pelos laboratórios e fundamental para o processo diagnóstico. Todos os laboratórios relataram realizar comunicação com médico, responsável ou paciente. Entretanto, um (5%) laboratório declarou não possuir valores críticos ou de alerta definidos. Tal fato parece contraditório, ou, no mínimo, representa desconhecimento sobre o significado de valores críticos. Quatro (20%) laboratórios pesquisados relataram dificuldades para implantar este requisito de qualidade, alegando que a interação com os médicos nem sempre é bem aceita pela categoria médica. Em geral, essa interação apresenta-se mais comumente em laboratório de serviço hospitalar.
Dezessete (85%) laboratórios pesquisados possuem instruções por escrito para emissão de laudos. Sete (35%) participantes disponibilizam os laudos apenas na forma impressa e 13 (65%) também na forma on-line para agilizar e facilitar o acesso ao resultado. Noventa por cento dos estabelecimentos adicionam comentários nos laudos para auxílio na interpretação dos resultados. Apenas nove (45%) laboratórios realizam o registro da retificação de laudos.
O arquivamento dos resultados de exames e dados brutos é realizado por todos os laboratórios por períodos que variam entre 5 (16 laboratórios – (80%) a 25 anos (um laboratório – (5%). Dezenove (95%) laboratórios afirmaram que, se necessário, os laudos laboratoriais estão acessíveis.
Todos os laboratórios realizam a notificação de doenças de notificação compulsória.
Em relação às diferentes formas de definição dos valores de referência, oito (40%) laboratórios pesquisados utilizam valores de referência de diretrizes, seis (30%) de diretrizes e instruções de trabalho (IT) de fabricantes de reagentes, dois (10%) apenas de IT, dois (10%) de IT e de pesquisa populacional local, um (5%) de diretrizes e de pesquisa populacional local, e apenas um (5%) definiu os valores de referência utilizando diretrizes, IT e pesquisa populacional.
Perfil dos laboratórios quanto à garantia da qualidade
Em relação à garantia da qualidade, 19 (95%) laboratórios realizam controle interno da qualidade de todos os parâmetros analisados e seis (30%) afirmaram que foi difícil implantar esse requisito da qualidade. Por outro lado, apenas 14 (70%) laboratórios realizam controle externo de qualidade de todos os parâmetros analisados e nove (45%) apresentaram dificuldades para implantar esse requisito. Para a garantia da qualidade, os participantes demonstraram dificuldades para implantar o Controle Interno da Qualidade (CIQ) afirmando que o custo mensal é elevado e há dificuldades para encontrar controles comerciais para todos os analitos. Alguns laboratórios relataram que reduziram de três para apenas uma amostra controle por dia para reduzir os custos. Neste requisito destacamos o depoimento do laboratório 2.
“Não há material de controle disponíveis para algumas análises, realizamos controle interno alternativos, por exemplo, amostra em duplicata e duplo cego de leitura microscópica.” (Laboratório 2)
Quinze (75%) laboratórios monitoram o processo de CIQ analítica por mapas de controle e 14 (70%) participantes possuem registros de ações corretivas adotadas devido à rejeição de amostras controle. Cinquenta por cento (10) dos laboratórios relataram dificuldades para implantação destes requisitos devido aos custos e tempo dispendido no processo.
Nove (45%) laboratórios relataram apresentar dificuldades para implantar o Controle Externo da Qualidade (CEQ) devido ao custo mensal para participar dos programas e reclamaram que alguns provedores não possuem amostras controle para todos os analitos. Uma alternativa utilizada pelos estabelecimentos foi a comparação interlaboratorial viabilizada com os laboratórios de apoio. Contudo, a RDC 302/2005 prevê a participação em ensaio de proficiência e somente quando não há disponibilidade no mercado é que são permitidas formas alternativas de CEQ.
Treze (65%) laboratórios monitoram o processo de CEQ por mapas de controle e 14 (70%) participantes possuem registros das ações corretivas adotadas devido a resultados inaceitáveis no controle externo. Doze (60%) laboratórios apresentaram dificuldades para implantação destes requisitos.
Dezoito (90%) laboratórios utilizam indicadores da qualidade como ferramenta de avaliação dos processos do serviço. A maioria dos estabelecimentos relatou dificuldades na implantação dos indicadores, alegando a necessidade de registros e de estudos para a interpretação correta e que os recursos humanos existentes não são comprometidos em fazê-los.
Monitorar o processo operacional é fundamental para o controle da qualidade, mas nem todos os laboratórios fazem uso de mapas de controle e possuem registros de ações corretivas adotadas devido à rejeição de amostras controle. Apenas oito (40%) dos laboratórios pesquisados atendem este requisito, 11 (55%) realizam ações corretivas, mas não possuem mapas e planos e um (5%) possui plano de ações corretivas e utiliza múltiplas regras de controle de qualidade mas não possui mapas. As dificuldades para implantação desses requisitos são semelhantes no CIQ e CEQ: é necessário dedicar tempo, possuir registro efetivo dos resultados dos controles e ações, os recursos humanos existentes não são comprometidos em registrar e falta conhecimento para desenvolvimento e interpretação correta dos mapas de controle e planos de ações.
De forma geral, os requisitos da qualidade menos cumpridos foram: instruções escritas e atualizadas para todos os processos analíticos realizados; controle físico-químico e microbiológico da água utilizada, controle externo de qualidade de todos os analitos analisados; presença de responsável técnico substituto; monitoramento e registro da temperatura de transporte de amostras; mapa de risco do laboratório; e registro da retificação de laudos. Por outro lado, os requisitos da qualidade mais cumpridos foram: registro de formação dos profissionais; projeto físico aprovado pela Anvisa; instruções e registros de manutenções e calibrações de todos os equipamentos; registro de aquisição de reagentes; rotulagem adequada de reagentes aliquotados; EPIs e EPCs disponíveis; critérios de aceitação e rejeição de amostras; relação por escrito dos exames terceirizados; valores críticos para analitos; comunicação com o médico; notificação compulsória; tempo de arquivamento de laudos e dados brutos; controle interno da qualidade de todos os analitos.
A RDC 302/2005 possui aproximadamente 151 requisitos para garantia da qualidade laboratorial. A ferramenta de pesquisa utilizada nesse estudo envolveu 129 questões objetivas e subjetivas, das quais 38 estão diretamente ligadas aos requisitos da resolução. Os laboratórios do Grupo B apresentaram-se como os que mais cumprem os requisitos da RDC (deixam de cumprir em média 3,6 requisitos) e os do Grupo C os que menos cumprem (deixam de cumprir em média 7 requisitos) (Tabela 5). Contudo, a quantidade de membros do Grupo C não é suficientemente representativa para a significância desta análise. Ao mesmo tempo em que, sabidamente, os laboratórios de grande porte (Grupo C) investem mais em qualidade, provavelmente o cumprimento de alguns requisitos da qualidade seja mais complexo por contar com maior número de colaboradores e dessa forma maior dificuldade de implementação de processos e mudança de cultura.
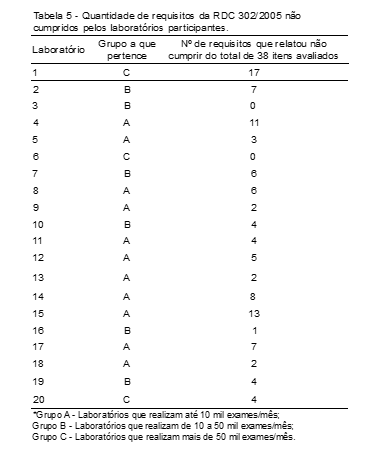
Os estabelecimentos de pequeno porte (Grupo A, que deixa de cumprir em média 5,7 requisitos) relataram dificuldades para implantar os requisitos da RDC e realizar as atividades de gestão, problema provavelmente decorrente do acúmulo de diversas funções pelo responsável técnico no laboratório (analista-clínico, administrador, gestor de qualidade, etc.).
Contudo, nove (45%) laboratórios não informaram dificuldades para implantação dos requisitos da RDC 302/2005 e 11 (55%) estabelecimentos relataram dificuldades em vários aspectos da implantação da resolução: critérios de aceitação e transporte de amostras, documentação de todas as técnicas realizadas, implantação da gestão da qualidade, da biossegurança, dos resíduos. Além disso, fizeram crítica à burocracia, à dificuldade do controle interno da qualidade para analitos com baixa estabilidade e das exigências legais serem as mesmas, independente do porte dos laboratórios.
Por fim, os vinte estabelecimentos participantes relataram que a RDC 302/2005 é essencial para o funcionamento dos laboratórios e os requisitos existentes estão em consonância com as necessidades do mercado. No entanto, sugerem que a resolução deve ser atualizada com maior frequência e apontaram a necessidade de requisitos mais claros e objetivos, como os de infraestrutura, sobre os profissionais habilitados a assinar laudos, sobre a gestão de riscos e segurança do paciente.
Considerações finais
A “qualidade” já foi um diferencial de mercado e hoje é uma condição de sobrevivência em todos os segmentos da prestação de serviços. Apesar das diretrizes para assegurar a qualidade e requisitos básicos para o funcionamento de laboratórios, ainda assim é comum observarmos no Brasil laboratórios diante de resultados insatisfatórios, com dificuldade de identificar as possíveis causas e definir ações que corrijam o problema para prover resultados mais confiáveis.(9)
Neste estudo foi possível perceber que qualidade nos serviços de saúde ainda é um desafio no Brasil. Segundo os relatos dos participantes, entre os desafios está a falta de profissionais capacitados e comprometidos com a gestão da qualidade. Oliveira e Mendes(9) afirmam que a rápida evolução dos processos também tem exigido um melhor preparo dos profissionais e a adoção de ferramentas de gestão eficazes por parte dos laboratórios para assegurar a qualidade dos resultados. E a formação em garantia da qualidade na área da saúde ainda está em processo de evolução no país, o que implica a falta de gestores para o setor.
Outra dificuldade relatada pelos participantes para a adequação à RDC 302/2005 foi o custo envolvido. Nesse contexto, tabelas desatualizadas de planos de saúde, atraso no recebimento de recursos públicos e diminuição dos valores de exames por parte dos concorrentes são motivos que afetam a estabilidade financeira do setor e, de acordo com os laboratórios pesquisados, dificultam a implantação da garantia da qualidade. Entretanto, nesse sentido, programas de educação para a qualidade possuem fundamentos básicos e importantes para combater desperdícios.(3)
Mesmo diante dessas dificuldades, a maioria dos laboratórios participantes afirmou possuir sistema de qualidade implantado e uma quantidade significativa relatou ter certificação da qualidade. Sessenta por cento dos estabelecimentos relataram cumprir integralmente os requisitos da RDC 302. No entanto, ao analisarmos as demais respostas da ferramenta de pesquisa, foi possível observar que a implantação não é integral. Apenas dois laboratórios cumprem todos os 38 requisitos da RDC 302 avaliados por meio do questionário (Tabela 5).
Com este estudo observamos a necessidade de maior conhecimento dos conceitos e ferramentas de gestão para os laboratórios, o que pode ser o início da solução para as dificuldades apresentadas. Assim dizia São Francisco de Assis, “Comece fazendo o que é necessário, depois o que é possível e de repente você estará fazendo o impossível.”
Abstract
Objective: To asses a decade after the publishment, if the clinical analysis laboratories from the state of Santa Catarina fulfill the requirements of the RDC 302/2005. Methods: The informations regarding the laboratories were obtained on the CNES. A questionnaire was elaborated based on the RDC and used as research tool that was sent to the laboratories. Results: From the total of 523 laboratories registered on the CNES, 198 were contacted and only 20 answered the questionnaire. The participating laboratories reported that the RDC 302/2005 is essential for the functioning of laboratories. The time to start the implementation of the RDC took on average a year and the time for complete the process, also a year. Twelve of establishments reported meet the resolution’s requirements. However, of the 38 requirements of the RDC 302 evaluated, only 2 laboratories meet all the criteria. The labeling requirements of reagents, equipment’s temperature control record, medical waste management, communication of critical values, notification of results that indicate notifiable disease and archiving of reports and gross data were fulfilled by all laboratories. The registration of the sample transport temperature requirement was the requirement fulfilled by the smallest number of laboratories, only 10. The difficulties related to implementation of the requirements were mainly in management and quality assurance, records, implementation of biosafety knowledge and resistance of employees to the change process. Conclusion: More studies in the concepts of management, quality and standardization system processes are needed in the laboratory and can be one solution to the problems presented.
Keywords
Quality management; Quality assurance; Quality control; Total quality; Clinical laboratory
REFERÊNCIAS
- Burtis CA, Ashwood ER, Tietz NW, Bruns DE (Ed.). Tietz, Fundamentos de química clínica. 6 ed. Rio de Janeiro: Saunders Elsevier; 2008.
- Vieira KF, Shitara ES, Mendes ME, Sumita NM. A utilidade dos indicadores da qualidade no gerenciamento de laboratórios clínicos J Bras Patol Med Lab. 2011 Jun;47(3):201-10.
- Biasoli MM e Oliveira CA. Programa 5S – Control Lab. 2005. Disponível em: http://www.controllab.com.br/pdf/manual_5s_2005.pdf. [acesso em 28 out 2016]
- Mendes ME. Gestão por processos no laboratório clínico: uma abordagem prática. São Paulo: EPR Ed, 2007.
- Agência Nacional de Vigilância Sanitária (Brasil). RDC no.302, de 13 de outubro de 2005. Dispõe sobre Regulamento Técnico para Funcionamento de Laboratórios Clínicos. Diário Oficial da União 14 out 2005.
- Minayo MCS, Assis SG, Souza ER. Avaliação por triangulação de métodos: abordagem de programas sociais. 20 ed. Rio de Janeiro: FIOCRUZ, 2005.
- Cadastro Nacional de Estabelecimentos de Saúde (CNES). Disponível em http://cnes2.datasus.gov.br/. [acesso em 10 jan 2016]
- Baffert S, Italiano A, Pierron G, Traoré MA, Rapp J, Escande F, et al. Comparative cost analysis of molecular biology methods in the diagnosis of sarcomas. Bull Cancer. 2013 Oct;100(10):963-71. doi: 10.1684/bdc.2013.1822.
- Oliveira CA e Mendes ME. Gestão da fase analítica do laboratório: como assegurar a qualidade na prática. 1ª ed. Rio de Janeiro: ControlLab, 2010.
- Vendrell X, Carrero R, Alberola T, Bautista-Llácer R, García-Mengual E, Claramunt R, Pérez-Alonso M. Quality management system in PGD/PGS: now is the time. J Assist Reprod Genet. 2009 Apr; 26 (4):197-204. doi: 10.1007/s10815-009-9307-9.
- Agência Nacional de Vigilância Sanitária (Brasil). RDC no.50, de 21 de fevereiro de 2002. Dispõe sobre o Regulamento Técnico para planejamento, programação, elaboração e avaliação de projetos físicos de estabelecimentos assistenciais de saúde.
- Agência Nacional de Vigilância Sanitária (Brasil). RDC no.306, de 7 de dezembro de 2004. Dispõe sobre o Regulamento Técnico para o gerenciamento de resíduos de serviços de saúde.
- Nichols JH. Quality in point-of-care testing: taking POC to the next level. Accred Qual Assur. 2006 Jun;11(6)273-7. doi: 10.1007/s00769-006-0130-z.
- Plebani M. Laboratory network of excellence: enhancing patient safety and service effectiveness. Clin Chem Lab Med. 2006 44(2):150-60. doi: 10.1515/CCLM.2006.028.
- SBPC. Recomendações da Sociedade Brasileira de Patologia Clínica/Medicina Laboratorial (SBPC/ML): coleta e preparo da amostra biológica. – Barueri, SP: Manole: Minha Editora, 2014.
Correspondência
Gustavo Henrique Lescowicz
Rua Delfino Conti s/n, sala 109, bloco K
Departamento de Análises Clínicas, Centro de Ciências da Saúde
Universidade Federal de Santa Catarina – Trindade
88040900 – Florianópolis-SC, Brasil
