El rol de las Trampas Extracelulares de Neutrófilos en pacientes con Covid-19
O papel das armadilhas extracelulares de neutrófilos em pacientes com Covid-19
The role of neutrophil extracellular traps in patients with Covid-19
Felipe Ignacio Garrido1, Luis Conrado Zaror2, Nicolás Ignacio Lara2, Catalina Nicol Zúñiga2
1 Hospital Dr. Hernán Henríquez Aravena, Laboratorio Clínico; Universidad Santo Tomás, Escuela de Tecnología Médica, Facultad de Salud – Temuco. Temuco, Chile.
2 Universidad Mayor, Escuela de Tecnología Médica, Facultad de Medicina y Ciencias de la Salud – Temuco. Temuco, Chile.
Recebido em 31/08/2023
Aprovado em 16/10/2023
DOI: 10.21877/2448-3877.202300144
INTRODUCCIÓN
El SARS-CoV-2 causante de la enfermedad Covid-19, es un virus que se aisló por primera vez, en 2019, en Wuhan, China, desde muestras de lavado broncoalveolar de pacientes con neumonía,(1) propagándose por todo el país y luego por el mundo, siendo declarada por la OMS, en marzo de 2020, como pandemia.(2)
Es la mayor crisis de salud pública mundial desde la pandemia de influenza de 1918, causando una morbilidad y mortalidad significativas. Este nuevo coronavirus, de la familia Coronaviridae, del orden Nidovirales, es altamente contagioso y se transmite principalmente de persona a persona, mediante gotitas respiratorias de individuos infectados. La mortalidad aumenta en adultos mayores con inmunidad reducida y personas con comorbilidades, como diabetes, enfermedad cardíaca, enfermedad renal crónica, enfermedad pulmonar crónica y otros factores sociodemográficos.(3,4)
La infección por SARS-CoV-2 cursa con un cuadro clínico variable, asintomática o sintomática, con manifestaciones similares a la gripe, y en casos más graves como una neumonía que puede progresar a un síndrome de dificultad respiratoria aguda (SDRA). En algunas personas, desemboca en una falla multiorgánica y posterior muerte.(5) Esto, como consecuencia de que el virus es capaz de escapar de las respuestas inmunes innatas.(6)
Los neutrófilos son unas de las células principales del sistema inmune innato(7) y sus niveles elevados en sangre son un indicador temprano de infección por SARS-CoV-2, que predice una enfermedad respiratoria grave y un peor pronóstico.(8) Ejercen su rol directamente, mediante la internalización del virus por fagocitosis para su eliminación, liberación de citoquinas, desgranulación y generación de especies reactivas de oxígeno (ROS).(9) En 2004, Brinkmann et al.,(5) describieron la capacidad de los granulocitos neutrófilos, para generar NET, las cuales están formadas por ácido desoxirribonucleico (ADN), histonas y proteínas de gránulos, tales como lactoferrina, catepsina G, elastasa de neutrófilos (NE) y mieloperoxidasa (MPO), además de proteínas citoplasmáticas y citoesqueléticas.(10) Las NET se forman a través de dos vías. La primera, es una vía de muerte celular denominada NETosis lítica, que comienza con la deslobulación nuclear y el desmontaje de la envoltura nuclear y continúa con la pérdida de polarización celular, la descondensación de la cromatina y la ruptura de la membrana plasmática.(11) La segunda vía, llamada NETosis no lítica, los neutrófilos pueden liberar parte o todo el núcleo, sin romper la membrana celular, lo que da como resultado citoplastos anucleares, que aún pueden moverse y fagocitar microorganismos.(12) La función principal de las NET es inmovilizar y degradar bacterias, hongos, virus y protozoos, siendo un mecanismo efector crítico para detener infecciones.(13) Además, de ser activada por agentes patógenos, se ha descrito a las plaquetas activadas como inductores de NETosis, al igual que los péptidos derivados del complemento, autoanticuerpos, interleuquina 8 (IL-8), peróxido de hidrógeno, cristales de urato, ionóforos y humo de cigarrillo.(12)
La desregulación en la formación de NET puede contribuir a la patogénesis de enfermedades relacionadas con el sistema inmunitario, que van desde inmunodeficiencias como la Enfermedad Granulomatosa Crónica (EGC) hasta enfermedades autoinmunes que incluyen el Lupus Eritematoso Sistémico (LES) y la Artritis Reumatoide (AR).(11,14) También, están implicadas en patologías cardiovasculares, inflamatorias, metabólicas e infecciosas, en donde las NET parecen elevar la morbilidad y mortalidad. Incluso, se ha demostrado que promueven la metástasis de tumores.(15) Durante la infección por Covid-19, la interacción entre huésped y el SARS-CoV-2, junto con la señalización viral conduce a una cascada de interacciones entre el mecanismo de reconocimiento del virus, la activación de los neutrófilos y los estímulos inflamatorios. Por ello, el proceso de NETosis puede proteger al huésped durante la respuesta al virus o bien exacerbar la hiperinflamación pulmonar en estos pacientes, a partir de una sobreproducción de NET.(16) La liberación de componentes intracelulares como el ADN, las histonas, MPO y NE, puede inducir lesiones en las células endoteliales vasculares y generar trombosis,(17) lo que sugiere que estarían relacionados con los efectos sistémicos nocivos en pacientes infectados con SARS-CoV-2.(13) La pandemia, generó estragos a nivel mundial, exigiendo al máximo las capacidades de los sistemas de salud, para comprender y actuar de manera eficaz, frente a los nuevos desafíos que supuso la enfermedad. Se ha descrito, la patogenicidad del virus en el huésped, y cómo este es capaz de ocasionar cuadros críticos en pacientes con Covid-19. También, se ha propuesto a las NET como un mecanismo involucrado en la progresión de la enfermedad, sobre todo en casos graves con riesgo de mortalidad. Esta última etapa de la enfermedad es de difícil manejo clínico, lo que hace necesario comprender el proceso fisiopatológico, en el que las NET pueden ser uno de los factores responsables de las complicaciones locales y sistémicas de la patología. Incluso, se ha propuesto la búsqueda de inhibidores de trampas. El objetivo de este estudio fue, establecer bibliográficamente, el rol de las NET en la evolución de pacientes enfermos de Covid-19.
MATERIAL Y MÉTODO
Se realizó una búsqueda bibliográfica en “PubMed”, “Nature” y “Elsevier” entre septiembre del 2021 a mayo del 2023, utilizando el gestor de referencias bibliográficas Mendeley. El estudio se enfocó en la enfermedad de Covid-19 y las NET, términos que se abordaron de manera individual, para obtener nociones generales e introductorias y de forma conjunta como eje central de esta revisión. En total, fueron seleccionadas 61 publicaciones en base al título, resumen y palabras clave.
RESULTADO Y DISCUSIÓN
Trampas extracelulares de neutrófilos
Fisiología
La formación de NET junto con la posterior muerte del neutrófilo es un mecanismo de defensa del huésped denominado NETosis o liberación lítica de NET (18). El proceso, comienza con la activación de los neutrófilos a través del reconocimiento de estímulos, que son captados por los “Toll like receptors 4 y 8” (TLR4 Y TL8), llevando a un aumento del Ca2+ intracelular, que induce la acción de la vía de señalización de la proteína quinasa C (PKC) y Raf-MEK-ERK que activa el complejo Nicotinamida-Adenina dinucleótido fosfato oxidasa (NADPH) o NOX y genera ROS.(15,18,19) Los cationes de Ca2+ actúan como cofactores de la peptidil arginasa desaminasa 4 (PAD4), enzima nuclear dependiente de ROS, que promueve la desaminación de las histonas, modificando así, los aminoácidos para permitir la descondensación de la cromatina, al promover la pérdida de las cargas positivas necesarias para la interacción de las histonas con el ADN.(19,20) Por consiguiente, se produce una separación gradual y pérdida de la membrana nuclear promovida por ROS, y luego la cromatina se dispersa, por el citoplasma para mezclarse con proteínas y toxinas, producto de la desgranulación del neutrófilo, de manera que se liberan enzimas como la NE y MPO, que interactúan con el núcleo, en donde escinden las histonas y facilitan la descondensación de la cromatina.(15) Finalmente, la cromatina se libera fuera de la célula a través de los poros de la membrana y de manera simultánea ocurre la lisis celular(19) (Figura 1).
La NETosis no lítica, también llamada NETosis vital, es otra forma por la cual los neutrófilos liberan NET. En este caso, sin la pérdida de la membrana nuclear o plasmática, y ocurre independientemente de ROS y de la vía Raf-MEK-ERK. Este proceso consiste en la liberación de ADN nuclear a través de cambios morfológicos, empezando con el crecimiento de la envoltura nuclear y liberación de vesículas. Luego, sigue la descondensación del núcleo y finalmente la ruptura de su envoltura.(19) Este tipo de NETosis es activado por el reconocimiento de los estímulos a través de receptores toll-like tipo 2 y tipo 4 o receptores del complemento independientes de la activación de NAPDH oxidasa. Después de la liberación de NET, a pesar de la pérdida de su ADN, los neutrófilos siguen vivos, en forma de citoplastos anucleados, que pueden moverse y fagocitar patógenos(18) (Figura 2).
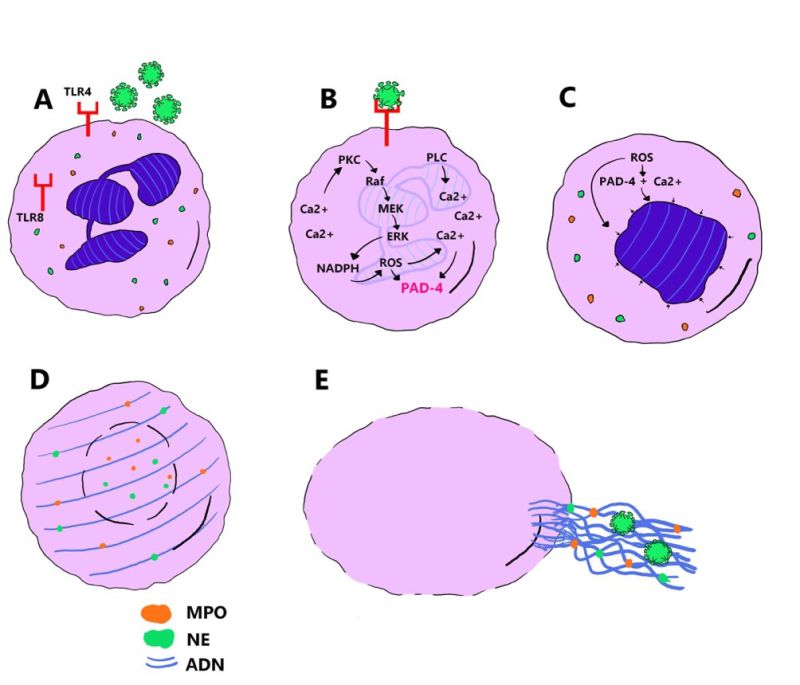
Figura 1
Pasos secuenciales de la NETosis lítica. Ilustración de elaboración propia.
A) Reconocimiento de estímulo viral a través del receptor de membrana TLR4 y TLR8. B) Aumento de Ca2+ intracelular que induce la activación de la vía de señalización PKC y Raf-MEK-ERK, que da como consecuencia la estimulación de NADPH y generación de ROS. El Ca2+ también actúa como cofactor de la enzima PAD4, la cual es dependiente del ROS generado anteriormente. C) De esta manera, se promueve la desaminación de histonas y se permite la descondensación de la cromatina. D) Separación gradual y pérdida de la membrana nuclear promovida por ROS. La cromatina se dispersa en el citoplasma y se comienza a mezclar con proteínas y toxinas, como la MPO y la NE producto de la desgranulación del neutrófilo. E) La MPO y NE escinde las histonas facilitando la descondensación de la cromatina, que se dispone en forma de red tridimensional y se libera fuera de la célula para la eliminación del virus. Simultáneamente ocurre la lisis celular.
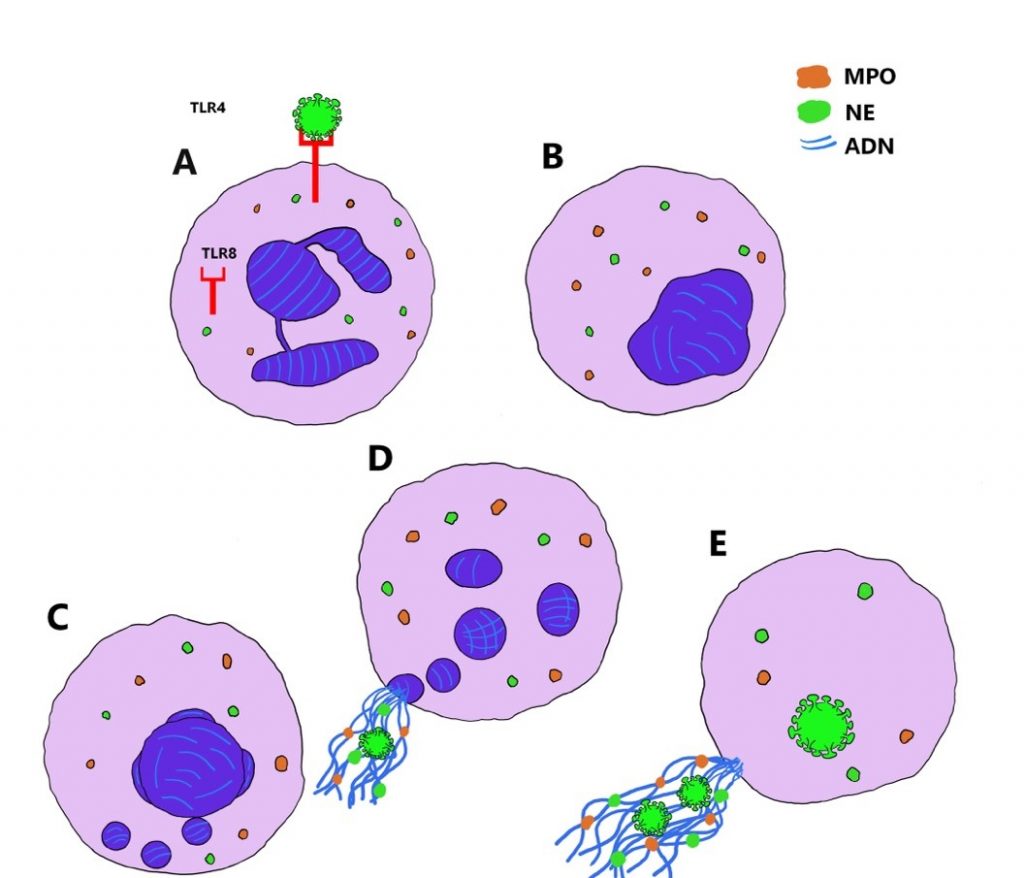
Figura 2
Pasos secuenciales de la NETosis no lítica. Ilustración de elaboración propia.
A) Reconocimiento del estímulo viral a través del receptor de membrana TLR4 y TLR8. B) Se inducen cambios morfológicos en la célula y el crecimiento de la envoltura nuclear. C) Liberación de vesículas de ADN. D) Comienza la descondensación del núcleo y ruptura de la envoltura nuclear. La MPO y NE escinde las histonas facilitando la descondensación de la cromatina, que se dispone en forma de red tridimensional y se libera fuera de la célula para la eliminación del virus. E) No ocurre lisis celular y el neutrófilo permanece en forma de citoplasto anucleado, conservando funciones vitales básicas como la movilidad y fagocitosis.
Se ha demostrado, que las NET, se generan principalmente a partir de ADN cromosómico.(21) Así, lo confirman Kenny et al.(22) (2017), quienes sometieron in vitro a neutrófilos, ante diversos estímulos desencadenantes de NET, observando en determinados casos, que sólo del 10 a 25% del ADN liberado durante la NETosis, era de origen mitocondrial. Teniendo estas evidencias, se podría pensar que, a nivel estructural, en la formación de NET, no existe más participación del ADN mitocondrial (ADNmt). Sin embargo, Ingelsson et al.(23) (2018), afirmaron que los neutrófilos pueden liberar exclusivamente redes de ADNmt extracelular, en respuesta a ciertos inductores. Por lo tanto, esta forma de liberación NET se podría categorizar como un nuevo mecanismo de producción de NETosis no lítica, en donde la célula posterior al proceso, continúa con sus funciones vitales.
Para lograr efectos protectores, en el curso de una infección y/o proceso inflamatorio, debe haber un equilibrio constante entre la generación de NET y su posterior degradación. Los reguladores claves en la degradación, son las ADNasas o nucleasas del huésped. Un deterioro en la digestión de NET por nucleasas faltantes o no funcionales, se asocia con enfermedades autoinmunes, como, nefritis lúpica o lupus eritematoso sistémico.(24-26)
Biología de la NETosis en Covid-19
En las infecciones virales, las NET capturan los virus a través de su estructura y los eliminan mediante concentraciones altas de MPO y péptidos antimicrobianos, evitando la propagación desde el área local a otros tejidos.(27) La NETosis es un proceso beneficioso en la defensa del huésped contra patógenos. No obstante, puede haber un daño colateral asociado a la formación sostenida de NET, que estimula procesos patológicos, incluidos los que ocurren durante las infecciones virales.(28) Las NET han sido estudiadas en el contexto de enfermedades cardiovasculares, donde infiltran y propagan la inflamación en la pared del vaso y cuando se forman intravascularmente, ocluyen arterias, venas y vasos microscópicos.(29) De hecho, la formación excesiva de estas, puede desencadenar una cascada de reacciones inflamatorias, que promueve la metástasis de las células cancerosas, destruye tejidos circundantes, facilita la microtrombosis y da como resultado un daño orgánico permanente en los sistemas respiratorio, cardiovascular y renal. Estos son tres sistemas de órganos comúnmente afectados en Covid-19 grave.(20)
Zuo et al.(29) (2020) determinaron la concentración de biomarcadores de NETosis, en muestras de suero de pacientes sin ventilación mecánica y pacientes que la requerían. Evidenciaron, que los pacientes sometidos a ventilación mecánica, poseen niveles significativamente más altos de ADN libre de células y MPO-ADN, pero no Cit-H3. Además, el marcador MPO-ADN se correlacionó con el recuento absoluto de neutrófilos. Estos datos, sugieren una relación entre el nivel sérico de NET, el recuento absoluto de neutrófilos y la gravedad de Covid-19.
Protasio et al.(30) (2020) realizaron un estudio en pacientes con Covid-19 grave, sometidos a ventilación mecánica, determinando que la concentración de NET en muestras de aspirado traqueal fue mayor que la de controles normales. Por otro lado, en pacientes enfermos los valores de NET en el aspirado traqueal fueron 10 veces mayores que la observada en el plasma. En paralelo, preparaciones histológicas post mortem de secciones pulmonares evidenciaron daño alveolar difuso, exudativo y proliferativo. De los fallecidos, sometidos a autopsia, se observó neumonía neutrofílica, en grados variables en 6 de 10 de ellos. Al hacer una indagación por microscopía confocal de los tejidos pulmonares post mortem de pacientes con Covid-19 con presencia de neutrófilos, se reveló la aparición de estructuras características de NET, visualizadas con tinción de ADN extracelular, diferenciando MPO y Cit-H3. Estos resultados, indican que las NET se liberan en el epitelio respiratorio bajo y están asociadas con daño pulmonar en pacientes con Covid-19 grave, pudiendo inferir, que el nivel de formación de NET se correlaciona progresivamente con la evolución clínica de la patología, siendo útil como valor pronóstico de gravedad y mortalidad.
NET y trombosis vascular en pacientes con Covid-19 grave
Existe evidencia de que la coagulopatía es el resultado de la profunda respuesta inflamatoria de Covid-19 y el daño endotelial. Informes de autopsias, demuestran inclusiones virales endoteliales pulmonares, aumento de la angiogénesis y de microtrombos capilares. Los pacientes con neumonía por Covid-19 presentan anomalías en la coagulación, caracterizada por elevaciones en los productos de degradación de fibrina, dímero D y fibrinógeno, lo que desencadena una situación crítica y mortal.(31,32) El dímero D, es un biomarcador comúnmente elevado en los pacientes afectados por la enfermedad y se encuentra hasta en el 45 % de ellos. En el caso de presentarse valores superiores a 1000 ng/mL (Valor de referencia: <100 ng/ml) los pacientes tienen casi 20 veces más probabilidades de morir a causa de su infección, que los que tienen valores más bajos.(33,34)
Rol del sistema inmune innato en la inmunotrombosis
La inmunotrombosis describe la participación del sistema inmunitario innato en la formación de un trombo a través de distintas interacciones celulares y moleculares, desencadenadas por el reconocimiento de patógenos y células dañadas.(35)
Una vez que el SARS-CoV-2, ingresa al cuerpo y rompe la membrana epitelial alveolar, después de unirse al receptor de la ACE2, el sistema inmunitario innato debe reconocerlo como extraño e iniciar una respuesta inmune, para destruir o eliminar al invasor. Los ARN virales posteriores, sirven como patrones moleculares asociados a patógenos (PAMPs), que luego son detectados por receptores de reconocimiento de patrones (PRR) tipo Toll. Esto, da como resultado la activación de las células epiteliales, iniciando una cascada de quimioatracción de células inmunitarias innatas; activando las poblaciones locales de macrófagos, que se encargarán de iniciar vías de transducción de señales, para culminar con la producción de citocinas y quimiocinas proinflamatorias.(36) Simultáneamente, se activa C3 del complemento al reconocer los PAMPs del virus, siendo este el punto de convergencia de la activación de todas las vías del complemento, conduciendo a la generación de C3a, C5a y sC5b-9, esta última, conocida como el complejo soluble terminal del complemento.(37) C3a activa las plaquetas, las cuales junto con C5a inducen la formación de trombina, que luego promueven la expresión de factor tisular (TF) de neutrófilos y NET, desencadenando la inmunotrombosis.(38)
Tormenta de citoquinas
La activación desregulada de una variedad de glóbulos blancos, incluidos linfocitos B, linfocitos T, células natural killer, macrófagos, células dendríticas, neutrófilos, monocitos y células epiteliales o endoteliales, inducen una liberación exagerada de citoquinas, denominada “Tormenta de citoquinas”, lo que desencadena un aumento de las concentraciones plasmáticas de diversas interleucinas, principalmente la IL-6.(39-41) Estos mediadores inflamatorios, pueden regular la función de los neutrófilos y su infiltración al foco inflamatorio. La tormenta de citoquinas promueve un ciclo de señalización entre los macrófagos y los neutrófilos que pueden conducir al estado inflamatorio prolongado, que se observa en los pacientes graves con Covid-19.(40) La infiltración continua de neutrófilos en el sitio de la infección, su desgranulación y liberación de NET, produce citoquinas y quimiocinas en exagerada cantidad, que podría contribuir a la tormenta de citoquinas durante el desarrollo de la enfermedad.(42)
Activación de plaquetas
Las plaquetas se adhieren a los vasos sanguíneos lesionados, se activan y expresan moléculas de adhesión, conduciendo al reclutamiento de neutrófilos. Las plaquetas circulantes no se unen espontáneamente a los neutrófilos, pero lo hacen en el contexto de una infección bacteriana o viral. Esta interacción, depende de las integrinas y da lugar a la formación de NET.(10) Las interacciones entre plaquetas y neutrófilos están mediadas por sus moléculas de superficie, como la p-selectina (CD62P), que se une al ligando 1 de la glicoproteína p-selectina (PSGL-1) en la superficie de los neutrófilos, lo que induce la activación plaquetaria. Asimismo, la p-selectina plaquetaria prepara los neutrófilos para la NETosis. Esto, sugiere una retroalimentación de trombosis microvascular, donde se forman complejos plaquetas-neutrófilos, activando la NETosis y provocando la agregación plaquetaria.(32,39)
Skendros et al.(38) (2020) estimularon neutrófilos aislados de individuos sanos, con plasma rico en plaquetas de pacientes con Covid-19, demostrando que tenían niveles aumentados de ARNm de TF. Las NET formadas, mostraron una alta producción de trombina, lo que respalda el papel de las plaquetas en la inmunotrombosis por Covid-19 mediada por NET.
Las NET impulsan la inmunotrombosis
Los neutrófilos, después de la exposición al virus, plaquetas activadas y citocinas, median un entorno procoagulante, principalmente a través de la liberación de NET. Los componentes de las trampas promueven la expresión génica de los factores de coagulación, inducen la oclusión de los vasos, tanto de manera dependiente como independiente de fibrina, y también activan la cascada de la coagulación a través de la vía intrínseca y extrínseca. Además, de su función como andamiaje, muchos de los componentes de las NET pueden inducir la activación plaquetaria y la coagulación sanguínea, lo que desencadena la formación de trombos.(35,36)
En casos de pacientes con Covid-19 grave, los principales componentes de las NET involucrados en la inducción de la coagulación son: el ADN genómico, histonas, NE, catepsina G y MPO.(43,44) En cuanto al ADN libre de neutrófilos, este entra en el plasma para desencadenar la generación de trombina, al unirse al factor Xll, que se ve potenciado por la disminución de los factores anticoagulantes y la fibrinólisis deficiente. Induce, además, la formación de trombina y la regulación a la baja de la trombomodulina.(35,36,39,43,45)
Las histonas inducen la expresión de TF en células endoteliales, macrófagos y monocitos, lo que activaría la coagulación a través de los factores V y X (FV y FX), encargados de convertir el fibrinógeno en fibrina, mediado por trombina.(26,39) Asimismo, pueden unirse al Factor Von Willebrand, fibrinógeno y fibrina, para reclutar plaquetas y eritrocitos.(36) La histona H3 disminuye la actividad de la trombomodulina, la cual es un cofactor proteico fundamental para la activación de la proteína C, que es uno de los anticoagulantes naturales reguladores de la hemostasia. Por lo tanto, se potenciaría aún más la generación de trombina en plasma. Por otro lado, la histona H4 se une a la protrombina y genera trombina por auto activación.(35,45)
La NE, está asociada con los procesos de inflamación y trombosis a través de la liberación de citoquinas proinflamatorias y la escisión proteolítica del inhibidor de la vía del factor tisular (TFPI), lo que mejora la activación del FX.(40) Alteran, además, el citoesqueleto de las células endoteliales, desencadenando su descomposición, induciendo el deterioro y la apoptosis en las células epiteliales, lo que afecta la integridad de la barrera alveolar; y se encargan de degradar y alterar la función de anticoagulantes como la trombomodulina.(35,40) La catepsina G, inactiva proteolíticamente al TFPI, lo que impide la eliminación correcta del coágulo.(35,36,45) Por último, la MPO conduce a la apoptosis de las células epiteliales mediante la liberación de ROS.(40) Sumado a que los componentes de las NET, inducen que se exprese el TF. Skendros et al.(38) (2020) confirmaron que las trampas son una fuente intrínseca de TF. Los investigadores, utilizaron microscopía de inmunofluorescencia confocal en neutrófilos recolectados de 4 pacientes con Covid-19 grave, evidenciando la formación espontánea de NET que expresan TF. Estos antecedentes confirman el rol de las NET y su contribución al estado procoagulante.
En los pacientes con Covid-19 grave, las NET tienen un rol fundamental en el estado de hipercoagulabilidad, que contribuye a generar eventos trombóticos, que afectan tanto la circulación arterial como la venosa, provocando un síndrome coronario agudo, accidente cerebrovascular, embolia pulmonar, trombosis venosa profunda y microvascular(10) (Figura 3).
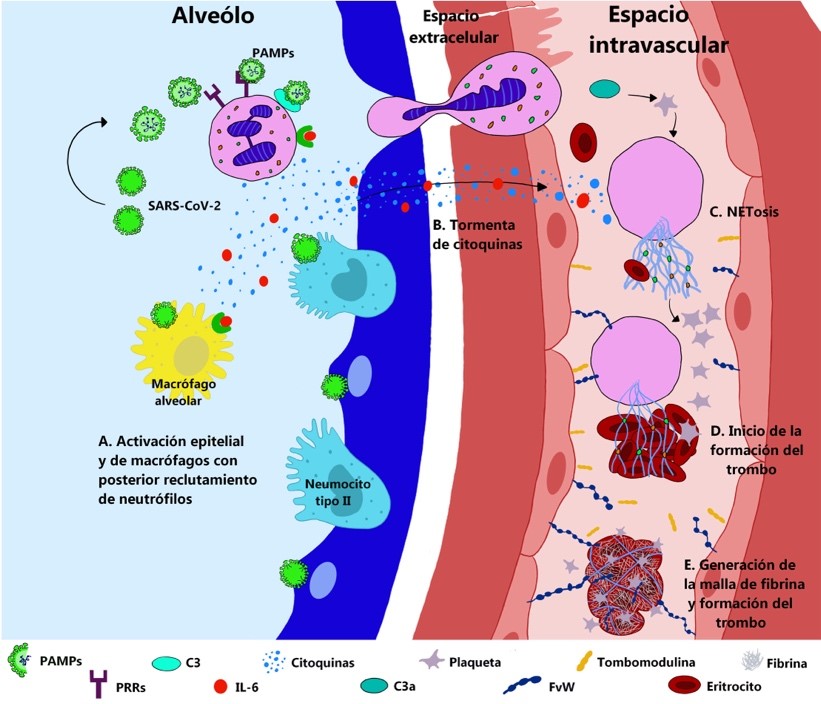
Figura 3
Modelo de inmunotrombosis vascular en pacientes COVID-19 grave. Ilustración de elaboración propia.
A) Invasión del virus SARS-CoV-2 a las células epiteliales alveolares, activándolas junto con las poblaciones locales de macrófagos. Los PAMPs del virus, son reconocidos por C3 del complemento y por los PRRs de los neutrófilos, generando su reclutamiento. B) Los macrófagos activados, neutrófilos y el complemento, inducen la producción y liberación de citoquinas y quimiocinas en el espacio extracelular. Principalmente, la IL-6 desencadena un ciclo de señalización entre los macrófagos y neutrófilos, que pueden generar al estado inflamatorio prolongado, debido liberación continua y exacerbada de interleucinas, produciéndose una “Tormenta de citoquinas”. C) Los neutrófilos que reconocieron los PAMPs del virus, se extravasan al espacio intravascular y comienzan a generar NET. Además, debido a la activación del complemento se genera C3a, que al igual que las NET funcionan como activadores plaquetarios. A su vez, las plaquetas activas y la producción exagerada de citoquinas inducen la producción de NET. D) Las NET extruidas, funcionan como andamiaje para que se empiece a formar el trombo, siendo soporte de eritrocitos y plaquetas agregadas. Simultáneamente, los componentes de las trampas promueven la expresión de factores de coagulación, activando la vía intrínseca y extrínseca. E) Las células endoteliales activadas, exocitan factor Von Willebrand, lo que permite la adherencia de neutrófilos y NET a la pared vascular. La trombomodulina presente en las células endoteliales se desprende, favoreciendo el entorno procoagulante. La activación de la cascada de la coagulación culmina con la generación de la malla de fibrina, que se entrelaza a glóbulos rojos y plaquetas agregadas. Finalmente, se genera microtrombosis del vaso.
Zuo et al.(34) (2021), en un estudio de casos y controles de pacientes hospitalizados con Covid-19 que desarrollaron trombosis, en comparación con pacientes del mismo sexo y edad sin trombosis clínica, demostraron niveles significativamente más altos de calprotectina, un marcador de activación de neutrófilos. De manera similar, tres marcadores diferentes de NET (ADN libre de células, complejos de mieloperoxidasa-ADN e histona H3 citrulinada) también estaban marcadamente elevados en el grupo de trombosis. Por otro lado, los autores demostraron que, había una correlación positiva entre los picos de dímero D, con la calprotectina, ADN libre y el recuento máximo de neutrófilos. Los niveles de calprotectina y ADN libre de células, también se correlacionaron positivamente con los recuentos máximos de plaquetas. De esta forma, se dilucida el papel de los neutrófilos hiperactivos y la liberación de NET, en eventos trombóticos mórbidos, que aumentarían el riesgo de mortalidad.
Síndrome Post Covid-19 y NETosis
Posterior a la infección aguda por SARS-CoV-2, algunos pacientes padecen secuelas crónicas, durante semanas o incluso meses. A esta condición, se le ha denominado Síndrome post Covid-19 (SPC).(46) La fisiopatología está regida principalmente por fenómenos inmunopatológicos o hiperinflamatorios, con manifestaciones clínicas generales e inespecíficas.(47,48)
La activación autoinmune persistente y el estado proinflamatorio que se ha planteado en el SPC, se asocia a los siguientes procesos: la propiedad del virus de hiperestimular el sistema inmunitario, el mimetismo molecular entre las proteínas virales y autoantígenos del huésped, y a la excesiva de producción de NET.(47,49) Al igual que en enfermedades autoinmunes como LES, AR y vasculitis, en el que los componentes de las NET funcionan como autoantígenos, también ocurre en Covid-19, de manera que se generan autoanticuerpos. Las NET son una fuente de antígenos citrulinados y de factor activador de células B, por lo tanto, se desencadena la activación de linfocitos B autorreactivos, con la consiguiente producción de autoanticuerpos, destacando los anticuerpos antinucleares (ANA), que se han evidenciado en pacientes que tuvieron Covid-19 grave.(50)
La fibrosis pulmonar es una afección respiratoria común posterior a la Covid-19, debido a la transición epitelial-mesenquimatosa.(43) George et al.(51) (2022) describieron en una cohorte de pacientes, cambios morfológicos y funcionales persistentes a nivel pulmonar, después de la recuperación del Covid-19 agudo, que relacionaron como un rasgo característico inmunitario asociado a neutrófilos regulados al alza. Entre otros experimentos, estos autores, realizaron pruebas in vitro con células epiteliales alveolares, a las cuales les administraron NET exógenas, dando como resultado la aparición de mediadores fibrogénicos y la alteración de la expresión de los genes involucrados en la transición epitelial-mesenquimatosa; destacando la importancia funcional de las NET, en la conducción a cambios pulmonares intersticiales, post enfermedad aguda.
La infección directa por SARS-CoV-2, junto con la neuroinflamación persistente por mediadores centrales o periféricos y las anomalías cerebrovasculares, todas ellas vinculadas a la producción excesiva de NET, se encuentran entre los mecanismos responsables del deterioro neurológico posterior a la enfermedad.(43,52) Por otro lado, junto con otros eventos cancerígenos, la Covid‐19 podría predisponer al organismo al desarrollo del cáncer y acelerar su progresión. Se ha demostrado que, las NET cambian el microambiente tumoral, activan las células cancerosas y mejoran la progresión tumoral y metástasis.(43,53,54)
Inhibidores de NET como modalidad terapéutica para Covid-19
La manipulación de los mecanismos de formación de NET, ha sido objetivo de investigación para desarrollar tratamientos e intervenciones terapéuticas o farmacológicas, para lograr combatir las actividades tóxicas de ellas. La mayor parte de las patologías relacionadas con las NET, están asociadas con el exceso y la falta de eliminación de estas.(15,40)
Dentro de las opciones terapéuticas más estudiadas para contrarrestar los efectos negativos de las NET, está la ADNasa humana recombinante (ADNasa rh), que permite degradar las trampas.(15) Estudios, han demostrado la capacidad destructiva de la ADNasa sobre la nucleoproteína del ADN y los complejos inmunitarios, mostrando una reducción de la NETosis, con menos infiltración de neutrófilos y disminuyendo la respuesta inflamatoria. Esto, permite minimizar los efectos de las NET en un proceso patológico, sin afectar la capacidad de los neutrófilos no estimulados, para fagocitar y desgranular, manteniendo así la inmunidad innata.(26,39,40)
Se ha logrado dilucidar el efecto de la ADNasa en la formación de trampas en pacientes con sepsis. Se evidenció que, el tratamiento temprano y simultáneo con ADNasa I y antibióticos, dio como resultado una mejor supervivencia, una reducción de la bacteriemia y protección contra la disfunción orgánica en condiciones sépticas, lo que sugiere una posible terapia de combinación para controlar la NETosis.(39)
Fischer et al.(55) (2021) trataron a 5 pacientes graves con Covid-19, donde todos requerían de oxigenoterapia externa, al momento del tratamiento. Se les administró oxígeno nasal de alto flujo, antes de la terapia con ADNasa rh. Posterior a ello, dentro de los 4 a 15 días del tratamiento, ninguno requirió ingreso en la unidad de cuidados intensivos o ventilación mecánica, y fueron desconectados de la oxigenoterapia, recuperándose. Se logró, demostrar que este fármaco podría ser utilizado como una opción terapéutica eficaz, contra la enfermedad ocasionada por el virus SARS-CoV-2. Si bien, la ADNasa parece una opción terapéutica atractiva, su uso debe evaluarse de manera crítica. En última instancia, la ADNasa ayuda a los fagocitos a degradar las NET al fragmentarlas y, en este proceso puede no eliminar de manera befectiva las histonas o las proteasas de la vasculatura, lo que deja a los pacientes expuestos al daño de tejidos y órganos.(15,40)
Pruebas de identificación de NET
Las metodologías comúnmente utilizadas para la detección de NETosis se han basado en tinción inmunohistoquímica y microscopía de fluorescencia confocal, mediante la identificación de proteínas granulares extruidas unidas a ADN y/o histonas, permitiendo evaluar el punto final de la extrusión nuclear. Sin embargo, poseen bajo rendimiento, son laboriosas, largas y pueden estar sesgadas por el operador.(17,56,57) El uso del ensayo inmunoabsorbente ligado a enzimas (ELISA) permite cuantificar las NET extruidas, enfocándose en la detección de la MPO y NE asociada al ADN. Una limitación de esta estrategia es el mayor riesgo de falsos positivos, dado que la liberación de ADN, también, se produce después de otros procesos, como la necrosis.(17,58)
La citometría de flujo de imágenes multiespectrales de alta velocidad resulta una técnica útil para evaluar la NETosis, de una manera rápida y automatizada. Además, permite cuantificar las etapas del proceso que preceden a la lisis celular, permitiendo diferenciar entre células que sufren NETosis vital versus suicida. Y permite identificar y cuantificar de forma específica la citrulinación de la histona H4 como marcador de NET y su relación con otras alteraciones a nivel nuclear y celular.(57-59)
Fedorov et al.(60,61) (2023) emplearon el contador hematológico de Sysmex y el autoanalizador de imágenes CellaVision, para el estudio de NETosis. Los autores, plantearon que las NET se encontrarían dentro del recuento de células difuminadas o “smudge cells” (SC), una subcategoría de glóbulos blancos. Las SC corresponden clásicamente a linfocitos degenerados (LD), que se pueden presentar en bajo porcentaje, pero que abundan en pacientes con leucemia linfocítica crónica (LLC), en donde debido a la fragilidad de sus linfocitos leucémicos, estos se destruyen al confeccionar el frotis, denominándose células o sombras de Gumprecht. Mediante el CellaVision, analizaron las SC de distintas muestras, distinguiendo a los LD como restos celulares, que no conservaban ningún componente estructural, y a las SC similares a NET, que se presentan como restos sin membrana plasmática perceptible, sin citoplasma intacto, gránulos dispersos, núcleos descondensados y congestionados, y proyecciones de cromatina polarizada que se asemejan a redes de araña. De esta forma, al tener el porcentaje de SC, crearon un perfil de cada tipo celular. Para confirmar los hallazgos, demostraron que las SC similares a NET no están presentes en muestras de sangre normales, y que muestran positividad de NET a la Citometría de flujo y a tinciones específicas de neutrófilos. Además, las muestras con SC similares a NET tienen una señal fluorescente lateral fuerte (SFL) en el recuento de blancos y el diagrama de dispersión de glóbulos rojos nucleados (WNR), lo que representa células con alto contenido de ácido nucleico. En comparación con los pacientes con porcentaje bajo de SC, aquellos con alto porcentaje de SC tienen una incidencia mayor de infecciones bacterianas y virales, como lo es Covid-19 (Figura 4).
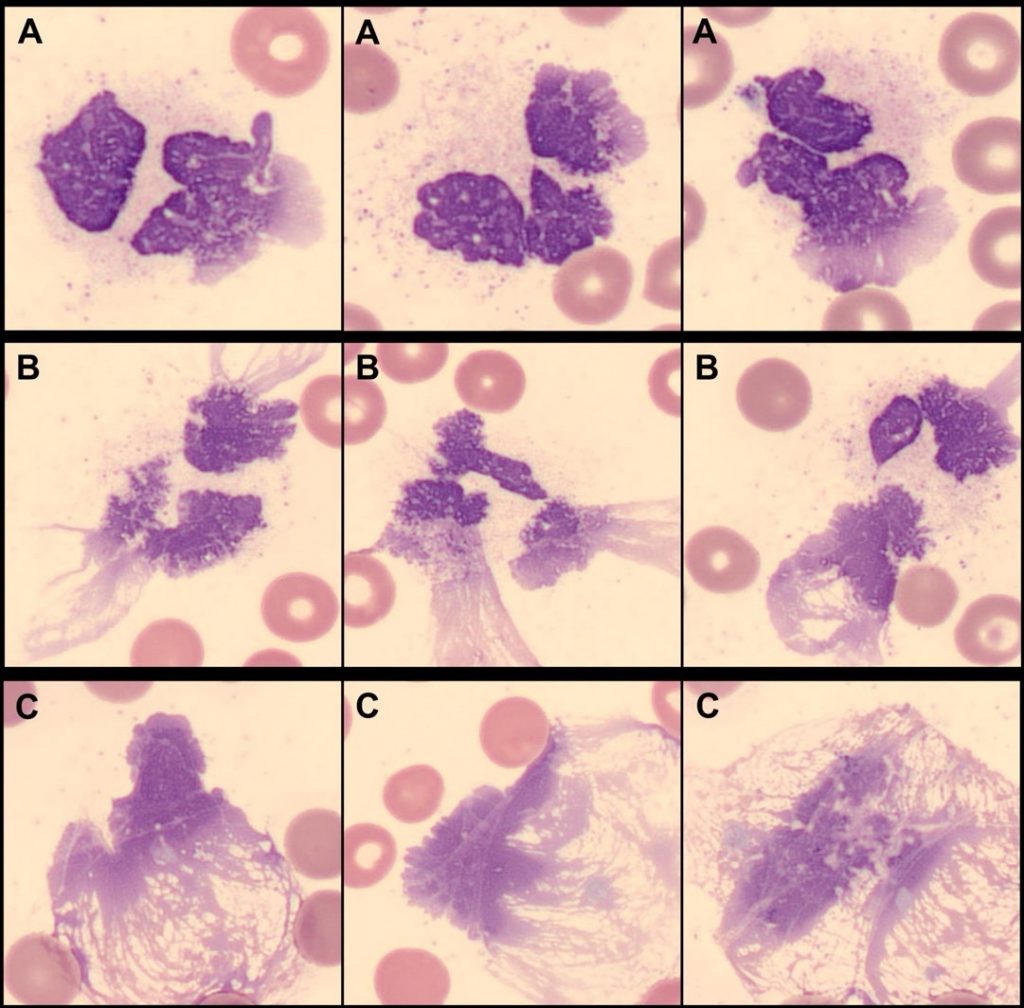
Figura 4
Distintos estadios de formación de NET en pacientes con COVID-19. Imágenes obtenidas con CellaVision DM1200 (Tinción May Grunwald Giemsa aumento 100X).
A) Neutrófilos con citoplasma desarticulado y con desgranulación. En cuanto al núcleo, sus lóbulos tienden a separarse parcial o completamente, la carioteca es cada vez menos definida y la cromatina menos compacta. La descondensación del ADN se evidencia como zonas terminales del núcleo con coloración más clara, que aumentan la superficie celular. B) Citoplasma desarticulado, sin membrana plasmática y con desgranulación. El núcleo se presenta de forma irregular, sin carioteca visible y cromatina laxa. Desde las partes en donde hay mayor descondensación de ADN (zonas más claras), las NET emergen como proyecciones en forma de redes alargadas al exterior de la célula. C) No se distingue citoplasma, debido a la pérdida de la membrana plasmática. El núcleo se presenta irregular y difuso debido a la descondensación considerable del ADN, y las NET abarcan gran parte de la superficie celular.
REFERENCIAS
- Jin Y, Yang H, Ji W, Wu W, Chen S, Zhang W, et al. Virology, epidemiology, pathogenesis, and control of covid-19. Viruses. 2020;12(4):1–17. doi: 10.3390/v12040372.
- Dhama K, Khan S, Tiwari R, Sircar S, Bhat S, Malik YS, et al. Coronavirus Disease 2019–Covid-19. Clin Microbiol Rev. 2020 Sep;33(4):1–48. doi: 10.1128/CMR.00028-20.
- Rahman S, Montero MTV, Rowe K, Kirton R, Kunik F. Epidemiology, pathogenesis, clinical presentations, diagnosis and treatment of Covid-19: a review of current evidence. Expert Rev Clin Pharmacol. 2021;14(5):601–621. doi: 10.1080/17512433.2021.1902303.
- Rothan HA, Byrareddy SN. The epidemiology and pathogenesis of coronavirus disease (Covid-19) outbreak. J Autoimmun. 2020;109:1-4. doi: 10.1016/j.jaut.2020.102433.
- Janiuk K, Jabłońska E, Garley M. Significance of nets formation in Covid-19. Cells. 2021;10(1):1–12. doi: 10.3390/cells10010151.
- Anka AU, Tahir MI, Abubakar SD, Alsabbagh M, Zian Z, Hamedifar H, et al. Coronavirus disease 2019 (Covid-19): An overview of the immunopathology, serological diagnosis and management. Scand J Immunol. 2021;93(4):0–1. doi: 10.1111/sji.12998.
- Mozzini C, Girelli D. The role of Neutrophil Extracellular Traps in Covid-19: Only an hypothesis or a potential new field of research? Thromb Res. 2020;191:26–27. doi: 10.1016/j.thromres.2020.04.031.
- Magán-Fernández A, Rasheed Al-Bakri SM, O’Valle F, Benavides-Reyes C, Abadía-Molina F, Mesa F. Neutrophil Extracellular Traps in Periodontitis. Cells. 2020;9(6):1-18. doi: 10.3390/cells9061494.
- Rosales C. Neutrophil: A cell with many roles in inflammation or several cell types? Front Physiol. 2018;9:1–17. doi: 10.3389/fphys.2018.00113.
- Ackermann M, Anders HJ, Bilyy R, Bowlin GL, Daniel C, De Lorenzo R, et al. Patients with Covid-19: in the dark-NETs of neutrophils. Cell Death Differ. 2021;28(11):3125-3139. doi: 10.1038/s41418-021-00805-z.
- Papayannopoulos V. Neutrophil extracellular traps in immunity and disease. Nat Rev Immunol. 2018;18(2):134–147. doi: 10.1038/nri.2017.105.
- Brinkmann V. Neutrophil Extracellular Traps in the Second Decade. J Innate Immun. 2018;10(5–6):414–421. doi: 10.1159/000489829.
- Agra Cavalcante-Silva LH, Madruga Carvalho DC, de Almeida Lima É, Galvao JG, de França da Silva JS, Marreiro de Sales-Neto J, et al. Neutrophils and Covid-19: The road so far. Int Immunopharmacol. 2021;90:1-7. doi: 10.1016/j.intimp.2020.107233.
- Cesta MC, Zippoli M, Marsiglia C, Gavioli EM, Cremonesi G, Khan A, et al. Neutrophil activation and neutrophil extracellular traps (NETs) in Covid-19 ARDS and immunothrombosis. Eur J Immunol. 2023;53(1):1–10. doi: 10.1002/eji.202250010.
- Ravindran M, Khan MA, Palaniyar N. Neutrophil extracellular trap formation: Physiology, pathology, and pharmacology. Biomolecules. 2019;9(8):1–15. doi: 10.3390/biom9080365.
- Borges L, Pithon-Curi TC, Curi R, Hatanaka E. Covid-19 and Neutrophils: The relationship between hyperinflammation and neutrophil extracellular traps. Mediators Inflamm. 2020;20:1-7. doi: 10.1155/2020/8829674.
- Masuda S, Shimizu S, Matsuo J, Nishibata Y, Kusunoki Y, Hattanda F, et al. Measurement of NET formation in vitro and in vivo by flow cytometry. Cytom Part A. 2017;91(8):1–8. doi: 10.1002/cyto.a.23169.
- Castanheira FVS, Kubes P. Neutrophils and NETs in modulating acute and chronic inflammation. Blood. 2019;133(20):2178–2185. doi: 10.1182/blood-2018-11-844530.
- Delgado-Rizo V, Martínez-Guzmán MA, Iñiguez-Gutierrez L, García-Orozco A, Alvarado-Navarro A, Fafutis-Morris M. Neutrophil extracellular traps and its implications in inflammation: An overview. Front Immunol. 2017;8:1–20. doi: 10.3389/fimmu.2017.00081.
- Barnes BJ, Adrover JM, Baxter-Stoltzfus A, Borczuk A, Cools-Lartigue J, Crawford JM, et al. Targeting potential drivers of Covid-19: Neutrophil extracellular traps. J Exp Med. 2020;217(6):1–7. doi: 10.1084/jem.20200652.
- Lood C, Blanco LP, Purmalek MM, Carmona-Rivera C, De Ravin SS, Smith CK, et al. Neutrophil extracellular traps enriched in oxidized mitochondrial DNA are interferogenic and contribute to lupus-like disease. Nat Med. 2016;22(2):146–153. doi: 10.1038/nm.4027.
- Kenny EF, Herzig A, Krüger R, Muth A, Mondal S, Thompson PR, et al. Diverse stimuli engage different neutrophil extracellular trap pathways. Elife. 2017;6:1–21. doi: 10.7554/eLife.24437.
- Ingelsson B, Söderberg D, Strid T, Söderberg A, Bergh AC, Loitto V, et al. Lymphocytes eject interferogenic mitochondrial DNA webs in response to CpG and non-CpG oligodeoxynucleotides of class C. Proc Natl Acad Sci U S A. 2018;115(3):478–487. doi: 10.1073/pnas.1711950115.
- De Buhr N, Von Köckritz-Blickwede M. How Neutrophil Extracellular Traps Become Visible. J Immunol Res. 2016;16:1-14. doi: 10.1155/2016/4604713.
- Angeletti A, Volpi S, Bruschi M, Lugani F, Vaglio A, Prunotto M, et al. Neutrophil extracellular traps-dnase balance and autoimmunity. Cells. 2021;10(10):1–8. doi: 10.3390/cells10102667.
- Demkow U. Molecular Mechanisms of Neutrophil Extracellular Trap (NETs) Degradation. Int J Mol Sci. 2023;24(5):1-16. doi: 10.3390/ijms24054896.
- Ma Y, Zhang Y, Zhu L. Role of neutrophils in acute viral infection. Immunity, Inflamm Dis. 2021;9(4):1186–1896. doi: 10.1002/iid3.500.
- Schönrich G, Raftery MJ. Neutrophil extracellular traps go viral. Front Immunol. 2016;7(366):1-7. doi: 10.3389/fimmu.2016.00366.
- Zuo Y, Yalavarthi S, Shi H, Gockman K, Zuo M, Madison JA, et al. Neutrophil extracellular traps in Covid-19. JCI Insight. 2020;5(11):1–11. doi: 10.1172/jci.insight.138999.
- Veras FP, Pontelli M, Silva C, Toller-Kawahisa J, de Lima M, Nascimento D, et al. SARS-CoV-2 triggered neutrophil extracellular traps (NETs) mediate Covid-19 pathology. J Exp Med. 2020;217(12):1-15. doi: 10.1084/jem.20201129.
- Wool GD, Miller JL. The Impact of Covid-19 Disease on Platelets and Coagulation. Pathobiology. 2021;88(1):15–27. doi: 10.1159/000512007.
- Colling ME, Kanthi Y. Covid–19-associated coagulopathy: An exploration of mechanisms. Vasc Med (United Kingdom). 2020;25(5):471–478. doi: 10.1177/1358863X20932640.
- Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with Covid-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395:1054–1062. doi: 10.1016/S0140-6736(20)30566-3.
- Zuo Y, Zuo M, Yalavarthi S, Gockman K, Madison JA, Shi H, et al. Neutrophil extracellular traps and thrombosis in Covid-19. J Thromb Thrombolysis. 2021;51(2):446–453. doi: 10.1007/s11239-020-02324-z.
- Jayarangaiah A, Kariyanna PT, Chen X, Jayarangaiah A, Kumar A. Covid-19-Associated Coagulopathy: An Exacerbated Immunothrombosis Response. Clin Appl Thromb. 2020;26:1-11. doi: 10.1177/1076029620943293.
- Blanch-Ruiz MA, Ortega-Luna R, Martínez-Cuesta MÁ, Álvarez Á. The neutrophil secretome as a crucial link between inflammation and thrombosis. Int J Mol Sci. 2021;22(8):1-23. doi: 10.3390/ijms22084170.
- Risitano AM, Mastellos DC, Huber-Lang M, Yancopoulou D, Garlanda C, Ciceri F, et al. Complement as a target in Covid-19? Nat Rev Immunol. 2020;20(6):343–344. doi: 10.1038/s41577-020-0320-7.
- Skendros P, Mitsios A, Chrysanthopoulou A, Mastellos DC, Metallidis S, Rafailidis P, et al. Complement and tissue factor-enriched neutrophil extracellular traps are key drivers in Covid-19 immunothrombosis. J Clin Invest. 2020;130(11):6151-6157. doi: 10.1172/JCI141374.
- Bautista-Becerril B, Campi-Caballero R, Sevilla-Fuentes S, Hernández-Regino LM, Hanono A, Flores-Bustamante A, et al. Immunothrombosis in covid-19: Implications of neutrophil extracellular traps. Biomolecules. 2021;11(5):1–19. doi: 10.3390/biom11050694.
- Blanch-Ruiz MA, Ortega-Luna R, Gómez-García G, Martínez-Cuesta MÁ, Álvarez Á. Role of neutrophil extracellular traps in covid-19 progression: An insight for effective treatment. Biomedicines. 2022;10(1):1–18. doi: 10.3390/biomedicines10010031.
- Keane C, Coalter M, Martin-Loeches I. Immune System Disequilibrium—Neutrophils, Their Extracellular Traps, and Covid-19-Induced Sepsis. Front Med. 2021;8:1–12. doi: 10.3389/fmed.2021.711397.
- Tomar B, Anders HJ, Desai J, Mulay SR. Neutrophils and Neutrophil Extracellular Traps Drive Necroinflammation in Covid-19. Cells. 2020;9(6):1–8. doi: 10.3390/cells9061383.
- Zhu Y, Chen X, Liu X. NETosis and Neutrophil Extracellular Traps in Covid-19: Immunothrombosis and Beyond. Front Immunol. 2022;13:1–11. doi: 10.3389/fimmu.2022.838011.
- Pisareva E, Badiou S, Mihalovičová L, Mirandola A, Pastor B, Kudriavtsev A, et al. Persistence of neutrophil extracellular traps and anticardiolipin auto-antibodies in post-acute phase Covid-19 patients. J Med Virol. 2023;95(1):1–9. doi: 10.1002/jmv.28209.
- Behzadifard M, Soleimani M. NETosis and SARS-CoV-2 infection related thrombosis: a narrative review. Thromb J. 2022;20(13):1–6. doi: 10.1186/s12959-022-00375-1.
- Groff D, Sun A, Ssentongo AE, Ba DM, Parsons N, Poudel GR, et al. Short-term and Long-term Rates of Postacute Sequelae of SARS-CoV-2 Infection: A Systematic Review. JAMA Netw Open. 2021;4(10):1–17. doi: 10.1001/jamanetworkopen.2021.28568.
- Stoian M, Procopiescu B, Șeitan S, Scarlat G. Post-Covid-19 syndrome: Insights into a novel post-infectious systemic disorder. J Med Life. 2023;16(2):195–202. doi: 10.25122/jml-2022-0329.
- Gallegos M, Martino P, Caycho-Rodríguez T, Calandra M, Razumovskiy A, Arias-Gallegos WL, et al. What is post-Covid-19 syndrome? Definition and update. Gac Med Mex. 2022;158(6):442–446. doi: 10.24875/GMM.M22000725.
- Acosta-Ampudia Y, Monsalve DM, Rojas M, Rodriguez Y, Zapata E, Ramirez-Santana C, et al. Persistent Autoimmune Activation and Proinflammatory State in Post-Coronavirus Disease 2019 Syndrome. J Infect Dis. 2022;225(12):2155–2162. doi: 10.1093/infdis/jiac017.
- Taghadosi M, Safarzadeh E, Asgarzadeh A, Roghani SA, Shamsi A, Jalili C, et al. Partners in crime: Autoantibodies complicit in Covid-19 pathogenesis. Rev Med Virol. 2023;33(2):1-17. doi: 10.1002/rmv.2412.
- George PM, Reed A, Desai SR, Devaraj A, Faiez TS, Laverty S, et al. A persistent neutrophil-associated immune signature characterizes post-Covid-19 pulmonary sequelae. Sci Transl Med. 2022;14(671):1-16. doi: 10.1126/scitranslmed.abo5795.
- Pramitasuri TI, Laksmidewi AAAP, Putra IBK, Dalimartha FA. Neutrophil extracellular traps in coronavirus disease-19associated ischemic stroke: A novel avenue in neuroscience. Exp Neurobiol. 2021;30(1):1–12. doi: 10.5607/en20048
- Saini G, Aneja R. Cancer as a prospective sequela of long Covid-19. BioEssays. 2021;43(6):1–5. doi: 10.1002/bies.202000331.
- Zhang Y, Guo L, Dai Q, Shang B, Xiao T, Di X, et al. A signature for pan-cancer prognosis based on neutrophil extracellular traps. J Immunother Cancer. 2022;10(6):1–11. doi: 10.1136/jitc-2021-004210.
- Fisher J, Mohanty T, Karlsson CAQ, Khademi SMH, Malmström E, Frigyesi A, et al. Proteome profiling of recombinant DNase therapy in reducing NETs and aiding recovery in Covid-19 patients. Mol Cell Proteomics. 2021;20:1-16. doi: 10.1016/j.mcpro.2021.100113.
- Zharkova O, Tay SH, Lee HY, Shubhita T, Ong WY, Lateef A, et al. A Flow Cytometry-Based Assay for High-Throughput Detection and Quantification of Neutrophil Extracellular Traps in Mixed Cell Populations. Cytom Part A. 2019;95(3):268–278. doi: 10.1002/cyto.a.23672.
- Gupta S, Chan DW, Zaal KJ, Kaplan MJ. A High-Throughput Real-Time Imaging Technique To Quantify NETosis and Distinguish Mechanisms of Cell Death in Human Neutrophils. J Immunol. 2018;200(2):869–879. doi: 10.4049/jimmunol.1700905.
- Elsherif L, Sciaky N, Metts CA, Modasshir M, Rekleitis I, Burris CA, et al. Machine Learning to Quantitate Neutrophil NETosis. Sci Rep. 2019;9(16891):1–12. doi: 10.1038/s41598-019-53202-5.
- Rebernick R, Fahmy L, Glover C, Bawadekar M, Shim D, Holmes CL, et al. DNA Area and NETosis Analysis (DANA): A High-Throughput Method to Quantify Neutrophil Extracellular Traps in Fluorescent Microscope Images. Biol Proced Online. 2018;20(1):1–9. doi: 10.1186/s12575-018-0072-y.
- Fedorov K, Barouqa M, Yin D, Kushnir M, Billett HH, Reyes Gil M. Identifying Neutrophil Extracellular Traps (NETs) in Blood Samples Using Peripheral Smear Autoanalyzers. Life. 2023;13(3):1–14. doi: 10.3390/life13030623.
- Susman D, Price R, Kotchetkov R. Lymphocytosis with Smudge Cells Is Not Equivalent to Chronic Lymphocytic Leukemia. Case Rep Oncol. 2021;14(2):950–956. doi: 10.1159/000516748.
Correspondência
Felipe Ignacio Garrido
E-mail: [email protected]
