Estudo microbiológico de amostras de água provenientes de farmácias e de centrais de materiais e esterilização hospitalares
Microbiological study of water samples from pharmacies and hospital material and sterilization centers
Bianca Stüker1, Rosiéli Martini1, Rita Denise Niederauer Weiss1, Vanessa Teixeira Kunz Paraginski1, Barbara Charlotte Bach1
1Universidade Federal de Santa Maria, Departamento de Microbiologia e Parasitologia – Santa Maria, Rio Grande do Sul, Brasil
Recebido em 01/12/2021
Aprovado em 20/04/2022
DOI: 10.21877/2448-3877.202200004
INTRODUÇÃO
A água é a matéria-prima de maior utilização na produção de várias formas farmacêuticas, sendo também utilizada para a limpeza e esterilização dos materiais utilizados durante as técnicas de manipulação. Além disso, é amplamente usada nas Centrais de Materiais e Esterilização (CME) hospitalares para limpeza e esterilização de superfícies, equipamentos e utensílios.(1)
É também considerada um dos principais meios de transmissão de microrganismos em farmácias e hospitais, que são os principais Centros de Saúde. A presença destes microrganismos na água pode provocar diversos problemas graves de saúde para a população, pois causam diferentes doenças infecciosas.(2)
Nos Centros de Saúde, a água denominada potável é utilizada nos processos iniciais de limpeza e também para a obtenção de águas com maior grau de pureza. A maioria dos processos que utiliza água no âmbito hospitalar e farmacêutico requer tratamentos adicionais desta água potável mediante diferentes processos de purificação, como a destilação, deionização, troca iônica, osmose reversa, entre outros. Estes procedimentos devem se guiar por um controle de qualidade periódico para garantir que o sistema de purificação esteja adequado e que a água obtida tenha boa qualidade.(3)
Em busca dessa boa qualidade da água, realiza-se o controle microbiológico. Este controle, bem como os limites bacterianos para as amostras de água purificada de uso em farmácias são definidos pela Farmacopeia Brasileira, edição em vigor.(3) Já para as águas utilizadas em CME hospitalares, a Resolução RDC nº 15, de 15 de março de 2012, que dispõe sobre os requisitos de boas práticas para o processamento de produtos para saúde e dá outras providências, define que a água utilizada para enxágue destes produtos deve atender aos padrões de potabilidade e para os produtos considerados críticos, o enxágue deve ser realizado com água purificada.(4) Os limites bacterianos para esta água de CME, que pode ser potável e/ou purificada, seguem as recomendações da Association for the Advancement of Medical Instrumentation (AAMI).(4,5)
Estes documentos aqui citados orientam que, tanto para as amostras de águas de uso farmacêutico como de CME hospitalar, devem ser feitas as contagens de bactérias heterotróficas (BH), de coliformes totais (CT) e coliformes termotolerantes (CTe) ou fecais (CF), assim como a verificação da presença de Escherichia coli e de Pseudomonas sp. Para se obter um resultado favorável da qualidade microbiológica da água purificada para uso farmacêutico, a contagem de BH não deve ultrapassar 1×10² Unidades Formadoras de Colônia por mililitro (UFC/mL) (≤ 100 UFC/mL). E para a água utilizada nas CME hospitalares a contagem de BH deve ser inferior a 2×10² UFC/mL (< 200 UFC/mL). Além disso, bactérias do grupo coliformes devem estar ausentes, bem como E. coli e bactérias do gênero Pseudomonas.(3,5)
As BH normalmente são definidas como microrganismos que requerem carbono orgânico como fonte de nutrientes e que são capazes de fornecer informações sobre a qualidade microbiológica da água de uma forma ampla.(6) Já os CT são bactérias Gram-negativas, não esporogênicos, aeróbios ou aeróbios facultativos, fermentadores de lactose com produção de gás. São bactérias que ocorrem no ambiente, originárias do trato intestinal de humanos e de animais de sangue quente. E os CTe também fermentam a lactose, produzem gás e são indicadores confirmatórios de contaminação fecal, tendo como principal representante a bactéria E. coli, entre outras.(7-9)
A bactéria Pseudomonas aeruginosa é considerada um bacilo Gram-negativo não fermentador de glicose (BGN-NF), aeróbico, não formador de esporos e pertencente à Família Pseudomonadaceae.(10,11) Em humanos comporta-se como patógeno oportunista, permanecendo em tecidos quando há quebra de barreiras naturais ou perda da imunidade. No entanto, em algumas situações, faz parte da flora normal de indivíduos sadios, e é considerado um dos principais agentes causadores de infecções hospitalares no Brasil.(12)
Assim, o presente estudo teve por finalidade verificar a qualidade microbiológica de amostras de água provenientes de farmácias e de Centrais de Materiais e Esterilização Hospitalares.
MATERIAIS E MÉTODOS
Coleta das Amostras e Local do Estudo
As amostras foram coletadas pelos responsáveis pelo controle da qualidade da água de cada farmácia e hospital, seguindo as orientações de coleta e armazenamento fornecidas pela equipe do Laboratório de Análises Microbiológicas (LabMicro), conforme as recomendações da Farmacopeia Brasileira(3) e AAMI(5). As coletas foram efetuadas em recipientes de vidro borossilicato estéreis ou bolsas/frascos plásticos estéreis apropriados para o uso microbiológico. O volume da amostra, em torno de 100mL, foi suficiente para realizar todas as análises necessárias e o recipiente permitiu a homogeneização antes da realização das técnicas.
Os testes microbiológicos foram realizados nas amostras em até duas horas após a coleta. Quando não foi possível proceder o teste neste intervalo, devido ao envio tardio da amostra após a coleta ao laboratório, esta, de acordo com o responsável pela coleta, foi mantida em temperatura de refrigeração na faixa de 2°C a 8°C. No entanto, as análises foram executadas dentro do período de 24 horas após a coleta, a fim de manter as características microbiológicas da amostra.
As análises foram realizadas no LabMicro, localizado no Departamento de Microbiologia e Parasitologia (DeMiP), do Centro de Ciências da Saúde (CCS), da Universidade Federal de Santa Maria (UFSM). Estas amostras de água foram oriundas de farmácias e de CME hospitalares, provenientes de Santa Maria e região. A pesquisa foi efetuada durante o período de quatro anos, de janeiro de 2016 a dezembro de 2019. Este estudo foi realizado a partir de um projeto de extensão intitulado “Investigação de Microrganismos Indicadores Biológicos de Qualidade, Higiene e Segurança Alimentar em Santa Maria e Região”.
Meios Utilizados e Técnicas Empregadas
Antes do início das análises microbiológicas, para as amostras que eram oriundas de rede de abastecimento ou de poço artesiano com cloração, procedeu-se a neutralização dos agentes desinfetantes com uma solução de tiossulfato de sódio (0,1mL de uma solução a 3% neutraliza acima de 5mg/L de cloro residual em uma amostra de 120mL). Assim foi possível garantir uma recuperação adequada dos microrganismos possivelmente presentes. Para as diferentes amostras foram realizadas a contagem de BH em placas de Petri contendo ágar padrão contagem (PCA), nas quais foram semeadas alíquotas de 0,1mL da amostra pura e de cada diluição realizada. Após, foram incubadas por um período de 24 a 48 horas em estufa bacteriológica na temperatura de 35 ± 0,2ºC. O resultado foi expresso pela média obtida das três diferentes semeaduras, em UFC/mL. Para a análise de CT e CTe, os materiais utilizados foram caldo laurel sulfato (CLS), caldo verde brilhante (CVB) e caldo escherichia coli (CEC), seguindo a técnica dos tubos múltiplos e determinação do Número Mais Provável (NMP) por mililitro (mL) de amostra, segundo a American Public Health Association (APHA).(7,13)
Para todas as amostras de água, foram realizadas as diluições decimais seriadas da seguinte maneira: da amostra pura foi transferido assepticamente 1mL da amostra para um tubo contendo 9mL da salina tamponada (diluição 10-1); posteriormente, foi transferido 1mL desta diluição para um outro tubo contendo novamente 9mL de salina tamponada (diluição 10-2). Também da amostra pura e de cada uma das diluições, foi semeado 1mL em três diferentes tubos contendo CLS, com tubos de Durhan invertidos no seu interior. Após a semeadura os tubos foram incubados por um período de 24 a 48 horas em estufa bacteriológica na temperatura de 36,5ºC ± 0,2ºC.
A seguir, realizou-se a leitura, e dos tubos em que ocorreu crescimento com produção de gás (observada pela presença de bolhas nos tubos de Durhan), foram transferidas alíquotas, através de alça de platina, para tubos contendo CVB, também com tubos de Durhan invertidos, e incubados novamente nas mesmas condições, para contagem de CT. Os tubos de CVB considerados positivos foram semeados em tubos com CEC, com Durhan invertidos, para contagem de CTe e incubados pelo mesmo período, porém a uma temperatura de 45ºC ± 0,2ºC. De cada um destes tubos com crescimento e produção de gás, foi semeada uma alça do conteúdo em ágar eosina azul de metileno (EMB Oxoid®), para isolamento de colônias características de E. coli, sendo a presença destas confirmada através de testes bioquímicos.
A estimativa do número de coliformes foi feita pela associação dos tubos positivos (crescimento com produção de gás) e negativos com base na tabela do NMP.(13) E para P. aeruginosa e demais bactérias do gênero Pseudomonas, foram utilizadas placas de Petri contendo ágar cetrimide e posteriores testes bioquímicos para identificação.(14,15)
RESULTADOS E DISCUSSÃO
Durante o período do estudo, um total de 185 amostras de água foi analisado, sendo 111 (60%) amostras de água purificada para uso farmacêutico e 74 (40%) amostras de água para uso hospitalar em CME. Entre as águas purificadas de uso farmacêutico, 106 amostras foram obtidas pelo processo de destilação e 5 por osmose reversa.
Todas as amostras de água de uso hospitalar foram oriundas de CME, sendo 59 amostras de água potável obtidas através de rede de abastecimento, 11 amostras de água purificada por osmose reversa, e 4 amostras de água potável provenientes de poços artesianos, das quais 2 com tratamento de cloro.
Em relação ao total das análises microbiológicas realizadas em cada ano do estudo, em 2019 foi efetuado o maior índice de análises, 34,8% (65/185). O Gráfico 1 demonstra as análises microbiológicas em cada ano do estudo e a distribuição das amostras conforme a sua finalidade de uso.
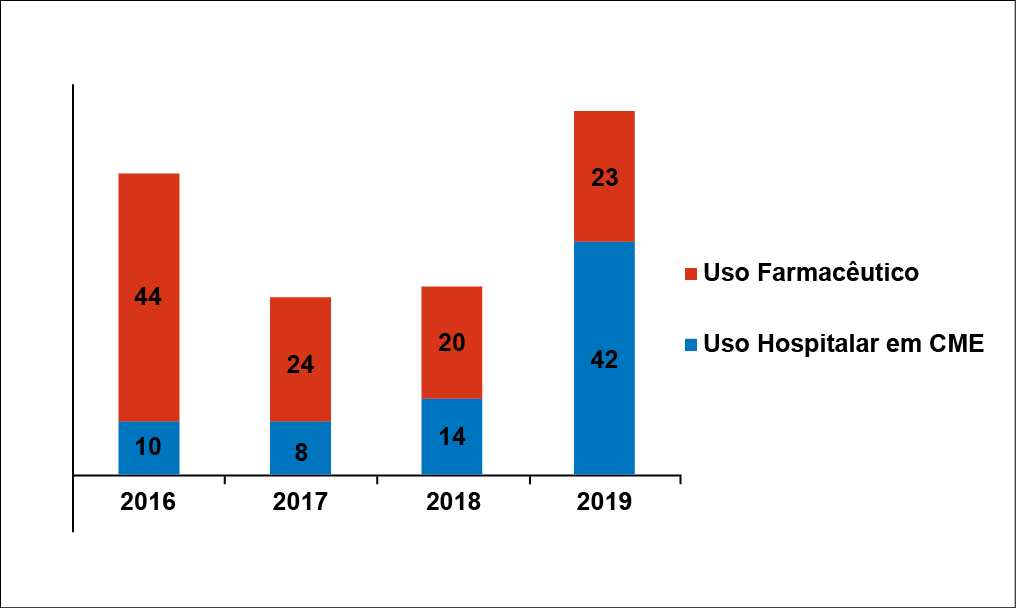
Gráfico 1
Distribuição das 185 amostras analisadas nos quatro anos de estudo, conforme a sua finalidade de uso
Fonte: Autoras (2020)
De acordo com o total de amostras de águas analisadas neste estudo, verificou-se uma maior busca (111/185) por análises microbiológicas de amostras de águas de uso farmacêutico. Isto se deve, principalmente, à recomendação que o controle microbiológico deve ser feito, no mínimo, mensalmente, pela Resolução RDC nº 67, de 08 de outubro de 2007, a qual dispõe sobre Boas Práticas de Manipulação de Preparações Magistrais e Oficinais para Uso Humano em Farmácias.(16)
Já para as amostras de água utilizadas em CME hospitalares, observou-se um menor número (74/185) de análises, quando comparado ao número de análises de amostras de água de uso em farmácias, podendo ser justificado em razão da determinação da AAMI, que recomenda que o controle microbiológico seja realizado uma vez ao mês ou pelo menos trimestralmente. Assim, diante da periodicidade das análises realizadas no laboratório, pode-se afirmar que alguns hospitais atendidos seguem a orientação de análise trimestral.(5)
Esta associação dedica-se a promover o desenvolvimento, o gerenciamento e o uso de tecnologia de saúde com segurança e eficácia. É considerada a principal fonte de padrões de consenso para o setor de dispositivos médicos, além de informações práticas, suporte e orientação para profissionais de tecnologia e esterilização em saúde. As informações referentes às águas de CME hospitalares encontram-se em um Relatório de Informações Técnicas (TIR) denominado Water for the Reprocessing of Medical Devices, que orienta a seleção e a manutenção de água com qualidade efetiva e adequada para reprocessar os dispositivos médicos. Fornece diretrizes para a seleção da qualidade da água necessária para o reprocessamento de várias categorias de dispositivos médicos e o tratamento, a distribuição e o armazenamento da água de equipamentos, bem como os procedimentos de controle para monitoramento da qualidade da água e estratégias para controle bacteriano e ambientais.(5)
O padrão de potabilidade microbiológico satisfatório, obtido a partir de todas as análises realizadas neste estudo, foi de 64,9% (120/185). Analisando separadamente conforme sua finalidade, para as águas de uso farmacêutico uma taxa de 67,6% (75/111) foi satisfatória e para a CME, 60,8% (45/74). Observa-se uma mínima diferença de satisfação entre as duas diferentes classes de água do estudo, sendo que as amostras de uso em farmácias mostraram um índice satisfatório um pouco melhor.
Andrade e colaboradores, em 2005, efetuaram um estudo em amostras de água purificada para fins farmacêuticos, obtidas de Farmácias de Manipulação em Goiânia (Goiás), e evidenciaram que 44% das amostras estavam em desacordo com as especificações farmacopeicas, por possuírem valores de BH superiores aos limites estabelecidos.(17) Este estudo demonstrou um índice de contaminação bacteriana maior quando comparado às águas obtidas de farmácia do presente estudo (32,4%). Já uma pesquisa por Moreno e colaboradores, em 2011, em amostras de água purificada oriundas de Farmácias Magistrais, em São José do Rio Preto (São Paulo), demonstrou que 20% das amostras analisadas não estavam em conformidade com os parâmetros microbiológicos recomendados,(1) demonstrando um menor índice de contaminação microbiana quando comparado as águas de uso farmacêutico desta pesquisa (32,4%).
No que tange às amostras insatisfatórias (36/111) de água para uso farmacêutico, estas apresentaram apenas contagem de BH superior ao limite estabelecido pela Farmacopeia Brasileira(3) e nenhuma amostra demonstrou crescimento de Coliformes e/ou E. coli e/ou Pseudomonas sp., diferentemente das pesquisas realizadas por: Andrade e colaboradores, em 2005, que detectaram a presença de E. coli em uma amostra.(17)
Moreno e colaboradores, em 2011, demonstraram uma porcentagem de 16,7% de presença de CT e CTe, e em 10% a presença de P. aeruginosa.(1) Dos Santos e colaboradores, em 2014, realizaram um estudo de qualidade microbiológica em águas purificadas de uso farmacêutico em diferentes cidades de São Paulo e relataram uma taxa de 4,56% (34/744) de contaminação por CT.(18)
A maior contagem de BH verificada nas amostras de água com fins farmacêuticos, foi de 1 x 105 UFC/mL, e nesta mesma amostra identificou-se a presença de um bacilo gram-negativo não fermentador de glicose, identificado como Acinetobacter sp. Estes bacilos são responsáveis por diversas infecções, como pneumonias, septicemias, infecções urinárias e meningites, principalmente em pacientes imunocomprometidos que estão internados nas unidades de terapia intensiva (UTI). É considerada uma bactéria oportunista de grande importância nas infecções nosocomiais e possui uma excelente capacidade de adquirir resistência aos antibióticos. Evidências sugerem que Acinetobacter baumannii adquirida em infecções hospitalares prolongam o tempo de internação, bem como os custos subsequentes de assistência médica.(19)
Analisando os processos de obtenção das diferentes águas purificadas, de uso farmacêutico, a porcentagem insatisfatória foi maior nas amostras obtidas pelo processo de osmose reversa (60% – 3/5), quando correlacionado ao processo de destilação (31,1% – 33/106). Em comparação com a destilação, o uso unicamente da osmose reversa pode aumentar o risco de contaminação microbiológica, devido principalmente à alta probabilidade de formação de biofilme nas membranas.(20)
A osmose reversa remove 90% a 99% da maioria dos contaminantes, mas a eficiência no processo está relacionada a diversos fatores como o tipo de polímero da membrana utilizada, temperatura, pH e a pressão diferencial ao longo da membrana.(3) Muitas vezes os equipamentos de purificação de água são considerados uma fonte crítica de contaminação microbiológica, pois procedimentos de limpeza e sanitização inadequados também possibilitam a formação de biofilme. Assim, estas comunidades de bactérias instalam um ciclo contínuo de crescimento, a partir de compostos orgânicos, que são os próprios nutrientes para os microrganismos.(21) Além disso, entre os métodos de purificação, a destilação já é consagrada pelo seu longo histórico de confiabilidade.(3)
Em relação ao total das 74 amostras de águas provenientes das CME hospitalares, observamos um percentual satisfatório em 60,8% (45/74). No que se refere às amostras consideradas insatisfatórias, o índice encontrado foi de 39,2% (29/74). Nestas amostras, a maior contagem de BH foi de 5,9 x 104 UFC/mL, sendo que somente uma destas amostras de água apresentou coliformes e E. coli, correspondendo a 1,3% (1/74), esta amostra era oriunda da rede de abastecimento. No que se refere à contaminação microbiológica por bactérias do gênero coliformes, um estudo realizado por Barros e colaboradores, em 2015, em 70 amostras de águas de diferentes pontos da rede hidráulica de um hospital público em Minas Gerais, sendo 7 de CME, demonstrou que o índice de contaminação por CT destas CME foi 42,8% (3/7),(22) índice muito maior quando comparado ao identificado no presente estudo, 1,3% (1/74). Já em estudo realizado por De Souza e colaboradores, em 2016, em um hospital de Minas Gerais em amostras de águas de diferentes pontos, incluindo água para enxágue final de roupas hospitalares, a presença de CT e CTe foi negativa em todas as análises.(23)
No que tange à presença de Pseudomonas sp. neste estudo, este microrganismo não foi encontrado, o que difere do estudo realizado por Barros e colaboradores, em 2015, que identificou a presença de Pseudomonas aeruginosa além de Acinetobacter spp. e Klebsiella oxytoca nas amostras de CME.(22) De Souza e colaboradores, em 2016, também evidenciaram a presença de bactérias do grupo Pseudomonas em água utilizada para enxágue final de roupas hospitalares.(23)
As amostras de águas utilizadas nas CME hospitalares provenientes de poços artesianos sem tratamento apresentaram a maior porcentagem insatisfatória (2/2 – 100%), seguido das amostras de osmose reversa (6/11 – 54,5%). Já nas que possuíam tratamento com cloro (rede de abastecimento e poços artesianos tratados), a menor porcentagem foi de 34,4% (21/61) de amostras insatisfatórias. Este resultado reforça a importância do tratamento prévio da água com cloro. Apesar de não ter se mostrado completamente eficaz, a cloração, em parte, pode ter sido responsável por este menor índice de contaminação. Como relatado por Bello e colaboradores, o processo de cloração é eficiente na inativação de bactérias, resultando em uma melhor qualidade microbiológica da água.(24)
O controle de qualidade da água está intimamente relacionado aos exames periódicos que monitoram a sua potabilidade, principalmente para verificar as condições da água que é recebida nos estabelecimentos, bem como averiguar o funcionamento e a eficácia do sistema de tratamento interno escolhido.(25) A importância deste controle periódico e contínuo pode ser ratificada a partir dos resultados do estudo de Cavassin e colaboradores, que verificaram o papel dos filtros como fonte de contaminação da água em ambientes hospitalares. A água ofertada pela rede disponível no hospital manteve sempre níveis excelentes em relação aos teores de cloro e da qualidade microbiológica. Mas, após filtração, um índice de 19,23% dos filtros testados passou a apresentar alguma contaminação por BH, mesmo dentro dos limites estabelecidos como aceitáveis.(26)
A partir do estudo de Cavassin e colaboradores, pode-se ratificar os dados do presente estudo em relação aos processos de filtração/purificação, pois as amostras provenientes de rede de abastecimento obtiveram um menor índice insatisfatório (33,9%), quando comparadas às amostras oriundas do processo de osmose reversa (54,5%). Este valor elevado pode estar relacionado à conservação e ao funcionamento insatisfatórios do sistema de purificação da água.
Diversas pesquisas demonstram a qualidade microbiológica da água utilizada nas CME hospitalares, principalmente através de análises dos equipamentos e utensílios manipulados neste setor. Crema e colaboradores realizaram uma pesquisa em instrumentos usados em cirurgia laparoscópica (trocáteres, pinças e bisturi ultrassônico) e processados na CME de um Hospital de Minas Gerais, totalizando 1016 culturas destes instrumentos. Nenhuma amostra demonstrou crescimento de microrganismos, evidenciando assim a boa qualidade microbiológica da água utilizada nestas CME.(27)
CONCLUSÃO
Os resultados obtidos neste estudo são de suma importância para a saúde de toda a população. A partir destes dados foi possível verificar que 64,9% do total de amostras foi considerado satisfatório, sendo este um bom índice de potabilidade. Um percentual de 35,1% foi considerado insatisfatório, devido principalmente à contagem de BH superiores aos limites estabelecidos pelas legislações. Obteve-se um pequeno índice (0,5%) de amostras com a presença de coliformes e E. coli. Além disso, nenhuma amostra apresentou contaminação por bactérias do gênero Pseudomonas.
No entanto, mesmo com o menor índice de amostras insatisfatórias, sabe-se da importância e da necessidade da qualidade microbiológica em amostras de águas, principalmente quando utilizadas em centros de saúde. Pode-se também afirmar que análises microbiológicas mais frequentes resultam em índices de qualidade microbiológica melhor, como foi encontrado nas amostras de águas de uso farmacêutico. Além disso, proporciona uma maior rapidez na busca e desfecho da contaminação, resultando assim na obtenção de um resultado excelente.
SUPORTE FINANCEIRO
Fundação de Apoio à Tecnologia e Ciência (FATEC) da Universidade Federal de Santa Maria (UFSM), Santa Maria, Rio Grande do Sul (SM/RS).
Pró-Reitoria de Assuntos Estudantis (PRAE) da Universidade Federal de Santa Maria (UFSM), Santa Maria, Rio Grande do Sul (SM/RS).
AGRADECIMENTOS
A toda a equipe do Laboratório de Análises Microbiológicas (LabMicro) e aos demais componentes do Departamento de Microbiologia e Parasitologia (DeMiP) da Universidade Federal de Santa Maria (UFSM), Santa Maria, Rio Grande do Sul (SM/RS).
REFERÊNCIAS
- Moreno AH, Tozo GCG, Salgado HRN. Avaliação da qualidade da água purificada em farmácias magistrais da região de São José do Rio Preto, SP. Revista de Ciências Farmacêuticas Básica e Aplicada, Araraquara, v. 32, n. 1, p. 69-75, 2011.
- Dias RS et al. Infecção hospitalar – IH – causas múltiplas e fatores de risco associados a microrganismos de veiculação hídrica. Revista Tecer, Belo Horizonte, v. 1, n. 1, p. 54-60, dez. 2008.
- BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Farmacopeia Brasileira. 6ª ed. Brasília: ANVISA, 2019. v. 1.
- BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução RDC nº 15, de 15 de março de 2012. Dispõe sobre os requisitos de boas práticas para o processamento de produtos para a saúde e dá outras providências. Brasília: Ministério da Saúde, 2012.
- ASSOCIATION FOR THE ADVANCEMENT OF MEDICAL INSTRUMENTATION. Water for the reprocessing of medical devices. AAMI TIR34:2007. Arlington: AAMI, 2007.
- Guerra NMM et al. Ocorrência de Pseudomonas aeruginosa em água potável. Acta Scientiarum Biological Sciences, Maringá, v. 28, n. 1, p. 13-18, jan./mar. 2006.
- Da Silva N et al. Manual de métodos de análise microbiológica de alimentos e água. 4ª ed. São Paulo: Varela, 2010.
- Da Silva CC et al. Análises do perfil bacteriológico das águas do Ribeirão das Antas, no município de Cambuí-MG, como indicador de saúde e impacto ambiental. Revista Agrogeoambiental, Pouso Alegre, n. 2, p. 61-66, 2014.
- De Sá, MF. Dinâmica da população de coliformes após a aplicação de dejetos de suínos no solo e durante a sua compostagem automatizada. 2012. 81 p. Dissertação (Mestrado em Ciência do Solo, Área de Concentração Biodinâmica e Manejo do Solo). Universidade Federal de Santa Maria, Santa Maria, 2012.
- Fuentefria DB et al. Pseudomonas aeruginosa: disseminação de resistência antimicrobiana em efluente hospitalar e água superficial. Revista da Sociedade Brasileira de Medicina Tropical, Uberaba, v. 41, n. 5, p. 470-473, 2008.
- Tortora GJ, Funke BR, Case CL. Microbiologia. 8ª ed. Porto Alegre: Artmed, 2005.
- Stheling EG, Leite DS, Silveira WD. Molecular typing and biological characteristics of Pseudomonas aeruginosa isolated from cystic fibrosis patients in Brazil. Brazilian Society of Infectious Diseases, São Paulo, v. 14, n. 5, p. 462-467, 2010.
- AMERICAN PUBLIC HEALTH ASSOCIATION. Standart methods for the examination of the wather and wastewater. 21. ed. Washington: APHA, 2005.
- Koneman EW et al. Diagnóstico Microbiológico. 6ª ed. Rio de Janeiro: MEDSI, 2008.
- Oplustil CP et al. Procedimentos básicos em microbiologia clínica. 3. ed. São Paulo: Sarvier, 2010.
- BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução RDC nº 67, de 08 de outubro de 2007. Dispõe sobre Boas Práticas de Manipulação de Preparações Magistrais e Oficinais para Uso Humano em Farmácias. Brasília: Ministério da Saúde, 2007.
- Andrade FRO et al. Análise microbiológica de matérias primas e formulações farmacêuticas magistrais. Revista Eletrônica de Farmácia, Goiânia, v. 2, n. 2, p. 38-44, 2005.
- Dos Santos NV et al. Avaliação da qualidade de águas purificadas utilizadas em farmácias de manipulação. Revista de Ciências Farmacêuticas Básica e Aplicada, Araraquara, v. 35, n. 3, p. 419-23, set. 2014.
- Scarcella ACA, Scarcella ASA, Beretta ALRZ. Infecção relacionada à assistência à saúde associada a Acinetobacter baumannii: revisão de literatura. Revista Brasileira de Análises Clínicas, Araras, v. 49, n. 1, p. 18-21, 2017.
- BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Guia de Qualidade para Sistemas de Purificação de Água para Uso Farmacêutico. Brasília: ANVISA, 2013.
- BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Consulta Pública n° 312, de 20 de fevereiro de 2017. O Diretor da Agência Nacional de Vigilância Sanitária, no uso da atribuição que lhe foi conferida pela Portaria nº 211, de 6 de fevereiro de 2017, […]. Brasília: ANVISA, 2017.
- Barros B et al. Presença de coliformes totais na rede hidráulica de um hospital público de ensino no estado de Minas Gerais, Brasil. Revista UNINGÁ Review, Maringá, v. 21, n. 3, p. 05-07, jan./mar. 2015.
- De Souza GHB et al. Pseudomonas aeruginosa em hospital da microrregião de Ouro Preto, Minas Gerais, Brasil. Infarma – Ciências Farmacêuticas, Ouro Preto, v. 28, p. 234-240, 2016.
- Bello ARC, Angelis DF, Domingos RN. Ultrasound efficiency in relation to sodium hypochlorite and filtration adsorption in microbial elimination in a water treatment plant. Brazilian Archives of Biology and Technology, Curitiba, v. 48, n. 5, p. 739-745, set. 2005.
- De Souza RQ, Graziano KU. Qualidade da água: fatos e mitos! Revista SOBECC, São Paulo, v. 21, n. 4, p. 210-212, out./dez. 2016.
- Cavassin ED et al. Análise microbiológica de água filtrada por filtros domésticos em ambiente hospitalar. Semina: Ciências Biológicas e da Saúde. v. 20/21, n. 2, p. 49-56, jun. 1999/2000.
- Crema E et al. Comparison of methods for the sterilization of instruments used for laparoscopic surgery. Brazilian Journal of Videoendoscopic Surgery, Rio de Janeiro, v. 3, n. 3, p. 134-138, jul./set. 2010.
Correspondência
Rosiéli Martini
E-mail: [email protected]
