Indicadores do monitoramento interno da qualidade dos exames citopatológicos do Laboratório Clínico da Pontifícia Universidade Católica de Goiás (PUC-GO)
Internal quality monitoring indicators of citopathological exams of Clinical Laboratory of Goias Pontifical Catholic University (PUC-GO)
Amanda Christina de Paula1
Nathany Gomes de Souza1
Thairine Carrijo do Prado1
Andrea Alves Ribeiro2
1Acadêmica do Curso de Biomedicina da Pontifícia Universidade Católica de Goiás (PUC-GO). Goiânia, GO, Brasil.
2Biomédica, Doutora em Medicina tropical área de concentração (Microbiologia), Professora Assistente I- Pontifícia Universidade Católica (PUC-GO), Goiânia, GO, Brasil.
Pontifícia Universidade Católica de Goiás (PUC-GO).
Conflito de interesse: Sem conflito de interesses
Suporte financeiro: Todos os gastos para a elaboração deste manuscrito foram custeados pelo autor responsável.
Artigo recebido em 15/09/2016
Artigo aprovado em 05/01/2017
DOI: 10.21877/2448-3877.201700534
Resumo
Objetivo: Avaliar a qualidade dos exames citopatológicos do Laboratório Clínico da Pontifícia Universidade Católica de Goiás (LAC-PUC-GO), de acordo com os indicadores da qualidade da fase analítica para o exame citopatológico, utilizando os índices que avaliam a qualidade, de acordo com o recomendado pelo Ministério da Saúde. Métodos: Os dados foram coletados no DATASUS através do SISCOLO alimentado pelo banco de dados do LAC-PUC-GO no período de janeiro de 2009 a dezembro de 2013. Os índices dos diagnósticos citopatológicos foram realizados utilizando Manual de Gestão da Qualidade para Laboratório de Citopatologia. Resultados: Do total de 7.015 exames citopatológicos realizados no período de janeiro de 2009 a dezembro de 2013, 99,5% foram classificados como satisfatórios, 91,8% exames citopatológicos negativos, 0,5% insatisfatórios e 7,7% exames alterados. O índice de positividade analisado no período de cinco anos alcançou uma média de 7%. O percentual de exames compatíveis com HSIL apresentou uma média de 1% e encontra-se dentro do esperado pelos índices de rastreamento até 2%; o percentual ASC/satisfatório foi baixo em 2009 (3%) e 2010 (2%) e alto em 2013 (7%), enquanto que a média de todos os anos foi de 4%; já a média da razão do percentual de ASC/SIL dois manteve-se dentro dos limites recomendados. Conclusão: O monitoramento interno da qualidade é uma ferramenta usada no auxílio diagnóstico, garantindo assim uma maior acurácia dos exames citopatológicos.
Palavras-chave
Neoplasias do colo do útero; Controle de qualidade; Indicadores de qualidade; Assistência à Saúde
INTRODUÇÃO
O câncer do colo uterino (CCU) é o terceiro tumor mais frequente na população feminina, atrás apenas do câncer de mama e do colorretal. A estimativa em 2014, segundo o Ministério da Saúde, foi de 15.590 novos casos, sendo a quarta causa de morte de mulheres por câncer no Brasil.(1)
Alguns tipos oncogênicos do Papilomavírus Humano (HPV) geralmente provocam lesões precursoras para o câncer do colo do útero (CCU), as quais são conhecidas como lesões intraepiteliais cervicais.(2,3) Para detectar essas lesões, a principal estratégia é fazer o diagnóstico precoce, pois o CCU é uma doença de evolução lenta, que varia de 10 a 20 anos para que a invasão se estabeleça.(4)
Conhecido internacionalmente, o exame preventivo (Papanicolaou) é o método mais barato, adequado e prático para o rastreamento do CCU. É preconizado que as mulheres com idade entre 25 a 64 anos e que já entraram em atividade sexual sejam submetidas ao exame.(1)
As lesões precursoras, quando diagnosticadas precocemente, apresentam um grande potencial de cura, chegando a 100%, sendo 80% dos casos tratados em âmbito ambulatorial.(5) Por isso, as ações de rastreamento e detecção precoce são tão importantes.
A realização de exames citopatológicos do colo uterino envolve profissionais qualificados e, levando em consideração a subjetividade do método, necessita de experiência e conhecimento do escrutinador.(6)
Os resultados citológicos falsos negativos (FN) variam de 6% a 56% e ocorrem na fase pré-analítica (erros de coleta) e analítica (erro de escrutínio e interpretação do diagnóstico).(7,8) Segundo dados da literatura, aproximadamente 2% a 62% dos resultados FN são atribuídos a causas anteriores à sua entrada no laboratório, erros na coleta do material, nos procedimentos de coloração e análise microscópica, no escrutínio do esfregaço ou na interpretação dos diagnósticos.
De acordo com a legislação brasileira (RDC 302/2005), os programas de controle interno e externo da qualidade devem ser implementados e executados nos laboratórios clínicos, com a finalidade de detectar erros diagnósticos, contemplando todas as etapas do processo, sobretudo no que se refere à diminuição de resultados FN. Portanto, esses programas visam melhorar a acurácia e a confiabilidade dos laudos citopatológicos.(10)
O Monitoramento Interno da Qualidade (MIQ) corresponde a um sistema de controle da qualidade dos exames realizados através da avaliação de critérios que monitoram as amostras quando são enviadas ao laboratório até a emissão do laudo citopatológico. Isto permite a identificação de falhas, proporcionando melhorias e medidas corretivas.(6)
Os métodos de avaliação recomendados pela Portaria Nº 3.388, de 30 de dezembro de 2013, que redefinem a qualificação nacional em citopatologia na prevenção do câncer do colo do útero, são chamado de QualiCito. No âmbito da Rede de Atenção à Saúde das Pessoas com Doenças Crônicas é realizada a revisão aleatória de 10% dos esfregaços negativos; revisão rápida de 100% dos esfregaços negativos e insatisfatórios; pré-escrutínio rápido de todos os esfregaços e revisão dos esfregaços selecionados com base em critérios clínicos de risco, contidos no Manual de Gestão da Qualidade para Laboratório de Citopatologia.(11,12)
De acordo com controle interno da qualidade, na revisão com base em critérios clínicos, revisão rápida de 100%, o re-escrutínio ou o pré-escrutínio rápido apresentaram melhor desempenho, pois foram também avaliados, posteriormente, em exames de rotina.(13) Em países como Canadá e Reino Unido, a revisão rápida de 100% das lâminas é feita nos laboratórios rotineiramente. Este método foi descrito, primeiramente, por Baker e Melcher, os quais mostraram que é possível detectar núcleos anormais de 30 a 60 segundos.(14) Em Goiás, o Laboratório Rômulo Rocha da Faculdade de Farmácia da Universidade Federal de Goiás (UFG) também realiza igualmente este método de MIQ.(13)
O controle externo da qualidade aplicado em laboratórios da rede pública é praticado pelos Laboratórios de Monitoramento Externo de Qualidade (LabMEQ).(15) Este serviço tem como finalidade padronizar os critérios citomorfológicos, reduzir o percentual de resultados FN, Falso-Positivos (FP) e, consequentemente, melhorar os indicadores de qualidade dos exames e promover a educação continuada de profissionais que atuam na realização dos exames citopatológicos.(16)
O objetivo desse trabalho foi avaliar a qualidade dos exames citopatológicos do Laboratório Clínico da Pontifícia Universidade Católica de Goiás (LAC-PUC-GO), de acordo com os indicadores da qualidade da fase analítica para o exame citopatológico, utilizando os índices que avaliam a qualidade, de acordo com o recomendado pelo Ministério da Saúde.
MATERIAL E MÉTODOS
Trata-se de um estudo retrospectivo analítico e descritivo, no qual os dados foram coletados no DATASUS, através do Sistema de Informações do Câncer (SISCOLO),(17,18) alimentados pelo banco de dados do LAC-PUC-GO. As relações entre os diagnósticos citopatológicos foram realizadas de acordo com o preconizado no Manual de Gestão da Qualidade para Laboratório de Citopatologia, estratificados no período de janeiro de 2009 a dezembro de 2013, visando analisar o controle de qualidade, por meio dos indicadores do MIQ.(12)
O presente estudo verificou o percentual de exames positivos em relação ao total de exames satisfatórios e aplicou os cálculos com base nas variáveis necessárias. Os indicadores foram selecionados por meio do SISCAN, utilizando quatro desses.(19) Seguem descritas suas fórmulas:
1- Índice de positividade (IP):
Fórmula:
Nº de exames alterados em determinado local e ano x 100
Total de exames satisfatórios
Foi determinada uma classificação do percentual de positividade:
– Muito baixa: abaixo de 2,0%
– Baixa: Entre 2,0% a 2,9%
– Esperada: entre 3,0% e 10%
– Acima do esperado: acima de 10%, deve se considerar que os prestadores podem atender serviços de referência secundária em patologia do colo do útero
2- Percentual de exames compatíveis com lesão intraepitelial de alto grau (HSIL):
A Lesão intraepitelial escamosa de alto grau (HSIL) representam as lesões verdadeiramente precursoras do câncer do colo do útero, ou seja, o percentual de exames compatíveis com HSIL. É um indicador que mede a capacidade de detecção de lesões precursoras. É esperado um resultado de até 2,0%.
Fórmula:
N° de exames HSIL x 100
Total de exames satisfatórios
3- Percentual de exames compatíveis com atipias de significado indeterminado em células
escamosas (ASC):
As Células Escamosas Atípicas (ASC) compõem um caso de dúvida diagnóstica, no qual os achados citológicos, caracterizados pela presença de alterações celulares, são insuficientes para o diagnóstico de lesão intraepitelial. Este indicador mede indiretamente a qualidade dessa etapa, mas impossibilita a avaliação isolada da qualidade do processo. Espera-se que, no máximo 4% a 5% de todos os exames sejam classificados como ASC. Valores superiores merecem avaliação e podem ser úteis para a orientação de reciclagem junto aos profissionais do laboratório.
Fórmula:
Nº de exames com ASC-US e ASC-H x 100
Total de exames satisfatórios
4 – Razão Atipias escamosas de significado indeterminado/Lesões intraepiteliais escamosas
(Razão ASC/SIL):
A razão ASC/SIL permite identificar o baixo desempenho profissional no rastreamento. Recomenda-se uma relação ASC/SIL não superior a três.
Fórmula:
Nº de ex. compatíveis com ASC-US e ASC-H
Nº de exames com LSIL e HSIL
Ética
Este trabalho foi devidamente aprovado pelo Comitê de Ética em Pesquisa da PUC- Goiás, segundo o protocolo número 235.376.
RESULTADOS
O Laboratório Clínico da PUC-GO realizou, no âmbito do Sistema Único de Saúde (SUS), um total de 7.015 exames citopatológicos, no período de janeiro de 2009 a dezembro de 2013. Desses, 99,5% (6/981/7015) foram classificados como satisfatórios. Neste período, observaram-se 91,8% exames citopatológicos negativos, 0,5% insatisfatórios e 7,7% exames alterados (Tabela I).
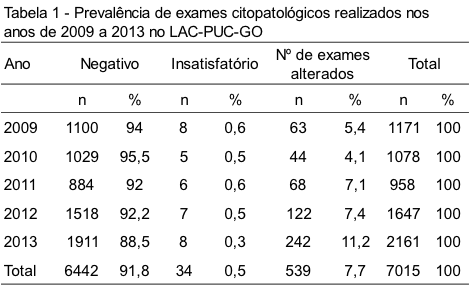
A Tabela 2 demonstra a prevalência das anormalidades citológicas, entre 2009 a 2013. Com um total de 7,7% (539/7015) de alterações observadas no período analisado, dessas anormalidades, foram obtidos 2,5% (179/7015) de células escamosas atípicas de significado indeterminado, possivelmente não neoplásicas (ASC-US – Atypical Squamous Cells of Undetermined Significance), 2,3% (165/7015) de células escamosas atípicas de significado indeterminado, não sendo possível afastar lesão de alto grau (ASC-H) 1,7% (124/7015) de lesão intraepitelial de baixo grau (LSIL – Low Grade Squameus Intraepithelial Lesion) e as principais lesões precursoras de CCU, lesão intraepitelial de alto grau, compreendendo neoplasias intraepiteliais cervicais graus II e III (HSIL – Squamous Intraepithelial Lesion). A prevalência foi de 0,9% (65/7015) dos casos. Os diagnósticos de células glandulares atípicas, possivelmente neoplásicas (AGC-NEO – Atypical Endocervical Cells) corresponderam a 0,2% (4/7015) dos casos e 0,1% (2/7015) de carcinomas escamosos foram encontrados. A prevalência de casos insatisfatórios foi de 0,5% (34/7015).
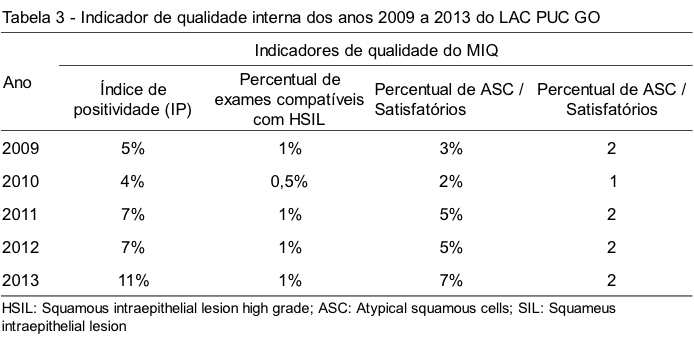
A Tabela 3 apresenta os indicadores do MIQ. No ano de 2013, observou-se um IP de 11%, este resultado encontra-se acima do recomendado para os laboratórios que prestam serviços para o SUS. No entanto, o IP analisado neste laboratório no período de cinco anos alcançou uma média de 7%.
O percentual de exames compatíveis com HSIL apresentou uma média de 1%, encontrando-se dentro do esperado pelos índices de rastreamento até 2%. A porcentagem de ASC/satisfatório encontrou-se baixa, nos anos de 2009 (3%) e 2010 (2%) e alta, em 2013 (7%), enquanto que a média de todos os anos foi de 4%. Já a média da razão do percentual de ASC/SIL foi 2. mantendo-se dentro dos limites recomendados pelo MS/ INCA, de até três.
DISCUSSÃO
Os resultados deste estudo mostram que, no decorrer dos anos, houve um aumento do IP: 5%, 4%, 7% e 11% respectivamente.
A média do IP dos cinco anos estudados foi de 7%. Esse índice encontra-se dentro dos valores previstos e propostos pelo MS/INCA que é de 3% a 10% para laboratórios credenciados ao SUS, segundo a Portaria Nº 3.388, de 30 de Dezembro de 2013, conceituado como laboratório tipo I, ou seja, laboratórios públicos e privados que prestam serviço ao SUS.(11)
Já no ano de 2013, este índice foi de 11%, o qual se apresentou acima do esperado. Esse aumento pode ter sido em decorrência da introdução de novos postos de atendimento da região noroeste de Goiânia (PSF Vila Mutirão) e da região Sul (CSF Jardim Mariliza, CSF Parque Atheneu e CSF Ville de France), o que pode ter colaborado para uma mudança no perfil das mulheres atendidas, consequentemente, um maior número de exames citopatológicos e alterações encontradas.
A partir do ano de 2007, o laboratório em estudo passou a realizar o MEQ, enviando todas as lâminas positivas, insatisfatórias e 10% das negativas selecionadas aleatoriamente ao LABMEQ e a participar do programa de educação continuada.(15) De acordo com os relatórios enviados mensalmente pelo LABMEQ, percebe-se que a porcentagem de exames citopatológicos discordantes é baixa, enquanto que os exames citopatológicos considerados concordantes obtiveram uma média de 85,6%, 87,2%, 95,9%, 86,9% e 90,6% nos anos de 2009 a 2013. Esses dados comprovam o aumento no IP devido à uniformização dos critérios citomorfológicos e aprimoramento dos citologistas.
No Brasil, a maioria dos laboratórios de citopatologia apresenta IP abaixo do esperado, caracterizando uma não consolidação do controle interno de qualidade nesses serviços. Bortolon et al., 2012, em seu estudo, concluiu que 53% dos laboratórios brasileiros apresentam IP abaixo de 2%. Na região centro-oeste, cerca 39% dos laboratórios apresentaram positividade “muito baixa” e maior do que 3%. Em Goiás, 38% dos laboratórios apresentaram IP <2%, 18% com IP entre 2% a 2,9% e 44% dos prestadores com IP >3%.
A razão entre ASC e os exames satisfatórios foi de 7% no ano de 2013, acima do limite recomendado, que é de 4% a 5%. Devido a esse elevado percentual, deve ser realizada nova análise para verificar a causa do erro e retificar esse aumento, que pode influenciar nos resultados dos índices de qualidade do MIQ.
De acordo com a história natural do CCU, esses erros têm impacto negativo menor devido ao alto percentual de regressão espontânea, cerca de 70% a 90 %.(20) As estatísticas mundiais relatam que aproximadamente 10% das pacientes com alterações citológicas indeterminadas irão desenvolver lesões intraepiteliais de alto grau, onde é necessário o uso da colposcopia e do exame histopatológico.(21)
O laboratório em estudo tem como MIQ a revisão dos esfregaços selecionados com base em critérios clínicos de risco e 10% das amostras negativas aleatórias, todas as alteradas e insatisfatórias. As amostras que tiverem discordância interobservadores são avaliadas por um terceiro citopatologista e estes entram em consenso para que seja liberado o diagnóstico final. Os métodos de avaliação são recomendados pelo e Qualicito e Manual de Gestão da Qualidade.(11,12) Esse mesmo método é utilizado no Instituto Nacional do Câncer – INCA, apresentando, no período de julho de 2013 a junho de 2014, a média do IP de 7,2%, sendo recomendado para laboratórios de grande rotina.(2) Cada laboratório faz a escolha do melhor método de acordo com a quantidade de exames realizados na rotina e pelo número de profissionais.
O MIQ é essencial para garantia de qualidade em citopatologia, resultando em uma melhor eficácia para a abordagem das questões em educação continuada, o que leva à obtenção de indicadores confiáveis que atendam às normas estabelecidas pela Qualicito e pela literatura nacional e internacional.(2,11)
De fato, tanto a incidência quanto a mortalidade por CCU podem ser reduzidas com programas de rastreamento organizado, ativos e bem gerenciados. Uma expressiva redução na morbimortalidade por essa doença foi alcançada, nos países desenvolvidos, após a implantação de programas de rastreamento de base populacional, a partir de 1950 e 1960.(22) Os países que implantaram esse programa reduziram a incidência da doença para menos de 10 casos por 100 mil mulheres por ano.(23)
CONCLUSÃO
Em face dos resultados, o MIQ é uma ferramenta de auxílio diagnóstico, evitando erros na fase analítica, através da revisão de no mínimo 10% dos negativos e todos os exames alterados e insatisfatórios, por mais de um profissional, garantindo, assim, uma maior acurácia dos exames citopatológicos. No entanto, é de fundamental importância manter uma vigilância regular da qualidade da coleta das amostras cervicais, seu processamento e análise. Vale ressaltar que o MEQ como parte integrante da estratégia de garantia e melhoria contínua da qualidade em citopatologia, com finalidade de certificação da realização dos exames citopatológicos, reduzindo, dessa maneira, o percentual de casos FN e FP; assim como os programas de educação continuada para a uniformização dos critérios citomorfológicos entre os citologistas.
Agradecimentos
Agradecemos à equipe técnica do Laboratório Clínico da PUC Goiás. Agradecemos à Drª. Andrea Alves Ribeiro pelo suporte, pelas correções e incentivos.
Abstract
Objective: To evaluate the quality of the cytopathological exams of the Clinical Laboratory of the Pontifical Catholic University of Goiás (LAC-PUC-GO), according to the quality indicators of the analytical phase for the cytopathological examination, using the indexes that evaluate the quality, according to the Recommended by the Ministry of Health. Methods: The data were collected in DATASUS through SISCOLO fed by the LAC-PUC-GO database from January 2009 to December 2013. The cytopathological diagnosis indices were performed using a Quality Management Manual for Cytopathology Laboratory. Results: A total of 7.015 cytological examinations from January 2009 to December 2013, these 99,5% were classified as satisfactory 91.8% negative cytopathology, 0.5% unsatisfactory and 7,7% abnormal tests. The positive rates analyzed in the five-year period reached an average of 7%. The percentage of exams compatible with HSIL averaged 1%, is in line with expectations by tracking rates up to 2%, the ASC/satisfactory percentage was lower in 2009 (3%) and 2010 (2%) and high in 2013 (7%), while the average of all years was 4%, as the average ratio of the percentage of ASC/SIL two is within the recommended limits. Conclusion: The internal quality monitoring It is a tool used for the diagnosis, thus ensuring greater accuracy of cervical screening
Keywords
Uterine Cervical Neoplasms; Quality Control; Quality Indicators; Health Care
REFERÊNCIAS
- Ministério da Saúde. Brasil. Instituto Nacional de Câncer José Alencar Gomes da Silva. Coordenação-Geral de Prevenção e Vigilância. Estimativa 2015: incidência de câncer no Brasil. Rio de Janeiro; 2015.
- Araujo Jr. MLC, Santana DA, Almeida LB, Quintana SBS, Silva GRF, Fonseca RCSP. Quality in cytopathology: an analysis of the internal quality monitoring indicators of the Instituto Nacional de Câncer. J. Bras. Patol. Med. Lab. 2015, Apr 51(2):102-107. Available from: http://www.scielo.br/scielo.php?script=sci_arttext&pid= S1676-24442015000200102&lng=en.http://doi.org/10.5935/1676-2444.20150018.
- Pinho AA, Mattos MCFI. Validade da citologia, cervicovaginal na detecção de lesões pré-neoplásicas e neoplásicas de colo de útero. J Bras Patol Med Lab. 2002 July;38:225-31.
- Manrique EJC, Souza NLA; Tavares, SBN, Zeferino LC, Amaral, RG. Desempenho da metodologia de revisão rápida de 100% em esfregaços citopatológicos do colo do útero com e sem informações clínicas.Rev Inst Adolfo Lutz. 2012; 71(1): 172-7.
- Brasil. Ministério da Saúde. Prevenção do Câncer do Colo do Útero. Manual Técnico para Laboratórios. 2002; Brasília, DF, 19 p.
- Bortolon PC, Silva MAF, Corrêa FM, Dias MBK, Knupp VMAO, Assis M, Claro IB. Avaliação da Qualidade dos Laboratórios de Citopatologia do Colo do Útero no Brasil Revista Brasileira de Cancerologia 2012; 58(3): 435-44
- Halford JA, Wright RG, Ditchmen EJ. Quality assurance in cervical cytology screening. Comparison of rapid rescreening and the PAPNET Testing System. Acta Cytol. 1997 Jan-Feb;41(1):79-81.
- Pias AA, Vargas VRA. Avaliação dos exames citológicos de papanicolaou com células epiteliais atípicas e respectivos exames colposcópicos com relação aos exames histopatológicos. RBAC. 2009;41(2):155-60.
- Amaral RG, Ribeiro AA, Miranda FAD, Tavares N, Lindany N, Souza A, Albuquerque P. Fatores que podem comprometer a qualidade dos exames citopatológicos no rastreamento do câncer do colo do útero. Public Health. 2006;38(1): 2004-06.
- Agência Nacional de Vigilância Sanitária. Resolução-RDC nº 302, de 13 de outubro de 2005. Dispõe sobre Regulamento Técnico para funcionamento de Laboratórios Clínicos. Diário Oficial da União, Brasília, DF, 14 out. 2005. Seção 1, p. 33.
- Ministério da Saúde. Portaria nº 3.388, de 30 de dezembro de 2013. Institui a Qualificação Nacional em Citopatologia na prevenção do câncer do colo do útero (QualiCito), no âmbito da Rede de Atenção à Saúde das Pessoas com Doenças Crônicas. Diário Oficial da República Federativa do Brasil. Brasília (DF); 2013 December 13. Seção 1, p. 42.
- Ministério da Saúde. Brasil. Instituto Nacional de Câncer José Alencar Gomes da Silva. Coordenação-Geral de Prevenção e Vigilância. Divisão de Detecção Precoce e Apoio à Organização de Rede. 2012; Manual de gestão da qualidade para laboratório de citopatologia. Rio de Janeiro: INCA.
- Manrique EJC. A revisão rápida de 100% é eficiente na detecção de resultados falsos-negativos dos exames citopatológicos cervicais e varia com a adequabilidade da amostra: uma experiência no Brasil. Rev Bras Ginecol Obstet. Rio de Janeiro. 2007;29(8):402-07.
- Tavares SB, Alves de Sousa NL, Manrique EJ, Pinheiro de Albuquerque ZB, Zeferino LC, Amaral RG. Improvement in the routine screening of cervical smears: A study using rapid prescreening and 100% rapid review as internal quality control methods. Cancer Cytopathol. 2011 Dec 25;119(6):367-76.
- Laboratório de Monitoramento Externo de Qualidade (LabMeq) [Internet]. [Acesso em setembro de 2015]. http://www.ead.farmacia. ufg.br.
- Ázara CZS, Araújo ES, Magalhães JC, Amaral RG. Avaliação dos Indicadores da Qualidade dos Exames Citopatológicos do Colo do Útero de Laboratórios Privados do Estado de Goiás Credenciados pelo Sistema Único de Saúde Assessment of Quality Indicators in Cervical Cytopathology Tests from Unified Health Sy. Rev. bras. cancerol; 60(4):295-303, out.-dez.2014.
- Ministério da Saúde (BR). Portal da Saúde: Datasus [Internet]. Brasília: Ministério da Saúde; [Acesso em março de 2015]. Disponível em: http://www.datasus.gov.br/DATASUS/index.php.
- Ministério da Saúde (BR). Sistema de informação do controle do câncer de mama (SISMAMA) e do câncer do colo do útero (SISCOLO): manual gerencial/Instituto Nacional de Câncer. Coordenação Geral de Ações Estratégicas. Divisão de Apoio à Rede de Atenção Oncológica [Internet]. 2011[acesso em junho de 2014]. Disponível em:http://bvsms.saude.gov.br/bvs/publicacoes/inca/Sistema_de_informacao_do_controle_do_cancer_de_mama.pdf.
- Ministério da Saúde (BR). Sistema de informação do câncer (SISCAN): manual preliminar de apoio á implantação/ Instituto Nacional de Câncer. Coordenação Geral de Prevenção e Vigilância. Divisão de Detecção Precoce e Apoio à Organização de Rede [Internet]. 2013. Disponível em: (http://bvsms.saude.gov.br/bvs/controle_cancer) e no Portal do INCA (http://www.inca.gov.br).
- Derchain SFM, Longatto Filho AL, Syrjanen KJ. Neoplasia intra-epitelial cervical: Diagnóstico e Tratamento. Rev Bras Ginecol Obstet. 2005;27(7):425-33.
- Koss LG, Gompel C. Introdução à citopatologia ginecológica com correlações histológicas e clínicas. Roca. 2006; v. 261, n. 5: 137-43.
- Ferlay J. Cancer incidence and mortality worldwide. Lyon: International Agency for Research on Cancer, 2010. (IARC Câncer Base, n. 10).
- Geneva: World Health Organization; 2007. Prevention. Cancer control: knowledge into action: WHO guide for effective programmes, module 2 2007; p. 42-8.
Correspondência
Thairine Carrijo do Prado
Avenida Manchester – 00
Condomínio Metrópoles apto. 301-p
Bairro Jardim Novo Mundo
74703-010 – Goiânia – GO
