Influência do tempo de centrifugação em testes de coagulação: tempo de protrombina e tempo de tromboplastina parcial
Influence of the centrifuge time in coagulation tests: prothrombin time and partial thromboplastin time
Bianca da Rosa Oliveira1
Bruno Ribeiro Cruz2
Mariane de Faria Moss2
Danielle Cristyane Kalva Borato3
1Graduanda em Farmácia pela Universidade Estadual de Ponta Grossa (UEPG), Ponta Grossa – PR, Brasil.
2Doutor em Medicina pela Universidade Federal de São Paulo (UNIFESP), SP – Brasil.
3Professor da Universidade Estadual de Ponta Grossa (UEPG), Ponta Grossa – PR, Brasil.
4Mestre em Ciências Farmacêuticas pela Universidade Estadual de Ponta Grossa – Professora da Universidade Estadual de Ponta Grossa (UEPG). Ponta Grossa – PR, Brasil.
Instituição: Universidade Estadual de Ponta Grossa (UEPG), Ponta Grossa – PR, Brasil.
Conflitos de interesse: não há conflitos de interesse.
Suporte financeiro: financiamento próprio.
Recebido em 16/10/2018
Artigo aprovado em 23/01/2019
DOI: 10.21877/2448-3877.201900782
INTRODUÇÃO
O sistema de coagulação é frequentemente investigado por meio de dois testes clássicos de coagulação in vitro, o tempo de protrombina (TP) e o tempo de tromboplastina parcial (TTP), considerados testes de triagem.(1) Enquanto que o TP avalia a ação dos fatores da via extrínseca da coagulação, o TTP avalia a ação dos fatores da via intrínseca da coagulação.(1)
Os cuidados pré-analíticos, como a centrifugação da amostra, são críticos para manter a integridade da amostra e a qualidade dos resultados dos testes de coagulação.(2) Desta forma, a padronização do tempo de centrifugação na fase pré-analítica é essencial para obtenção de resultados confiáveis dos testes de coagulação.(3) Como a centrifugação é um dos passos mais críticos na fase pré-analítica, tempos de centrifugação reduzidos ou aumentados podem ser prejudiciais para confiabilidade dos resultados laboratoriais.(4,5)
Por exemplo, o tempo abaixo de 15 minutos para rotina de coagulação pode resultar em um plasma incompleto de separação, com elementos de células sanguíneas residuais, especialmente plaquetas, prejudicando os resultados.(5) Desta forma, os testes de coagulação devem ser realizados em amostras de plasma pobre em plaquetas, com concentração de plaquetas no plasma inferior a 10.000/mm3.(2,6) Entretanto, procedimentos laboratoriais confiáveis para reduzir o tempo necessário de centrifugação podem melhorar o tempo de entrega dos resultados dos testes de coagulação.(5)
A recomendação atual do Clinical Laboratory Standards Institute (CLSI) é a realização de centrifugação em 1500 g por 15 minutos, à temperatura ambiente.(6) Porém, estudos têm demonstrado que tempos de centrifugação inferior a 15 minutos não prejudicam a avaliação do TP e TTP.(5,7,8)
Desta forma, não existe um consenso na literatura atual com relação ao tempo de centrifugação para TP e TTP. Portanto, o objetivo deste estudo foi analisar os resultados dos testes de coagulação: TP e TTP em diferentes tempos de centrifugação da amostra biológica, com relação ao protocolo padrão estabelecido pelo CLSI.
MATERIAL E MÉTODOS
Os voluntários desta pesquisa foram recrutados do LABCENTER Laboratório de Análises Clínicas Limitada, em Itararé no estado de São Paulo. As amostras biológicas de sangue venoso foram coletadas conforme procedimento padrão por farmacêutico-bioquímico habilitado. Para todas as coletas, foi respeitado um período máximo de 30 segundos de garroteamento, sendo excluídas as coletas traumáticas.
O sangue total foi distribuído em dois tubos primários de 3,5 mL com anticoagulante Citrato de Sódio 3,2% Vacuette® (Greiner Bio-One, Kremsmünster, Áustria), respeitando o volume recomendado, garantindo a proporção adequada entre a amostra e o anticoagulante (nove partes de sangue total para uma de anticoagulante). Posteriormente, as amostras foram homogeneizadas por inversão suave de cinco a oito vezes. Em seguida, foi verificado o hematócrito dos voluntários no contador hematológico ABX Pentra 60® (Horiba ABX Diagnostics, Montpellier, França) e as amostras com hematócrito superior a 55% foram excluídas da análise, uma vez que podem ocasionar falsos prolongamentos no TP, TTP e fatores de coagulação. Também foram excluídas amostras com hemólise e lipêmicas.
O sangue total dos tubos de Citrato de sódio 3,2% foram divididos em cinco alíquotas de 1 mL cada, em tubos de plástico. A primeira alíquota foi imediatamente centrifugada (ALB 32/15 CS 3.5, INBRAS®, Indústria Brasileira de Equipamentos para Saúde, São Paulo, Brasil) de acordo com o protocolo padrão (1.500 g por 15 min à temperatura ambiente), utilizando o freio automático.
Em seguida, quatro alíquotas foram centrifugadas em diferentes tempos: um, dois, cinco e dez minutos com a velocidade de referência (1.500 g). Após a centrifugação, os tubos foram mantidos tampados até a execução do teste, para evitar a mudança do pH da amostra, que pode interferir nos resultados.
Todas as alíquotas foram imediatamente analisadas em aparelho automatizado (CLOTimer® CLOT Produtos para Coagulação, São Paulo, Brasil), para os testes de coagulação TP e TTP, utilizando os seguintes reagentes TP: Wierner lab Soluplastin (Wierner lab, Rosario, Argentina); TTP: Wama diagnóstica (WAMA Diagnóstica, São Carlos, Brasil).
As alíquotas de plasma foram analisadas no contador hematológico ABX Pentra 60® (Horiba ABX Diagnostics, Montpellier, França) com relação aos parâmetros: contagem de eritrócitos, leucócitos totais e contagem de plaquetas.
Na análise estatística, foi avaliada a normalidade dos dados pelo teste de Shapiro-Wilk. Os dados demonstraram distribuição normal e foram apresentados em valores médios. Para avaliar os resultados dos diferentes tempos de centrifugação em relação ao protocolo padrão (1.500 g por 15 min à temperatura ambiente) foi utilizado o teste de T-student para amostras pareadas e a concordância entre os resultados foi verificada pelo método de Bland & Altman. Além disso, foi analisado se os limites encontrados apresentam diferenças aceitáveis do ponto de vista clínico, sendo considerado como viés máximo permitido, de acordo com os “Critério de Ricós” ± 2,0% para o TP e ± 2,3% para o TTP.(9) Em todas as análises, o nível de significância foi pré-fixado em p<0,05. Os dados foram analisados pelo programa MedCalc®, versão 11.4.2.0 (MedCalc Software, Mariakerke, Bélgica).
ÉTICA
Os participantes foram devidamente informados sobre os métodos e objetivos deste estudo e, após concordarem, assinaram um termo de consentimento livre e esclarecido. Este estudo foi aprovado pelo Comitê de Ética em Pesquisa da Universidade Estadual de Ponta Grossa (UEPG), parecer N° 1.339.496. Esta pesquisa foi realizada em conformidade com a Declaração de Helsinki.
RESULTADOS
Foram selecionadas dez amostras biológicas de sangue venoso de indivíduos saudáveis com idade média de 36,5 ± 14,7 anos, sendo quatro (40%) do sexo masculino e seis (60%) do sexo feminino.
Os resultados dos valores médios obtidos para os testes de coagulação TP e TTP, de acordo com os tempos de centrifugação, estão representados na Figura 1 A e B; respectivamente.
Para o TP observou-se diferença estatística em relação ao protocolo padrão (1.500 g por 15 min à temperatura ambiente), para os tempos de centrifugação de dez minutos (p=0,005), cinco minutos (p=0,001), dois minutos (p=0,001) e um minuto (p<0,001), enquanto que para o TTP não foi observada diferença estatística para os valores médios no tempo de dez minutos de centrifugação (p=0,062); porém, em cinco minutos (p=0,010), dois minutos (p=0,030) e um minuto (p=0,018) observou-se aumento significativo dos valores.
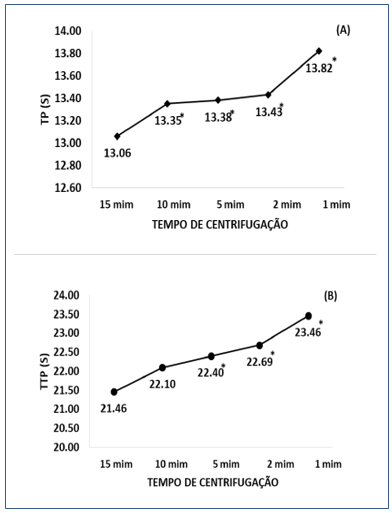 Figura 1. Comparação dos valores médios obtidos para o teste tempo de protrombina (A) e tempo de tromboplastina parcial (B) nos tempos de centrifugação 10,5, 2 e 1 minuto em relação ao protocolo padrão (1500 x g por 15 min à temperatura ambiente). Teste de T-student para amostras pareadas. *diferença estatística p<0,05.
Figura 1. Comparação dos valores médios obtidos para o teste tempo de protrombina (A) e tempo de tromboplastina parcial (B) nos tempos de centrifugação 10,5, 2 e 1 minuto em relação ao protocolo padrão (1500 x g por 15 min à temperatura ambiente). Teste de T-student para amostras pareadas. *diferença estatística p<0,05.
Os valores máximos dos elementos residuais: eritrócitos, leucócitos e plaquetas encontrados em todas as amostras analisadas de acordo com os tempos de centrifugação estão representados na Figura 2. No tempo de centrifugação de 15 minutos não foram encontradas células residuais nas amostras analisadas (Figura 2).
Observou-se presença de eritrócitos em cinco amostras apenas no menor tempo de centrifugação, de um minuto (Figura 2 A). Uma amostra apresentou 100 leucócitos/mm3 nos tempos de dez e cinco minutos de centrifugação. No tempo de dois minutos, cinco amostras apresentaram 100 leucócitos/mm3, enquanto que no tempo de um minuto observou-se contagem de 400 leucócitos/mm3 em uma dessas amostras (Figura 2 B).
A contagem de plaquetas foi o parâmetro que apresentou maior alteração nos tempos de centrifugação de cinco, dois e um minuto (Figura 2 C). Em cinco minutos de centrifugação duas amostras apresentaram 1.000 plaquetas/mm3 (Figura 2 C). Enquanto que em dois minutos observou-se grande oscilação dos valores em sete amostras, com valor mínimo detectado de 1.000 plaquetas/mm3 e valor máximo de 17.000 plaquetas/mm3 (Figura 2 C). No tempo de um minuto de centrifugação houve oscilação da contagem em todas as amostras com valor mínimo de 3.000 plaquetas/mm3 para 97.000 plaquetas/mm3 (Figura 2 C).
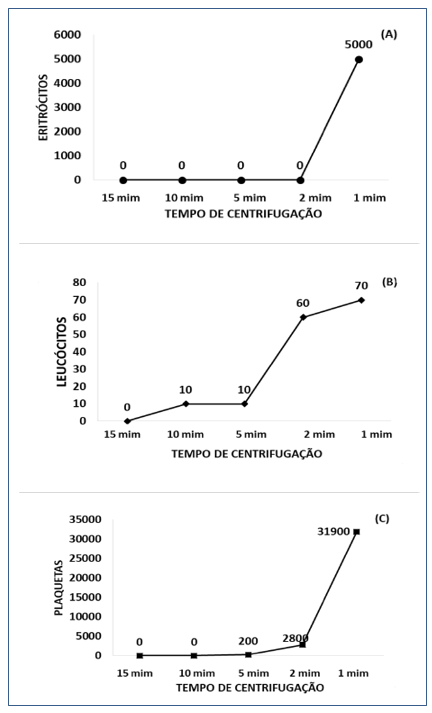
Figura 2. Valores máximos de contagem de eritrócitos (A), leucócitos totais (B) e contagem de plaquetas (C) detectados nas amostras analisadas de acordo com os tempos de centrifugação.
Os resultados da interpretação de Bland Altmam para o TP estão representados na Figura 3 e para o TTP na Figura 4. Observou-se um viés significativo do limite clínico aceitável de ± 2,0% para o TP e ± 2,3% para o TTP para todos os tempos de centrifugação.
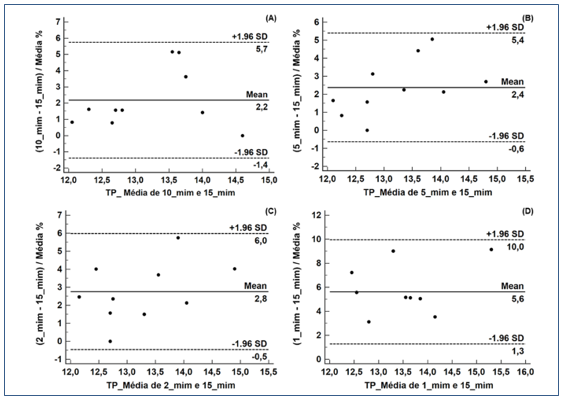 Figura 3. Gráficos de Bland Altmam para os resultados do Tempo de Protrombina: análise de concordância entre as amostras realizadas pelo protocolo padrão (1500 x g por 15 min à temperatura ambiente) e as amostras centrifugadas em 10, 5, 2 e 1 minuto (A, B, C e D, respectivamente).
Figura 3. Gráficos de Bland Altmam para os resultados do Tempo de Protrombina: análise de concordância entre as amostras realizadas pelo protocolo padrão (1500 x g por 15 min à temperatura ambiente) e as amostras centrifugadas em 10, 5, 2 e 1 minuto (A, B, C e D, respectivamente).
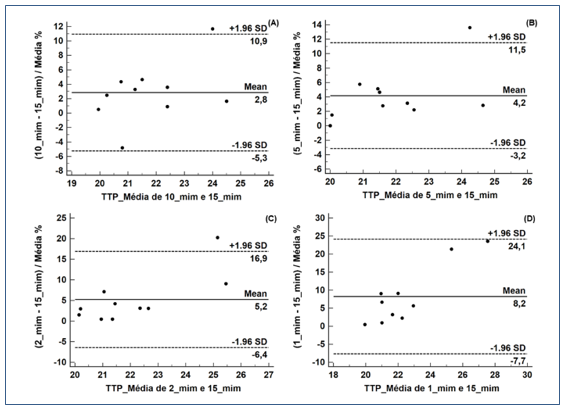 Figura 4. Gráficos de Bland Altmam para os resultados do Tempo de Tromboplastina Parcial: análise de concordância entre as amostras realizadas pelo protocolo padrão (1500 x g por 15 min à temperatura ambiente) e as amostras centrifugadas em 10, 5, 2 e 1 minuto (A, B, C e D, respectivamente).
Figura 4. Gráficos de Bland Altmam para os resultados do Tempo de Tromboplastina Parcial: análise de concordância entre as amostras realizadas pelo protocolo padrão (1500 x g por 15 min à temperatura ambiente) e as amostras centrifugadas em 10, 5, 2 e 1 minuto (A, B, C e D, respectivamente).
DISCUSSÃO
Os resultados do presente estudo demonstraram para o TP aumento nos valores das amostras centrifugadas por dez minutos ou menos, enquanto que para o TTP houve variação dos resultados das amostras centrifugadas por cinco minutos ou menos. Deve ser levado em consideração que, com dez minutos de centrifugação, as amostras apresentaram células sanguíneas residuais, os leucócitos, e com cinco minutos houve a presença principalmente das plaquetas. Portanto, o presente estudo demonstrou que o tempo de centrifugação de 15 minutos é o ideal para remoção completa das células sanguíneas residuais, que podem interferir nos resultados dos testes de coagulação quando utilizado uma força centrífuga relativa de 1.500 g.
A oscilação dos valores de TTP pode ser explicada principalmente pela presença das plaquetas residuais nas amostras analisadas.(10) As plaquetas podem fornecer a superfície fosfolipídica para ativar os fatores de coagulação e, portanto, interferir no diagnóstico laboratorial de testes que utilizam fosfolipídios como reativo.(10) A recomendação para realização dos testes de coagulação é a utilização de plasma pobre em plaquetas com contagem plasmática inferior a 10.000/mm3;(6) no entanto, o presente estudo encontrou valores superiores do aconselhado somente em dois minutos ou menos de centrifugação.
Contudo, Lippi et al. demonstraram que os tempos de centrifugação de cinco a dez min, em força centrífuga relativa de 1.500 g, podem ser adequados para obtenção de resultados confiáveis dos testes de coagulação de rotina, TP e TTP, mesmo com a presença de plaquetas residuais de 39.000/mm3 a partir do tempo de dez minutos de centrifugação.(5) Esse estudo não demonstrou alteração para os valores médios de TP nos tempos de centrifugação de dez, cinco, dois e um minuto com relação ao tempo de centrifugação de referência de 15 minutos.(5) No entanto, para o teste TTP houve aumento dos resultados em dois minutos de centrifugação.(5) Com relação aos elementos residuais, Lippi et al. observaram a presença significativa de plaquetas em dez minutos ou menos, hemácias em cinco, dois e um minuto e leucócitos somente no tempo de centrifugação de um minuto.(5)
Outro estudo desenvolvido por Carroll et al. avaliou o TP e o TTP em plasmas ricos em plaquetas (PRPs) e plasmas pobres em plaquetas (PPPs) preparados a partir da mesma amostra de sangue. As medições desses parâmetros não foram estatisticamente ou clinicamente significativas em 100 comparações pareadas.(8) Além disso, esse estudo demostrou que, em PRPs, a contagem de plaquetas de pelo menos 199.000/mm3 não alteraram os resultados de TP e TTP.(8) Por outro lado, Sultan et al. compararam os resultados obtidos a partir de plasma centrifugado durante cinco minutos a 3.000 g ou durante dez minutos a 2.000 g com o protocolo de referência e não encontraram diferenças nos resultados dos testes de coagulação TP e TTP.(7) Portanto, esse estudo concluiu que cinco minutos de centrifugação a 3.000 g é uma opção confiável e útil para reduzir o tempo de entrega dos resultados para esses testes.(7)
Daves et al. avaliaram cinquenta amostras divididas em duas alíquotas, avaliadas de acordo com as recomendações da CLSI, porém, para centrifugação da primeira alíquota, foi utilizado o freio ajustado para ligado, e para a segunda o freio foi desligado.(4) Observou-se que, quando o freio da centrífuga estava ligado, a frequência de amostras que excederam a contagem de plaquetas 10.000/mm3 foi quase o dobro do que nos plasmas obtidos com o freio desligado.(4) Portanto, esses resultados demonstraram que a centrífuga deve ser utilizada com o freio ajustado para desligado, pois pode ocorrer uma ressuspensão parcial dos elementos residuais ao plasma, devido a grande força de desaceleração quando o freio está ligado.(4)
Com relação aos testes de coagulação, Daves et al. não encontraram diferença para os valores de TTP, porém os resultados de TP apresentaram um pequeno prolongamento usando o freio da centrífuga ajustado para ligado (0,2 segundos; p<0,001).(4) Portanto, centrifugações de amostras de exames de coagulação com o freio desligado gera resultados mais compatíveis com as recomendações atuais do CLSI.(4)
O presente estudo também avaliou os resultados de acordo com o ponto de vista clínico aceitável, por meio da interpretação dos gráficos de Bland Altman. Os resultados de TP e TTP excederam as especificações de qualidade para o viés desejável em todos os tempos de centrifugação.
O TP demonstrou viés de 2,2%, 2,4%, 2,8% e 5,6%, portanto com aumento de 0,2%, 0,4%, 0,8% e 3,6% nos tempos dez, cinco, dois e um minuto, respectivamente, excedendo as especificações permitidas de ± 2,0%, enquanto que o TTP apresentou viés de 2,8%, 4,2%, 5,2%, 8,2%, portanto com aumento de 0,5%, 1,9%, 2,9% e 5,9% nos tempos dez, cinco, dois e um minuto, respectivamente, excedendo as especificações permitidas de ± 2,3%.
No entanto, Lippi et al. apresentaram todos os resultados de TP dentro do viés desejável, 0,0%, -0,5%, -0,75% e -0,8% nos tempos dez, cinco, dois e um minuto, respectivamente.(5) Para o TTP, encontraram 0,0%, 0,4%, 1,6% e 2,4% nos tempos dez, cinco, dois e umminuto, respectivamente, sendo que apenas o tempo de um minuto excedeu as especificações permitidas de ± 2,3%, em 0,1%.(5) Entretanto, esse estudo não menciona se o freio da centrífuga estava ajustado para ligado ou desligado.(5) Portanto, essas discrepâncias entre estudos realizados com mesmo tempo e velocidade de centrifugação podem ser atribuídas aos diferentes tipos de centrífugas utilizadas, como, por exemplo, com diferentes programações de velocidades de desaceleração ao término da centrifugação.
CONCLUSÃO
Apesar de vários estudos na literatura demonstrarem a possibilidade de diminuir o tempo de centrifugação das amostras para realização dos testes de coagulação de rotina, o presente estudo demonstrou alteração dos valores médios e da interpretação clínica para os resultados dos testes TP e TTP nos diferentes tempos de centrifugação (dez, cinco, dois e um minuto) com relação ao protocolo padrão estabelecido pelo CLSI.
Deve-se ressaltar que a presente pesquisa e todos os estudos supracitados utilizaram centrífugas, coagulômetros e reagentes diferentes para realização dos testes de coagulação. Portanto, esses resultados demonstram a importância de cada laboratório clínico realizar a padronização dos tempos de centrifugação de acordo com seus recursos específicos de trabalho.
Agradecimentos
Os autores são gratos ao LABCENTER Laboratório de Análises Clínicas Ltda por permitir a realização deste estudo.
Abstract
Objective: To analyze the coagulation tests: prothrombin test (PT) and partial thromboplastin time (PTT) in different centrifugation times of the sample, in relation to the standard protocol of the Clinical Laboratory Standards Institute (CLSI). Methods: The selected samples were splitted up into five aliquots of 1 mL. Centrifugation of these aliquots was carried out at 15, 10, 5, 2 and 1 minute at 1500 g. The PT and PTT were analyzed in an automated apparatus. The plasmas were analyzed for presence of residual elements: erythrocytes, leukocytes and platelets. Results: The results showed a change in the values of PT at the 10, 5, 2 and 1 minute centrifugation times and the PTT at 5, 2 and 1 minutes, relative to the standard protocol. In the interpretation of Bland Altman, a significant bias of the acceptable clinical limit for TP and TTP at all centrifugation times was observed, relative to the standard protocol. Only in the 15 minute centrifugation time no residual cells were found in the analyzed samples. Conclusion: The present study demonstrated that the 15-minute centrifugation time is ideal for complete removal of residual blood cells and to ensure the reliability of the results of the PT and PTT coagulation.
Keywords
Centrifugation; prothrombin time; partial thromboplastin time; blood coagulation tests
REFERÊNCIAS
- Berntorp E, Salvagno GL. Standardization and clinical utility of thrombin-generation assays. Semin Thromb Hemost. 2008 Oct;34(7): 670-82.
- Silva PH, Alves HB, Comar SR, Henneberg R, Merlin JC, Stinghen ST. Hematologia Laboratorial: Teoria e Procedimentos. Porto Alegre: Artmed; 2016.
- Salvagno GL, Lippi G, Montagnana M, Franchini M, Poli G, Guidi GC. Influence of temperature and time before centrifugation of specimens for routine coagulation testing. Int J Lab Hematol. 2009;31(4):462-7.
- Daves M, Giacomuzzi K, Tagnin E, Jani E, Adcock Funk DM, Favaloro EJ, et al. Influence of centrifuge brake on residual platelet count and routine coagulation tests in citrated plasma. Blood Coagul Fibrinolysis. 2014;25(3):292-5.
- Lippi G, Salvagno GL, Montagnana M, Manzato F, Guidi GC. Influence of the centrifuge time of primary plasma tubes on routine coagulation testing. Blood Coagul Fibrinolysis. 2007;18(5):525-8.
- Adcock DM, Hoefner DM, Kottke-Marchant K, Marlar RA, Szamosi DI, Warunek DJ. Collection, Transport, and Processing of Blood Specimens for Testing Plasma-Based Coagulation Assays and Molecular Hemostasis Assays. Clinical Laboratory Standards Institute; CLSI document H21-A5; 2008.
- Sultan A. Five-minute preparation of platelet-poor plasma for routine coagulation testing. East Mediterr Heal J. 2010;16(2):233-6.
- Carroll WE, Wollitzer AO, Harris L, Ling MC, Whitaker WL J. The significance of platelet counts in coagulation studies. J Med. 2001; 32(1-2):83-96.
- Doumas BT, Eckfeldt JH. Errors in measurement of total bilirubin: a perennial problem. Clin Chem. 1996;42(6 Pt 1):845-8.
- Mendelsohn EE, Solum NO, Brosstad F. Effects of platelets and platelet-derived material on the activated partial thromboplastin time (Cephotest®) coagulation test. Scand J Clin Lab Invest. 2005; 65(4): 321-32.
Correspondência
Danielle Cristyane Kalva Borato
Universidade Estadual de Ponta Grossa
Departamento de Análises Clínicas e Toxicológicas
Avenida General Carlos Cavalcanti, 4748, Uvarana
84030-900 – Ponta Grossa – PR, Brasil
Telefone: 3220-3118
e-mail: [email protected]
