Leptospirose: Características da enfermidade em humanos e principais técnicas de diagnóstico laboratorial
Leptospirosis: Characteristics of the human disease and main laboratory diagnostic techniques
Tatiane Mendes Varela Ramos1
Ilana Teruszkin Balassiano2
Taíssa de Souza Menezes da Silva3
Joseli Maria da Rocha Nogueira4
1 Doutoranda/Fiocruz (Laboratório de Zoonoses – IOC – FIOCRUZ).
2 Doutorado/Fiocruz (Curadora da Coleção de Leptospira – IOC – FIOCRUZ).
3 Mestranda/ENSP (Escola Nacional de Saúde Pública Sérgio Arouca – Fiocruz).
4 Doutorado/Fiocruz (Chefe do Laboratório de Microbiologia – ENSP – FIOCRUZ).
Instituição: ENSP – Escola Nacional de Saúde Pública Sérgio Arouca – Fiocruz. Rio de Janeiro, RJ, Brasil.
Recebido em: 18/02/2021
Aprovado em: 12/03/2021
DOI: 10.21877/2448-3877.202102110
INTRODUÇÃO
A leptospirose é uma das zoonoses de maior distribuição geográfica presente em praticamente todo o planeta. Estima-se que a cada ano ocorram 1,03 milhão de casos e 58.900 mortes, o que torna a leptospirose uma das zoonoses mais prevalentes no mundo.(1) Além disso, dados do Ministério da Saúde mostram que, no Brasil, no período de 2007 a 2019, foram registrados 48.670 casos confirmados de leptospirose humana e 4.287 óbitos, sendo notificada a maior incidência da doença nas regiões Sul e Sudeste.(2)
A doença é causada por espiroquetas invasivos pertencentes ao gênero Leptospira, sendo o ambiente contaminado a fonte de infecção indireta para o homem e outros mamíferos.(3) A leptospirose humana torna-se epidêmica nas estações chuvosas, quando podem ocorrer enchentes, sobretudo em cidades com condições inadequadas de saneamento básico, como esgoto a céu aberto e lixões, que propiciam a contaminação da água com urina de roedores, principalmente o Rattus norvegicus (ratazanas), que habitam comumente esses ambientes.(4)
O diagnóstico da leptospirose baseia-se principalmente no teste sorológico pela reação de microaglutinação, que é a técnica reconhecida como padrão-ouro pela Organização Mundial da Saúde (OMS) e pelo Ministério da Saúde, pela alta sensibilidade e especificidade, porém é limitada a centros de referência. O tratamento é baseado na antibioticoterapia, a qual apresenta maior eficácia nos primeiros dias após início dos sintomas.(5)
A eficácia do tratamento para a leptospirose depende principalmente do diagnóstico precoce da doença, o que tem levado à busca por técnicas laboratoriais mais modernas que ofereçam um resultado rápido e confiável, permitindo que a terapia antimicrobiana seja iniciada em tempo hábil para garantir sua eficiência.(5)
OBJETIVO
Este trabalho foi desenvolvido com o objetivo de reunir conceitos atualizados sobre a leptospirose humana e as principais técnicas de diagnóstico laboratorial empregadas, ampliando a compreensão a respeito da doença e do seu agente, além de fornecer informações importantes sobre a escolha do melhor método diagnóstico levando em consideração a característica bifásica da doença em humanos.
METODOLOGIA
O presente artigo de revisão foi constituído a partir de pesquisa bibliográfica baseada em artigos científicos contendo os dados mais relevantes para este trabalho. A busca foi realizada através da ferramenta de pesquisa PubMed, utilizando os termos leptospirose, leptospiras, taxonomia, ambiente, diagnóstico laboratorial, PCR, MAT, ELISA-IgM e teste rápido, contemplando artigos dos últimos 10 anos, além de revisões clássicas citadas em diversas publicações em leptospirose.
ETIOLOGIA
O agente etiológico da leptospirose pertence ao gênero Leptospira, que compreende um grupo heterogêneo de espécies patogênicas e saprófitas. São espiroquetas que exibem uma forma em espiral longa, fina (0,1 a 0,2µm de diâmetro e 6 a 20µm de comprimento) e flexível, sendo altamente móveis e apresentando uma ou ambas as extremidades em forma de gancho.(6) São bactérias aeróbias obrigatórias, com crescimento fastidioso in vitro, e podem ser cultivadas em meios líquidos, semissólidos e sólidos, sendo o meio Ellinghausen-McCullough-Johnson-Harris (EMJH) o mais frequentemente utilizado. A temperatura ideal para o cultivo situa-se na faixa de 28ºC-30ºC e o tempo de geração em cultura ou em modelos animais é de 6 a 8 horas.(3)
As leptospiras apresentam dois flagelos situados no periplasma que são responsáveis pela motilidade e compostos pelas proteínas FlaA e FlaB.(6) A bactéria apresenta uma estrutura de dupla membrana, na qual a membrana citoplasmática e a parede de peptideoglicana estão intimamente associadas e envolvidas pela membrana externa. Nesta estrutura, o lipopolissacarídeo (LPS) constitui o principal antígeno para Leptospira, o qual apresenta uma baixa toxicidade para células animais, quando comparado ao LPS das bactérias Gram-negativas.(6) Isto ocorre porque o LPS das leptospiras difere da macromolécula tipicamente encontrada nas bactérias Gram-negativas no que diz respeito às atividades biológicas, propriedade que possivelmente está relacionada com a estrutura única do lipídio A do gênero Leptospira.(7) Outras estruturas presentes na membrana externa são as lipoproteínas (LipL32, LipL21, LipL41, por exemplo), proteínas integrais de membrana e sistemas proteicos de secreção (T2SS, por exemplo).(8)
Desde 1907, após sua descrição original por Stimson, o gênero Leptospira foi dividido tradicionalmente em dois grupos: saprófitas (Leptospira biflexa) e patogênicas (Leptospira interrogans). O conceito evoluiu e essas duas espécies foram submetidas a dois esquemas de classificação, um baseado na sorologia, onde o sorovar representa a unidade taxonômica básica, e outro baseado na análise do DNA, o qual utiliza a taxonomia molecular para identificar espécies.(8) A classificação sorológica baseia-se na reatividade de antígenos de superfície contra anticorpos específicos, sendo o LPS o antígeno responsável pela diversidade entre os sorovares.(8) Por essa classificação já foram identificados mais de 300 sorovares, sendo a maioria patogênicos, agrupados em quase 30 sorogrupos, utilizando o Teste de Aglutinação Microscópica e o Teste de Aglutinação-Absorção Cruzada.(9)
Esquemas de classificação molecular envolvem estudos em análise filogenética e consideram também o nível de patogenicidade de cada espécie: saprófitas –presentes no ambiente e não causam infecção; intermediárias – possuem baixa virulência e estão relacionadas à doença branda; patogênicas – virulentas e causam infecção.(10) O estudo mais recente, baseado em sequenciamento de whole-genome e genômica comparativa, revelou a existência de 64 espécies agrupadas em dois clados principais: saprófitas e patogênicas (inclui espécies responsáveis por doença em homens e animais e espécies ambientais que ainda não tiveram sua virulência elucidada). Estes clados são subdivididos em quatro subclados: P1 – Espécies patogênicas; P2 – anteriormente descritas no grupo intermediário; S1 – 21 espécies anteriormente classificadas no grupo saprófita; S2 – 05 espécies incapazes de estabelecer o processo infeccioso em modelos animais, porém exibem características de crescimento in vitro similares às de espécies patogênicas.(11)
A grande questão concernente à taxonomia em Leptospira é que não há correlação entre as classificações sorológica e genética, pois alguns sorogrupos incluem cepas de até seis espécies diferentes, caracterizando a complexidade deste gênero bacteriano.(10) No entanto, é possível identificar um determinado sorovar circulante e assim contribuir com os dados epidemiológicos de uma dada região, empregando-se tanto os métodos sorológicos de referência quanto os moleculares, como por exemplo o PFGE (do inglês, Pulsed Field Gel Electrophoresis).(10)
LEPTOSPIRAS E O AMBIENTE
As leptospiras patogênicas colonizam os rins dos reservatórios (várias espécies de mamíferos) e são eliminadas através da urina diretamente no ambiente, onde sobrevivem por longos períodos que podem variar de poucas horas a vários meses, dependendo da espécie do sorovar e das características da matriz ambiental.(4)
Os mecanismos que permitem a persistência de leptospiras patogênicas em ambientes aquosos, fora do hospedeiro, ainda são pouco conhecidos. Alguns estudos demonstraram que o ambiente viscoso favorece a permanência das leptospiras no solo, tornando-o potencialmente infectante, e como outras espiroquetas, as leptospiras podem alterar sua morfologia de acordo com as condições ambientais, incluindo agregação celular.(12) A aderência é uma estratégia de sobrevivência bacteriana, característica do biofilme, representando um importante fator que pode estar envolvido na persistência das leptospiras fora do hospedeiro.(12)
A formação de biofilme já foi identificada (in vitro) para o gênero Leptospira, e pode conferir a capacidade de sobrevivência em diversos ambientes, mesmo sob escassez de nutrientes, tanto para as saprófitas quanto para as patogênicas.(13) A persistência de cepas virulentas no ambiente (solo ou água) exerce um papel importante, pois constitui uma fonte de patógenos potencialmente infectantes naquele local.(14) Após as fortes chuvas, as leptospiras virulentas presentes no solo entram em suspensão, juntamente com outras partículas, tornando aquele ambiente aquoso uma fonte de contaminação para o homem e os animais.(13)
MANIFESTAÇÕES CLÍNICAS DA LEPTOSPIROSE
A infecção por bactérias do gênero Leptospira pode ser assintomática ou produzir uma ampla variedade de sinais e sintomas que se confundem com outras doenças febris.(3) Evidências sorológicas de infecção são encontradas em 15% a 40% dos indivíduos que foram expostos, mas não desenvolveram a doença.(3) Nos casos sintomáticos de leptospirose, as manifestações clínicas variam de leve a moderada ou grave, podendo ser fatais. Mais de 90% dos indivíduos sintomáticos apresentam a forma mais branda e, geralmente, anictérica, enquanto a forma grave com icterícia ocorre em 5% a 10% dos pacientes infectados.(5)
A forma mais severa da doença, com danos sistêmicos que incluem injúria vascular, hepática, renal, pulmonar e músculo-esquelética, é conhecida como a Síndrome de Weil.(15) O período de incubação é de uma a duas semanas, podendo variar de 2 a 30 dias. Nesses casos, a leptospirose em humanos apresenta um caráter bifásico, mas a distinção entre a primeira e a segunda fase nem sempre é tão evidente. A primeira fase, ou fase de bacteremia, corresponde à disseminação das bactérias no sangue e em outros líquidos corporais, com duração de 4 a 7 dias. A segunda fase, ou fase imune (Figura 1), inicia-se com o aparecimento de anticorpos e posterior eliminação das bactérias na urina de forma intermitente, tendo duração de 10 a 30 dias.(16)
PATOGÊNESE
A primeira etapa na patogênese da leptospirose é a penetração através da barreira tecidual, que é facilitada por abrasões na pele e pelo contato direto com as mucosas da conjuntiva ou cavidade oral.(7) Nos períodos chuvosos onde ocorre a imersão em águas de enchentes ou até mesmo nas atividades recreativas aquáticas, o contato com águas contaminadas torna-se um fator de risco para infecção, principalmente pela exposição das mucosas.(17)
A transmissão pode acontecer pelo contato direto com um hospedeiro infectado, porém é mais comum através do solo e da água contaminados com urina de animais colonizados pelas leptospiras. No entanto, atividades que envolvem manejo de animais infectados também são um risco de desenvolver a leptospirose.(15)
A segunda etapa na patogênese é a disseminação através da corrente sanguínea. Após atravessar a pele, leptospiras patogênicas seguem pela circulação sanguínea e persistem nesta via durante a fase de leptospiremia (bacteremia), diferente de outros espiroquetas patogênicos como B. burgdorferi e T. pallidum, os quais estabelecem a infecção na pele.(7)
Os mecanismos envolvidos na patogênese da leptospirose podem ser relacionados tanto aos efeitos diretos das leptospiras no hospedeiro, quanto à resposta imune à infecção. Um mecanismo importante de virulência é a motilidade, que permite a migração dessas bactérias através de meios viscosos, sendo importante no início da infecção e na sua disseminação desde o sítio de entrada até os alvos dentro do hospedeiro.(16)
DIAGNÓSTICO LABORTORIAL
A leptospirose não pode ser diagnosticada com base apenas em fundamentos clínicos devido à variabilidade nas manifestações sintomáticas, as quais se assemelham a outras enfermidades, o que torna necessária a confirmação por meio do diagnóstico laboratorial.(5)
Segundo Adler (2010), o critério para considerar um resultado indicativo de infecção recente por Leptospira spp. é aceito como um título ≥400 de aglutinação de leptospiras na MAT, na presença de sinais clínicos e história epidemiológica, ou pelo aumento de quatro vezes no título entre amostras pareadas.(6)
Nos primeiros dias da doença, o diagnóstico envolve a detecção direta de Leptospira spp. em fluidos como sangue e líquor, pelo cultivo em meio específico (em geral, utiliza-se o meio EMJH) ou a detecção indireta pela técnica da PCR (do inglês polymerase chain reaction), pois nesta fase inicial as leptospiras circulam na corrente sanguínea. A partir da segunda semana, elevam-se os níveis de anticorpos das classes IgM e IgG (Figura 1), aumentando a sensibilidade dos testes sorológicos, sendo a técnica de aglutinação microscópica (MAT – do inglês Microscopic Aglutination Test) o método padrão-ouro para investigação da leptospirose em humanos e animais.(5)
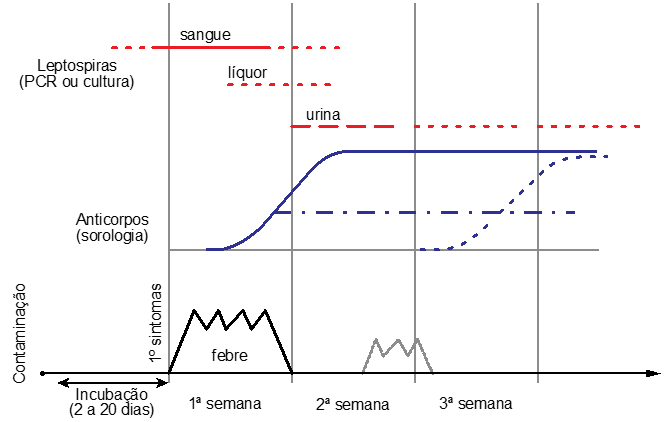 Figura 1. Esquema representando as fases da leptospirose e o emprego das técnicas de diagnóstico laboratorial mais adequadas. Adaptado de Goarant, 2016.(10)
Figura 1. Esquema representando as fases da leptospirose e o emprego das técnicas de diagnóstico laboratorial mais adequadas. Adaptado de Goarant, 2016.(10)
- Cultura
Os principais meios de cultura desenvolvidos para o gênero Leptospira são o Korthof, Fletcher e Ellinghausen-McCullough-Johnson-Harris (EMJH), sendo este último o mais utilizado na rotina de isolamento de leptospiras. Com o intuito de minimizar a contaminação do cultivo a partir de amostras clínicas, principalmente nos casos de urina, o antibiótico 5-fluorouracil pode ser empregado na preparação dos meios.(18)
As leptospiras podem ser recuperadas de amostras de sangue e líquor, na fase aguda da doença. No caso de isolamento a partir de amostras de urina, esta deve ser coletada na segunda semana após o início dos sintomas.(5) A duração da excreção destas bactérias na urina pode ocorrer por semanas, porém é necessário alcalinizar o pH da amostra, a fim de garantir a viabilidade das bactérias.(7)
Os cultivos em meio semissólido são incubados na faixa de 28ºC-30ºC, por várias semanas (6 a 13), ao abrigo da luz, sendo regularmente examinados ao microscópio de campo escuro para detecção do espiroqueta. Este exame identifica características como morfologia e motilidade, de modo que são necessárias outras técnicas para confirmação do gênero bacteriano e para a identificação da cepa isolada.(3)
O isolamento de leptospiras de espécimes clínicos é a mais forte evidência para a confirmação do diagnóstico e permite a posterior identificação dos sorovares circulantes em uma determinada região.(7) No entanto, a técnica apresenta algumas desvantagens, dentre elas o crescimento fastidioso (dias a semanas) e a complexidade na tipagem, que pode demorar até meses e atrasar consideravelmente o diagnóstico.(5) Contudo, a despeito das dificuldades, este é o método que melhor contribui para os estudos epidemiológicos da leptospirose. Outro detalhe importante é que a técnica de isolamento deve ser empregada antes do início do tratamento com antibióticos.(7)
Um estudo realizado por Boonsilp e colaboradores(19) comparou a sensibilidade de detecção de Leptospira spp. empregando as técnicas de cultura e PCR. O estudo foi conduzido com 418 pacientes apresentando doença febril aguda a partir de amostras de sangue coletadas em heparina e EDTA para os métodos de cultura e PCR (detecção do gene rrs, que codifica o RNA ribossomal 16S), respectivamente. As cepas isoladas foram posteriormente sequenciadas para identificação da espécie. Do total de amostras (418), 39 (9%) foram positivas no cultivo e 81 (19%) foram positivas na PCR (e negativas na cultura). Os resultados deste estudo demonstraram que há uma alta taxa de falso negativo no exame baseado na cultura, comparando-se com a PCR. Além disso, especula-se que o pré-tratamento com antibióticos pode influenciar na baixa sensibilidade do isolamento por cultivo.
- PCR (Polymerase chain reaction – reação em cadeia da polimerase)
A técnica da PCR tem sido utilizada para a detecção de Leptospira spp. a partir de amostras clínicas por muitos anos, objetivando o diagnóstico precoce da leptospirose, que deve ocorrer na fase aguda da doença, ou fase de leptospiremia, o que é crucial para que a terapia antimicrobiana seja administrada de forma eficaz (WHO, 2003). A utilização de PCR em tempo real tem sido uma ferramenta de grande importância para agilizar o diagnóstico da leptospirose, principalmente na fase aguda da doença.(20)
Atualmente, as técnicas de amplificação de ácidos nucleicos são usadas a partir de amostras de sangue, urina e líquor, e têm como alvo genes específicos tanto para detecção do gênero Leptospira (ex: rrs e secY) quanto para espécies patogênicas (ex: lfb1, lipL32, ligA e ligB), de modo que DNA de outros espiroquetas, como Borrelia spp., por exemplo, não são amplificados.(21,22)
Além da pesquisa em amostras clínicas, o gene lipL32 tem sido utilizado como alvo para detecção de leptospiras patogênicas em amostras ambientais, pois durante o isolamento, as amostras (água e solo) coletadas podem carrear cepas saprófitas, as quais acabam por se multiplicar mais rapidamente no meio de cultivo e mascarar a presença das patogênicas.(13) A detecção indireta pela técnica molecular aumenta a sensibilidade do método, uma vez que este gene está presente em todas as espécies patogênicas, porém ausente nas espécies intermediárias e saprófitas.(23)
Os métodos moleculares, embora promissores, deparam-se com a dificuldade de acesso às plataformas, principalmente quando se trata de ambientes remotos ou rurais, além da exigência de alto nível técnico para tal metodologia.(10) Outra limitação do diagnóstico da leptospirose baseado em PCR é a incapacidade de identificar tanto a espécie quanto o sorovar infectante.(7) Entretanto, esta informação pode não ser significativa para o tratamento individual do paciente, mas é de grande importância para a vigilância epidemiológica.(7) A despeito das limitações relacionadas às técnicas moleculares, a demonstração da presença de leptospiras patogênicas ou de seu DNA, em qualquer um dos fluidos biológicos mencionados anteriormente, permite o diagnóstico precoce, definitivo e correto da leptospirose.(10)
- Testes sorológicos
Devido à baixa sensibilidade do isolamento de leptospiras em cultura e das dificuldades técnicas encontradas em alguns laboratórios para a realização da PCR, a maioria dos casos de leptospirose é diagnosticada pela sorologia. Na primeira fase da doença, 5 a 7 dias após o início dos sintomas, os anticorpos da classe IgM já são detectáveis. A partir da segunda semana, ambas as classes IgM e IgG podem ser detectadas pelas técnicas sorológicas.(5)
3.1. Ensaio de Imunoabsorção Enzimática (ELISA, do inglês, Enzyme-Linked Immunosorbent Assay)
A complexidade do teste de MAT leva ao emprego de testes sorológicos mais simples, que podem ser utilizados na fase aguda da doença, permitindo o diagnóstico precoce da leptospirose. ELISA é uma técnica que tem sido amplamente utilizada no diagnóstico da leptospirose, pela detecção dos anticorpos da classe IgM, que tem maior importância quando se trata de amostras coletadas na fase aguda da doença, pois este anticorpo está presente na primeira fase da resposta imune.(24)
Existem muitos testes ELISA-IgM comerciais e a maior parte deles utiliza a espécie Leptospira biflexa (saprófita) para preparação de antígeno, pois apresenta reação cruzada com espécies patogênicas através de antígenos de superfície como o LPS, o que torna possível a detecção de anticorpos gerados contra uma cepa patogênica na amostra clínica.(25) Lipoproteínas recombinantes como a LipL32 ou LigA também foram desenvolvidas como preparação de antígenos para este teste.(8)
Além da praticidade e reprodutibilidade, outra vantagem do ELISA é que não requer a manutenção de culturas de antígenos vivos, como na MAT, o que é trabalhoso e de alto custo, restrito a centros de referência. Por outro lado, uma grande desvantagem desta técnica é que, sozinha, não pode assegurar o diagnóstico final, sendo necessária a confirmação pela MAT.(5)
Um estudo realizado por Rosa e colaboradores (26) demonstrou a eficácia do teste de ELISA-IgM como teste rápido para detecção precoce da doença, devido à alta sensibilidade, contribuindo para o melhor prognóstico dos pacientes e diminuindo a letalidade da doença. Estes achados sugerem que, embora não apresente a mesma especificidade do padrão-ouro (MAT), o teste pode ser utilizado como triagem em locais com pouca infraestrutura, o que contribui para o diagnóstico precoce da leptospirose.
3.2. Teste rápido
Qualquer esforço no desenvolvimento de um novo kit de diagnóstico rápido para leptospirose é valioso e significativo, pois permite o início do tratamento de forma adequada, oferecendo um bom suporte laboratorial. Os kits de teste rápido para leptospirose disponíveis no mercado também se baseiam na detecção do anticorpo IgM, justificando seu emprego na fase inicial da doença.(27)
Nabity e colaboradores(28) realizaram um estudo para testar a precisão do teste rápido DPP (do inglês, Dual Path Platform), em amostras de casos severos e brandos de leptospirose. A sensibilidade em amostras de soro pareadas foi de 100% e 73% para doença severa e branda, respectivamente. Na fase aguda o ensaio alcançou a sensibilidade menor para leptospirose severa e branda (85% e 64%, respectivamente). A sensibilidade do teste também foi similar ao ELISA-IgM. Os resultados demonstraram que o teste DPP apresentou uma performance aceitável para o diagnóstico da leptospirose severa e pode ser facilmente implementado em hospitais e postos de saúde. Contudo, a precisão do teste pode ser melhorada para os casos de doença branda e no estágio inicial, onde os sintomas são confundíveis com outras doenças febris, como dengue e hepatite, em regiões de alta transmissão da leptospirose.
Posteriormente, Nabity e colaboradores(29) avaliaram a precisão do teste rápido DPP através de outro estudo, partindo de três tipos de amostra: gota de sangue (dedo), sangue venoso total em EDTA e soro. Os resultados demonstraram uma sensibilidade para leptospirose clássica de 93% para amostras de gota de sangue e 96% para sangue venoso total, ambos maiores que para o soro. Concluíram, então, que houve uma boa performance do teste DPP para amostra coletada de forma mais simples (gota), nos casos de leptospirose clássica, o que demonstra a viabilidade de utilização do teste em pequenas unidades de saúde.
Outros testes rápidos disponíveis no mercado também foram submetidos a avaliação de precisão, como o Leptocheck-WB e o teste ImmuneMed Leptospira IgM Duo Rapid. Alia e colaboradores(30) testaram amostras de pacientes com suspeita de leptospirose utilizando esses dois kits. A sensibilidade e especificidade gerais foram 47,37% e 80,65% para o Leptocheck-WB e 21,05% e 90,32% para o teste ImmuneMed Leptospira IgM Duo Rapid. Comparando os resultados a partir de amostras positivas previamente confirmadas na MAT, o primeiro teste mostrou maior sensibilidade (90,72%) do que o segundo (40,21%), porém os valores de especificidade foram similares, sendo 82,89% para o primeiro e 88,89% para o segundo. Com base nos resultados deste estudo, o teste Leptocheck-WB foi considerado o mais sensível para o rastreamento da leptospirose em ambientes hospitalares.
3.3. Teste de Aglutinação Microscópica
(MAT, do inglês Microscopic Aglutination Test)
O MAT é uma técnica baseada na aglutinação antígeno-anticorpo, sendo o teste de referência para o diagnóstico da leptospirose, reconhecido como “padrão-ouro”. Esta técnica detecta anticorpos de ambas as classes, IgM e IgG, e determina o título de anticorpos, diferenciando infecção recente de contato prévio.(5)
O princípio da técnica é simples e consiste na reação do soro-teste com culturas de leptospiras, observando então a formação de aglutinação ao microscópio de campo escuro em duas etapas. Na primeira observa-se apenas a formação de aglutinação e na segunda etapa, os soros são diluídos serialmente para determinação do título (recíproca da diluição). O ponto final de leitura é aquele em que se observa 50% de aglutinação ou de leptospiras livres, quando comparado ao controle do antígeno (sem soro). Utiliza-se uma bateria de antígenos vivos, representantes de 19 diferentes sorovares, recomendados pela OMS.(5) Este número é limitado diante da diversidade de sorovares já reconhecidos e pode não contemplar um sorovar desconhecido em uma determinada região. Por conta disso, a cepa saprófita Patoc I (L. biflexa) está incluída na bateria de antígenos, pois apresenta reação cruzada com vários sorovares patogênicos.(31)
O MAT não tem a capacidade de detectar o sorovar infectante, uma vez que, dentro de um mesmo sorogrupo, todos os sorovares pertencentes a ele podem apresentar títulos similares, caracterizando uma reação inespecífica em nível de sorovar.(7) Por esta razão, a interpretação da MAT é complexa, em especial na fase aguda da doença, onde ocorre alto grau de reação cruzada entre diferentes sorogrupos, o que difere da fase convalescente, onde se observa relativa especificidade de sorogrupo.(7)
Outro ponto a ser considerado é a dificuldade de concluir o diagnóstico da leptospirose pela MAT na fase inicial da doença, principalmente porque, em muitos casos, é necessária a análise de uma segunda amostra, o que se torna um desafio, uma vez que a maioria dos pacientes ambulatoriais não retorna para segunda coleta.(32) Além disso, os demais testes sorológicos empregados no diagnóstico laboratorial da leptospirose devem ser comparados a MAT, avaliando os critérios de especificidade e sensibilidade.(5)
Niloofa e colaboradores(33) conduziram um estudo com pacientes diagnosticados clinicamente para leptospirose e as amostras foram submetidas aos testes de MAT, ELISA-IgM e teste rápido (Leptocheck -WB). Nas amostras coletadas na fase aguda da doença, a MAT apresentou especificidade e sensibilidade de 95,7% e 55,3% respectivamente, comparando-se com o resultado da MAT total (fase aguda + fase convalescente – 100%). O teste rápido e o ELISA-IgM apresentaram sensibilidade similar, comparando-se com a MAT na fase aguda, apesar do ELISA-IgM mostrar maior especificidade (84,5%) que o teste rápido (73,3%). Segundo os pesquisadores, os resultados indicaram que o ELISA-IgM pode ser superior à MAT durante a fase aguda como método de diagnóstico precoce, e o teste rápido também apresentou-se adequado para este propósito.
Em contrapartida, Araghian e colaboradores(34) realizaram um estudo mais recente comparando as técnicas de MAT e ELISA-IgM em amostras de pacientes sintomáticos com suspeita de leptospirose. Os resultados revelaram uma sensibilidade de 82,4% no ELISA-IgM, comparado à sensibilidade de 100% na MAT. Os valores de especificidade mostraram uma diferença significativa entre os dois métodos (MAT – 100%, ELISA-IgM – 78,8%), mantendo a categoria de padrão de diagnóstico para a MAT.
Segundo Philip e colaboradores,(32) uma forma de melhorar a eficiência no diagnóstico da leptospirose é associar outra técnica à MAT, quando se trata de amostras coletadas na fase aguda. De acordo com os resultados deste estudo, o emprego da técnica de PCR em conjunto com a MAT aumentou a eficácia no diagnóstico da doença, comparando-se com o uso das técnicas individualmente.
CONSIDERAÇÕES FINAIS
A leptospirose é uma zoonose de distribuição mundial, que pode levar ao óbito, quando ocorrem manifestações mais severas. Com o intuito de melhorar o prognóstico dos pacientes e iniciar o tratamento adequado, muitos estudos têm sido conduzidos para o desenvolvimento de técnicas mais simples e rápidas, que permitam o diagnóstico precoce e acurado da leptospirose.
Todas as técnicas conhecidas até o momento precisam ser comparadas à MAT, que permanece como o teste padrão-ouro, reconhecido pela OMS. Contudo, por ser uma técnica complexa e laboriosa, torna-se inviável em locais sem a infra-estrurura dos centros de referência.
O emprego de técnicas de diagnóstico precoce, quando ajustadas às diferentes fases da doença, pode oferecer bons resultados, permitindo, assim, o início da terapia antimicrobiana dentro do intervalo de tempo em que seja efetiva, diminuindo, assim, o agravamento dos casos de leptospirose e possíveis internações. Além disso, o conhecimento das técnicas disponíveis e a viabilidade do uso de cada uma delas, no contexto logístico do laboratório disponível para o diagnóstico, reflete um melhor manejo de insumos, equipamentos e mão de obra especializada, o que implicará a rapidez e melhoria do diagnóstico bem como a brevidade do tratamento deste agravo nos casos positivos, como também a redução dos índices de óbitos por essa enfermidade em nosso país.
Abstract
Leptospirosis is the most widespread zoonosis, which has a balance of almost 60,000 deaths per year. Bacteria of Leptospira genus, which has more than 300 different serovars and 64 species already identified, cause the disease, being the environment the main source of contamination. The human disease presents a large set of clinical manifestations, showing biphasic presentation, the reason why leptospirosis must be confirmed by laboratory diagnosis. This study aimed to group recent concepts concerning human leptospirosis and the main diagnosis techniques employed at the laboratory. MAT is considered the gold standard for leptospirosis diagnosis, but has low sensitivity on the onset of disease, leading to the use of techniques with higher sensitivity on this period. Based on several studies, PCR, ELISA-IgM and rapid test presented satisfactory sensitivity on the onset of symptoms. In the second week, MAT showed 100% of sensitivity, maintaining its high specificity in both phases. In general, the ELISA-IgM and rapid serological tests showed satisfactory results as methods for early diagnosis, especially in the case of places with poor infrastructure, different from the reference laboratories where it is possible to use the PCR and MAT techniques.
Keywords
Human leptospirosis; Spirochaetes; Laboratory Diagnosis
REFERÊNCIAS
- Costa F, Hagan JE, Calcagno J, Kane M, Torgerson P, Martinez-Silveira MS, et al. Global morbidity and mortality of leptospirosis: A systematic review. PLoS Negl Trop Dis. 2015; 9(9): e0003898.
- BRASIL. Casos Confirmados de leptospirose de 2007 a 2019. 2020. Disponível em: <http://antigo.saude.gov.br/images/pdf/2020/fevereiro/07/casos-conf-lepto-2007-2019.pdf> acessado em: 03/01/2021.
- Faine S, Adler B, Bolin C, Perolat P. Leptospira and leptospirosis. 2nd ed. Melbourne, Australia: Medsci; 1999.
- Casanovas-Massana A, Costa F, Riediger IN, Cunha M, Oliveira D, Mota DC, et al. Spacial and temporal dynamics of pathogenic Leptospira in surface waters from the urban slum environment. Water Research. 2018; 130: 176- 184.
- World Health Organization (WHO). International Leptospirosis Society (ILS). Human leptospirosis: guidance for diagnosis, surveillance and control. 2003. Geneva: World Health Organization.
- Adler B, de la Peña Moctezuma A. Leptospira and leptospirose. Vet Microbiol. 2010; 140: 287-296.
- Haake DA e Levett PN. Leptospirosis in humans. Curr Top Microbiol Immunol. 2015; 387: 65–97.
- Marquez A, Djelouadji Z, Lattard V, Kodjo A. Overview of laboratory methods to diagnose Leptospirosis and to identify and to type leptospires. Int Microbiol. 2017; 20(4): 184-193.
- Guernier V, Goarant C, Benschop J, Lau CL. A systematic review of human and animal leptospirosis in the Pacific Islands reveals pathogen and reservoir diversity. PLoS Negl Trop Dis. 2018; 12(5): e0006503.
- Goarant C. Leptospirosis: risk factors and management challenges in developing countries. Res Rep Trop Med. 2016; 7: 49–62.
- Vincent AT, Schiettekatte O, Goarant C, Neela VK, Bernet E, Thibeaux R, et al. Revisiting the taxonomy and evolution of pathogenicity of the genus Leptospira through the prism of genomics. PLoS Negl Trop Dis. 2019; 13(5): e0007270.
- Barragan VA, Mejia ME, Trávez A, Zapata S, Hartskeerl RA, Haake DA, Trueba GA. Interactions of Leptospira with Environmental Bacteria from Surface Water. Curr Microbiol 2011; 62: 1802-6.
- Bierque E, Thibeaux R, Girault D, Soupé-Gilbert M-E, Goarant C. A systematic review of Leptospira in water and soil environments. PLoS ONE. 2020; 15 (1): e0227055.
- Kumar KV, Lall C, Raj RV, Vedhagiri K, Vijayachari P. Coexistence and survival of pathogenic leptospires by formation of biofilm with Azospirillum. FEMS Microbiol Ecol 2015; 91: fiv051.
- De Brito T, da Silva AMG, Abreu PAE. Pathology and pathogenesis of human leptospirosis: a commented review. Rev Inst Med Trop São Paulo. 2018;60:e23
- Bharti AR, Nally JE, Ricaldi JN, Matthias MA, Diaz MM, Lovett MA, et al. Leptospirosis: a zoonotic disease of global importance. Lancet Infect Dis. 2003; 3:757-71.
- Levett PN. Leptospirosis. Clin Microbiol. Ver. 2001; 14: 296-326.
- Johson RC, Rogers P. 5-Fluorouracil as a Selective Agent for Growth of Leptospirae. J Bacteriol. 1964; 87: 422-6.
- Boonsilp S, Thaipadungpanit J, Amornchai P, Wuthiekanun V, Chierakul W, Limmathurotsakul D, Day NP, Peacock SJ. Molecular detection and speciation of pathogenic Leptospira spp. in blood from patients with culture-negative leptospirosis. BMC Infectious Diseases. 2011; 11:338.
- Riediger IN, Stoddard RA, Ribeiro GS, Nakatani SM, Moreira SDR, Skraba I, et al. Rapid, actionable diagnosis of urban epidemic leptospirosis using a pathogenic leptospira lipL32- based real-time PCR assay. PLoS Negl Trop Dis. 2017; 11(9): e0005940.
- Waggoner JJ e Pinsky BA. Molecular diagnostics for human leptospirosis. Curr Opin Infect Dis. 2016 Oct; 29(5): 440-5.
- Galloway RL and Hoffmaster AR. Optimization of LipL32 PCR assay for increased sensitivity in diagnosing leptospirosis. Diagn Microbiol Infect Dis. 2015; 82: 199-200.
- Rawlins J, Portanova A, Zuckerman I, Loftis A, Ceccato P, Willingham AL, et al. Molecular Detection of Leptospiral DNA in Environmental Water on St. Kitts. Int. J. Environ. Res. Public Health 2014; 11: 7953-7960.
- Soo ZMP, Khan NA, Siddiqui R. Leptospirosis: Increasing importance in developing countries. Acta Tropica. 2020; 201: 105183.
- Khaki P. Clinical laboratory diagnosis of human leptospirosis. Int J. Enteric Pathog. 2016; 4: e 31859.
- Rosa MI, dos Reis MF, Simon C, Dondossola E, Alexandre MC, Colonetti T, Meller FO. IgM ELISA for leptospirosis diagnosis: a systematic review and meta-analysis. Cien Saude Colet. 2017; 22(12):4001-12.
- Rao M, Amran F, Aqilla N. Evaluation of a rapid kit for detection of IgM against Leptospira in human. Can J Infect Dis Med Microbiol.2019; 1-4.
- Nabity SA, Ribeiro GS, Aquino CL, Takahashi D, Damião AO, Gonçalves AH, et al. Accuracy of a dual path platform (DPP) assay for the rapid point-of-care diagnosis of human leptospirosis. PLoS Negl Trop Dis. 2012; 6(11): e1878.
- Nabity SA, Hagan JE, Araújo G, Damião AO, Cruz JS, Nery N, et al. Prospective evaluation of accuracy and clinical utility of the dual path platform (DPP) assay for the point-of-care diagnosis of leptospirosis in hospitalized patients. PLoS Negl Trop Dis. 2018; 12(2): e0006285.
- Alia SN, Joseph N, Philip N, Azhari NN, Garba B, Masri SN, Sekawi Z, Neela VK. Diagnostic accuracy of rapid diagnostic test for the early detection of leptospirosis. J Infect Public Health. 2019;12(2):263-9.
- Murray CK, Gray MR, Mende K, Parker TM, Samir A, Rahmam BA, et al. Use of a patient-specific isolates in the diagnosis of leptospirosis employing microscopic agglutination testing (MAT). Trans. R. Soc. Trop. Med. Hyg. 2011; 105: 209-213.
- Philip N, Affendy NB, Masri SN, Yuhana MY, Than LTL, Sekawi Z, et al. Combined PCR and MAT improves the early diagnosis of the biphasic illness leptospirosis. PLoS ONE. 2020; 15(9): e0239069.
- Niloofa R, Fernando N, Silva NL, Karunanayake L, Wickramasinghe H, Dikmadugoda N, et al. Diagnosis of leptospirosis: comparison between microscopic agglutination test, IgM-ELISA and IgM rapid immunochromatography test. PLoS ONE. 2015;10(6): e0129236.
- Araghian A, Elmi A, Farahbakhsh M, Hosseini S, Faezi S. Seroepidemiology of leptospirosis in Guilan province, northern Iran: comparison between MAT and IgM-ELISA techniques. J Infect Dev Ctries. 2018; 12(2):109-114.
Correspondência
Joseli Maria da Rocha Nogueira
Laboratório de Microbiologia
Departamento e Ciências Biológicas
Escola Nacional de Saúde Pública (ENSP)
Fundação Oswaldo Cruz (Fiocruz) – Manguinhos
Rio de Janeiro-RJ, Brasil
E-mail: [email protected]
