Limiar de positividade e sensibilidade dos métodos de Faust et al. e Lutz para detecção de cistos de Giardia duodenalis
Artigo Original/Original Article
Limiar de positividade e sensibilidade dos métodos de Faust et al. e Lutz para detecção de cistos de Giardia duodenalis
Positivity threshold and sensitivity of methods of Faust et al. and Lutz for detection of Giardia duodenalis cysts
Regielly Caroline Raimundo Cognialli1
Juciliane Haidamak1
Stela Adami Vayego2
Débora do Rocio Klisiowicz3
1Programa de Pós-graduação em Microbiologia, Parasitologia e Patologia / Universidade Federal do Paraná – Curitiba, PR, Brasil.
2Doutorado. Universidade Federal do Paraná – Curitiba, PR, Brasil.
3Professora Adjunta de Parasitologia Básica. Pós-doutorado – Universidade Federal do Paraná – Curitiba, PR, Brasil.
Instituição: Universidade Federal do Paraná – Curitiba, PR, Brasil.
Artigo recebido em 05/09/2013
Artigo aprovado em 29/01/2016
DOI: 10.21877/2448-3877.201600204
Resumo
Objetivo: O presente estudo teve como objetivo determinar e comparar o limiar de positividade e a sensibilidade dos métodos de centrífugo-flutuação em sulfato de zinco (Faust et al.) e sedimentação espontânea (Lutz) para o diagnóstico de cistos de Giardia duodenalis. Métodos: Para obtenção de amostras fecais com quantidades conhecidas de cistos de G. duodenalis, amostras positivas para o parasito foram purificadas e quantificadas, e posteriormente alíquotas com diferentes quantidades foram adicionadas a amostras fecais negativas para parasitos. Após a contaminação de oito amostras negativas com quantidades variando entre 1.000 e 200.000 cistos por grama de fezes (c/g/f), as mesmas foram submetidas aos métodos de Faust et al. e Lutz, onde o primeiro se mostrou mais sensível para a detecção de cistos de G. duodenalis. Resultados: O limiar de positividade do método de Faust et al. foi de 11.000 c/g/f, e do método de Lutz foi de 100.000 c/g/f, portanto, cargas parasitárias inferiores a esses limiares levariam a resultados falso-negativos. Conclusão: O método de Lutz não é adequado para o diagnóstico de giardíase, portanto deve ser sempre utilizado em conjunto com o método de Faust et al.
Palavras-chave
Giardia lamblia; Sensibilidade e especificidade; Métodos analíticos de preparação de amostras
INTRODUÇÃO
As enteroparasitoses são consideradas um problema de saúde pública devido à sua alta prevalência e sua ampla distribuição geográfica,(1-3) podendo acarretar má absorção de nutrientes, anemia, diarreia crônica, desnutrição e dores abominais.(4) Estima-se que 3,5 bilhões de pessoas estejam infectadas por parasitos intestinais em todo o mundo, e, dessas, 450 milhões estão doentes, sendo a maioria crianças.(5)
O diagnóstico de enteroparasitos é realizado principalmente através de exames coproparasitológicos, os quais são exames de baixo custo, de simples execução e com boa sensibilidade.(6-9) Existem diversos métodos para a realização de exames coproparasitológicos, sendo que cada um possui especificidade e sensibilidade diferente para cada parasito e nenhum método isolado é capaz de diagnosticar todas as formas parasitárias.(10-12)
Giardia duodenalis (sin. Giardia lamblia ou Giardia intestinalis) é uma espécie de enteroprotozoário cosmopolita e estima-se que infecta cerca de 2,8 milhões pessoas a cada ano, principalmente crianças na faixa etária de 0-5 anos de idade.(13) A maioria dos infectados é assintomática, porém podem ocorrer manifestações clínicas como diarreia crônica, má absorção de nutrientes e perda de peso.(13,14) O diagnóstico da giardíase é realizado principalmente pela demonstração de trofozoítos ou cistos do parasito nas fezes, por meio de exames coproparasitológicos, porém o diagnóstico se torna mais difícil, uma vez que o parasito libera os cistos nas fezes de forma intermitente e o diagnóstico exige experiência do laboratorista.(15,16)
No Brasil, a prevalência de G. duodenalis é relatada variando de 2,7% a 74,1%,(17-21) porém esse tipo de comparação é inviável, visto que não existe uma padronização dos métodos coproparasitológicos utilizados, o número de coletas realizadas e nem mesmo o número de lâminas a serem examinadas em cada método. Essa falta de padronização torna os dados epidemiológicos não confiáveis, prejudicando a elaboração de medidas de controle.
O método de Faust et al.(22) é considerado mais sensível para a detecção de cistos de protozoários quando comparado ao método de Lutz ou Hoffman, Pons e Janer,(11,23-25) porém de acordo com Souza e Amor,(12) o método mais utilizado na rotina laboratorial é o método de Lutz.
Apesar da elevada importância em se conhecer o limiar de positividade dos métodos de Faust et al. e Lutz para a detecção de cistos de G. duodenalis não existe nenhum trabalho publicado. Sabendo-se disso, o objetivo do presente trabalho foi determinar e comparar o limiar de positividade e a sensibilidade dos métodos de Faust et al. e Lutz para o diagnóstico de cistos de G. duodenalis.
MATERIAL E MÉTODOS
Amostras de fezes provenientes de crianças participantes do projeto de extensão “Epidemiologia e Controle de Entero e Ectoparasitoses em Crianças de Centros Municipais de Educação Infantil” foram processadas pelos métodos de centrífugo-flutuação em sulfato de zinco (Faust et al.) e sedimentação espontânea (Lutz) no laboratório de Parasitologia da Universidade Federal do Paraná. As amostras positivas para G. duodenalis foram submetidas ao método de purificação de cistos descrito por Roberts-Thomson.(26) Após a purificação, as suspensões resultantes, contendo cistos de G. duodenalis, foram quantificadas em Câmara de Neubauer.
Para obter amostras de fezes com quantidades conhecidas de cistos de G. duodenalis por grama de fezes (c/g/f), variando de 1.000 a 200.000 c/g/f, amostras de fezes negativas para enteroparasitos foram pesadas em balança analítica Shimadzu AY220, e a partir do peso foi calculada a quantidade a ser adicionada das suspenções de cistos de G. duodenalis. As fezes negativas foram homogeneizadas com as suspensões até que uma consistência pastosa fosse obtida, para que houvesse uma distribuição uniforme dos cistos na amostra fecal.
As amostras fecais contaminadas experimentalmente com cistos de G. duodenalis, juntamente com outras amostras de fezes negativas para enteroparasitos, foram processadas pelos métodos Faust et al. e Lutz por três profissionais com experiência em Parasitologia, sendo dois bioquímicos e um biólogo. Cada profissional examinou três lâminas da mesma amostra fecal para cada método. O estudo foi conduzido de maneira duplo-cego.(27)
Os dados foram analisados quanto à sensibilidade e especificidade para diagnóstico de cistos de G. duodenalis.
O teste de McNemar foi utilizado para avaliar a discordância entre método de Faust et al. e o método de Lutz na detecção de cistos deste parasito.
RESULTADOS
Em todas as amostras fecais negativas (n=4) e na amostra contendo 1.000 c/g/f, o resultado dos três profissionais em todas as lâminas examinadas foi negativo para cistos de G. duodenalis, tanto no método de Faust et al. quanto no método de Lutz (Tabela 1).
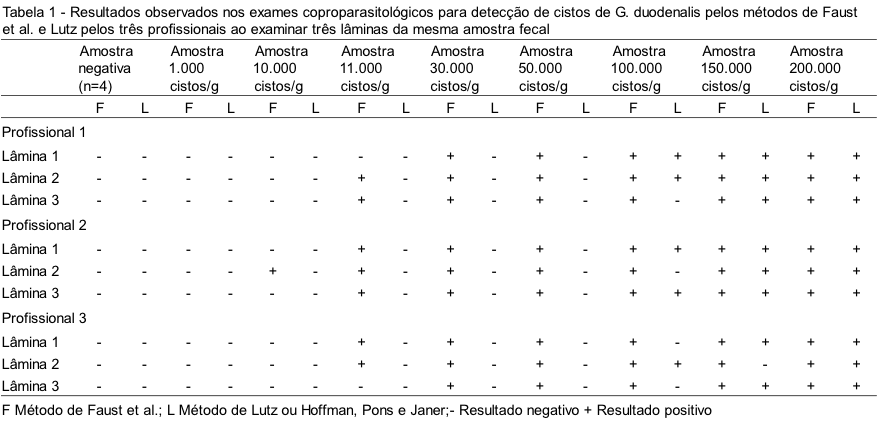
O resultado foi positivo na amostra com 10.000 c/g/f somente no método de Faust et al. e por apenas um profissional, o qual identificou cisto deste parasito na segunda lâmina examinada. Já na amostra contendo 11.000 c/g/f o resultado foi positivo para os três avaliadores apenas no método de Faust et al., porém os cistos não foram observados em todas as lâminas examinadas.
A partir da amostra contendo 30.000 c/g/f, todos os resultados foram positivos para G. duodenalis pelos três profissionais no método de Faust et al., porém, somente a partir de 100.000 c/g/f os avaliadores puderam identificar os cistos no método de Lutz e nem todas as lâminas examinadas nesse método foram positivas.
No presente estudo observou-se que há discordância de diagnóstico entre os dois métodos (p < 0,0001), tendo o método de Faust et al. diagnosticado maior proporção de cistos de G. duodenalis quando comparado ao método de Lutz.
DISCUSSÃO
No presente trabalho, o método de Faust et al. foi mais sensível para a detecção de cistos de G. duodenalis (76,34%) em relação ao método de Lutz (37,5%). Em estudo similar, Chaves et al.(10) e Souza(28) não observaram diferença estatística entre os métodos para o diagnóstico de protozoários, porém, nesses estudos, a carga parasitária não foi determinada.
Para determinar o limiar de positividade foi observado que o exame de três lâminas foi essencial tanto pelo método de Faust et al. quanto pelo de Lutz, visto que, em algumas amostras, somente foi possível observar o parasito na segunda ou terceira lâmina. Portanto, o exame de, no mínimo, três lâminas é fundamental para aumentar a sensibilidade do mesmo, corroborando estudo publicado por Tibiriçá et al.(29)
O limiar de positividade do método de Faust et al. de 11.000 c/g/f para o diagnóstico de G. duodenalis foi próximo ao trabalho realizado por Castanho,(30) o qual, utilizando metodologia diferente, encontrou positividade em amostras com 10.000 c/g/f, porém, nesse estudo, a carga parasitária foi apenas estimada, ao contrário do presente estudo, onde as amostras foram previamente purificadas, concentradas, e posteriormente quantificadas. Portanto, cargas parasitárias inferiores a esse limiar de positividade levariam a resultados falso-negativos pelo método de Faust et al., o qual é considerado o melhor método para diagnóstico de cistos de G. duodenalis, uma vez que fornece um campo com menor quantidade de detritos.(31,32)
Para o método de Lutz, o qual é muitas vezes o único utilizado na rotina laboratorial, foi necessária uma alta carga parasitária (100.000 c/g/f) para que o resultado fosse positivo; portanto, esse método não é indicado para o diagnóstico de infecções por G. duodenalis.
Outro fator que deve ser considerado para a realização de exames coproparasitológicos de rotina, é que, devido à liberação intermitente de cistos de G. duodenalis nas fezes, o exame de apenas uma única amostra de fecal pode induzir resultados falso-negativos; portanto, a análise de amostras múltiplas aumenta a sensibilidade do método.(9,33)
Novos métodos diagnósticos foram desenvolvidos para a pesquisa de G. duodenalis, como o método de ELISA (Enzyme-linked immunosorbentassay), o qual tem sido amplamente estudado e mostrado uma alta sensibilidade.(27,30,33-36) Apesar deste método ser mais sensível para o diagnóstico de G. duodenalis, quando comparado ao método de Faust et al.,(27,28,30) ele não é indicado para a realização de exames coproparasitológicos de rotina nos laboratórios de análises clínicas, pois, além ser mais caro, não permite o diagnóstico de mais de um enteroparasito na mesma amostra fecal.(27,37,38)
CONCLUSÕES
O limiar de positividade para detecção de cistos de G. duodenalis foi determinado pela primeira vez para os métodos de Faust et al. e Lutz; tal informação é essencial para tentar reduzir os resultados falso-negativos na rotina laboratorial.
Os resultados corroboram que o método de Faust et al. é mais sensível do que o método de Lutz para o diagnóstico de giardíase, uma vez que possibilita a identificação de cistos de G. duodenalis em amostras fecais a partir de 11.000 c/g/f. Portanto, os laboratórios de análises clínicas não devem utilizar apenas o método de Lutz para processar as amostras de fezes na rotina, devendo sempre associar mais de um método coproparasitológico, para, dessa forma, ampliar a pesquisa dos enteroparasitos e minimizar os resultados falso-negativos. Além disso, outro ponto importante é a necessidade de se examinarem no mínimo três lâminas para cada método coproparasitológicos empregado.
Estes dados poderão ser usados em futuros trabalhos para a discussão da prevalência dessa importante parasitose intestinal, além de contribuir para uma padronização dos métodos coproparasitológicos utilizados na rotina laboratorial.
Agradecimentos
À Karen Caroline da Silva e Isabel Biasi Yamanaka pelo auxílio no processamento das amostras.
Abstract
Objective: The present study aimed to determine and compare the positivity threshold and sensitivity of the methods of zinc sulfate centrifugal flotation (Faust et al.) and spontaneous sedimentation (Lutz) for the diagnosis of Giardia duodenalis. Methods: To obtain fecal samples containing known amounts of G. duodenalis cysts, the samples with the parasite were purified and quantified, then aliquots with different amounts were added to fecal samples negative for parasites. After the contamination of eight negative samples with amounts ranging between 1.000 and 200.000 cysts per gram of feces, they were subjected to methods of Faust et al. and Lutz, where the first was more sensitive for the detection of G. duodenalis cysts. Results: The positivity threshold of the method of Faust et al. was 11.000 c/g/f, and the method of Lutz was 100.000 c/g/f, so parasitic loads below those thresholds would lead to false-negative results. Conclusion: The method of Lutz is not suitable for the diagnosis of giardiasis, therefore must always be associated with the method Faust et al.
Keywords
Giardia lamblia; Sensitivity and specificity; Analytic sample preparation methods
REFERÊNCIAS
- Dagci H, Kurt O, Demirel M, Ostan I, Azizi NR, Mandiracioglu A, et al. The prevalence of intestinal parasites in the province of Izmir, Turkey. Parasitol Res. 2008 Sep;103(4):839-45.
- Mascarini LM, Donalisio MR. Epidemiological aspects of enteroparasitosis at daycare centers in the city of Botucatu, State of São Paulo, Brazil. Rev. Bras. Epidemiol. 2006;9(3):297-308.
- Cabral-Miranda G, Dattoli VCC, Dias-Lima A. Enteroparasitos e condições socioeconômicas e sanitárias em uma comunidade Quilombola do semiárido Bahiano. Rev. Patol. Trop., 39 (1): 48-55, 2010.
- Buschini MLT, Pittner E, Czervinski T, Moraes IF, Moreira MM Sanches HF, et al. Spatial distribution of enteroparasites among school children from Guarapuava, State of Paraná, Brazil. Rev. bras. epidemiol. 2007, vol.10, n.4, pp.568-578.
- World Health Organization (WHO). Parasitic Diseases. Disponível em: 15/01/2013.
- World Health Organization (WHO) – Prevention and control of intestinal parasitic infection. Technical Report Series, 749, Expert Committee, Geneva, 1987.
- Angel Núñez F, Ginorio DE, Finlay CM. External quality assessment in coproparasitology in Havana City Province, Cuba. Cad Saude Publica. 1997 Jan;13(1):67-72. [Article in Spanish].
- Savioli L1, Smith H, Thompson A. Giardia and Cryptosporidium join the ‘Neglected Diseases Initiative’. Trends Parasitol. 2006 May;22(5):203-8.
- Trabelsi S, Aouinet A, Khaled S. Procedure and indications of stool examination in parasitology. Tunis Med. 2012 Jun;90(6):431-4. [Article in French].
- Chaves A, de Alcantara OS, Carvalho OS, dos Santos JS. Comparative study of Lutz, Kato-Katz and modified Faust coprologic methods. Rev Saude Publica. 1979 Dec;13(4):348-52. [Article in Portuguese].
- Nunes MPO, Costa MSG, Nunes JFL, Silva EMA, Dantas MFA. Avaliação dos métodos de Faust e cols., de Hoffman e cols., de Baerman modificado, utilizados na rotina sistemática, para o diagnóstico das enteroparasitoses. Rev. Bras. Anál. Clín., 25 (1): 25-26, 1993.
- Souza RF, Amor AL M. Controle de qualidade de técnicas realizadas nos laboratórios de parasitologia da Secretaria Municipal de Saúde do Município de Salvador, Bahia. RBAC, 42 (2):101-105, 2010.
- Ali SA, Hill DR. Giardia intestinalis. Curr Opin Infect Dis. 2003 Oct;16(5):453-60.
- de Sá Cardoso G, de Santana AD, de Aguir CP. Prevalence and epidemiolgic aspects of giardiasis in day care centers in the Municipality of Aracaju, SE, Brazil. Rev Soc Bras Med Trop. 1995 Jan-Mar;28(1):25-31. [Article in Portuguese].
- Flanagan PA. Giardia–diagnosis, clinical course and epidemiology. A review. Epidemiol Infect. 1992 Aug;109(1):1-22.
- Gardner TB, Hill DR. Treatment of Giardiasis. Clin Microbiol Rev. 2001 Jan;14(1):114-28.
- Biscegli TS, Romera J, Cândido AB, Santos JM, Cândido ECA, Binotto AL. Estado nutricional e prevalência de enteroparasitoses em crianças matriculadas em creche. Rev. paul. pediatr. [online]. 2009, vol.27, n.3, pp.289-95. Available from: http://www. scielo.br/scielo.php?script=sci_arttext&pid=S0103-05822009000300009&lng=en
- Uchôa CMA, Lobo AGB, Bastos OMP, Matos AD. Parasitoses intestinais: prevalência em creches comunitárias da cidade de Niterói, Rio de Janeiro, Brasil. Rev. Inst. Adolfo Lutz, 60 (2): 97-101, 2001.
- Damazio SM, Lima Mde S, Soares AR, Souza MA. Intestinal parasites in a quilombola community of the Northern State of Espírito Santo, Brazil. Rev Inst Med Trop Sao Paulo. 2013;55(3). pii: S0036-46652013000300179.
- Monteiro AMC, Silva EF, Almeida KS, Sousa JN, Mathias LA, Baptista F, Freitas FLC. Parasitoses intestinais em crianças de creches públicas localizadas em bairros periféricos do município de Coari, Amazonas, Brasil. Rev. patol. trop;38(4):284-290, out.-dez. 2009.
- Bencke A, Artuso GL, Reis RS, Barbieri NL, Rott MB. Enteroparasitoses em escolares residentes na periferia de Porto Alegre, RS, Brasil. Rev. Patol. Trop., 35(1):31-36, 2006.
- Faust EC, D’Antoni JS, Odom V, Miller MJ, Peres C, Sawitz W, et al. A critical study of clinical laboratory technics for the diagnosis of protozoan cysts and helminth eggs in feces: I. Preliminary communication. Am J Trop Med 1938;18(2): 169-183.
- Lutz AO. Shistosomum mansoni segundo observações feitas no Brasil. Mem. Inst. Oswaldo Cruz, 11 121-155, 1919.
- Hoffman WA, Pons JA, Janer J L. The sedimentation-concentration method in schistosomiasis mansoni. J. Public Health, 9 283-298, 1934.
- Cantos GA, Galvão M, Linécio J. Comparação de Métodos Parasitológicos tendo como Referencial o Método de Faust para a Pesquisa de Cistos de Protozoários. NewsLab, 104 160-165, 2011.
- Roberts-Thomson IC, Stevens DP, Mahmoud AA, Warren KS. Giardiasis in the mouse: an animal model. Gastroenterology. 1976 Jul;71(1):57-61.
- Vidal AMB, Catapani WR. Enzyme-linked immunosorbent assay (ELISA) immunoassaying versus microscopy: advantages and drawbacks for diagnosing giardiasis. Sao Paulo Med. J. [Internet]. 2005 Dec 123( 6):282-285. Available from: http://www.scielo. br/scielo.php? script=sci_ arttext&pid=S1516-31802005000600006&lng=en
- Souza DS, Barreiros JT, Papp KM, Steindel M, Simões CM, Barardi CR. Comparison between immunomagnetic separation, coupled with immunofluorescence, and the techniques of Faust et al. and of Lutz for the diagnosis of Giardia lamblia cysts in human feces. Rev Inst Med Trop Sao Paulo. 2003 Nov-Dec;45(6):339-42.
- Tibiriçá SHC, Abramo C, Simões AS, Pinheiro IO, Ribeiro LC, Coimbra ES. Validação do número de lâminas para realização do método de sedimentação espontânea das fezes. HU Rev., 35 (2): 105-110, 2009.
- Castanho REP. Estudo do limiar de positividade do método imunoenzimático (ELISA) para pesquisa de coproantígeno de Giardia lamblia Stiles, 1915. Sua utilização como exame de controle de cura após terapêutica. 2004. 108 p. Pós-graduação em Análises Clínicas – Faculdade de Ciências Farmacêuticas UNESP. Araraquara.
- Faust EC, Sawitz W, Tobie J, Odom V, Peres C, Lincicome DR. Comparative efficiency of various technics for the diagnosis of protozoa and helminths in feces. J. Parasitol., 1939, 25: 241-62.
- Shrivastav JB. Comparative efficiency of three different techniques for the diagnosis of cystic forms of intestinal protozoa and helminthic ova in faeces. Indian J Med Res. 1954 Oct;42(4):497-508.
- Hiatt RA, Markell EK, Ng E. How many stool examinations are necessary to detect pathogenic intestinal protozoa? Am J Trop Med Hyg. 1995 Jul;53(1):36-9.
- Dutt P, Mehta S, Vinayak VK. Enzime-linked immunosorbent assay for copro-diagnosis of giardiasis and characterisation of a specific Giardia lamblia antigen in stools. J Med Microbiol., 34 271-275, 1991.
- Chakarova B. Comparative evaluation of the diagnostic methods for detection of Giardia intestinalis in human fecal samples.Trakia J. Sci., 8 (2):174-179, 2010.
- Ungar BL, Yolken RH, Nash TE, Quinn TC. Enzyme-linked immunosorbent assay for the detection of Giardia lamblia in fecal specimens. J Infect Dis. 1984 Jan;149(1):90-7.
- Machado RLD, Figueredo MC, Frade AF, Kudó ME, Filho MGS, Póvoa MM. Comparação de quatro métodos laboratoriais para diagnóstico da Giardia lamblia em fezes de crianças residentes em Belém, Pará. Rev. Soc. Bras. Med. Trop. [Internet]. 2001 Feb;34(1): 91-93. Available from: http://www.scielo.br/scielo. php? script=sci_arttext&pid=S0037-86822001000100014&lng=en.
- El-Nahas HA, Salem DA, El-Henawy AA, El-Nimr HI, Abdel-Ghaffar HA, El-Meadawy AM. Giardia diagnostic methods in human fecal samples: a comparative study. Cytometry B Clin Cytom. 2013 Jan-Feb;84(1):44-9.
Correspondência
Regielly Caroline Raimundo Cognialli
Centro Politécnico S/N – Jardim das Américas,
81531-980 – Curitiba, PR
