Monitoramento da qualidade da coloração de Papanicolaou no Instituto Nacional de Câncer
Papanicolaou staining quality monitoring in National Institute of Cancer
Mario Lucio Cordeiro Araujo Junior1
Daniela Alves Santana2
Lívia Braga de Almeida3
Flavio Paiva de Paula Ribeiro4
Claudio Borys Nunes Guimarães4
Fabiano Lacerda Carvalho5
Claudia Lopes Pires6
1Médico Citopatologista, Doutor em Medicina, Seção Integrada de Tecnologia em Citopatologia do Instituto Nacional de Câncer José Alencar Gomes da Silva – Rio de Janeiro, RJ, Brasil.
2 Citotecnologista, Bióloga, Seção Integrada de Tecnologia em Citopatologia do Instituto Nacional de Câncer José Alencar Gomes da Silva – Rio de Janeiro, RJ, Brasil.
3 Citotecnologista, Bióloga, Bolsista de Desenvolvimento Institucional do Instituto Nacional de Câncer José Alencar Gomes da Silva – Rio de Janeiro, RJ, Brasil.
4 Citotecnologista, Seção Integrada de Tecnologia em Citopatologia do Instituto Nacional de Câncer José Alencar Gomes da Silva – Rio de Janeiro, RJ, Brasil.
5 Citotecnologista, Farmacêutico, Seção Integrada de Tecnologia em Citopatologia do Instituto Nacional de Câncer José Alencar Gomes da Silva – Rio de Janeiro, RJ, Brasil.
6 Médica Citopatologista, Seção Integrada de Tecnologia em Citopatologia do Instituto Nacional de Câncer José Alencar Gomes da Silva – Rio de Janeiro, RJ, Brasil.
Instituição: Instituto Nacional de Câncer José Alencar Gomes da Silva – Rio de Janeiro, RJ, Brasil.
Artigo recebido em 26/11/2015
Artigo aprovado em 19/02/2016
Resumo
Introdução: A coloração de Papanicolaou é universalmente aplicada em laboratórios de citopatologia. A versão clássica passou por modificações baseadas em dados da literatura, reduzindo o número de lavagens e/ou substituindo algumas substâncias químicas. Objetivo: Descrever a coloração de Papanicolaou adaptada pela Seção Integrada de Tecnologia em Citopatologia (SITEC) do Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA) e demonstrar a necessidade da troca de corante, a fim de manter a qualidade da coloração. Métodos: Monitoramento da coloração de 760 lâminas escolhidas aleatoriamente de um total de 160.933 exames colpocitológicos, utilizando o método convencional, no período de outubro de 2011 a março de 2012. Todos os dados obtidos para análise foram organizados em tabelas utilizando-se o programa Microsoft Excel 2010. Resultados: A perda da qualidade da coloração do EA aconteceu após 1.750 lâminas coradas para cada 430 mL de corante, a da Hematoxilina ocorreu após 2.250 lâminas/430 mL, sendo determinada a troca de 50% da solução a cada 1.500 lâminas e 100% a cada 3.000 lâminas e o Orange G mostrou perda na qualidade após 6.000 lâminas. Conclusão: Neste estudo, compartilhamos a experiência da SITEC/DIPAT/INCA na formulação dos corantes e monitoramento dos prazos de validade dos mesmos a fim de garantir a qualidade desse procedimento, permitindo a leitura segura dos exames colpocitológicos.
Palavras-chave
Coloração de Papanicolaou; Citopalogia; Controle de qualidade
INTRODUÇÃO
A coloração de Papanicolaou é universalmente utilizada em citopatologia ginecológica e constitui um dos critérios a ser analisado na fase pré-analítica do Monitoramente Interno da Qualidade (MIQ) dos laboratórios públicos e privados prestadores de serviço para o Sistema Único de Saúde (SUS).(1-3)
Nesta técnica, os esfregaços citopatológicos, após serem fixados, seguem para a bateria de coloração, que é constituída por um corante nuclear, a hematoxilina, e dois citoplasmáticos, Orange G e EA (36, 50 ou 65).(1,3-5)
A coloração de Papanicolaou clássica, criada em 1942, por Georgius Nikolaou Papanicolaou, passou por modificações apresentadas baseadas na literatura, reduzindo o número de lavagens e/ou alterando substâncias químicas, a fim de diminuir os custos e o tempo, além de reduzir os prejuízos ao meio ambiente, porém, mantendo os critérios estabelecidos para avaliação da qualidade.(4,6,7)
Este estudo tem como objetivo descrever a coloração de Papanicolaou adaptada pela Seção Integrada de Tecnologia em Citopatologia (SITEC) da Divisão de Patologia (DIPAT) do Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA) e demonstrar o método utilizado para monitorar o prazo de validade do corante, a fim de manter a qualidade da coloração.
MATERIAL E MÉTODOS
Este estudo qualitativo consistiu na análise da coloração, indicador da fase pré-analítica do MIQ, proposto na Portaria do Ministério da Saúde nº 3.388, que redefine a Qualificação Nacional em Citopatologia na prevenção do câncer do colo do útero (QualiCito)(2) e no Manual de Gestão da Qualidade para Laboratórios de Citopatologia.(1)
O controle de qualidade foi realizado por meio do monitoramento de 760 lâminas escolhidas aleatoriamente de um total de 160.933 exames colpocitológicos, utilizando-se o método convencional, no período de outubro de 2011 a março de 2012. Para realizar a coloração, foi utilizada a coradora automática Shandon Varistain 24-4 (GMI inc). A bateria de coloração de Papanicolaou adaptada pela SITEC/DIPAT/INCA está representada na Tabela 1. Todas as cubas de corantes foram preenchidas com o volume de 430 mL, quantidade necessária para corar o esfregaço e não atingir as etiquetas, prejudicando a identificação.
O controle da qualidade foi realizado diariamente, por amostragem, para monitorar a qualidade de cada corante, inclusive sua estabilidade. Para cada lâmina observada ao microscópio óptico Nikon Eclipse E200, foram atribuídas notas de 0 a 10, considerando os seguintes critérios: a intensidade de coloração nuclear, o contraste entre a coloração citoplasmática eosinofílica e cianofílica, a definição da cromatina nuclear, a qualidade da desidratação da lâmina e a clareza da montagem. Cada caso foi observado avaliado por dois citotecnologistas experientes, um deles responsável pela coloração e o outro funcionário envolvido na rotina de escrutínio. A avaliação da coloração destas lâminas foi realizada pela média das notas atribuídas. Estas lâminas ainda foram submetidas à observação e orientação de um citopatologista. As lâminas que apresentaram notas acima de 8 (Figura 1 A e B) foram consideradas como satisfatórias na avaliação dos corantes. Desta forma, foi analisada a qualidade das três soluções (Hematoxilina, Orange G e EA). Sabendo-se que cada corante possui características e perda de sua qualidade distintas, o objetivo era diagnosticar em que momento ocorreria a perda da eficiência de cada corante. A partir desta análise foram estabelecidos critérios para a troca, ou seja, a relação entre a quantidade de lâminas coradas e a qualidade da coloração. Na SITEC/DIPAT/INCA considera-se que o momento ideal para a troca dos corantes situa-se antes da ocorrência da perda da qualidade da coloração.

A
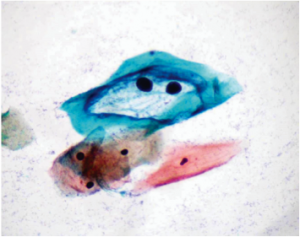
B
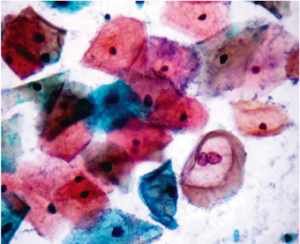
Figura 1 A e B. Coloração de Papanicolaou monstrando a diferenciação na impregnação dos corantes. Cianofilia demonstrada no citoplasma das células intermediárias e eosinofilia no citoplasma das células superficiais, ambos corados pelo EA, além de núcleos corados pela Hematoxilina.
Fonte: SITEC/DIPAT/INCA
Todos os dados obtidos para análise foram organizados em planilhas (programa Microsoft Excel 2010) para monitorar a qualidade da coloração, assim como a quantidade de lâminas coradas. O estudo foi aprovado pelo Comitê de Ética em Pesquisa (CEP) do INCA, CAAE 32632314.6.0000.5274.
RESULTADOS
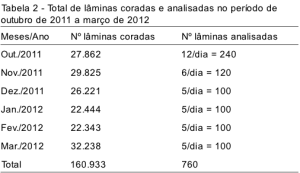
A Tabela 2 apresenta a quantidade de lâminas coradas e analisadas na SITEC/INCA durante o período de outubro de 2011 a março de 2012. Esse controle diário foi feito, inicialmente, a partir da observação ao microscópio (Nikon Eclipse E200), de 12 lâminas retiradas aleatoriamente da rotina. A quantidade de lâminas analisadas foi reduzida ao longo dos meses.
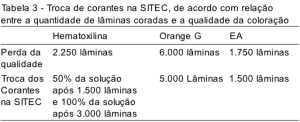
A perda da qualidade de cada corante e o momento que a SITEC/DIPAT/INCA considera ideal para realizar as trocas estão representados na Tabela 3. O corante que se mostrou mais sensível a esta diluição foi o EA, apresentando perda de sua eficiência após 1.750 lâminas coradas para cada 430 mL de corante. A diminuição da qualidade da Hematoxilina ocorreu após 2.250 lâminas/430 mL, sendo determinada a troca de 50% da solução a cada 1.500 lâminas e 100% a cada 3.000 lâminas. O Orange G possui maior estabilidade, mostrando perda na qualidade após 6.000 lâminas.
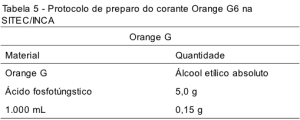
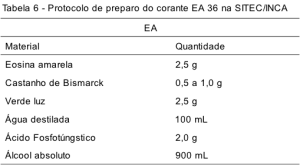
As Tabelas 4, 5 e 6 apresentam o protocolo de preparação de um litro dos corantes hematoxilina, Orange G e EA, respectivamente, na SITEC/DIPAT/INCA. Após o preparo, todos os corantes são filtrados, envasados em um recipiente escuro, etiquetados com identificação, lote e data de preparo e guardados em local protegido de luz e calor.

DISCUSSÃO
O procedimento da coloração de Papanicolaou na citologia oncótica consiste em processo de múltiplas etapas destinadas a evidenciar variações na morfologia, nos graus de maturidade e de atividade metabólica da célula.(6,8)
Simples variações como a composição química da água corrente, a temperatura ambiente, pH da amostra e número de lâminas coradas por lote podem afetar o equilíbrio entre os diferentes matizes de cores produzidas pelos corantes utilizados na técnica de Papanicolaou. Sendo assim, é fundamental que os laboratórios realizem verificações diárias de controle de qualidade com esfregaços escolhidos aleatoriamente.(1,5,9)
Após a coleta do material, os esfregaços citopatológicos devem ser fixados em álcool a 96% ou em fixadores de cobertura. Na SITEC/DIPAT/INCA, o recebimento das amostras é padronizado em álcool a 96%, considerado na literatura como o fixador mais eficiente(5) e seguem diretamente para a bateria de coloração. Já os esfregaços com fixadores de cobertura, antes da coloração, devem ser submetidos a banhos de álcool a 96% (pelo menos duas cubas, no mínimo 15 minutos cada) para eliminar a película de cobertura. Essa película inibe a penetração apropriada da coloração, especialmente da hematoxilina e do verde luz.(1)
Os corantes podem ser adquiridos prontos ou formulados a partir dos sais de corantes originais.(1,8-10) Na SITEC/DIPAT/INCA são preparados os corantes que serão utilizados na bateria de coloração, com protocolo adaptado para que se obtenha maior qualidade no diagnóstico. É importante ressaltar que, de acordo com o fabricante, esses materiais possuem características tintoriais e concentrações variáveis, que devem ser considerados pelos profissionais do setor de coloração.(7)
Gupta et al.,(8) Moosa et al.(12) e Izhar et al.(11) citam em seus trabalhos a utilização do ácido acético a 1% em substituição ao álcool etílico absoluto na preparação da coloração de Papanicolaou. Esta modificação é uma solução para países que, por motivos econômicos ou religiosos, não podem utilizar grandes quantidades de álcool etílico absoluto em seus laboratórios.
A coloração nuclear é realizada usando-se o corante natural básico, a hematoxilina. Na SITEC/DIPAT/INCA, é utilizado o método de coloração regressiva, no qual o núcleo é deliberadamente corado e o excesso de corante é removido com o fluxo contínuo da água corrente. A hematoxilina de Harris é a mais utilizada neste procedimento.(5,6)
Quando o núcleo é corado fracamente, é necessário verificar aspectos como tempo insuficiente na hematoxilina, espécime dessecado, contaminação da hematoxilina por fixadores de cobertura, tempo excessivo na água corrente, água corrente com pH ácido (excesso de cloro) ou corante com data expirada. Já quando o núcleo cora fortemente, o tempo de coloração pode ter sido ultrapassado, o corante pode estar muito concentrado ou a concentração do ácido da água corrente estar muito baixa. A solução de coloração também deve ser filtrada diariamente antes da sua utilização, caso contrário, poderá ocorrer o depósito de hematoxilina nos esfregaços.(5) Na SITEC, foi observado que, assim como os outros corantes, a hematoxilina perde sua eficiência devido à diluição crescente da solução (3.000 lâminas), ocorrida na sequência das baterias da coloração. Para se fazer a correção deste corante, pode-se realizar a troca total ou realizar trocas fracionadas com intuito de aumentar a concentração da solução. Em nossa rotina optamos em fazer, de forma intercalada, uma troca de 50% (1.500 lâminas) e, posteriormente, a troca total da solução (3.000 lâminas).
O Orange G é um corante monocromático que cora queratina, os grânulos de eosinófilos, as hemácias e as células superficiais.(13) É um corante ácido, levemente solúvel em álcool a 96% e em água. A adição de ácido fosfotúngstico, um mordante que se liga fortemente a proteínas, intensifica a cor do Orange G.(6) O tempo de exposição deste corante é variável (normalmente entre 15´´ e 30´´), dependendo da preferência dos profissionais quanto à intensidade desta coloração no esfregaço. O Orange G mostrou, na rotina da seção, uma maior estabilidade se comparada aos outros componentes da coloração. Na SITEC tem-se optado pela troca total da solução (5.000 lâminas), já que, no momento da detecção de sua ineficiência, a diluição do corante se mostrou bastante evidente.
O EA é um corante ácido, derivado da combinação do verde luz, eosina amarela e, em alguns casos, do castanho Bismarck. No método de Papanicolaou, o verde luz atua corando o citoplasma das células metabolicamente ativas, das células intermediárias, parabasais e células colunares, histiócitos, de carcinoma indiferenciado de grande e pequenas células e de adenocarcinoma. A eosina cora o citoplasma das células superficiais.(6,13) Na preparação do EA, os corantes eosina amarela e castanho Bismarck são diluídos em álcool absoluto. Já o corante verde luz é diluído em água. Assim, no protocolo de preparação da SITEC/DIPAT/INCA, são adicionados 100 mL de água destilada a cada litro de solução. O ácido fosfotúngstico é adicionado como parte final no processo do preparo da solução do EA. Um fator importante a ser considerado é a fotossensibilidade elevada deste corante,(6) sendo necessário o recolhimento do corante, de forma adequada, ao final da rotina, para preservar a substância e assim evitar a perda de sua eficiência de forma prematura. Deve-se ainda considerar que o EA é um corante policrômico de estabilidade delicada. Nos testes realizados no setor de coloração da SITEC, detectou-se uma queda abrupta da qualidade do corante após o início da perda de sua eficiência (1.750 lâminas). Portanto, em nossa rotina de coloração, foi estabelecido que se fizesse a troca total desta solução antes mesmo da queda prevista (1.500 lâminas), como medida de segurança, a fim de garantir a qualidade final da coloração.
Quando o citoplasma cora palidamente, é necessário verificar a data dos corantes, se os esfragaços ficaram muito tempo mergulhados no álcool ou se a remoção dos fixadores foi inadequada. Se as células estiverem coradas em rosa, as causas prováveis são: que tenham ficado pouco tempo no EA, que o esfregaço esteja dessecado, tempo muito curto nos últimos banhos de álcool, contaminação do álcool com água antes do clareamento com xilol ou erro na preparação do corante. Caso o esfregaço tenha ficado por tempo em excesso na hematoxilina, ou quando há falha na remoção da hematoxilina no método regressivo, o citoplasma pode apresentar coloração acinzentada. É necessário atentar para critérios como tempo insuficiente de coloração, tempo no álcool após os corantes citoplasmáticos, nível de solução nas cubas, filtração e agitação dos corantes, imprescindíveis para adequação da coloração citoplasmática.(5) Os resultados da coloração de Papanicolaou não dependem apenas do método utilizado, mas também das características comerciais dos corantes e do pH da amostragem celular. Portanto, a coloração de Papanicolaou não pode ser considerada como exata e perfeita.(9)
CONCLUSÃO
A coloração de Papanicolaou é universalmente aplicada em laboratórios de citopatologia. Nesse estudo, foi compartilhada a experiência da SITEC/DIPAT/INCA na formulação dos corantes e acompanhamento dos momentos de necessidade de troca dos mesmos a fim de garantir a qualidade desse procedimento, permitindo leitura segura dos exames colpocitológicos.
Abstract
Introduction: The Papanicolaou stain method is universally applied in cytopathology laboratories. The classic version has undergone modifications presented in the literature by reducing the number of washes and / or by replacing some chemicals. Objective: To describe the Papanicolaou staining method adapted by the Seção Integrada de Tecnologia em Citopatologia [Integrated Center for Technology in Cytopathology] – SITEC of the Instituto Nacional de Câncer [National Cancer Institute] – INCA and to demonstrate the method used to assess the need for dye exchange in order to maintain quality coloring. Methods: 760 slides were randomly chosen from 160,933 cervical cytology specimens, to monitor the staining quality, using the conventional method, from October 2011 to March 2012. All data for analysis was organized in tables using Microsoft Excel 2010. Results: The loss of EA staining quality occurred after 1,750 slides stained for each 430 mL of dye. Hematoxylin after 2250 sheets/430 mL suggesting that 50% of the solution should be replaced every 1,500 slides. After 3,000 slides 100% of the solution should be replaced. Orange G showed loss in quality after 6,000 stained slides. Conclusion: In this study, we share the experience of SITEC/DIPAT/INCA in the formulation of dyes and expirations dates monitoring to replace solutions in order to ensure the quality of the procedure, allowing safe screening in cervical cytology.
Keywords
Papanicolaou staining; Cytopathology; Quality control
Referências
- Brasil, Ministério da Saúde. Instituto Nacional de Câncer José Alencar Gomes da Silva. Coordenação-Geral de Prevenção e Vigilância. Divisão de Detecção Precoce e Apoio à Organização de Rede. Manual de Gestão da Qualidade para Laboratório de Citopatologia. Rio de Janeiro: Inca, 2012.
- ________. Portaria nº 3.388, de 30 de Dezembro de 2013, Institui a Qualificação Nacional em Citopatologia na prevenção do câncer do colo do útero (QualiCito), no âmbito da Rede de Atenção à Saúde das Pessoas com Doenças Crônicas. Diário Oficial [da República Federativa do Brasil]. Seção 1, página 42. Brasília DF, 31 de Dezembro de 2013.
- Koss LG, Gompel C. Citopatologia Ginecológica com Correlações Histológicas e Clínicas. São Paulo, SP. Editora Roca, 2006.
- Dergovics FL, Moura TPS, Shirata NK, Pereira SMM. Avaliação do desempenho da mistura verniz/xilol na diafanização de lâminas de citopatologia coradas com a técnica de Papanicolaou. Rev Bras Anál Clín. 2012;44(1):35-38.
- Queiroz C, Lima D. O Laboratório de Citopatologia: Aspectos Técnicos e Operacionais. Editora Universitária UFPE, Recife, 222p, 2000.
- Eleutério Jr J. Noções Básicas de Citologia Ginecológica. Livraria Santos Editora Ltda, São Paulo, 2003.
- Molinaro EM. Conceitos e Métodos para Formação de Profissionais em Laboratórios de Saúde. Volume 2. Rio de Janeiro: EPSJV, IOC, 2010.
- Gupta S, Chachra KL, Bhadola P, Sodhani P. Modified Papanicolaou staining protocol with minimum alcohol use: a cost-cutting measure for resource-limited settings. Cytopathology. 2010 Aug; 21(4):229-33.
- http://www.eurocytology.eu/en/course/1119. Visualizado: 12 de maio de 2015, às 07:54 h.
- Berkan TK, Reeder JE, Lopez PA Jr, Gorman KM, Wheeless LL Jr. A protocol for Papanicolaou staining of cytologic specimens following flow analysis. Cytometry. 1986 Jan;7(1):101-3.
- Izhar S, Kaur R, Masih K. Efficacy of rapid, economical, acetic acid, Papanicolaou stain in cervical smears as an alternative to conventional Papanicolaou stain. J Cytol. 2014 Jul;31(3):154-7.
- Moosa NY, Khattak N, Alam MI, Sher A, Shah W, Mobashar S, et al. Comparison of cervical cell morphology using two different cytology techniques for early detection of pre-cancerous lesions. Asian Pac J Cancer Prev. 2014;15(2):975-81.
- Bibbo M, Wilbur D. Comprehensive Cytopathology. 3ª Edição. Elsevier Editora, 2010.
Correspondência
Mario Lucio Cordeiro Araujo Junior
Dipat-Inca
Rua Cordeiro da Graça, 156 – Santo Cristo
Rio de Janeiro, RJ, Brasil
