Monitoramento externo da qualidade em citopatologia cervical no Instituto Nacional do Câncer, Rio de Janeiro, Brasil
External quality monitoring in cervical cytopathology of the National Câncer Institute, Rio de Janeiro, Brazil
Shirley Borges de Souza Quintana1
Mario Lucio Cordeiro Araujo Junior2
Daniela Alves Santana3
Gloria Regina Ferreira da Silva3
Carine Fernandes Botelho4
1Citotecnologista. Instituto Nacional do Câncer – INCA – Rio de Janeiro, RJ, Brasil.
2Citopatologista, PhD. Instituto Nacional do Câncer – INCA – Rio de Janeiro, RJ, Brasil.
3Especialização em Citologia Clínica. Instituto Nacional do Câncer – INCA – Rio de Janeiro, RJ, Brasil.
4Mestre em Biologia Animal – Universidade Federal Fluminense – UFF – Niterói, RJ, Brasil.
Instituição: Instituto Nacional do Câncer José Alencar Gomes da Silva (INCA) – Rio de Janeiro, RJ, Brasil.
Artigo recebido em 10/12/2015
Artigo aprovado em 24/02/2016
DOI: 10.21877/2448-3877.201600443
Resumo
O Monitoramento Externo da Qualidade (MEQ) é uma estratégia proposta pelo Ministério da Saúde a fim de monitorar a qualidade do trabalho de laboratórios públicos ou privados que prestam serviço ao Sistema Único de Saúde, referentes aos exames colpocitológicos. Neste trabalho, o funcionamento do MEQ na Seção Integrada de Tecnologia em Citopatologia (SITEC), da Divisão de Patologia (DIPAT) do Instituto Nacional do Câncer José Alencar Gomes da Silva (INCA) é apresentado com o passo a passo de ações de laboratório tipo II e o manuseio das informações necessárias para levar a uma quantificação dos dados, transformando-os em indicadores. São abordadas a apresentação de fluxogramas, planilhas, a formatação de relatórios, além de enfatizada a literatura relacionada à implantação do MEQ no Brasil. O presente trabalho pretende contribuir para que o gestor saiba onde será necessário intervir visando melhorias no laboratório, seja no âmbito técnico ou profissional.
Palavras-chave
Controle de Qualidade; Esfregaço vaginal; Oncologia
INTRODUÇÃO
O câncer de colo uterino permanece como um importante problema de saúde pública no Brasil. A estimativa de câncer para o biênio 2016/2017 em nosso país aponta para a ocorrência de aproximadamente 16.340 mil novos casos dessa neoplasia.(1)
O exame preventivo ginecológico é um exame de citologia cervical realizado como prevenção ao câncer do colo do útero e tem sido considerado de baixa sensibilidade (41% a 70%) e grande parte dos laboratórios brasileiros apresentam indicadores da qualidade fora dos padrões recomendados, como Índice de Positividade (IP) abaixo de 3,0%.(2-6) Essa realidade gerou a necessidade de proceder a uma revisão dos exames realizados pelos laboratórios que ainda mantinham credenciamento pelo Sistema Único de Saúde (SUS). Para isso, foi regulamentada, pela Portaria Federal nº 3.388 de 30 de dezembro de 2013, a redefinição da Qualificação Nacional em Citopatologia na prevenção do câncer do colo do útero (QualiCito), no âmbito da Rede de Atenção à Saúde das Pessoas com Doenças Crônicas.(7,8)
A QualiCito redefine os padrões de avaliação da qualidade do exame citopatológico do colo uterino através do acompanhamento do desempenho dos laboratórios públicos e privados prestadores de serviços para o SUS, com a implementação do Programa de Controle de Qualidade, abrangendo o Monitoramento Interno da Qualidade (MIQ) e o Monitoramento Externo da Qualidade (MEQ).(8)
O MEQ consiste na revisão dos esfregaços do exame preventivo ginecológico por laboratório diferente daquele que realizou a primeira leitura. São considerados laboratórios tipo I aqueles que realizam exames citopatológicos do colo do útero e tipo II os responsáveis por realizar estes exames no âmbito do MEQ, além de poderem realizar também as ações dos laboratórios tipo I.(5,8)
Este trabalho tem por objetivo apresentar o funcionamento do MEQ na Seção Integrada de Tecnologia em Citopatologia (SITEC), da Divisão de Patologia (DIPAT) do Instituto Nacional do Câncer José Alencar Gomes da Silva (INCA). A pesquisa foi submetida ao Comitê de Ética e Pesquisa (CEP) da instituição e aprovada sob o nº. CAAE 32632314.6.0000.5374.
MONITORAMENTO EXTERNO DA QUALIDADE
Segundo a QualiCito, o MEQ tem por finalidades avaliar o desempenho dos laboratórios tipo I e a qualidade dos exames citopatológicos do colo do útero por eles realizados, detectar as diferenças de interpretação dos critérios citomorfológicos, aumentar a eficiência do processo de realização destes exames e reduzir o percentual de exames falsos-negativos, falsos-positivos e insatisfatórios.(8)
Para tal, o Sistema de Informação de Câncer (SISCAN) ou outro sistema de informação definido pelo Ministério da Saúde (MS) realiza uma seleção das lâminas de uma determinada competência previamente pactuada entre a Secretaria Estadual de Saúde (SES) e/ou Secretaria Municipal de Saúde (SMS) e o laboratório tipo II. Essa seleção abrange todos os exames positivos e insatisfatórios e, no máximo, 10% dos exames negativos produzidos em cada laboratório tipo I sob sua responsabilidade.(8)
Dentro desse contexto de avaliação da qualidade dos laboratórios citopatológicos, há cinco indicadores que avaliam o desempenho dos laboratórios: o IP, o percentual de exames compatíveis com atipias escamosas de significado indeterminado (ASC) entre os exames satisfatórios, o percentual de ASC entre os exames alterados, a razão ASC/Lesões intraepiteliais escamosas (SIL) e o percentual de lesão intraepitelial de alto grau (HSIL) conforme consta no Manual de Gestão da Qualidade para Laboratórios de Citopatologia.(5)
Para contratação ou renovação de contrato com laboratórios próprios ou prestadores de serviços do SUS, esses indicadores devem estar comprovadamente dentro das seguintes margens: IP igual ou superior a 3% dos exames satisfatórios, o percentual de ASC/Alterados inferior a 60%, o percentual de HSIL igual ou superior a 0,4% dos exames satisfatórios. O Manual de Gestão da Qualidade para Laboratórios de Citopatologia ainda recomenda que a razão ASC/SIL seja menor que 3 e que a razão ASC/exames satisfatórios seja de 4%-5%. Ressalta-se ainda que o laboratório tipo I deve apresentar uma produção mínima de 15 mil exames/ano.(5,8)
Metodologia para Monitoramento Externo da Qualidade na SITEC/INCA
Cabe à Secretaria Municipal de Saúde (SMS) e/ou Secretaria Estadual de Saúde (SES), no âmbito das Comissões Intergestores, definir o fluxo e a periodicidade do envio dos exames dos laboratórios tipo I para os laboratórios tipo II. A listagem selecionada pela SES e/ou SMS é enviada ao laboratório tipo I para que as lâminas sejam separadas e, no prazo de até dez dias, são enviadas ao laboratório tipo II, onde será realizada a revisão. Essas devem vir em caixas numeradas, separadas por seleção, tais como: negativos, positivos e insatisfatórios,(8) se possível, ou na ordem da listagem selecionada coincidindo lâmina com a cópia do laudo.(5)
A revisão deve ser feita em até trinta dias, quando as lâminas devem ser devolvidas ao laboratório tipo I. Os laudos são digitados e exportados para a SES e/ou SMS para a emissão dos relatórios (sintético e analítico). O relatório final com as não conformidades e a relação de exames discordantes e suas orientações devem ser enviados ao laboratório tipo I. Segundo os critérios estabelecidos pelo INCA, consideram-se concordantes os que recebem a mesma conduta clínica e discordantes os que implicam mudança de conduta.(5)
No relatório final é sugerida uma data para reunião de consenso entre os médicos citopatologistas e/ou citologistas habilitados de ambos os laboratórios. Nesta reunião, todos os exames que foram diagnosticados como discordantes pelo laboratório tipo II são debatidos.(5) A Figura 1 ilustra esse procedimento, enquanto que os critérios de concordância obedecem ao diagrama da Figura 2.
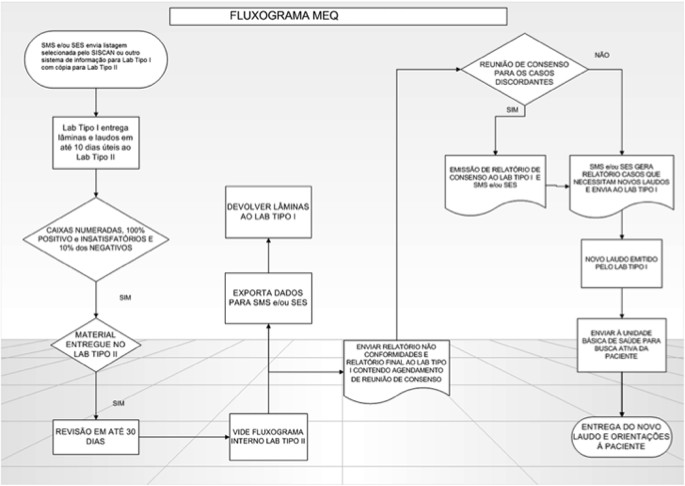
Figura 1. Fluxograma MEQ. MEQ: Monitoramento Externo da Qualidade; SMS: Secretaria Municipal de Saúde; SES: Secretaria Estadual de Saúde; SISCAN: Sistema de Informação de Câncer.
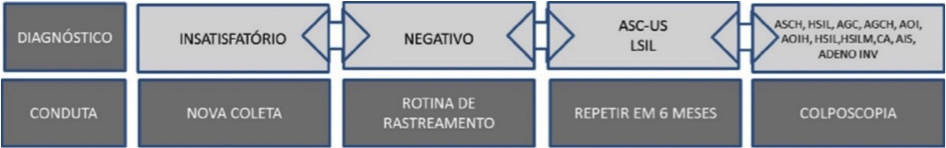
Figura 2. Condutas preconizadas a partir dos diagnósticos.
Fluxograma interno para o Monitoramento
Externo da Qualidade na SITEC/INCA
As fases do processo de revisão dos exames pelo laboratório tipo II são classificadas em pré-analítica, analítica e pós-analítica.
Fase pré-analítica
A avaliação é feita no momento em que os exames chegam à recepção do laboratório tipo II. De acordo com a listagem selecionada, é realizada a avaliação dos itens listados na Tabela 1 e anotadas as não conformidades discriminadas em planilha utilizando-se o programa Excel 2010.

Fase analítica
Consiste na avaliação dos itens apresentados na Tabela 2 no momento da leitura das lâminas pelo profissional de nível superior (médicos citopatologistas e/ou citologistas habilitados).
Tabela 2 – Lista de Itens da Avaliação Analítica
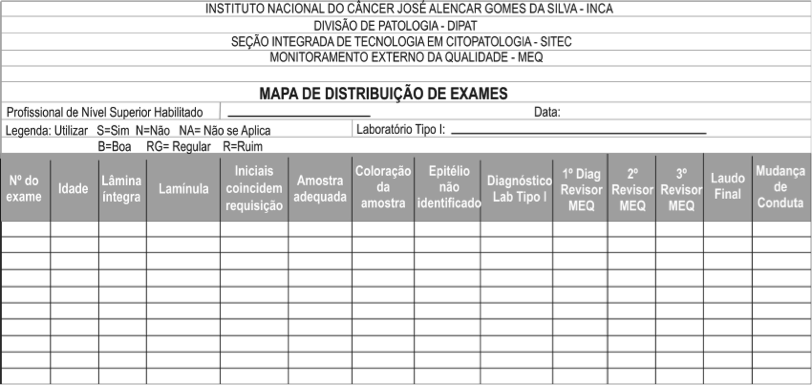
Fase pós-analítica
Após a fase analítica, todos os dados anotados na Tabela 2 são lançados em planilha utilizando-se o programa Excel 2010. Esses dados são automaticamente atualizados a partir de fórmulas previamente criadas, cujos totais e percentuais são calculados e discriminados conforme ítens da Tabela 3.
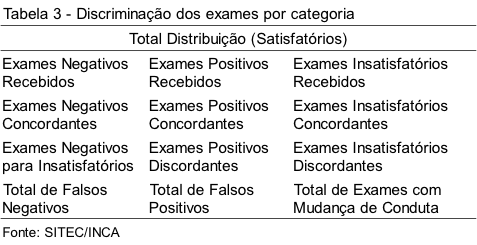
Os casos que apresentarem diagnóstico discordante entre os laboratórios tipo I e o MEQ têm as imagens das células capturadas por um aparelho de fotografia digital acoplado a um microscópio. As imagens são gravadas em CD-ROM e encaminhadas junto ao relatório final.(5)
É realizado relatório final pelo MEQ, contendo todos os dados desde a avaliação pré-analítica até a pós-analítica e enviado ao laboratório tipo I. Nesse relatório estão inseridos gráficos contendo o total e o percentual de resultados falsos-negativos, falsos-positivos, bem como o total de exames que mudarão de conduta. São anotadas recomendações para as melhorias que devem ser feitas no laboratório tipo I em relação à qualidade dos exames citopatológicos. Todas as etapas do processo interno do MEQ são ilustradas na Figura 3.
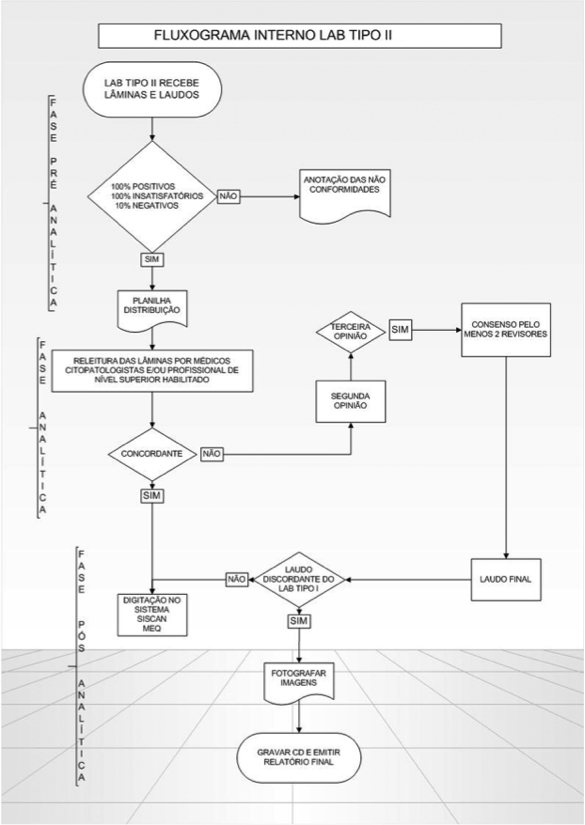
Figura 3 – Fluxograma Interno do MEQ SITEC
MEQ: Monitoramento Externo da Qualidade; SITEC: Seção Integrada de Tecnologia em Citopatologia
DISCUSSÃO
Este artigo pretende compartilhar a metodologia de MEQ da SITEC/DIPAT/INCA a fim de contribuir na implementação de rotinas de monitoramento da qualidade nos laboratórios brasileiros de citopatologia, públicos ou privados, que prestam serviço ao SUS.
Alguns artigos sobre análise de monitoramento da qualidade dos laboratórios prestadores de serviço ao SUS demonstraram que, após a implantação do MEC, ocorreu uma melhoria dos laboratórios e diagnósticos dos exames de citopatologia.(9-11) Esses artigos comprovaram a exequibilidade do MEQ dos exames citopatológicos na esfera estadual, sua sustentabilidade ao longo de dez anos e a contribuição para a garantia da qualidade dos diagnósticos feitos no SUS, demonstrada pela crescente melhoria nos índices de concordância obtidos.(12) Na experiência adquirida com a implantação dessa metodologia no MEQ/SITEC/INCA, foi observada melhoria na coloração e na fixação, além de diminuição dos índices de falsos-negativos e falsos-positivos nos laboratórios tipo I avaliados (dados não publicados). A realização do MEQ de forma organizada contribui para o planejamento de estratégias de educação continuada, de forma a garantir a melhoria da qualidade dos exames colpocitológicos.(2)
CONCLUSÃO
O presente trabalho descreve o passo a passo de ações de laboratório tipo II e o manuseio das informações necessárias para levar a uma quantificação dos dados, transformando-os em indicadores para que o gestor saiba onde será necessário intervir visando melhorias no laboratório, seja no âmbito técnico seja no profissional.
Abstract
External Quality Monitoring (EQM) is a strategy proposed by the Ministry of Health to monitor the quality of colpocytologic exams in public or private laboratories that render services to the Unified Health System (SUS). In this paper, we present how EQM works at the Cytopathology Technology Integrated Section (SITEC) of the Pathology Division (DIPAT) of the National Câncer Institute José Alencar Gomes da Silva (INCA), stating systematically the type II laboratory actions that are carried out and managing specific information to turn into data quantification, leading to indicators. Flowcharts, spreadsheets and report structuring will be included, as well as an emphasis on the literature related to the EQM implementation in Brazil. This paper intends to contribute so that managers know necessary points of intervention to improve the laboratory on technical and professional levels.
Keywords
Quality Control; Vaginal smears; Oncology
REFERÊNCIAS
- Brasil. Ministério da Saúde. Brasil. Instituto Nacional do Câncer José Alencar Gomes da Silva. Coordenação de Prevenção e Vigilância. Estimativa 2016: Incidência de Câncer no Brasil. Rio de Janeiro; 2015. Disponível em; http://www.inca.gov.br/ bvscontrolecancer/publicacoes/edicao/Estimativa_2016.pdf
- Etlinger D, Pereira SMM., Sakai YI, et al. Análise das discordâncias dos exames citopatológicos do Programa de Monitoramento Externo de Qualidade no Estado de São Paulo, Brasil, 2000-2010. Rev. bras. cancerol. 2012;58(3):481-8.
- Tuon FFB, Bittencourt MS, Panichi MA, Pinto AP. Avaliação da sensibilidade e especificidade dos exames citopatológicos em relação ao exame histológico na identificação de lesões intra-epiteliais cervicais. Rev. Assoc. Med. Bras. 2002;48(2):140-4.
- Renshaw AA, Elsheikh TM. Predicting screening sensitivity from workload in gynecologic cytology: a review. Diagn Cytopathol. 2011 Nov;39(11):832-6.
- Brasil. Ministério da Saúde Instituto Nacional do Câncer José Alencar Gomes da Silva. Coordenação-Geral de Prevenção e Vigilância. Divisão de Detecção Precoce e Apoio à Organização de Rede. Manual de gestão da qualidade para laboratório de citopatologia. Rio de Janeiro; 2012. Disponível em: http://www1.inca.gov.br/inca/Arquivos/livro_completo_manual_ citopatologia.pdf
- Bortolon PC, Silva MAF, Corrêa FM, Dias MBK, Knupp VMAO, Assis M, et al – Avaliação da qualidade dos laboratórios de citopatologia do colo do útero no Brasil. Rev. bras. cancerol. 2012;58(3):435-44.
- Brasil. Ministério da Saúde. Secretaria de Políticas de Saúde. Secretaria de Assistência à Saúde. Portaria conjunta n. 92, 16 outubro 2001. Diário Oficial da República Federativa do Brasil, Brasília (DF) 2001 Out 17.
- Brasil. Ministério da Saúde. Portaria nº 3.388, de 30 de Dezembro de 2013, Institui a Qualificação Nacional em Citopatologia na prevenção do câncer do colo do útero (QualiCito), no âmbito da Rede de Atenção à Saúde das Pessoas com Doenças Crônicas. Diário Oficial [da República Federativa do Brasil]. Brasília (DF); 2013 December 13. Seção 1, p. 42.
- Amaral RG, Souza NLA, Tavares SBN, Manrique EJC, Assem DZ, Azevedo LL, et al. Controle externo da qualidade dos diagnósticos citológicos no rastreamento do câncer cervical: estudo piloto. RBAC. 2006;38(2):79-81.
- Collaço LM, de Noronha L, Pinheiro DL, Bleggi-Torres LF. Quality assurance in cervical screening of a high risk population: a study of 65,753 reviewed cases in Parana Screening Program, Brazil. Diagn Cytopathol. 2005;33(6):441-8.
- Pereira SMM, Ramos DEL, Yamamoto LSU, Shirata NK, di Loreto C, Ferraz MGMC, et al. Monitoramento externo de qualidade em citopatologia cervical e o reflexo na rotina dos laboratórios da rede pública. DST J Bras Doenças Sex Transm. 2006;18(3):172-7.
- Freitas HG, Thuler LCS. Monitoramento externo da qualidade dos exames citopatológicos cervicais realizados pelo Sistema Único de Saúde (SUS) no Estado de Mato Grosso do Sul. Trabalho realizado na Secretaria Estadual de Saúde de Mato Grosso do Sul – Cuiabá (MT), Brasil. [Internet] Available at: http://www.scielo.br/pdf/rbgo/v34n8/02.pdf.
Correspondência
Shirley Borges de Souza Quintana
Rua Cordeiro da Graça, 156 – Santo Cristo
22220-400 – Rio de Janeiro, RJ
