Ocorrência de micoses superficiais em um centro de saúde pública localizado na cidade de Patos – PB, Brasil
Occurrence of superficial mycoses in public health unit in the city of Patos – PB, Brazil
Ertenia Paiva Oliveira1
Franciélia de Sousa Andrade2
Reginaldo Gonçalves de Lima-Neto3
1Técnica de laboratório. Graduanda em Biomedicina – Faculdades Integradas de Patos – PB, Brasil.
2Graduanda em Biomedicina – Faculdades Integradas de Patos – PB, Brasil.
3Pós-Doutorando em Biologia de Fungos – Universidade Federal de Pernambuco – Recife – PE, Brasil.
Instituição: Faculdades Integradas de Patos – PB, Brasil.
Artigo recebido em 30/11/2012
Artigo aprovado em 24/02/2016
DOI: 10.21877/2448-3877.201600064
Resumo
Micoses superficiais são infecções fúngicas que acometem as camadas superficiais da pele e seus anexos. Essas micoses são prevalentes em todo mundo, e, embora o semiárido nordestino apresente clima propício para o surgimento dessas infecções, são raros os estudos acerca do assunto. Diante do exposto, essa pesquisa teve como objetivo diagnosticar e evidenciar a incidência de micoses superficiais em pacientes atendidos na área de dermatologia de um centro de saúde pública na cidade de Patos – PB, além de determinar o perfil de sensibilidade antifúngica dos agentes etiológicos isolados. Foram coletadas 34 amostras biológicas, obtidas através de escarificações epidérmicas ou ungueais. Das amostras coletadas, 15 (44,11%) apresentaram resultado positivo para dermatomicose. As infecções que mais acometeram os pacientes foi Candidíase (60%), Pitiríase versicolor (26,66%), Fusariose cutânea (6,66%) e Onicomicose aspergilar (6,66%). Nos testes de sensibilidade antifúngica, os isolados de Candida sp. foram sensíveis a todos os fármacos testados, já o Fusarium sp. apresentou resistência. A Candida sp. foi o agente etiológico isolado mais frequente e isso pode ser explicado pelos fatores climáticos e socioeconômicos da região, que são propícios para o desenvolvimento desse fungo oportunista.
Palavras-chave
Micoses; Diagnóstico; Candida sp.; Fusarium sp.; Testes de sensibilidade a antifúngicos
INTRODUÇÃO
As micoses superficiais são infecções causadas por fungos que mais comumente atingem a população humana, restringindo-se às camadas mais superficiais da pele e seus anexos, acometendo pele, cabelo e unhas, sendo os fungos queratinofílicos seus principais agentes etiológicos.(1,2,3)
As principais dermatomicoses no homem são as dermatofitoses (tinhas), pitiríase versicolor, além das leveduroses superficiais. Segundo Criado et al.,(4) as micoses superficiais são prevalentes em todo o mundo, sendo frequentes no Brasil devido a seu clima tropical, sendo mais encontrada em locais de clima quente e úmido. Na região Nordeste, o maior número de casos de dermatoses encontram-se em regiões litorâneas, no entanto não há pesquisas suficientes acerca do assunto no semiárido, embora saibamos que o referido clima é propicio para o desenvolvimento de tais micoses.(5) Segundo um dos raros estudos epidemiológicos realizados no estado da Paraíba, observou-se um alto índice de pitiríase versicolor, com 78% de acometimento da população.(6)
Para a obtenção do tratamento adequado é necessário conhecer o perfil de sensibilidade dos isolados clínicos e o espectro de ação dos antifúngicos, e para isso é importante a realização da análise in vitro da atividade antifúngica através do antifungigrama.(2) Pouco tempo atrás, o antifungigrama não era solicitado na prática médica, pois a maioria dos fungos apresentavam-se sensíveis a anfotericina B; entretanto, os fungos desenvolveram resistência a algumas drogas, e isso, somado ao fato do tratamento tornar-se mais difícil quando o paciente apresenta um imunocomprometimento, levou à necessidade de se determinar o perfil de sensibilidade dos isolados clínicos para orientação da terapêutica de forma correta. Além disso, esses fármacos podem causar diversos efeitos colaterais, entre eles destacando-se a hepatotoxicidade e a nefrotoxicidade.(1,7,8)
A frequência com que micoses superficiais acometem a população humana vem aumentando, tornando-as de grande interesse na prática médica; além disso, as micoses não constituem doença de notificação obrigatória, portanto não sabemos a extensão dessa prevalência. Isso evidencia a necessidade de estudos que investiguem os agentes etiológicos dessas infecções em conjunto com a realização dos testes de antifungigrama.
Este trabalho teve por objetivo verificar a ocorrência de micoses superficiais em um centro de saúde pública da cidade de Patos, isolar e identificar os agentes etiológicos dessas infecções e determinar o padrão de sensibilidade desses fungos isolados frente aos antifúngicos comercialmente disponíveis.
Material e Métodos
Foram coletadas 34 amostras clínicas de pacientes atendidos na área de dermatologia do Centro de Saúde Frei Damião da cidade de Patos, PB. Nos casos sugestivos de Pitiríase versicolor, foi realizada uma assepsia no local da lesão e, em seguida, feita a coleta através da escarificação das escamas epidérmicas em placa de Petri devidamente esterilizada. Paralelamente foi realizado o método de Porto, sendo em seguida semeado parte do material em meio ágar Sabouraud, para que pudesse ser feita a identificação do agente etiológico, sendo também realizado o exame direto, onde as escamas epidérmicas eram colocadas entre lâmina e lamínula e adicionada KOH a 20%, para ser possível a visualização das estruturas fúngicas caso houvesse; já para a técnica de Porto utilizou-se o corante azul de metileno, com o objetivo de visualizar também estruturas fúngicas. Nos casos sugestivos de dermatofitoses (tinhas) e leveduroses, foi feita assepsia no local da lesão, e o material foi então coletado por meio de escarificações epidérmicas, ungueais ou retirada de pêlo ou cabelo onde apresentavam lesões com indício de infecção fúngica. Estas coletas foram realizadas com auxílio de bisturi esterilizado, coletadas em placas de Petri, devidamente estéreis, sendo posteriormente analisadas por exame direto preparado com adição do KOH a 20% e semeado em ágar Sabouraud para o isolamento e identificação do fungo baseado nos estudos macro e micromorfológico das colônias, e, posteriormente, feita a verificação da sensibilidade aos antifúngicos.
Foram avaliados dois isolados de Candida e um isolado de Fusarium quanto ao perfil de sensibilidade para agentes antifúngicos. Os métodos utilizados seguiram as condições descritas no documento em M27-A3 para leveduras (CLSI, 2008) e M38-A2 para fungos filamentosos (CLSI, 2008).
Os agentes antifúngicos comerciais utilizados no teste in vitro foram cetoconazol, itraconazol e ciclopirox olamina (Medley S.A., Campinas, SP, Brasil) diluídos em dimetil sulfóxido (DMSO; Gibco, Minas Gerais, Brasil) e o fluconazol (FLU; Pfizer, Nova York, EUA), preparado em água destilada. Concentrações diferentes de ambos os antifúngicos foram preparados e usados nos intervalos de 0,03 a 16 µg/mL-1 para cetoconazol e itraconazol, 0,06 a 32 µg/mL-1 para ciclopirox olamina e 0,125 a 64 µg/mL-1 para fluconazol.
As amostras clínicas de Candida foram mantidas em meio Sabouraud Dextrose Ágar (SDA-Difco) e incubadas a 37°C por 24 horas. Suspensões dos isolados foram preparadas e a densidade foi ajustada de acordo com a escala 0,5 de MacFarland em 90% da transmitância a 530 nm, utilizando-se um espectrofotômetro (Spectronic Genesys, Application SoftcardTM, Milton Roy). O volume final do inóculo foi ajustado para 5,0 mL de solução salina esterilizada e, posteriormente, diluído em RPMI 1640 para uma concentração de 2-5×103 céls/mL-1 .
Os isolados de fungos filamentosos foram repicados em Sabouraud Dextrose Ágar (SDA-Difco) e incubados a 37ºC até ser obtida boa esporulação. Sequencialmente, 1 mL de solução salina (cloreto de sódio a 0,85%) esterilizada foi adicionada às colônias fúngicas e preparada uma suspensão mexendo-se delicadamente as colônias com a ponta de uma pipeta de transferência. Posteriormente, a mistura resultante foi transferida para tubo de ensaio esterilizado, adicionado de 10 mL de tween 20 para facilitar a dispersão dos esporos. Após cinco minutos de repouso, o sobrenadante foi transferido para outro tubo de ensaio esterilizado e agitado por 15 segundos em vórtex. A densidade da suspensão foi ajustada por espectrofotômetro a 530 nm para obter uma transmitância de 65-70%. Em seguida, as suspensões foram diluídas (1:50) em RPMI 1640, obtendo-se uma concentração final de 5 x 104 céls/mL.
Para os testes de sensibilidade, foram utilizadas placas de microtitulação de 96 poços (TPP; Trasadingen, Suíça). O inóculo foi adicionado aos poços com as drogas testadas, e as placas foram incubadas a 37oC durante 48 horas antes da leitura dos resultados para determinação da Concentração Inibitória Mínima (CIM) dos antifúngicos avaliados.
A sensibilidade antifúngica foi determinada de acordo com o método de referência publicado pelo Clinical Laboratory Standard Institute, baseado na variação de sensibilidade. O valor de CIM para as leveduras foi definido como a menor concentração de cetoconazol, ciclopirox olamina e itraconazol capaz de inibir totalmente o desenvolvimento dos isolados clínicos e a concentração do fluconazol capaz de inibir 50% de desenvolvimento em relação ao controle. O valor de CIM para o Fusarium sp. foi definido como a menor concentração itraconazol capaz de inibir totalmente o desenvolvimento do isolado clínico, a concentração do cetoconazol e fluconazol capaz de inibir 50% de desenvolvimento em relação ao controle e a concentração de ciclopirox olamina capaz de inibir pelo menos 80%.
Resultados
Foram analisadas 34 amostras biológicas (pele, unha e cabelo) coletadas de 32 pacientes, no período de agosto a setembro do ano de 2012. Destas, 15 amostras foram positivas para micoses superficiais, representando um índice de 44,11% de positividade. Além disso, em sete amostras foram observadas a presença de bactérias. O resultado dos exames micológicos é sumarizado na Tabela 1.
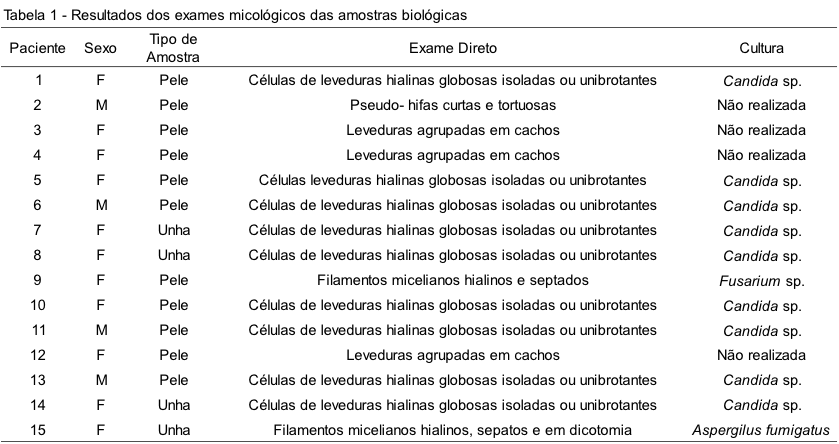
Conforme os resultados descritos na Tabela 1, observamos que, dentre as quinze amostras positivas, em nove (60%) identificamos Candida sp., quatro (26,66%) apresentaram resultado do exame direto sugestivo de Malassezia sp., em uma (6,66%) identificamos Fusarium sp. e, em outra (6,66%), Aspergillus fumigatus.
Foi avaliada a atividade antifúngica de cetoconazol, ciclopirox olamina, itraconazol e fluconazol frente a dois isolados clínicos de Candida sp. e um isolado clínico de Fusarium sp. A variação da concentração mínima inibitória de cada antifúngico testado é apresentada na Tabela 2.
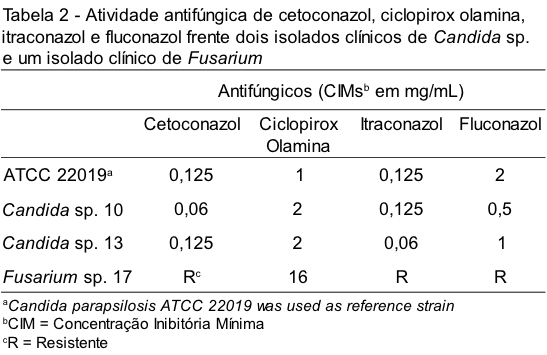
De acordo com a Tabela 2 observamos que os isolados de Candida sp. apresentaram menor CIM para o cetoconazol e itraconazol e demonstraram sensibilidade in vitro frente a todos os antifúngicos testados. Já para o Fusarium sp. só foi determinado CIM do ciclopirox olamina de 16 mg/mL, considerado resistente, assim como os demais antifúngicos.
Discussão
De acordo com Tomaz et al.,(9) estima-se que 20% a 25% da população mundial é acometida por micoses superficiais. Nossos resultados demonstraram uma incidência de 44,11% de infecções superficiais causadas por fungos.
As leveduras são um dos principais agentes etiológicos responsáveis pelas micoses superficiais e nesse estudo foi observado uma alta incidência de leveduras do gênero Candida sp. como o principal agente causador das dermatomicoses nessa região, o que pode ser explicado pelos fatores climáticos e socioeconômicos que são propícios para o desenvolvimento deste fungo que é oportunista.(1)
Em um trabalho realizado por Pontes et al.,(3) a Candida sp. foi o fungo mais isolado como agente etiológico das onicomicoses em João Pessoa, PB com uma incidência de 82%, dados esses que corroboram nossos achados, pois observamos as leveduras do gênero Candida sp. como as responsáveis por 75% das onicomicoses.
Um estudo realizado em Cuiabá (MT), no qual se pesquisaram leveduras do gênero Candida sp. na pele, mucosas e unhas de profissionais militares que apresentavam lesões clínicas compatíveis com leveduroses, demonstrou um índice de positividade de 46,2% de candidíase.(10) Nessa pesquisa observamos a Candida sp. como a responsável por 60% das infecções fúngicas superficiais, acometendo pele e unha. Com relação à distribuição por sexo, essa levedura apresentou uma predisposição pelo sexo feminino.
Pitiríase versicolor é outra das dermatomicoses que mais acomete o homem, sua frequência varia de 5% a 50% em climas quentes e úmidos. Os raros estudos sobre essa micose realizados no estado da Paraíba evidenciam uma incidência de 78%.(6,11) No presente estudo obtivemos uma incidência de 26,66% de casos compatíveis com pitiríase versicolor.
A análise in vitro da atividade antifúngica permite a comparação entre os diferentes antifúngicos, podendo assim auxiliar na escolha da terapia eficaz para os pacientes acometidos por infecções fúngicas. As espécies de Candida sp. foram sensíveis a todos os antifúngicos testados, o que também foi observado no estudo de Silva et al.,(12) que verificaram a sensibilidade aos antifúngicos de leveduras desse gênero.
A fusariose representa uma complicação de alta morbidade e mortalidade em imunocomprometidos, pois as opções terapêuticas são limitadas devido à relativa resistência do Fusarium sp. aos antifúngicos mais comumente utilizados.(13) Nesse estudo, o Fusarium sp. aparece como agente etiológico de uma micose superficial, que apresentou resistência para os fármacos testados, confirmando os resultados de Guillermetti et al.,(14) Azor et al.,(13) e Almeida et al.,(1) onde o Fusarium sp. apresentou CIM elevada frente aos antifúngicos comercialmente disponíveis. Nossos resultados possibilitaram determinar CIM apenas para ciclopirox olamina de 16 mg/mL.
Conclusão
Foi possível observar neste estudo que as infecções que acometeram os pacientes foram Candidíase, Pitiríase versicolor, Onicomicose aspergilar e Fusariose cutânea, onde o Fusarium sp. apresentou resistência frente a todos os agentes antifúngicos testados, o que sinaliza a necessidade da busca de nova opções de terapêuticas antifúngica.
Agradecimentos
Agradecemos aos diretores e funcionários do Centro de Saúde Frei Damião e ao dermatologista Dr. Umberto Joubert, além dos voluntários que aceitaram participar da pesquisa.
Abstract
Superficial mycoses are fungal infections that affect the more superficial layers of the skin. These mycoses are prevalent worldwide, and although semi-arid present favorable climate to the emergence of these infections, there are few studies about this question. Considering the above, this work aimed to diagnose and to display the incidence of superficial mycoses in patients served in the dermatological service of a public health center at Patos, Paraíba, Brazil, besides to determine the antifungal susceptibility profile of the etiologic agent isolates. We collected 34 samples obtained by epidermal and nail scraping. Our results showed that 15 (44.11%) were positive for dermatomycosis. Infections that attacked patients were candidiasis (60%), tinea versicolor (26.66%), cutaneous fusariosis (6.66%) and aspergillar onychomycosis (6.66%). In the antifungal susceptibility testing all Candida isolates were susceptible to cetoconazole, fluconazole, itraconazole and anidulafungin. However, Fusarium sp. was resistant all drugs tested. Candida was the most common etiologic agent and this can be explained by climatic and socioeconomic factors in the region that are conducive to the development of opportunistic fungus
Keywords
Mycoses; Diagnosis; Candida sp.; Fusarium sp.; Antifungal sensitivity tests
REFERÊNCIAS
- Almeida LM, Souza EA, Bianchin DB, Svidzinski TI. In vitro response of cutaneous mycosis fungal agents to the most widely used systemic antifungals in dermatology. An Bras Dermatol. 2009;84(3):249-55. [Article in English, Portuguese]
- Magagnin CM, Stopiglia CD, Vieira FJ, Heidrich D, Machado M, Vetoratto G, et al. Antifungal susceptibility of dermatophytes isolated from patients with chronic renal failure. An Bras Dermatol. 2011;86(4):694-701. [Article in English, Portuguese]
- Pontes ZB, Lima Ede O, Oliveira NM, Dos Santos JP, Ramos AL, Carvalho MF. Onychomycosis in João Pessoa City, Brasil. Rev Argent Microbiol. 2002;34(2):95-9.
- Criado PR, Oliveira CB, Dantas KC, Takiguti FA, Benini LV, Vasconcellos C. Superficial mycosis and the immune response elements. An Bras Dermatol. 2011;86(4):726-31. [Article in English, Portuguese]
- Araújo Gde M, Araújo ND, Farias RP, Cavalcanti FC, Lima Mdo L, Braz RA. Superficial mycoses in Paraíba: a comparative analysis and bibliographical revision. An Bras Dermatol. 2010;85(6):943-6. [Article in English, Portuguese]
- Vasconcelos PA, Lima EO. Estudo epidemiológico da Pitiríase versicolor no Estado da Paraíba-Brasil. An Bras Dermatol. 33:63-67, 2001.
- Peres NT, Maranhão FC, Rossi A, Martinez-Rossi NM. Dermatophytes: host-pathogen interaction and antifungal resistance. An Bras Dermatol. 2010;85(5):657-67.
- Schreiber AZ. Antifungigrama: Quando solicitar e como interpretar. Pratica Hospitalar. Ano IX, 49: 87-91, 2007.
- Tomaz D. Será fungo? Revista Portuguesa de Clínica Geral, 27(1):96-108, 2011.
- Leite Júnior DP, Yamamoto AC, Martins ER, Teixeira AF, Hahn RC. Species of Candida isolated from anatomically distinct sites in military personnel in Cuiabá, Mato Grosso, Brazil. An Bras Dermatol. 2011;86(4):675-80. [Article in English, Portuguese]
- Brito LB, Lima EO, Carmo ES, Carvalho FFP, Albuquerque PBS, Figueiredo MM P. Estudo epidemiológico da pitiríase versicolor na cidade de João Pessoa, PB, de 1999 a 2008. Revista Brasileira de Análises Clínicas. 2011;43(2):142-4.
- Silva JO, Ferreira JC, Candido RC. Enzymatic activity, slime production and antifungal agent sensitivity of Candida sp. Rev Soc Bras Med Trop. 2007;40(3):354-5. [Article in Portuguese]
- Azor M, Gené J, Cano J, Guarro J. Universal in vitro antifungal resistance of genetic clades of the Fusarium solani species complex. Antimicrob Agents Chemother. 2007;51(4):1500-3.
- Guilhermetti E, Takahachi G, Shinobu CS, Svidzinski TI. Fusarium spp. as agents of onychomycosis in immunocompetent hosts. Int J Dermatol. 2007;46(8):822-6.
Correspondência
Ertenia Paiva Oliveira
Rua Horácio Nóbrega, S/N – Belo Horizonte
58704-000 – Patos – PB, Brasil
