Padrão hormonal feminino: menopausa e terapia de reposição
Female hormone pattern: menopause and replacement therapy
Jade Oliveira1
Maria Helena Peruch2
Sabrina Gonçalves3
Patricia Haas4
1Acadêmica do Curso de Graduação em Farmácia- Habilitação Análises Clínicas – Universidade Federal de Santa Catarina – UFSC, Florianópolis, SC, Brasil.
2Farmacêutica do Hospital Materno Infantil Santa Catarina/SAMU SC Mesorregião Sul.
3Estudante de Doutorado. Universidade Federal de Santa Catarina – UFSC, Florianópolis, SC, Brasil.
4Professora do Curso de Graduação em Farmácia – Habilitação Análises Clínicas, Departamento de Análises Clínicas – Universidade Federal de Santa Catarina – UFSC, Florianópolis, SC , Brasil.
Artigo recebido em 01/10/2012
Artigo aprovado em 29/01/2016
__________________________________________________________________________________________
Resumo
Os hormônios são responsáveis pela integração da atividade de sistemas orgânicos. As mulheres em idade reprodutiva produzem todas as classes de esteroides sexuais, estrógenos, progestinas e androgênios. Níveis normais de estrógenos implicam no desenvolvimento das características sexuais femininas. Alterações rítmicas na secreção dos hormônios femininos e mudanças morfológicas nos ovários e órgãos sexuais são características dos anos reprodutivos das mulheres. A maturação e a diferenciação do epitélio do colo uterino dependem da ação hormonal do estrogênio e progesterona, determinando o predomínio de células de determinado grau de diferenciação, de acordo com a faixa etária e a fase do ciclo menstrual da mulher. O diagnóstico da menopausa é clínico, amenorreia por um ano, com sinais de hipoestrogenemia e níveis séricos elevados de hormônio folículo-estimulante. O principal tratamento para os sintomas da menopausa utiliza estrogênio isolado ou combinado com progesterona para prevenir estímulo endometrial. O estrogênio na reposição hormonal previne osteoporose e sintomas relacionados à diminuição do estradiol. Entretanto, o estrogênio pode levar ao aumento da proliferação celular no útero e mamas, aumentando o risco de desenvolvimento de neoplasias nestas regiões. A terapêutica ideal consiste em uma substância que tenha ação estrogênica sobre o sistema ósseo e urogenital, mas não em útero e mamas.
Palavras-chave
Hormônios femininos; Menopausa; Terapia de reposição
INTRODUÇÃO
Os hormônios são substâncias responsáveis pela integração da atividade de sistemas e subsistemas orgânicos. Alteram a função celular em resposta à variação do meio externo, induzem a manutenção do trabalho celular e alteram o nível de atividade de tecidos e órgãos mantendo a constância de composição do meio interno.(1)
Os hormônios esteroides sexuais femininos incluem principalmente os estrogênios e a progesterona. São sintetizados a partir do colesterol em vários tecidos endócrinos, ligam-se a proteínas carreadoras e são levados pela corrente sanguínea até suas células-alvo. Afetam o desenvolvimento e o comportamento sexual e uma variedade de outras funções reprodutivas e não reprodutivas, por meio da ação em receptores nucleares modificando a expressão de genes específicos.(2)
Os estrogênios incluem compostos diversos que diferem substancialmente em sua estrutura química e propriedades gerais, mas que apresentam propriedade biológica comum, a capacidade de estimular o crescimento e a manutenção das características sexuais femininas. Os principais estrogênios presentes na mulher são estradiol, estrona e estriol, com potências diversas em varias ações. São produzidos pelas células da granulosa dos ovários, pela placenta na gravidez e, ainda, podem ser derivados da reação de aromatização dos androgênios nos tecidos periféricos.(3)
Por outro lado, corpo lúteo é o local de produção da progesterona, que é responsável pela diferenciação do endométrio, controle da implantação e maturação do epitélio mamário, sendo, portanto, essencial para o início e a manutenção da gestação.(4)
O ciclo menstrual consiste em duas fases, a folicular e a lútea, separadas pela ovulação.(5) Este ciclo consiste de aproximadamente 28 dias, onde a fase folicular (ou de re-epitelização), marcada pela secreção de estrogênio, corresponde aos primeiros 14 dias, na qual ocorre o crescimento de novos folículos nos ovários; um desses folículos torna-se finalmente maduro e ovula ao término desta fase. Após a ovulação, a célula secretora do folículo transforma-se no corpo lúteo, que secreta grande quantidade de progesterona e estrogênio. Depois de duas semanas, o corpo lúteo degenera, e, em consequência, os hormônios ovarianos diminuem acentuadamente e começa a menstruação.(6,7)
O epitélio escamoso do colo uterino tem crescimento hormônio-dependente, basicamente induzido pelo estrogênio e com o auxílio da progesterona para a diferenciação, refletindo as oscilações hormonais ao longo do ciclo menstrual. Após a descamação do período de fluxo, o epitélio encontra-se baixo, com muitas células intermediárias e poucas superficiais. Já no esfregaço, representando aproximadamente o meio do ciclo, é observado o epitélio com seu maior desenvolvimento, com numerosas células superficiais. Após o pico de estrogênio, começa a haver preponderância da progesterona, ocorrendo predomínio de células intermediárias.(8)
A duração do ciclo menstrual é bastante variável no início e no final da vida reprodutiva devido à variabilidade nos intervalos da ovulação entre a menarca e a menopausa.(9) A menopausa é definida pela Organização Mundial da Saúde como cessação permanente da menstruação, consequente à perda da função folicular ovariana ou à retirada cirúrgica dos ovários.(10) É datada como o último período menstrual que foi seguido por doze meses de amenorreia, normalmente ocorrendo entre os 48-52 anos de idade.(11)
No Brasil, assim como em um número crescente de países do mundo, as mulheres já vivem, em média, quase um terço das suas vidas na fase pós-menopausa.(12) Estudos demográficos indicam que, em 1990, havia cerca de 467 milhões de mulheres com idade igual ou superior a 50 anos de idade, e para o ano de 2030 a estimativa é que este grupo ultrapasse 1,2 bilhões de mulheres.(13)
Após a menopausa, o endométrio, em decorrência da falta de atividade estrogênica, apresenta-se inativo, mostrando histologicamente pequenas glândulas e o estroma denso, caracterizando o endométrio atrófico. Da mesma forma, o esfregaço de material coletado do colo uterino mostra predomínio de células parabasais, evidenciando a atrofia cérvico-vaginal característica de mulheres pós-menopausa. Apesar disso, tanto a mucosa uterina quanto o epitélio cérvico-vaginal continuam responsivas aos estímulos esteroídicos de esteroides endógenos ou exógenos.(8,14)
O uso de hormônios para aliviar a sintomatologia relacionada à menopausa é amplamente praticado em todo o mundo, e potenciais efeitos adversos são de grande interesse para a Saúde Pública devido ao potencial impacto numa grande população exposta.(15) Estudos que avaliaram o impacto da terapia de reposição hormonal (TRH) na qualidade de vida de mulheres na pós-menopausa apresentaram resultados conflitantes. Alguns autores observaram melhora da qualidade de vida de mulheres usuárias desta terapia quando comparadas a um grupo placebo. Entretanto, outros autores não verificaram diferenças na qualidade de vida entre usuárias e não usuárias.(16)
OBJETIVOS
Objetiva-se abordar, com base em uma revisão sistemática da literatura, as principais características dos hormônios sexuais femininos, a relação destes com os hormônios hipofisários durante o ciclo hormonal feminino e as consequentes mudanças que estes acarretam no padrão citológico cérvico-vaginal. Também foi realizada a conceituação da menopausa e a descrição das mudanças ocorridas no colo uterino durante este estágio da vida da mulher. Além disso, este trabalho visou revisar os aspectos mais importantes relacionados à terapia de reposição hormonal na menopausa.
MATERIAL E MÉTODOS
Foi realizada uma revisão em fontes primárias, como artigos de revistas científicas, e fontes secundárias, como livros e artigos de revisão bibliográfica, utilizando bases de dados como PubMed, SciELO e Scopus; como descritores foram considerados “ciclo menstrual feminino”, “menopausa”, “estrogênio”, “progesterona”, “hormônios sexuais femininos”, “padrão citológico feminino”, “esfregaço atrófico em mulheres pós-menopausa” e “reposição hormonal”. Foram selecionados artigos publicados no período de 2003 a 2010, nos idiomas Português, Espanhol e Inglês.
CARACTERÍSTICAS HORMONAIS
Hormônios são substâncias que constituem a base química para a comunicação entre as células. O termo foi originalmente usado para descrever os produtos das glândulas endócrinas liberados para a circulação sanguínea e que respondem às mudanças na homeostase. No entanto, nos últimos anos, o termo vem sendo usado para descrever substâncias liberadas por uma célula que provoca uma resposta em outra célula, regulando as ações corretivas para manter o equilíbrio interno, mesmo quando a substância não entra na circulação geral. Alguns efeitos hormonais ocorrem em questão de segundos, enquanto que outros necessitam de vários dias para se manifestar, embora persistam por semanas, meses ou até anos.(7,17,18)
As células identificam os hormônios através de receptores, que são estruturas proteicas especializadas em reconhecimento molecular. Depois da aproximação e interação (hormônio-receptor) ocorre uma cascata de reações bioquímicas, levando a respostas biológicas específicas.(19) De forma geral, os hormônios controlam funções como transporte de substâncias através da membrana celular, controle da expressão gênica, síntese de proteínas, ativa ão enzimática, entre outras, participando em vários eventos específicos do organismo, tais como crescimento celular e dos tecidos, regulação do metabolismo, regulação da frequência cardíaca e da pressão sanguínea, função renal, eritropoiese, motilidade do trato gastrointestinal, secreção de enzimas digestivas e de outros hormônios, lactação e atividade do sistema reprodutivo.(20)
Os hormônios podem ser classificados, de acordo com sua estrutura bioquímica e via de síntese, em grandes grupos, como os peptídeos, derivados de aminoácidos e esteroides. A maioria deles são peptídeos e variam em tamanho, desde substâncias formadas por três aminoácidos até pequenas proteínas de mais de duzentos aminoácidos, como os hormônios luteinizantes (LH) e o folículo estimulante (FSH), por exemplo. Os derivados de aminoácidos são um grupo misto, incluindo os hormônios da tireoide, catecolaminas e dopamina.(21)
Os hormônios esteroides são sintetizados a partir do colesterol e são basicamente divididos em dois grupos, os hormônios sexuais masculinos e femininos e os esteroides suprarrenais. Os principais esteroides suprarrenais são aqueles com atividades mineralocorticoide e glicocorticoide. Os mineralocorticoides afetam o equilíbrio hidroeletrolítico, e o principal hormônio endógeno é a aldosterona. Os glicocorticoides afetam o metabolismo de carboidratos e proteínas, e os principais representantes desta classe são a hidrocortisona e a corticosterona.(2,22)
AÇÃO HORMONAL
As mulheres normais em idade reprodutiva produzem todas as três classes de esteroides sexuais, os estrógenos, as progestinas e os androgênios.(23) O papel dos androgênios na fisiologia normal da mulher ainda não é totalmente esclarecido, eles são os precursores dos estrogênios, parecem aumentar a libido e a massa muscular e estão envolvidos no desenvolvimento normal do folículo ovariano e de sua atresia.(3)
Mais de vinte estrógenos foram identificados, sendo que os mais importantes são o estrona, o estriol e o estradiol.(3,23) O estradiol ou 17b estradiol é o mais potente estrógeno, enquanto que o estrona e o estriol são produtos de seu metabolismo. O estrona possui aproximadamente um terço de sua potência e o estriol está presente em quantidades significativas durante a gravidez, porque é o principal estrógeno produzido pela placenta.(24)
Os folículos ovarianos, corpo lúteo e a placenta, durante a gravidez, são os principais locais de secreção dos estrógenos, mas outros tecidos não reprodutivos, tais como tecido adiposo, neurônios do hipotálamo e músculo também podem produzi-los.(25) Níveis normais de estrógenos circulantes implicam o adequado desenvolvimento e manutenção dos órgãos sexuais e a presença de características sexuais secundárias femininas.(26)
A progesterona é um modulador chave das funções reprodutivas normais. Estas funções incluem a ovulação, desenvolvimento uterino e das glândulas mamárias, e a expressão neurocomportamental associada com a capacidade de resposta sexual. Logo, ela é essencial para o estabelecimento e manutenção da gravidez.(27)
Estrógenos e progesterona exercem seus efeitos biológicos sobre os tecidos-alvos por meio da associação com proteínas receptoras intracelulares. Esses receptores são membros da superfamília de receptores nucleares. A ligação do hormônio ativa o seu receptor específico, o que lhe permite interagir com sequências específicas de DNA dentro de genes promotores responsivos ao estrógeno ou progesterona, para que ocorram as mudanças dos perfis de expressão gênica em tecidos-alvos.(28,29) Esta via, por meio de uma resposta celular genômica, corresponde à mais bem caracterizada via de sinalização de receptores de esteroides. No entanto, a ativação de receptores de esteroides associados à membrana pode sinalizar uma resposta celular rápida, não genômica, onde a ativação da via de transdução de sinal ou de segundo mensageiro de sinalização resulta na ativação do gene-alvo.(4)
A dosagem de hormônios esteroides tornou-se uma ferramenta importante na investigação e gestão de doenças e distúrbios hormonais. Os ensaios laboratoriais para essas dosagens sofreram grandes evoluções nos últimos cinquenta anos. Desde a descrição inicial do radioimunoensaio, na década de 60, os imunoensaios representam o principal instrumento de detecção e quantificação de hormônios em amostras biológicas. Os imunoensaios são testes usados para detectar ou quantificar uma substância específica, o analito, em uma amostra biológica, por meio do reconhecimento de um antígeno por um anticorpo. A elevada afinidade do anticorpo pelo antígeno, assim como a utilização de sistemas indicadores ou de detecção capazes de amplificar o analito pesquisado, contribuem para a elevada sensibilidade dos imunoensaios. A especificidade do anticorpo pelo antígeno, por sua vez, determina a elevada especificidade desses ensaios. Por causa dessas características é que os imunoensaios representam o método de escolha para a medida de analitos presentes em concentrações muito baixas numa amostra, como é o caso de hormônios no soro.(30,31)
As desvantagens dos radioimunoensaios são a utilização do radioisótopo, que exige licença e instalações adequadas para sua manipulação e descarte, ocasionando problemas de armazenamento e, principalmente, o perigo de exposição à sua radiação.(20) Além disso, os problemas na execução dos imunoensaios dificultam a sua ampla aplicação e a tradução dos resultados das investigações em informações úteis para o cuidado do paciente. Em vista disso, em 2007, a Division of Laboratory Sciences, o National Center for Environmental Health, e o Centers for Disease Control and Prevention responderam a essa necessidade, iniciando um projeto – Improving Steroid Hormone Measurements in Patient Care and Research Translation – para padronizar esses testes. Esse estudo apontou que a espectrometria de massa combinada com cromatografia gasosa ou cromatografia líquida de alta eficiência pode superar as limitações observadas com os imunoensaios, especialmente para as medições das concentrações de testosterona em mulheres e crianças e das concentrações de estradiol em mulheres na pós-menopausa, homens e crianças.(31)
CICLO HORMONAL FEMININO
Os anos reprodutivos normais da mulher caracterizam-se por alterações rítmicas mensais na velocidade da secreção dos hormônios femininos e por mudanças correspondentes nos ovários e nos órgãos sexuais. Esse padrão rítmico é denominado ciclo menstrual feminino, que possui duração média de 28 dias.(7)
O ciclo menstrual humano normal depende da interação intimamente coordenada dos efeitos de feedback entre o hipotálamo, lóbulo anterior da hipófise, ovários, como também dos estímulos ambientais.(23) Os neurônios hipotalâmicos liberam de maneira pulsátil o hormônio liberador de gonadotrofina (GnRH), que tem como alvo primário a hipófise anterior, e esta responde positivamente, aumentando a síntese e secreção do LH e FSH. Estes regulam a função ovariana, em particular o desenvolvimento folicular e secreção de hormônios pelo folículo. Os esteroides gonadais, por sua vez, agem no hipotálamo e na hipófise em um ciclo de retroalimentação negativa clássica, inibindo a expressão de GnRH e gonadotrofinas. É bem estabelecido que o feedback negativo regula o eixo hipotálamo-hipófise-gonadal (Figura 1). Contudo, a regulação nas mulheres é um pouco mais complexa, já que o estradiol pode ter ambos os efeitos estimulatórios e inibitórios, dependendo da fase do ciclo menstrual.(32,33)
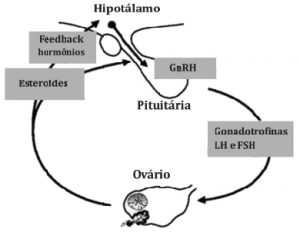
Figura 1. Eixo hipotálamo-hipófise-gonadal.
Experimentos mostraram que uma razão para a secreção de GnRH acontecer de modo pulsátil é evitar a down-regulation (modulação negativa) do receptor de GnRH na hipófise. Em animais com lesões hipotalâmicas nos quais a liberação de gonadotrofina hipofisária foi suprimida, a infusão constante de GnRH exógeno não conseguiu restaurar a secreção de gonadotrofina, enquanto que a administração intermitente de uma dose a cada uma hora restabeleceu a secreção dos hormônios hipofisários.(32) Além disso, a secreção de GnRH varia em frequência e amplitude ao longo do ciclo e isso permite o estímulo adequado para secreção de gonadotrofinas, resultando em padrões diferenciados de liberação de LH e FSH durante os diferentes períodos do ciclo mensal.(34,35)
Os dois resultados significativos do ciclo menstrual humano são, em primeiro lugar, apenas um ovócito, normalmente liberado dos ovários a cada mês, de modo que apenas um feto possa começar a se desenvolver se houver fertilização. Em segundo lugar, o endométrio uterino é preparado para a implantação do ovo fertilizado na época adequada do mês. Este ciclo pode ser dividido em dois segmentos de acordo com o órgão examinado e com as flutuações hormonais, o ciclo ovariano e o uterino (Figura 2). O ciclo ovariano caracteriza-se por uma fase folicular e uma fase lútea, enquanto que o ciclo uterino é dividido nas fases proliferativa e secretora.(35)
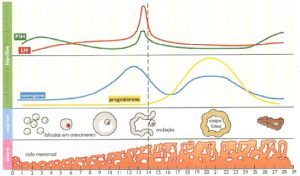 Figura 2. Representação das fases do ciclo menstrual.
Figura 2. Representação das fases do ciclo menstrual.
A duração média da fase folicular varia de 10 a 14 dias; em seu período inicial, as concentrações de FSH, que atuam no amadurecimento dos folículos, encontram-se elevadas, mas declinam até a ovulação, enquanto que a secreção de LH começa a aumentar por volta da metade desta fase. A secreção de estrógenos pelo folículo aumenta de forma dramática aproximadamente dois dias antes da ovulação, o que estimula positivamente o hipotálamo e desencadeia o pico de LH cerca de vinte horas antes da ovulação. O LH é indispensável para o final do crescimento folicular e para ovulação e sofre regulação bifásica pelos estrogênios circulantes, os quais, em concentrações menores, inibem a sua secreção, e, em níveis maiores, estimulam sua liberação.(7,23,35)
Os níveis séricos de progesterona aumentam gradualmente a partir do pico de LH e continuamente durante a fase lútea, que representa a segunda metade do ciclo ovariano e é caracterizada pela formação do corpo lúteo após a ovulação a partir do folículo remanescente. O corpo lúteo é um órgão altamente secretor, que produz grandes quantidades de progesterona e estrogênio e, consequentemente, há uma redução gradual das concentrações de LH e FSH. Na mulher normal, o corpo lúteo cresce até atingir um diâmetro e cerca de 1,5 cm, aproximadamente, no período de sete a oito dias após a ovulação; em seguida começa a involuir e, eventualmente, perde sua função secretora.(36)
Durante a fase proliferativa do ciclo uterino, o estrogênio, predominante durante a primeira fase do ciclo ovariano, interage com o útero através de receptores nucleares específicos, preparando o endométrio para implantação do embrião. Já a progesterona, produzida após a ovulação, produz modificação do aspecto histológico do endométrio para a fase secretora uterina.(37) Na ausência de gravidez, o endométrio degenera (há o sangramento) e o ciclo se repete. Durante a menstruação normal, a maior parte do tecido é eliminada nos primeiros dois dias. A hemorragia continua, no entanto, por vários dias até que o revestimento epitelial danificado seja reparado pela regeneração e proliferação.(9)
PADRÃO CITOLÓGICO
Anatomicamente, o colo do útero divide-se em duas porções denominadas de ectocérvice e endocérvice. O epitélio que recobre a cavidade endocervical é formado por uma única camada de células cilíndricas endocervicais, com função secretora e locomotora. A ectocérvice, histologicamente, apresenta três extratos de células escamosas (Figura 3), camada profunda, constituída por uma camada de células basais e várias de células parabasais (Figura 4); extrato intermediário, constituído por várias camadas de células intermediárias (Figuras 4 e 5); e extrato superficial, constituído por várias camadas de células superficiais (Figura 5). O processo de maturação e diferenciação deste epitélio é diretamente dependente de ação hormonal cíclica de estrogênio e progesterona, determinando o predomínio de células de determinado grau de diferenciação celular, de acordo com a faixa etária e a fase do ciclo menstrual em que a mulher se encontra. Este processo de maturação é caracterizado por um aumento do tamanho do citoplasma e diminuição do núcleo.(38,39)
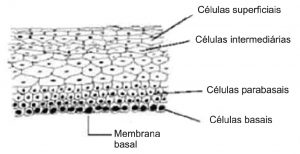 Figura 3. Esquema representativo das células escamosas que compõem os três extratos do epitélio escamoso estratificado.
Figura 3. Esquema representativo das células escamosas que compõem os três extratos do epitélio escamoso estratificado.
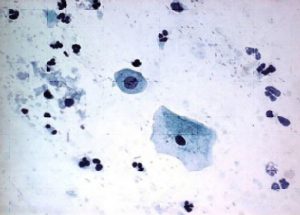
Figura 4. Célula parabasal com núcleo grande e citoplasma escasso
e célula intermediária com citoplasma mais abundante e núcleo relativamente menor.
Os esfregaços com atividade estrogênica podem ser divididos nas fases pré-ovulatória e ovulatória. Na fase pré-ovulatória, as células, originalmente intermediárias, identificam a fase e indicam o início da maturação provocada pela influência estrogênica no epitélio escamoso antes de atingirem seu máximo amadurecimento, representado pelas células superficiais. As células pré-ovulatórias apresentam citoplasma bastante aumentado e núcleo com diâmetro reduzido, porém este ainda não se tornou picnótico, coram-se fracamente em cianofilia, embora, algumas vezes, leves tonalidades eosinófilas possam aparecer na porção média das células. Outras vezes são acentuadamente eosinófilas, sendo a cor rosa a mais encontrada.
Estas células pré-ovulatórias que predominam nesta fase representam aproximadamente 50% do número total de células escamosas do esfregaço, enquanto que 30% são de células tipicamente intermediárias e os 20% restantes de células superficiais. Na fase ovulatória há predomínio de células superficiais que atingem o máximo de maturação e esfoliação nesta fase e chegarão à metade dos elementos celulares do esfregaço. A coloração de seu citoplasma é nitidamente rósea ou vermelha com algumas células amareladas ou alaranjadas tipicamente eosinofílicas, com núcleo extremamente picnótico.(8,40)
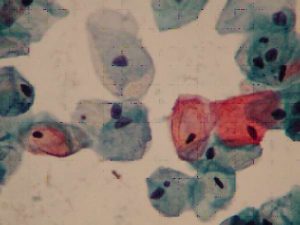
Figura 5. Células intermediárias com coloração azul ou cianofilicas (basofílicas)
e células superficiais com coloração avermelhada ou eosinofílicas.
Os esfregaços com atividade luteínica ou progesterônica são divididos nas fases pós-ovultória, pré-menstrual e menstrual. Na fase pós-ovulatória, as células superficiais e intermediárias diminuem de tamanho, sendo chamadas de células regressivas. Estas células são submetidas a um processo de reabsorção e não a um processo de citólise. Nesta fase é também observado que as células superficiais e intermediárias alongadas aumentam de número, refletindo a supressão da ação estrogênica sobre a mucosa vaginal. Já a fase pré-menstrual tem um padrão muito típico, e é composta por células pré-menstruais, que são, na maioria, células intermediárias com citoplasma acentuadamente cianofílico e os núcleos aumentados de tamanho, apresentam-se agrupadas, formando grandes aglomerados, sendo maiores que os grupos observados nas outras fases. A predominância destas células é acima de 50%. Um aspecto comum destas células é a irregularidade da forma citoplasmática, uma vez que o contorno citoplasmático é menos nítido e, não raro, indica citólise inicial. Na fase menstrual, além do grande número de eritrócitos presentes no esfregaço há uma abundante escamação de células epiteliais.(8)
MENOPAUSA
Conceituação
O climatério (ou perimenopausa) é definido pela Organização Mundial de Saúde como uma fase fisiológica da vida e não um processo patológico, que compreende a transição entre o período reprodutivo e o não reprodutivo da vida da mulher, período em que surgem as irregularidades menstruais e queixas vasomotoras, antecedendo a menopausa. A menopausa é o marco dessa fase, correspondendo ao último ciclo menstrual, que foi seguido por doze meses de amenorreia, ou seja, é a parada permanente da menstruação. A idade média de sua ocorrência em âmbito mundial é aproximadamente aos 50 anos, com uma variação de 43 a 57 anos. O período precedente, em que a menstruação já se encontra irregular, é identificado como pré-menopausa, e o período subsequente, no qual dominam as manifestações regressivas, como pós-menopausa. No Brasil, a menopausa ocorre em média aos 51,2 anos. Contudo, a menopausa que ocorre anteriormente à idade mínima prevista é considerada precoce ou prematura.(11,16,41-44)
De acordo com as estimativas do DATASUS, em 2007, a população feminina brasileira totalizava mais de 98 milhões de mulheres. Deste total, cerca de 30 milhões tinham entre 35 anos e 65 anos de idade, o que significa que 32% das mulheres brasileiras estavam na faixa etária em que ocorre o climatério.(41)
A menopausa resulta da diminuição da secreção dos hormônios ovarianos, estrogênio e progesterona, devido à perda definitiva da atividade folicular ovariana. A redução da função ovariana e, consequentemente, do feedback negativo, resultará na elevação das concentrações do FSH, sendo esta a primeira indicação laboratorial do climatério inicial. Estudos populacionais sugerem que o fumo e a condição socioeconômica baixa estão associados com o final precoce dos períodos menstruais. Outros fatores podem afetar a idade nas quais as mulheres têm seu período menstrual finalizado, como menarca, paridade, uso prévio de contraceptivos orais, índice de massa corpórea, etnia e história familiar.(45-48)
Alterações decorrentes da menopausa: fisiológicas, comportamentais e patológicas
Das mulheres que entram na menopausa, cerca de 20% apresentam-se assintomáticas, mas a maioria experimenta sintomas desagradáveis causados pela diminuição dos níveis de estrogênio.(49)
A deficiência estrogênica observada na menopausa é responsável por várias alterações fisiológicas e comportamentais na mulher. As alterações fisiológicas que ocorrem são ondas de calor, suores noturnos, atrofia urogenital. Entre as patológicas destacam-se a osteoporose e doenças cardiovasculares, as quais interferem na qualidade de vida da mulher, enquanto que as alterações comportamentais referem-se às mudanças de humor, depressão, irritabilidade e insônia. Estes sintomas normalmente apresentam-se alguns anos antes da menopausa e persistem por vários anos após sua instalação, acometem 60% a 80% das mulheres que se encontram nesta situação.(16,45,50,51)
Setenta e cinco por cento das mulheres na menopausa referem ondas de calor, 80% destas têm fogachos que perduram por mais de um ano, os quais caracterizam-se por rubor súbito da face, pescoço e tórax, acompanhado por uma sensação de calor corporal intenso e finaliza com uma sudorese profusa.(52)
Os sintomas genitais decorrentes do hipoestrogenismo incluem prurido vulvar, secura vaginal e dispareunia, e os urinários vão desde a disúria e polaciúria até infecção e incontinência. Os sintomas ocorrem principalmente devido à atrofia vaginal, o que leva a mucosa a tornar-se mais fina e seca, ou ainda o epitélio vaginal pode tornar-se inflamado, o que irá contribuir para os problemas urinários.(53)
Um indicativo da sensibilidade do trato urinário inferior aos esteroides é a existência de receptores hormonais em suas células, sendo assim responsivas a estes hormônios. Portanto, a atrofia vulvovaginal que pode ocorrer em qualquer momento do ciclo de vida de uma mulher é mais comum na fase pós-menopausa. Numerosos estudos retrospectivos têm avaliado a prevalência de sintomas de atrofia vulvovaginal, os quais estão presentes em cerca de 4% nos grupos de mulheres na fase pré-menopausa enquanto que entre as pós-menopausadas a prevalência é de 47%.(53,54)
A redução estrogênica favorece também o surgimento da obesidade central, a qual pode desencadear complicações metabólicas, dentre as quais a dislipidemia. Em relação à idade, a menopausa também pode acelerar a incidência do aumento da pressão arterial, aumentando o risco cardiovascular. Outro fato que pode explicar o aumento de risco cardiovascular nesta fase é o efeito cardioprotetor do estrogênio, o qual está relacionado ao metabolismo das lipoproteínas, que irá resultar em uma elevação significativa do colesterol presente na lipoproteína de baixa densidade (LDL-C) e uma diminuição do colesterol presente na lipoproteína de alta densidade (HDL-C), propiciando um perfil pró-aterogênico.(43,55,56)
A osteoporose afeta milhões de pessoas em todo o mundo, acometendo principalmente mulheres na idade da pós-menopausa; estima-se que 200 milhões de mulheres são acometidas por esta patologia. A deficiência estrogênica promove perda da massa óssea em decorrência do desequilíbrio da remodelação óssea, o qual determina maior reabsorção em relação à neoformação óssea. Isto ocorre devido ao estrogênio ser um hormônio importante na inibição da reabsorção óssea; deste modo, a deficiência estrogênica e, consequentemente, a perda óssea causam um quadro de osteopenia e, posteriormente, de osteoporose. Os mecanismos de ação do estrogênio sobre o tecido ósseo não estão completamente elucidados, apesar de algumas vias de ação desse hormônio já serem conhecidas.(57)
Diante da deficiência estrogênica, observa-se aumento de apoptose de osteócitos. As células em apoptose exibem modificações em sua membrana plasmática, as quais representam uma sinalização para sua remoção através da fagocitose. Além disso, a morte dos osteócitos pode, possivelmente, constituir-se num fator quimiotático de osteoclastos, além de estimular sua atividade reabsortiva.(58)
Padrão citológico pós-menopausa
Um esfregaço atrófico é um padrão normalmente visto em mulheres na pós-menopausa. Neste esfregaço há predomínio de células da camada parabasal, sendo esta a principal característica (Figura 6). Frequentemente, pode-se identificar a presença de poucas células intermediárias e raramente células superficiais, e, quando presentes, as células intermediárias apresentam núcleos maiores que nos outros esfregaços. Existe uma gradação na atrofia do epitélio escamoso, e o tipo de esfregaço descrito acima (com presença de células intermediárias e superficiais) representa uma atrofia precoce ou inicial que é chamada de esteatrofia. A atrofia tardia, ou teleatrofia, apresenta somente células parabasais. Pode-se dizer que o índice de maturação do epitélio cérvico-vaginal na pós-menopausa sofre desvio à esquerda.(8,59)
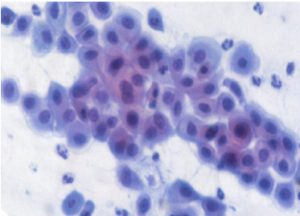
Figura 6. Células parabasais em esfregaço atrófico, característico da fase pós-menopausa
Existem vários índices para classificar as influências hormonais no epitélio vaginal e urinário, dentre eles os mais utilizados são o índice de maturação celular, o índice de cariopicnose e de eosinofilia. O mais informativo é o índice de maturação celular ou de Frost, o qual avalia a proporção relativa de células parabasais, intermediárias e superficiais do epitélio vaginal (P/I/S). O valor de maturação ou índice de Meisels é calculado a partir do índice de maturação celular e corresponde ao somatório do número das células profundas multiplicadas por zero, do número de células intermediárias multiplicadas por meio e do número de células superficiais multiplicadas por um, porém não é indicado para laudos citológicos destinados à clínica.(60)
Em associação com o hipoestrogenismo, alterações do pH e da flora vaginal podem predispor mulheres pós-menopausadas à infecção urinária.(53) O estrogênio está relacionado à deposição de glicogênio nas células vaginais, o qual é decomposto em monossacarídeos pelas fosforilases e glicosidases da camada muscular da vagina e, posteriormente, convertido em ácido lático pelos lactobacilos. Então, quando a mulher inicia o período da menopausa, ocorre diminuição de estrogênio, o epitélio vaginal torna-se extremamente delgado, ocasionando diminuição ou até ausência de glicogênio. Acredita-se que a redução do glicogênio seja responsável, pelo menos parcialmente, pela diminuição de Lactobacillus e elevação do pH vaginal evidenciados nestas mulheres. Esta mudança do ambiente permite a proliferação de outras bactérias, incluindo Streptococcus do grupo B, Staphilococcus sp., coliformes e difteroides. Isso, teoricamente, predispõe estas mulheres a infecções genitais.(54,61)
Reposição hormonal
A média de sobrevida das mulheres na Idade Média era de 25 anos; somente no início do século XX, com os avanços científicos, é que a expectativa de vida pôde chegar aos 50 anos. No Brasil, a esperança de vida média da mulher, ao nascer, no ano 2001 foi de 68,82 anos. Com o aumento da expectativa de vida, as mulheres passaram a sobreviver um tempo suficiente para poder experimentar mudanças em seus corpos, o que muitas de gerações anteriores não conseguiram vivenciar.(47)
Como consequência, no Brasil, como em um número crescente de países do mundo, as mulheres já vivem, em média, quase um terço das suas vidas na fase pós-menopausa. Neste contexto, o debate sobre os possíveis benefícios e efeitos indesejáveis da TRH sobre a saúde e a qualidade de vida assumiu grande relevância em anos recentes. Este tratamento tem como principal componente o estrogênio, usado isolado ou em combinação com progesterona.(45,62)
O Ministério da Saúde do Brasil orienta que a dose administrada da terapia hormonal deve ser a mínima eficaz para melhorar os sintomas indesejáveis causados pela menopausa, devendo ser interrompida assim que os benefícios tenham sido alcançados ou os riscos superem os benefícios.(41,63)
Os estrógenos naturais – estradiol, estriol e estrona – são os mais utilizados na reposição hormonal. Os estrógenos conjugados são hormônios naturais extraídos da urina de éguas prenhas e incluem, além de estradiol, estrona e sulfato de estrona, também derivados de equilina, equilenina e seus sulfatos. Os efeitos biológicos dos estrógenos conjugados são resultantes principalmente da combinação de sulfato de estrona, sulfato de equilina e seus metabólitos. A equilina, por si só, é mais potente que todos os outros componentes dos estrógenos conjugados. As vias de administração de estrógenos naturais são a oral, transdérmica, percutânea e vaginal. Quando a TRH usa estrógenos associados aos progestínicos ela é denominada de “combinada”. A combinação pode variar entre contínua e sequencial ou cíclica. A forma mais popular de esquema contínuo combinado é o uso de 0,625 mg de estrógenos conjugados com 2,5 mg de medroxiprogesterona. O esquema que utiliza estrogênio isolado, de forma cíclica ou contínua, é recomendado para mulheres histerectomizadas.(15)
Nas mulheres em que a terapia hormonal é indicada após a suspensão dos ciclos e não apresentam contraindicações, administram-se estrogênios equinos conjugados (0,3 mg/dia a 0,625 mg/dia por via oral), estradiol micronizado (1 mg/dia a 2 mg/dia por via oral) ou valerato de estradiol (1 mg/dia a 2 mg/dia por via oral) ou 17b – estradiol (25 µg/dia a 50 µg/dia ou 0,5 g a 1,5 g por via transdérmica, na forma de adesivo ou gel respectivamente), diariamente sem interrupção. Em mulheres com útero, a qualquer forma de estrogenioterapia deve ser associado um progestógeno, que pode ser o acetato de medroxiprogesterona ou acetato de nomegestrol (5 mg/dia por via oral) ou diidrogesterona (10 mg/dia por via oral), ou progesterona natural (200 mg a 300 mg por via oral ou vaginal), ou gestodeno (25 µg/dia, sempre do primeiro ao décimo quarto dia de cada mês).(64)
A TRH surgiu com o propósito de aliviar sintomas e de agir preventivamente, reduzindo assim o aparecimento de doenças, como as cardiovasculares e a osteoporose. Está clara a importância da TRH na melhora dos sintomas climatéricos, como os sintomas vasomotores e atrofia urogenital. Todavia, menos de 20% das mulheres pós-menopáusicas fazem uso desta terapia.(16,43,65)
Revisão realizada no Clinical Evidence encontrou mais de quarenta ensaios clínicos randomizados comparando estrógenos em diferentes preparações e vias com placebo. A maioria mostrou redução significativa dos sintomas vasomotores com a terapia estrogênica, enquanto que os tratamentos combinados não diferiram significativamente do uso de estrógenos isolados, demonstrando que a associação desses a progestógenos não conferiu alívio adicional dos sintomas vasomotores. MacLennan et al.(66) realizaram um estudo de metanálise de 21 ensaios clínicos randomizados, com 2.511 participantes, avaliando a terapia de reposição hormonal com estrógenos isolados ou associados a progestógenos. Foi encontrada redução de 77% na frequência de fogachos com a utilização de TRH. A intensidade dos sintomas também foi significativamente menor com a TRH.(66)
Estrógenos mostram-se úteis no controle de ressecamento da mucosa vaginal e dispareunia associados à deficiência hormonal na menopausa. Estudo realizado avaliando o efeito preventivo da reposição estrogênica sobre infecções urinárias de repetição demonstrou que o estrogênio administrado por via oral reduziu a frequência de infecções urinárias. Além disso, ensaios clínicos evidenciaram a melhora significativa da lubrificação vaginal com administração de estrogênios independentemente da via empregada. Todavia, a administração vaginal de estrogênio é eficaz e acarreta menos efeitos adversos. Com base em uma revisão baseada em evidências de ensaios clínicos examinando preparações disponíveis em baixas doses de estrogênio vaginal para o tratamento da atrofia vulvovaginal, a North American Menopause Society (NAMS) declarou, em 2007, que a escolha da terapia deve ser guiada pela experiência clínica e preferência do paciente.(54,67,68)
O tratamento da osteoporose foi avaliado por estudos observacionais, como o de Grady e Lufkin, os quais estimam uma diminuição de até 50% no risco de fraturas em cinco anos com o uso da terapia hormonal. Os marcadores ósseos revelam uma diminuição de reabsorção entre 25% e 50% por ano.(69,70)
Em estudos de coorte, o benefício associou-se a uso corrente prolongado (seis anos ou mais), iniciado precocemente e com altas doses de estrógenos, isolados ou em associação com progesterona. Tais resultados geraram a recomendação de TRH para prevenção primária da osteoporose pós-menopáusica, a ser iniciada preferencialmente logo após o início da amenorreia, com a finalidade de prevenir a perda óssea. Estudos observacionais sobre TRH na prevenção secundária produziram resultados similares. Estudo caso-controle de base populacional avaliou 1.327 mulheres, entre 50 anos a 81 anos de idade, com fratura de quadril prévia e 3.262 controles. Usuárias correntes de TRH, quando comparadas às não usuárias, tiveram diminuição de risco de cerca de 6% para cada ano de terapia. O benefício perdurou por cinco anos após a suspensão do uso continuado.(66,71)
Gupta et al.,(71) em um estudo demonstraram que, após a TRH, o padrão de esfregaço mostrou predomínio de células parabasais em 46% das não usuárias, enquanto que nenhuma das usuárias apresentou predomínio de células parabasais maior que 70%. Uma elevada porcentagem de células intermediárias foi encontrada em 46,6% das usuárias e apenas 16,6% das não usuárias. Um índice de maturação elevado foi encontrado em mais de 75% das usuárias, mas em apenas 16,6% das não usuárias. Vê-se, assim que o padrão cito-hormonal nos esfregaços correlaciona-se bem com a resposta à terapia hormonal e sintomas clínicos.(72-74)
O debate principal relacionado ao uso de TRH é devido ao risco de desenvolvimento de doenças cardiovasculares. Estudos observacionais vinham sugerindo efeitos benéficos, em contraste com ensaios clínicos como o WHI (Women’s Health Initiative), que relataram aumento do risco de eventos secundários de coronariopatia e, mais recentemente, em relação a seus eventos primários, ocorrendo então uma modificação na indicação desta terapia, restringindo sua utilização. O ensaio WHI avaliou a eficácia definitiva da TRH na prevenção primária da doença coronariana, o risco de doença coronariana foi 29% maior nas usuárias de TRH, correspondendo ao risco absoluto de sete eventos coronarianos por 10 mil pessoas/ano, sendo então não indicado o emprego desta terapia na prevenção primária de doença cardiovascular. Do ponto de vista de saúde pública, a principal motivação do uso da TRH em larga escala vinha sendo a redução do risco de morte por doenças cardiovasculares entre mulheres acima de 50 anos, e tal indicação, portanto, não mais se justifica.(62,75,76)
O estrogênio pode levar a um aumento de proliferação celular no útero e nas mamas, podendo aumentar o risco de desenvolvimento de neoplasias uterinas. O emprego de estrógenos sem oposição de progesterona determina risco duas a três vezes maior de câncer de endométrio em relação a mulheres não usuárias. Quando esse uso é superior a dez anos, o risco é oito a dez vezes maior, representando 46 casos a mais de neoplasia de endométrio em 100 mil mulheres/ano.(45,77)
Estudos de metanálise demonstraram que, após 15 anos de uso da TRH, há aumento de 30% no risco de desenvolver câncer de mama, enquanto que pacientes que possuíam história familiar de câncer de mama apresentaram o dobro de risco de desenvolver a doença.(78) Usuárias de TRH apresentaram risco 50% maior de morte por câncer de ovário quando comparadas a pacientes que não utilizaram esta terapia. O uso de estrógeno por mais de dez anos na pós-menopausa aumenta significativamente o risco de morte por câncer de ovário, persistindo até 29 anos após suspensão do uso.(66)
Efeitos adversos da TRH como os apontados pelo estudo WHI influenciaram alguns profissionais da saúde e suas pacientes a buscar terapias alternativas que aliviem os sintomas e melhorem a qualidade de vida. Nas últimas décadas, aumentou o interesse pela utilização de fitoestrógenos para o controle de sintomas da menopausa, por suas ações estrogênicas e antiestrogênicas. As isoflavonas são compostos químicos fenólicos, sendo que as duas principais encontradas em grãos de soja são a genisteína e a daidzeína ou seus derivados glicosídeos. Estes derivados das isoflavonas são bioativos e possuem estrutura química semelhante ao 17b-estradiol, encaixando-se nos receptores de estrogênio mimetizando suas propriedades fisiológicas e bioquímicas. Após sua metabolização possuem três ações distintas no organismo – ação estrogênica, antiestrogênica e antioxidante. O efeito antiestrogênico é devido às isoflavonas competirem com o estrogênio pelos sítios de ligação nos receptores, impedindo que exerça seus efeitos negativos.(79)
No Brasil, a Anvisa aprova o uso de isoflavonas somente para o tratamento dos fogachos e como adjuvante na redução dos níveis séricos do colesterol.(80)
Há autores que contestam a ação protetora das isoflavonas, uma vez que mulheres com dieta rica em isoflavonas poderiam ter proliferação de lesões pré-malignas e aumento de risco de câncer de mama, sendo que o tempo de exposição seria o determinante para esse efeito.(81)
De qualquer forma, os clínicos conjuntamente com as pacientes devem sempre optar pela alternativa terapêutica com base nos riscos e benefícios individuais de cada paciente, com o objetivo de promover as condições para a mulher atravessar a transição da menopausa com qualidade de vida. Para isso, além da terapia é preciso que a paciente seja avaliada, inicialmente, um ou dois meses depois de instituída a medicação para ajustar as doses de estrogênio ou progesterona, se necessário. Em seguida, aos seis meses e doze meses e depois pelo menos anualmente. Na avaliação inicial e anual devem ser solicitados: mamografia de alta resolução, ultrassonografia pélvica nas mulheres com útero e densitometria óssea.(82,83)
CONSIDERAÇÕES FINAIS
Considerando a literatura consultada, constatou-se a importância da inter-relação entre os hormônios esteroides e da ação destes no ciclo menstrual mensal feminino, no epitélio estratificado do colo uterino, entre outros tecidos responsivos a eles.
Além disso, pode-se perceber que a menopausa é um importante evento fisiológico da vida reprodutiva feminina, normalmente acompanhada de alterações orgânicas importantes, as quais podem afetar a qualidade de vida das mulheres.
O conhecimento dessas alterações torna-se fundamental uma vez que as mulheres já passam grande parte de suas vidas nesse período. Ademais, no momento, a terapia de reposição hormonal é a principal alternativa para minimizar os sintomas do climatério.
A terapêutica ideal seria uma substância que tenha ação estrogênica sobre o tecido ósseo e o sistema urogenital, mas não em útero e mamas. O último posicionamento publicado pelas autoridades especializadas preconiza a indicação da terapia hormonal na menopausa para alívio dos sintomas vasomotores, conservação do trofismo urogenital, preservação da massa óssea e do colágeno, melhora do bem-estar e da sexualidade. A terapia hormonal com o objetivo de prevenção primária ou secundária de doença cardiovascular não é indicada, o mesmo ocorre em relação à osteoporose, em que a terapia hormonal não é a primeira escolha de tratamento já que existem outras condutas com resultados bastante satisfatórios.
Há necessidade, portanto, de novos estudos para melhor compreensão da indicação e contraindicação dessa terapia e também para o desenvolvimento de novas alternativas terapêuticas contra as alterações fisiológicas, comportamentais e patológicas decorrentes da menopausa.
AGRADECIMENTOS
Agradecemos a Deus, aos nossos pais e familiares, especialmente às nossas mães, pela dedicação e apoio ao longo desta caminhada tanto na vida pessoal como acadêmica.
Aos nossos namorados pela compreensão e aos amigos pelos momentos felizes compartilhados durante toda a graduação.
A nossa orientadora, Professora Patrícia Haas, por ter aceitado prontamente nos auxiliar e pela sua valiosa orientação e também por sua dedicação.
Abstract
Hormones are responsible for the integration of the organic systems activities. Women of reproductive age produce all three classes of sex steroids, estrogen, progestin and androgen. Normal levels of estrogens involve female sexual characteristics development. Rhythmic changes of secretion of female hormones and modification in the ovaries and sexual organs are characteristics of the reproductive years in women. The maturation and differentiation of the epithelium of the cervix are dependent on the hormonal action of estrogen and progesterone, determining the predominance of cells of a given degree of cell differentiation, according to age and menstrual cycle phase of woman. The basic diagnosis of menopause is the clinic, amenorrhea for a year, signs of hypoestrogenaemia and elevated serum follicle-stimulating hormone. The main treatment for menopausal symptoms utilizes estrogen, used alone or in combination with progesterone to prevent endometrial stimulation. The estrogen for hormone replacement can prevent osteoporosis and symptoms related to decreased serum estradiol. However, estrogen can lead to increased cell proliferation in the uterus and breasts, increasing the risk of developing uterine cancer. The ideal therapy would be a substance that has estrogenic action in bone and urogenital system, but not in the uterus and breasts.
Keywords
Female hormones; Menopause; Replacement therapy
Referências
- Guião-Leite FL. Avaliação da eficiência capilar como técnica analítica na prospecção de metabólitos de esteroides em extratos fecais de onça-pintada (Panthera onca). 2006. 124p. Tese (Doutorado em Medicina Veterinária). Faculdade de Medicina Veterinária e Zootecnia, Universidade de São Paulo. São Paulo.
- Nelson DL, Cox MM. Lehninger princípios de bioquímica. 4ª. ed. São Paulo: Sarvier, 2006.
- Fonseca AM, Bagnoli VR, Halbe HW, Pinotti, JA. Ginecologia endócrina – manual de normas. 1ª ed. SP: Roca Ltda, 2004. v. 1. 391 p.
- Ellmann S, Sticht H, Thiel F, Beckmann MW, Strick R, Strissel PL. Estrogen and progesterone receptors: from molecular structures to clinical targets. Cell Mol Life Sci. 2009 Aug;66(15): 2405-26.
- Selgrade JF, Harris LA, Pasteur RD. A model for hormonal control of the menstrual cycle: Structural consistency but sensitivity with regard to data. J Theor Biol. 2009;260(1):572-80.
- Souza Jr. AH, Albuquerque ES. Liberação automática de exames laboratoriais clínicos. Estudos. 2007; 34 (11/12): 1005-20.
- Guyton AC. Tratado de Fisiologia Médica. 11ª ed. Rio de Janeiro: Guanabara Koogan, 2006.
- Carvalho G. Citologia do trato genital feminino. 5ª ed. São Paulo: Atheneu, 2008.
- ESHRE Capri Workshop Group, Collins J, Crosignani PG. Endometrial bleeding. Hum Reprod Update. 2007 Sep-Oct;13(5):421-31.
- Spritzer PM, Wender MCO. Terapia hormonal na menopausa: quando não usar. Arq Bras Endocrinol Metabol. 2007;51(7):1058-63.
- Burger H, Woods NF, Dennerstein L, Alexander JL, Kotz K, Richardson G. Nomenclature and endocrinology of menopause and perimenopause. Expert Rev Neurother. 2007 Nov;7(11 Suppl): S35-4.
- Aranha RN, Faerstein E, Azevedo GM, Werneck G, Lopes CS. Análise de correspondência para avaliação do perfil de mulheres na pós-menopausa e o uso da terapia de reposição hormonal. Cad. Saúde Pública. 2004;20(1):100-08.
- WHO – World Health Organization. Research on the menopause in the 1900s. Disponível em: http://apps.who. int/bookorders/anglais/detart1.jsp?sesslan=1&codlan= 1&codcol=10&codcch=866. Acesso em: 10 janeiro 2010.
- Tamanaha S, Aldrighi JM, Dos Santos RE, Prado RAA. Sensibilidade e especificidade da histerossonografia nas afecções endometriais em mulheres assintomáticas pós-menopausa. Rev Assoc Med Bras. 2004;50 (4):427-32.
- Araújo Jr. NLC, Athanazio DA. Terapia de reposição hormonal e o câncer do endométrio. Cad. Saúde Pública. 2007;23(11):2613-22.
- Zahar SEV, Aldrighi JM, Neto AMP, Conde DM, Zahar LO, Russomano F. Qualidade de vida em usuárias e não usuárias de terapia de reposição hormonal. Rev. Assoc. Méd. Bras. 2005;51 (3):133-8.
- Melmed S, Conn PM. Endocrinology: Basics and Clinical Principles. 2th. Totowa: Humana Press, 2005. 439 p.
- Speroff L, Fritz MA. Clinical gynecologic endocrinology and infertility. 7th edition. Philadelphia: Lippincott Williams & Wilkins, 2005. 1334 p.
- Reis Filho RW, Araújo JC, Vieira EM. Hormônios sexuais estrógenos: Contaminantes bioativos. Quim. Nova. 2006;29(4):817-22.
- Reghelin ALS. Diagnóstico de enfermidades endócrinas. 2007. 36p. Monografia (Graduação em Medicina Veterinária) – Curso de Medicina Veterinária, Universidade Federal do Paraná, Paraná.
- 21. Holt RIG, Hanley NA. Essential Endocrinology and Diabetes. 5th. Malden, MA .Blackwell Publishing Ltd:, 2007.272 p.
- Rang HP, Dale MM, Ritter JM, Flower RJ. Farmacologia. 6ª ed. Rio de Janeiro: Elsevier, 2007. 848 p.
- Burtis CA, Ashwood ER, Bruns DE. Tietz Fundamentos de Química Clínica. 6ª ed. Rio de Janeiro: Elsevier, 2008. 992p.
- Harvey RA, Champe PC, Finkel R, Cubeddu LX, Clark MA. Pharmacology. 4th. Philadelphia: Lippincott Williams & Wilkins, 2009. 565p.
- Golan DE, Tashjian Jr., AH, Armstrong EJ, Armstrong AW. Principles of Pharmacology: The Pathophysiologic Basis of Drug Therapy. 2th. Philadelphia: Lippincott Williams & Wilkins, 2008. 987p.
- Jameson JL. (ed). Harrison’s Endocrinology. New York, NY: McGraw-Hill Publisher, 2006. 563p.
- Croxatto HB, Schürmann R, Fuhrmann U, Schellschimidt I (eds). New mechanisms for tissue-selective estrogen-free contraception. Heidelberg: Springer, 2005. 269 p.
- Srinivasan S, Nawaz Z. Molecular biology of estrogen receptor action. Hormones, brain and behavior, 2nd ed. Los Angeles: Elsevier, 2009. p.1187-1218,
- Brys M, Szyllo K, Romanowicz-Makowska H, Dobrowolski Z, Maskowska I, Krajewska W. Expression of estrogen and progesterone receptor genes in endometrium, myometrium and vagina of postmenopausal women treated with estriol. Sao Paulo Med J. 2009;127(3):128-3.
- Amato AA, Rossi A, Garcia EC, Thoma I, Vaz RF, De Paula AS, et al. Dosagem de hormônios por métodos imunobiológicos. Brasília méd. 2009;46 (1):63-74.
- CDC- Center for Disease Control and Prevention. Hormone Standardization. Disponível em: <http://www.cdc. gov/nceh/dls/hormone_standardization.htm> Acesso em: 15 fev 2010.
- Tsutsumi R, Webster NJG. GnRH pulsatility, the pituitary response and reproductive dysfunction. Endocr J. 2009;56(6):729-37.
- Burger H. The menopausal transition – endocrinology. J Sex Med. 2008 Oct;5(10):2266-73.
- Moreira SNT, Lima JG, Souza MBC, Azevedo GD. Estresse e função reprodutiva feminina. Rev. Bras. Saude Mater. Infant. [online]. 2005, vol.5, n.1, pp.119-125. http://dx.doi.org/10.1590/S1519-38292005000100015.
- Berek JS. Berek & Novak’s Gynecology. 14th. Philadelphia: 14th. Philadelphia: Lippincott Williams & Wilkins, 2007. 1671 p.
- Messinis IE. Ovarian feedback, mechanism of action and possible clinical implications. Hum Reprod Update. 2006 Sep-Oct;12(5): 557-71.
- Bombail V, Macpherson S, Critchley HO, Saunders PT. Estrogen receptor related beta is expressed in human endometrium throughout the normal menstrual cycle. Hum Reprod. 2008 Dec;23 (12):2782-90.
- Plewka J. Estudo sobre variações no método de citologia em meio líquido para o exame de papanicolaou. 2007. 110p. Dissertação (Mestrado em Ciências Farmacêuticas) – Universidade Federal do Paraná, Paraná.
- Tapia FL. Citología del tracto genital femenino y de la glándula mamaria. Málaga: Vértice. 2008, 315p.
- Atkinson BF. Atlas de Diagnóstico Citopatológico. 2ª ed. Madrid: Elsevier, 2005.816 p.
- Brasil. Ministério da Saúde – Secretaria de Atenção à Saúde Departamento Programáticas Estratégicas. Manual de Atenção à Mulher no Climatério/Menopausa. 1a ed. Brasília: Editora MS, 2008.
- Peña BC. Citología endometrial em pacientes posmenopáusicas com terapia hormonal. Rev Obstet Ginecol Venez 2008;68(2) 73-80.
- Giacomini DR, Mella EAC. Reposição Hormonal: vantagens e desvantagens. Semina Ciênc Biol Saúde. 2006; 27(1):71-92.
- Brasil. Ministério da Saúde- Secretaria de Atenção à Saúde Departamento Programáticas Estratégicas. Política Nacional de Atenção Integral à Saúde da Mulher: Princípios e Diretrizes. 1ª. ed. Brasília: Editora MS, 2004.
- Pantaleão JAS, Henriques HN, Carvalho ACB, Pollastri CE, Soares Filho PJ; Guzmán-Silva MA. Efeito da tibolona sobre o endométrio de ratas castradas. Rev Bras Ginecol Obstet. 2009;31(3):124-30.
- Péret FJA, Caetano JPJ. Ginecologia e Obstetrícia: Manual para concursos. 4ª ed. Rio de Janeiro: Guanabara Koogan; 2007.
- Vigeta SMG, Brêtas ACP. A experiência da perimenopausa e pós-menopausa com mulheres que fazem uso ou não da terapia de reposição hormonal. Cad. Saúde Pública. 2004;20(6):1682-9.
- Blake J. Menopause: evidence-based practice. Clin. obstet. gynecol. 2006;20 (6):799-839.
- Correia MIV. Conhecimentos e comportamentos das mulheres menopáusicas sobre menopausa. 2009. 103 p. Monografia (Grau de Licenciatura em Enfermagem). Universidade Fernando Pessoa, Ponte de Lima.
- Martins MAD, Nahas EAP, Nahas-Neto J, Uemura G, Buttros DAB, Traiman, P. Qualidade de vida em mulheres na pós-menopausa, usuárias e não usuárias de terapia hormonal. Rev. Bras. Ginecol. Obstet. 2009;31(4):196-202.
- Ricóveri FA. Receptores de estrógenos en posmenopáusicas. Rev Obstet Ginecol Venez. 2008;68(1):41-6.
- Hoover K, Wallach E.E. Manual de ginecologia e obstetrícia do Johns Hopkins. 2ª ed. Artmed: São Paulo, 2006, p.475-481.
- Castelo-Branco C, Cancelo MJ, Villero J, Nohales F, Juliá MD. Management of post-menopausal vaginal atrophy and atrophic vaginitis. Maturitas. 2005;52 (1):46-52.
- Mac Bride MB, Rhodes DJ, Shuster LT. Vulvovaginal atrophy. Mayo Clin Proc. 2010 Jan;85(1):87-94.
- Oliveira MA, Costa LS, Martins VS, Tress JC, Aldrighi JM, Wajngarten M, et al. Efeito da terapia de reposição hormonal e do raloxifeno a curto prazo sobre o intervalo QTc e dispersão de QTc em mulheres idosas com hipertensão arterial sistêmica. Rev. SOCERJ. 2005;18(1):77-81.
- Oliveira A, Mancini Filho J. Perfil nutricional e lipídico de mulheres na pós-menopausa com doença arterial coronariana. Arq Bras Cardiol. 2005;84(4):325-9.
- Faloni APS, Cerri PS. Mecanismos celulares e moleculares do estrógeno na reabsorção óssea. Rev. Odontol. UNESP. 2007; 36(2):181-8.
- Gu G, Mulari M, Peng Z, Hentunen TA, Väänänen HK. Death of osteocytes turns off the inhibition of osteoclasts and triggers local bone resorption. Biochem Biophys Res Commun. 2005 Oct 7;335(4):1095-101.
- Bachmann G, Lobo RA, Gut R, Nachtigall L, Notelovitz M. Efficacy of low-dose estradiol vaginal tablets in the treatment of atrophic vaginitis: a randomized controlled trial. Obstet Gynecol. 2008 Jan;111(1):67-76.
- Alves DL. Avaliação da citologia vaginal e estudo morfológico e imunoistoquímico dos efeitos do Trifolium pratense e da Cimicífuga racemosa no endométrio de Rattus norvegicus albinus ooforectomizadas. 2008.94 p. Tese (Mestrado em Medicina) – Faculdade de Ciências Médicas da Santa Casa de São Paulo, São Paulo.
- Hasenack BS, Miquelão AK, Marquez AS, Pinheiro EHT, Soares FF, Siqueira MP, et al. Vaginose bacteriana em mulheres carentes menopausadas e não menopausadas. RBAC. 2006;38(4):239-42.
- Nunes R, Faerstein E, Azevedo GM, Werneck G, Lopes CS. Análise de correspondência para avaliação do perfil de mulheres na pós-menopausa e o uso da terapia de reposição hormonal. Cad.Saúde Pública. 2004;20 (1):100-8.
- Fernandes CE, Pinho-Neto JSL, Gebara OCE, Santos Filho RD, Pinto Neto AM, Pereira Filho AS, et al. I Diretriz Brasileira sobre Prevenção de Doenças Cardiovasculares em Mulheres Climatéricas e a Influência da Terapia de Reposição Hormonal (TRH) da Sociedade Brasileira de Cardiologia (SBC) e da Associação Brasileira do Climatério (SOBRAC). Arq Bras Cardiol.2008;91 (1 supl.1):1-23.
- SOBRAC – Sociedade Brasileira de Climatério. Consenso Brasileiro Multidisciplinar de Assistência à Saúde da Mulher Climatérica. São Paulo: Segmento, 215-271, 2003.
- Hurd WW, Amesse LS, Randolph Junior JF. Menopausa. In: Berek JS, Novak ER, editors. Novak tratado de ginecologia. 13th ed. Rio de Janeiro: Guanabara Koogan; 2005. p.1035-64.
- MacLennan A, Lester S, Moore V. Oral oestrogen replacement therapy versus placebo for hot flushes. Cochrane Database Syst Rev. 2001;(1):CD002978.
- Duncan BB, Schmidt MI, Giugliani ERJ. Medicina ambulatorial: Condutas clínicas em atenção primária baseadas em evidências. 3ª ed. Porto Alegre: Artmed, 2004.
- Wannmacher L, Lubianca JN. Terapia de reposição hormonal na menopausa: evidências atuais. Disponível em: www.bvsms.saude. gov.br. Acesso em: 20 janeiro 2010
- Danckers LF. Salud Ósea y Menopausia. Rev. Med. Clin. Condes – 2009;20(1) 67-73.
- Grady D, Rubin SM, Petitti DB, Fox CS, Black D, Ettinger B, Ernster VL, Cummings SR.
- Austrália. Better Health Channel. Menopause and osteoporosis. Disponível em: http://www.betterhealth. Vic.gov.au Acesso em: 19 maio 2010.
- Gupta S, Kumar N, Singhal N, Manektala U, Jain S, Sodhani P. Cytohormonal and morphological alterations in cervicovaginal smears of postmenopausal women on hormone replacement therapy. Diagn Cytopathol. 2006 Oct;34(10):676-81.
- Bateson DJ, Weisberg E. An open-label randomized trial to determine the most effective regimen of vaginal estrogen to reduce the prevalence of atrophic changes reported in postmenopausal cervical smears. Menopause. 2009 Jul-Aug;16(4):765-9.
- Cotreau MM, Chennathukuzhi VM, Harris HA, Han L, Dorner AJ, Apseloff G, et al. A study of 17ß-estradiol-regulated genes in the vagina of postmenopausal women with vaginal atrophy. Maturitas. 2007 Dec 20;58(4):366-76.
- Aldrighi JM, Ribeiro AL. Terapia com estrogênio após a menopausa reduz o risco de calcificação na artéria coronária. Rev. Assoc. Med. Bras. 2007;53(4):284-284,
- Andreoli TE, Cecil RL. Cecil medicina interna básica. 6ª ed. Rio de Janeiro (RJ): Elsevier, 2005.
- Yildirim G, Tugrul S, Uslu H, Pekin O, Eren S. Effects of two different regimens of continuous hormone replacement therapy on endometrial histopathology and postmenopausal uterine bleeding. Arch Gynecol Obstet. 2006;273 (1):268-73.
- Prentice RL, Manson JE, Langer RD, Anderson GL, Pettinger M, Jackson RD, et al. Benefits and risks of postmenopausal hormone therapy when it is initiated soon after menopause. Am J Epidemiol. 2009 Jul 1;170(1):12-23.
- Grings AC, Kühne J, Gomes AP, Jacobsen T, Cascaes AC, Lara GM. Riscos e benefícios da terapia de reposição hormonal (TRH) em mulheres na menopausa. RBAC. 2009;41(3):229-33.
- Araujo CS, Scalzer LP, Siniscalchi V, Silva AG, Endringer DC, Garcia Jr. RP. Avaliação do efeito da “essência de hormônio natural, almeirão-roxo” produzido pela Pastoral da Saúde de Domingos Martins, ES, em ratas com menopausa cirúrgica. Natureza on line, v.7, n.1, p.12-18, 2009. Disponível em http://www.naturezaonline.com.br
- Piovesan AC, Soares Jr. JM, Mosquette R, Simões MJ, Simões RS, Baracat EC. Estudo morfológico e molecular da mama de ratas castradas tratadas com isoflavona ou estrogênios. Rev Bras Ginecol Obstet. 2005;27(4):204-9.
- Clapauch R, Athayde A, Meirelles RMR, Weiss RV, Pardini DP, Leão LMCSM, et al Terapia hormonal da menopausa: posicionamento do Departamento de Endocrinologia Feminina e Andrologia da SBEM em 2004. Arq Bras Endocrinol Metabol. 2005;49(3):449-54.
- Pardini D. Terapia hormonal da menopausa. Arq Bras Endocrinol Metab. 2007;51(6):938-42.
Correspondência
Sabrina Gonçalves
Campus UFSC Araranguá – Bairro Mato Alto
88900-000 – Araranguá, SC
