Perfil clínico e laboratorial de pacientes com hipercelularidade no líquido cefalorraquidiano: um estudo retrospectivo em um hospital universitário brasileiro
Clinical and laboratory profile of patients with cerebrospinal fluid hypercellularity: A retrospective study in a Brazilian University Hospital
Cecília de Farias Dutra1, Laura Bonai Casal1,2, João Batista Costa-Neto1,2,3, Fernanda Gomes Nascimento1,2,4, José Antônio Mainardi de Carvalho1,2, Clóvis Paniz1,2
1 Universidade Federal de Santa Maria, Laboratório de Pesquisa em Análises Clínicas Aplicadas – LAPACA, Departamento de Análises Clínicas e Toxicológicas. Santa Maria, RS, Brasil.
2 Universidade Federal de Santa Maria, Programa de Pós-Graduação em Ciências Farmacêuticas, Departamento de Análises Clínicas e Toxicológicas. Santa Maria, RS, Brasil.
3 Academia do Líquor, Análise de líquor – São Bernardo do Campo, SP – Brasil.
4 Universidade Federal de Santa Maria, Hospital Universitário de Santa Maria. Santa Maria, RS, Brasil.
Recebido em 11/12/2024
Aprovado em 03/05/2024
DOI: 10.21877/2448-3877.202500213.pt
INTRODUÇÃO
O líquido cefalorraquidiano (LCR) é um fluido biológico complexo, produzido principalmente pelos plexos coroides — tecidos secretores localizados em ventrículos específicos — e, em menor proporção, nos espaços intersticial e subaracnoide.(1) Esse fluido circula entre os ventrículos cerebrais e o espaço subaracnoide, situado entre as leptomeninges aracnoides e a pia-máter, no encéfalo e na medula espinhal, desempenhando um papel essencial na proteção mecânica. Atua como um amortecedor para o cérebro e a medula espinhal, protegendo essas estruturas contra impactos externos, traumatismos e variações de pressão. Além disso, é fundamental para a manutenção da flutuabilidade cerebral, defesa do sistema nervoso central (SNC) contra agentes infecciosos, remoção de resíduos e substâncias tóxicas e circulação de nutrientes.(2,3)
A análise do LCR é uma etapa fundamental no diagnóstico de distúrbios neurológicos, sendo que a hipercelularidade — definida como um aumento anormal de células nucleadas — constitui um marcador diagnóstico importante.(4–6) Em condições fisiológicas, a celularidade do LCR é notavelmente baixa, com valores de referência geralmente inferiores a 5 células/μL em adultos e inferiores a 20 células/μL em neonatos.(7–9) Esse limite rigoroso reflete o papel restritivo da barreira hematoencefálica (BHE), que permite apenas vigilância imunológica restrita (ex.: linfócitos T ativados), impedindo a infiltração generalizada de células do sistema imune.(7,10)
Entretanto, processos neuroinflamatórios podem romper esse equilíbrio. Infecções (bacterianas, virais, fúngicas ou parasitárias), doenças autoimunes, traumatismos ou neoplasias podem desencadear a migração de células imunes para o LCR por meio de vênulas pós-capilares, do plexo coroide ou da barreira aracnoide.(6,11,12) Apesar da utilidade diagnóstica da hipercelularidade, persistem lacunas críticas, tais como: 1. Padrões específicos de doenças: embora a elevação na contagem celular indique a presença de doença, a composição diferencial das células imunológicas (por exemplo, neutrófilos na meningite bacteriana vs. linfócitos nas infecções virais) e sua correlação com diferentes etiologias ainda não estão suficientemente caracterizadas;(4,13–15)
2. Valor prognóstico: a relação entre os níveis de celularidade, os subtipos de células infiltrantes e os desfechos clínicos (por exemplo, resposta ao tratamento, mortalidade) é pouco compreendida, especialmente em contextos com recursos limitados;(16–18) 3. Desigualdades regionais: a maioria dos estudos que definem os valores de referência do LCR e os perfis inflamatórios provém de países de alta renda, o que limita sua aplicabilidade a populações com diferentes cargas epidemiológicas (por exemplo, maiores taxas de neuroinfecções em regiões tropicais).(19,20)
No sul do Brasil, onde as doenças infecciosas e inflamatórias do SNC são prevalentes, uma compreensão detalhada dos padrões de hipercelularidade no LCR pode otimizar os fluxos diagnósticos e as avaliações prognósticas. Para abordar essas lacunas, o presente estudo teve como objetivo estabelecer o perfil clínico-laboratorial de pacientes com hipercelularidade no LCR atendidos em um hospital universitário no sul do Brasil, no período de janeiro de 2020 a dezembro de 2023.
MATERIAIS E MÉTODOS
O conjunto de dados foi composto por prontuários médicos e resultados de exames laboratoriais de todos os pacientes que realizaram análise do LCR no Hospital Universitário de Santa Maria, no estado do Rio Grande do Sul (sul do Brasil), entre 1º de janeiro de 2020 e 31 de dezembro de 2023. Os critérios de inclusão foram: idade igual ou superior a um ano, presença de mais de 5 células/mm³ no LCR (indicativa de aumento da celularidade)(7,8,9), e prontuário médico devidamente preenchido, além de dados laboratoriais contendo, no mínimo, informações sobre celularidade, glicorraquia e níveis de proteínas.
Durante esse período, 3.250 amostras foram analisadas no hospital. Foram excluídos da análise pacientes com menos de um ano de idade (n=798), em razão da barreira hematoencefálica ainda estar em processo de formação, o que poderia resultar em um perfil de resposta distinto frente aos distúrbios avaliados. Também foram excluídos pacientes que apresentaram menos de cinco células na citologia do LCR (n=1.790), uma vez que o objetivo do estudo era avaliar pacientes com níveis celulares aumentados. Pacientes com dados incompletos nos prontuários médicos e no sistema de exames laboratoriais do hospital também foram excluídos (n=87). Das 575 amostras restantes, 251 foram excluídas por corresponderem a múltiplas coletas de um mesmo paciente, que havia sido submetido a mais de uma análise durante o período estudado. Nos casos em que o paciente realizou múltiplas punções lombares em momentos distintos, foram incluídos os resultados da coleta com o maior número de células na citologia do LCR. Assim, após as exclusões mencionadas, este estudo contou com a participação de 325 pacientes.
Os dados clínicos coletados incluíram sexo, idade, sorologia, diagnósticos obtidos e óbitos. Os dados laboratoriais abrangeram o exame citológico do LCR, dosagens de glicose e proteínas, e testes voltados à identificação de agentes etiológicos. Os níveis de glicose e proteínas foram quantificados pelos métodos enzimático e imunoturbidimétrico, respectivamente, utilizando o analisador Dimension RxL (Siemens Healthcare Diagnostics Inc., EUA). A contagem total de células foi realizada com a câmara de Fuchs-Rosenthal. A contagem diferencial de células foi executada por microscopia óptica em lâmina preparada com centrífuga citológica Excelsa® Flex 3400 (Fanem, Brasil), seguida de coloração May-Grünwald-Giemsa. O laboratório responsável pelos dados participa de programas de controle de qualidade interno e externo vinculados ao Programa Nacional de Controle de Qualidade (PNCQ). O estudo foi conduzido de acordo com a Declaração de Helsinque e aprovado pelo Comitê de Ética em Pesquisa da instituição (CAAE nº 23081.034325/2022-52).
ANÁLISE ESTATÍSTICA
As análises estatísticas foram realizadas por meio dos softwares SPSS Statistics versão 22.0 (IBM, EUA) e GraphPad Prism versão 5.04 (GraphPad, EUA). O teste de normalidade de Kolmogorov-Smirnov foi aplicado para verificar a distribuição das variáveis. Como os dados não apresentaram distribuição normal, estes foram expressos como medianas e intervalos interquartis. As comparações entre os grupos foram feitas com o teste de Kruskal-Wallis, seguido pelo teste de comparações múltiplas de Dunn quando significativo. As variáveis categóricas foram representadas por contagens absolutas e percentuais, sendo analisadas por meio do teste do qui-quadrado. Adotou-se um nível de significância de 5% (p<0,05).
RESULTADOS
Ao examinar as amostras dos 325 pacientes, observou-se que a maioria (48,3%) apresentava infecções do sistema nervoso central (SNC). A segunda causa mais prevalente de aumento da celularidade foi a presença de neoplasias, correspondendo a 16% dos casos. Uma visão abrangente de todas as condições que resultaram em aumento da celularidade no SNC é apresentada na Tabela 1.
Tabela 1
Etiologia da hipercelularidade no líquido cefalorraquidiano segundo a categoria diagnóstica em 325 amostras analisadas em um hospital universitário.
| Categoria Diagnóstica | Casos confirmados
n = 240 |
Confirmados + casos presumidos*
n = 325 |
|
| Infecções gerais | 72 (30,0) | 157 (48,3) | |
| Infecções bacterianas | 36 (50,0) | 67 (42,7) | |
| Infecções virais | 9 (12,5) | 40 (25,5) | |
| Infecções fúngicas | 16 (22,2) | 18 (11,5) | |
| Infecções parasitárias | 7 (9,7) | 7 (4,5) | |
| Infecções bacterianas e fúngicas concomitantes | 3 (4,2) | 3 (1,9) | |
| Infecção fúngica e parasitária concomitante | 1 (1,4) | 1 (0,6) | |
| Etiologia indefinida | 21 (13,4) | ||
| Autoimune | 15 (6,2) | 15 (4,6) | |
| Neoplasias | 52 (21,6) | 52 (16,0) | |
| Acidente vascular cerebral/Traumatismo | 36 (15,0) | 36 (11,1) | |
| Epilepsia | 23 (9,6) | 23 (7,1) | |
| Outros | 42 (17,5) | 42 (12,9) | |
Os resultados são expressos como número de indivíduos (percentual). *Presumido: quando o diagnóstico foi estabelecido sem confirmação laboratorial, geralmente com base na manifestação clínica ou em exames de imagem (ressonância magnética ou tomografia computadorizada).
A maioria dos 325 pacientes incluídos no estudo era do sexo masculino, com mediana de idade de 37 anos. Entre os pacientes, 63 (19,4%) viviam com o vírus da imunodeficiência humana (HIV) e 77 (23,7%) foram a óbito. As características de todos os pacientes do estudo, estratificadas pelos diferentes grupos de doenças diagnosticadas, são apresentadas na Tabela 2.
Além disso, observamos discrepâncias significativas entre os grupos estratificados ao comparar a celularidade, as concentrações de proteína e a glicorraquia (isto é, concentrações de glicose no LCR). A celularidade nas neuroinfecções [49 (8–304) células/mm³] foi significativamente maior do que a observada no grupo com epilepsia [10 (5–23) células/mm³] e no grupo com doenças autoimunes [8 (6–14) células/mm³] (p = 0,002). Nos casos de epilepsia, as concentrações de proteína no LCR foram inferiores [31,2 (22,2–72,9) mg/dL] em comparação com o grupo de neuroinfecção [81,8 (45,8–172,0) mg/dL] (p = 0,004). Os maiores valores de glicorraquia foram encontrados no grupo com acidente vascular cerebral/traumatismo [73,0 (61,0–91,7) mg/dL], sendo significativamente superior aos valores observados nos grupos com neuroinfecção [53,5 (38,7–71,0) mg/dL] e neoplasia [54,0 (48,0–76,0) mg/dL] (p < 0,001). Os dados detalhados sobre celularidade, proteínas no LCR e glicorraquia entre os grupos de doenças do SNC estão apresentados na Tabela 3.
Tabela 2
Perfil dos pacientes submetidos à punção lombar entre 2020 e 2023 com mais de 5 células/mm³ no líquido cefalorraquidiano, atendidos em um hospital universitário
| Variáveis | Total | Infecção | Autoimune | Neoplasias | Epilepsia | Acidente vascular cerebral/ Traumatismo | Outros | p |
| n = 325 | n = 157 | n = 15 | n = 52 | n = 23 | n = 36 | n = 42 | ||
| Idade (anos) | 37 (12–56) | 37 (10–52)a | 36 (10–55)a,b,c | 41 (10–59)a,c | 8 (5–25)b | 52 (37–62)c | 40 (23–57)a,c | < 0,001 |
| Sexo (Feminino) | 132 (40,6) | 62 (39,5) | 8 (53,3) | 19 (36,5) | 13 (56,5) | 8 (22,2) | 22 (52,4) | 0,046 |
| HIV | 63 (19,4) | 38 (24,2)a | 0 (0,0) | 6 (11,5) a,b | 5 (21,7) a,b | 1 (2,8)b | 13 (31,0)a | 0,003 |
| Desfecho (morte) | 77 (23,7) | 37 (23,6)a | 1 (6,7)a | 24 (46,2)b | 2 (8,7)a | 7 (19,4)a | 6 (14,3)a | 0,001 |
As variáveis contínuas são apresentadas como mediana com intervalos interquartis. O teste de Kruskal-Wallis foi utilizado para comparar os grupos. O teste de comparações múltiplas de Dunn foi aplicado quando se identificou diferença estatisticamente significativa. As variáveis categóricas são expressas como número de indivíduos (percentual), e os valores dos diferentes grupos foram comparados por meio do teste do qui-quadrado.
Tabela 3
Celularidade, proteína e glicorraquia no líquido cefalorraquidiano em diferentes grupos de doenças do sistema nervoso central em pacientes submetidos à punção lombar entre 2020 e 2023 com mais de 5 células/mm³ no líquido cefalorraquidiano, atendidos em um hospital universitário
| Variáveis | Infecção | Autoimune | Neoplasias | Epilepsia | Acidente vascular cerebral ou traumatismo | p |
| Células (/mm³) | 49 (8–304)a | 8 (6–14)b,c | 14 (6–64)a,c,d | 10 (5–23)b,d | 15 (7–47)a,c,d | 0,002 |
| n = 157 | n = 15 | n = 52 | n = 23 | n = 36 | ||
| Proteína (mg/dL) | 81,8 (45,8–172,0)a | 67,5 (49,0–492,1)a,c | 52,9 (34,5–106,8)a,d | 31,2 (22,2–72,9)b,c,d | 78,2 (52,2–127,4)a,c | 0,004 |
| n = 154 | n = 14 | n = 44 | n = 23 | n = 35 | ||
| Glicorraquia (mg/dL) | 53,5 (38,7–71,0)a | 67,0 (60,0–74,5)a,c | 54,0 (48,0–76,0)a | 62,0 (47,0–79,0)a,d | 73,0 (61,0–91,7)b,c,d | <0,001 |
| n = 154 | n = 14 | n = 42 | n = 23 | n = 36 |
Letras sobrescritas diferentes entre as colunas indicam diferenças entre os grupos. O teste de Kruskal-Wallis foi utilizado para comparar os grupos. O teste de comparações múltiplas de Dunn foi aplicado quando se identificou diferença estatisticamente significativa.
Observamos diferenças significativas nas concentrações de glicorraquia e proteínas no líquor em relação aos principais agentes causadores de infecções neurológicas. Notavelmente, as infecções bacterianas [52 (28–68) mg/dL] e fúngicas [31 (20–51) mg/dL] apresentaram concentrações de glicose significativamente mais baixas em comparação com as infecções virais [60 (33–72) mg/dL] (p<0,001), enquanto as infecções bacterianas demonstraram concentrações de proteínas marcadamente elevadas [109 (56–251) mg/dL] em comparação com as virais [65 (37–110) mg/dL] (p=0,027). A celularidade foi mais pronunciada nas infecções bacterianas, com predomínio de neutrófilos, ao passo que infecções virais, fúngicas e parasitárias apresentaram predomínio linfocítico. A Figura 1 ilustra a tríade composta por: (A) predomínio neutrofílico da celularidade nas infecções bacterianas; (B) hipoglicorraquia acentuada em casos bacterianos/fúngicos; (C) elevação desproporcional da proteinorraquia em etiologias bacterianas; e (D) predomínio celular em cada grupo de neuroinfecção.
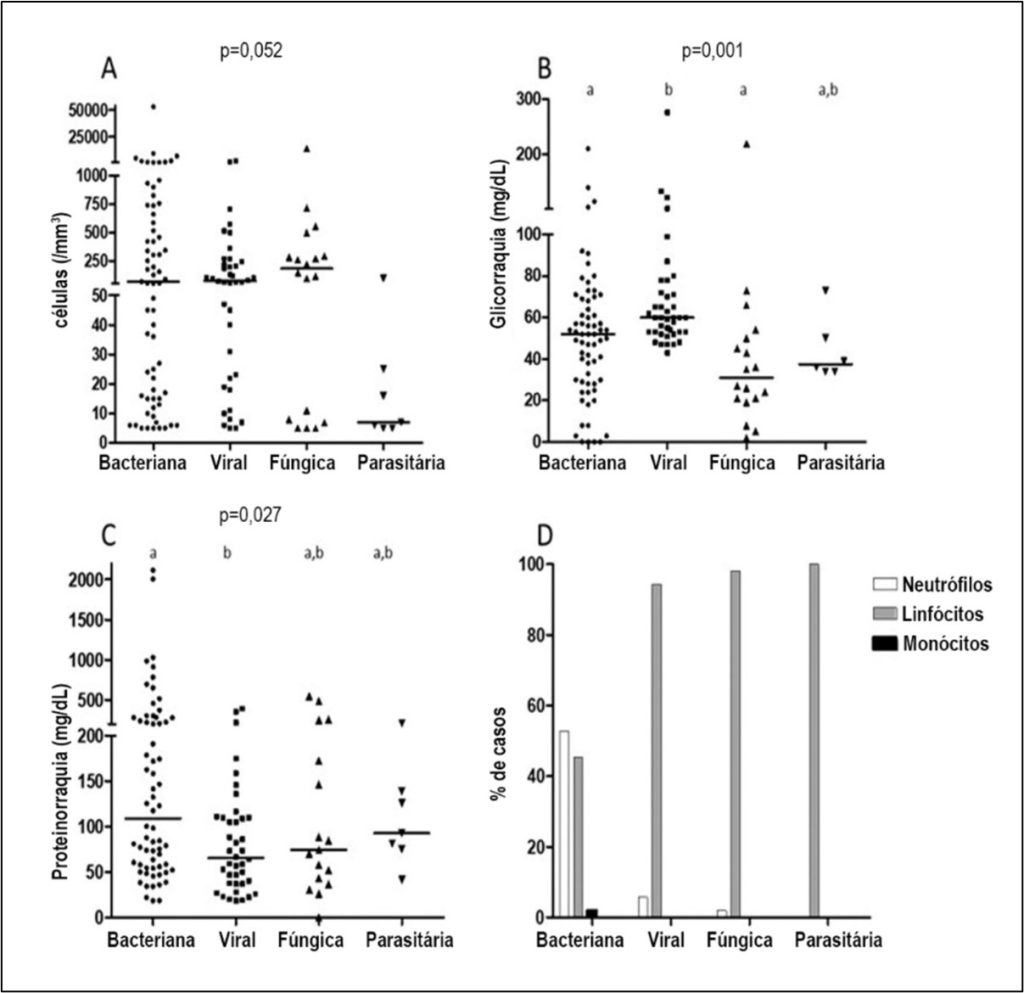
Figura 1
Celularidade (A), glicorraquia (B), proteinorraquia (C) e predomínio celular (D) no líquido cefalorraquidiano nos diferentes grupos etiológicos infecciosos em 157 pacientes com meningite submetidos à punção lombar entre 2020 e 2023 com mais de 5 células/mm³ no líquor, atendidos em um hospital universitário
Letras diferentes no topo dos dados dos grupos indicam diferenças entre eles. O teste de Kruskal-Wallis foi utilizado para comparar os grupos. O teste de comparações múltiplas de Dunn foi realizado quando se identificou diferença estatisticamente significativa.
DISCUSSÃO
Este estudo realizou uma análise retrospectiva de dados de pacientes com hipercelularidade no líquor (LCR) atendidos em um hospital universitário, com o objetivo de traçar perfis para diferentes doenças e identificar alterações nos parâmetros laboratoriais. A hipercelularidade no LCR é um marcador essencial de processos inflamatórios ou infecciosos no sistema nervoso central (SNC) e indica o provável diagnóstico de diversas doenças.(15)
As principais condições associadas ao aumento da celularidade no LCR foram as neuroinfecções, seguidas pelas doenças neoplásicas e por condições relacionadas a acidente vascular cerebral (AVC) ou traumatismo. Esses achados diferem de um estudo realizado na Dinamarca, no qual houve predominância de infecções neurológicas, seguidas por causas vasculares, doenças degenerativas e neoplasias.(11) A ausência de dados sobre pacientes com menos de 5 células/mm³ no LCR pode ter excluído muitos casos de doenças neurodegenerativas, que nem sempre apresentam hipercelularidade no líquor.
Entre todos os grupos de doenças, as neuroinfecções, incluindo meningites e encefalites, apresentaram uma mediana de celularidade mais elevada em comparação aos demais grupos. A alta celularidade observada nas infecções bacterianas indica inflamação aguda.(14) Além disso, tanto as neuroinfecções quanto as doenças neoplásicas apresentaram concentrações reduzidas de glicose no LCR. A elevada demanda por glicose por microrganismos patogênicos e por células neoplásicas, conforme demonstrado em diversos outros estudos, corrobora nossos resultados.(12,17,18)
As diferenças significativas na glicorraquia (infecções bacterianas/fúngicas vs. virais) e nas concentrações de proteína no LCR (bacterianas > outras etiologias) entre os agentes etiológicos destacam mecanismos fisiopatológicos distintos: infecções bacterianas promovem intensa glicólise e comprometimento da barreira hematoencefálica, enquanto infecções virais desencadeiam alterações metabólicas mais brandas.(21,22)
Esses padrões, aliados à predominância de neutrófilos (bacterianas) versus linfócitos (virais/fúngicas), oferecem subsídios diagnósticos especialmente úteis em contextos com recursos limitados, onde a confirmação do agente etiológico pode ser tardia (Tabela 3, Figura 1).
Além disso, as neuroinfecções tiveram como principais agentes etiológicos as bactérias, seguidas pelos vírus e fungos. A comparação das características das infecções causadas pelas diferentes classes revelou que as infecções bacterianas e fúngicas apresentaram concentrações medianas mais baixas de glicorraquia em comparação às infecções virais. Ademais, as infecções bacterianas apresentaram concentrações proteicas mais elevadas. Esses achados podem ser atribuídos às propriedades inerentes da estrutura e do metabolismo microbiano, que influenciam os diferentes níveis de consumo de glicose e a resposta imune às bactérias, o que resulta em proteinorraquia aumentada.(19,20)
Do ponto de vista citológico, a maioria das infecções bacterianas demonstrou predominância de neutrófilos, enquanto as demais infecções apresentaram predominância linfocitária. Esses dados ilustram o fenômeno amplamente conhecido da resposta imune, que favorece a neutrofilia nas infecções bacterianas e a linfocitose nas infecções virais, fúngicas e parasitárias.(10) Esse comportamento citológico pode estar associado à localização específica da infecção, como meningite, meningoencefalite, encefalite ou mielite.(23) Contudo, é importante destacar que muitas infecções bacterianas do SNC apresentam predominância linfocitária. Portanto, o clínico deve estar atento a esse achado para evitar atrasos no tratamento da meningite bacteriana, que pode ser fatal. Em contraste, Jaijakul e colaboradores(15) apresentaram uma perspectiva alternativa sobre essa sobreposição. Em um estudo multicêntrico realizado nos Estados Unidos, que incluiu 182 pacientes com infecções neurológicas virais confirmadas, 25% apresentaram predominância de neutrófilos no LCR. O estudo concluiu que essa sobreposição é mais prevalente nos primeiros dias da infecção. A presunção do agente etiológico na maioria dos casos decorre de várias limitações presentes no sistema de saúde, incluindo a baixa sensibilidade do método de Gram e o tempo necessário para o crescimento das culturas microbianas. Além disso, a predominância leucocitária e práticas não laboratoriais, como exames de neuroimagem, permitem essa presunção e uma iniciação mais rápida do tratamento.(13)
A variabilidade nos padrões celulares evidencia a complexidade do diagnóstico das infecções do SNC. Para além dos achados laboratoriais, fatores específicos dos pacientes, como o estado imunológico, desempenham um papel crucial. Nesse contexto, nossos achados também revelaram que 19,4% dos pacientes viviam com HIV, uma prevalência consistente com as observações de Chen et al. , (16) que relataram que a imunossupressão associada ao HIV aumenta a suscetibilidade a infecções oportunistas do SNC. Esse resultado está em consonância com evidências anteriores de Onkarappa et al. (2020),(24) cujo estudo retrospectivo sobre neuroinfecções associadas ao HIV/AIDS na Índia destacou o risco elevado de complicações neurológicas nessa população. Notavelmente, seu trabalho identificou as infecções oportunistas como a manifestação neurológica mais frequente em pacientes com AIDS e um dos principais fatores de mortalidade.
Em nossa coorte, a mortalidade entre os pacientes HIV positivos alcançou 23,7%, o que reforça a gravidade do quadro clínico das doenças neurológicas relacionadas ao HIV. Essa elevada taxa de letalidade ressalta a necessidade crítica de detecção precoce e manejo direcionado das infecções do SNC em indivíduos imunocomprometidos, especialmente em contextos de alta prevalência.
Em comparação com estudos realizados na América Latina, nossos dados apresentam semelhanças e contrastes relevantes. Por exemplo, um estudo colombiano observou uma prevalência significativa de meningite bacteriana, com destaque para a doença meningocócica invasiva causada por Neisseria meningitidis.(25) Em contraste com ambos os estudos, Silva et al., em uma análise da dinâmica epidemiológica da meningite no Brasil, observaram uma tendência estacionária na prevalência de meningite viral e uma tendência decrescente da meningite bacteriana e de outros agentes etiológicos. Esses dados reforçam a importância de considerar o contexto regional e as características da população atendida ao interpretar os achados laboratoriais e clínicos do LCR.(26)
Essas disparidades regionais destacam a necessidade de protocolos diagnósticos localizados. Nesse sentido, outros estudos realizados no Brasil corroboram os achados laboratoriais observados nesta análise, especialmente no que se refere à elevação da celularidade e das concentrações de proteínas em infecções bacterianas do SNC. Um estudo conduzido em um hospital da região metropolitana de Porto Alegre/RS relatou que, em casos de meningite bacteriana, observaram-se hipoglicorraquia, hiperproteinorraquia e elevação significativa da celularidade, reforçando a utilidade da análise combinada dos parâmetros do LCR como uma ferramenta diagnóstica eficaz na diferenciação entre etiologias infecciosas.(27) Os padrões observados de hipercelularidade e aumento de proteínas no LCR estão alinhados com pesquisas retrospectivas prévias realizadas em crianças mexicanas, conforme descrito por Franco-Paredes et al. (2008).(28)
Devem-se reconhecer as limitações do estudo, como a presunção de diagnósticos com base em características clínicas e predominância celular, sem confirmação do agente etiológico. Além disso, por se tratar de um estudo retrospectivo, estavam disponíveis apenas os dados dos exames de rotina previamente realizados, o que impossibilitou a inclusão de novos testes. Apesar dessas limitações, os dados coletados pelo estudo fornecem informações valiosas e delineiam um perfil das análises do LCR com alta celularidade.
CONCLUSÃO
Os resultados demonstram que as infecções microbianas são os distúrbios do sistema nervoso central mais prevalentes na população estudada. Os principais agentes etiológicos são as bactérias, seguidas por vírus e fungos. As maiores contagens celulares foram observadas nos casos de neuroinfecção, enquanto as infecções causadas por agentes bacterianos e fúngicos apresentaram uma redução mais acentuada na glicorraquia em comparação com outras infecções.
O estudo também destaca a baixa celularidade observada na maioria das etiologias, especialmente nas não bacterianas. Isso evidencia a importância da precisão técnica na preparação laboratorial do líquor e do estabelecimento de valores de referência claros para a identificação de hipercelularidade, o que permite aos médicos tomar decisões clínicas mais precisas.
Em síntese, este estudo delineia o perfil dos pacientes submetidos à análise do líquor na região estudada, que abrange áreas atendidas por um hospital de alta complexidade localizado na região central do estado do Rio Grande do Sul, no sul do Brasil. Pesquisas adicionais, incluindo análises multicêntricas e métodos moleculares complementares, são necessárias para validar esses achados e aprimorar a estratificação de risco em neuroinfecções, especialmente em populações sub-representadas.
AGRADECIMENTOS
Os autores agradecem ao Hospital Universitário de Santa Maria e, em especial, à equipe da Unidade de Análises Clínicas e Anatomia Patológica pelo fornecimento dos dados utilizados neste estudo e pelo apoio técnico.
CONTRIBUIÇÃO DOS AUTORES
CFD foi responsável pela concepção do estudo, coleta e análise de dados, análise estatística e redação do manuscrito.
LBC foi responsável pela análise de dados e redação do manuscrito.
JBCN e FGN foram responsáveis pela análise de dados e revisão do manuscrito.
JAMC foi responsável pela concepção do estudo, análise estatística e revisão do manuscrito.
CP foi responsável pela concepção do estudo, análise de dados, análise estatística e revisão do manuscrito.
REFERÊNCIAS
- Lun MP, Monuki ES, Lehtinen MK. Development and functions of the choroid plexus–cerebrospinal fluid system. Nat Rev Neurosci. 2015 Aug 15;16(8):445–57.
- Liu G, Ladrón-de-Guevara A, Izhiman Y, Nedergaard M, Du T. Measurements of cerebrospinal fluid production: a review of the limitations and advantages of current methodologies. Fluids Barriers CNS. 2022 Dec 15;19(1):101.
- Spector R, Robert Snodgrass S, Johanson CE. A balanced view of the cerebrospinal fluid composition and functions: Focus on adult humans. Exp Neurol. 2015 Nov;273:57–68.
- Dyckhoff-Shen S, Bewersdorf JP, Teske NC, Völk S, Pfister HW, Koedel U, et al. Characterization and diagnosis spectrum of patients with cerebrospinal fluid pleocytosis. Infection. 2024 Feb 1;52(1):219–29.
- Shahan B, Choi EY, Nieves G. Cerebrospinal Fluid Analysis. Am Fam Physician. 2021 Apr 1;103(7):422–8.
- Hasbun R, Bijlsma M, Brouwer MC, Khoury N, Hadi CM, van der Ende A, et al. Risk score for identifying adults with CSF pleocytosis and negative CSF Gram stain at low risk for an urgent treatable cause. Journal of Infection. 2013 Aug;67(2):102–10.
- Otto F, Harrer C, Pilz G, Wipfler P, Harrer A. Role and Relevance of Cerebrospinal Fluid Cells in Diagnostics and Research: State-of-the-Art and Underutilized Opportunities. Diagnostics. 2021 Dec 30;12(1):79.
- Kestenbaum LA, Ebberon J, Zorc JJ, Hodinka RL, Shah SS. Defining cerebrospinal fluid white blood cell count reference values in neonates and young infants. Pediatrics. 2010 Feb;125(2):257-64.
- Seehusen DA, Reeves MM, Fomin DA. Cerebrospinal fluid analysis. Am Fam Physician. 2003 Sep 15;68(6):1103-8.
- Mapunda JA, Tibar H, Regragui W, Engelhardt B. How Does the Immune System Enter the Brain? Front Immunol. 2022 Feb 22;13.
- Baunbæk Egelund G, Ertner G, Langholz Kristensen K, Vestergaard Jensen A, Benfield TL, Brandt CT. Cerebrospinal fluid pleocytosis in infectious and noninfectious central nervous system disease. Medicine. 2017 May;96(18):e6686.
- Brown B, Fidell A, Ingolia G, Murad E, Beckham JD. Defining diagnostic approaches and outcomes in patients with inflammatory CSF: A retrospective cohort study. Clin Neurol Neurosurg. 2018 Sep;172:105–11.
- Tumani H, Petereit HF, Gerritzen A, Gross CC, Huss A, Isenmann S, et al. S1 guidelines “lumbar puncture and cerebrospinal fluid analysis” (abridged and translated version). Neurol Res Pract. 2020 Dec 16;2(1):8.
- Fouad R, Khairy M, Fathalah W, Gad T, El-Kholy B, Yosry A. Role of Clinical Presentations and Routine CSF Analysis in the Rapid Diagnosis of Acute Bacterial Meningitis in Cases of Negative Gram Stained Smears. J Trop Med. 2014;2014:1–7.
- Jaijakul S, Salazar L, Wootton SH, Aguilera E, Hasbun R. The clinical significance of neutrophilic pleocytosis in cerebrospinal fluid in patients with viral central nervous system infections. International Journal of Infectious Diseases. 2017 Jun;59:77–81.
- Chen Y, Shi ZW, Strickland AB, Shi M. Cryptococcus neoformans Infection in the Central Nervous System: The Battle between Host and Pathogen. Journal of Fungi. 2022 Oct 12;8(10):1069.
- Deak D, Gorcea-Andronic N, Sas V, Teodorescu P, Constantinescu C, Iluta S, et al. A narrative review of central nervous system involvement in acute leukemias. Ann Transl Med. 2021 Jan;9(1):68–68.
- Staal SL, Olie SE, ter Horst L, van Zeggeren IE, van de Beek D, Brouwer MC. Granulocytes in cerebrospinal fluid of adults suspected of a central nervous system infection: a prospective study of diagnostic accuracy. Infection. 2024 Mar 23;
- Subbarao S, Ribeiro S, Campbell H, Okike I, Ramsay ME, Ladhani SN. Trends in laboratory-confirmed bacterial meningitis (2012–2019): national observational study, England. The Lancet Regional Health – Europe. 2023 Sep;32:100692.
- Zeggay A, Patry I, Chirouze C, Bouiller K. Characteristics and outcomes of cerebrospinal fluid shunt and drain-associated infections. Infect Dis Now. 2023 Apr;53(3):104665.
- Van de Beek D, Cabellos C, Dzupova O, Esposito S, Klein M, Kloek AT, et al. ESCMID guideline: diagnosis and treatment of acute bacterial meningitis. Clin Microbiol Infect. 2016 May 1; 22(S3):S37-S62.
- Al-Obaidi MMJ, Desa MNM. Mechanisms of Blood Brain Barrier Disruption by Different Types of Bacteria, and Bacterial-Host Interactions Facilitate the Bacterial Pathogen Invading the Brain. 2018 Oct;38(7):1349-1368.
- Tsamis KI, Sakkas H, Giannakis A, Ryu HS, Gartzonika C, Nikas IP. Evaluating Infectious, Neoplastic, Immunological, and Degenerative Diseases of the Central Nervous System with Cerebrospinal Fluid-Based Next-Generation Sequencing. Mol Diagn Ther. 2021 Mar 1;25(2):207–29.
- Onkarappa S, Panpalia N, Naik K. Retrospective Hospital-based Study of Opportunistic Neuroinfections in HIV/AIDS. Neurol India. 2020;68(4):875.
- Coronell-Rodriguez W, Caceres DC, Cintra O, Guzman-Holst A. Epidemiology of Invasive Meningococcal Disease in Colombia: A Retrospective Surveillance Database Analysis. Infect Dis Ther. 2023 Dec 15;12(12):2709–24.
- Silva LR da, Arruda LES de, Barreto I de JB, Aragão JVR de, Silva MLFI da, Lira G, et al. Geografia e saúde coletiva: análise da dinâmica epidemiológica das meningites no Brasil, entre os anos de 2010 e 2019. Rev Bras Epidemiol. 2024;27.
- Pereira LB et. al. Perfil laboratorial liquórico de pacientes com meningite atendidos em um hospital da região metropolitana de Porto Alegre/RS – Brasil. Revista da AMRIGS. 2021;65(4).
- Franco-Paredes C, Lammoglia L, Hernández I, Santos-Preciado JI. Epidemiology and outcomes of bacterial meningitis in Mexican children: 10-year experience (1993-2003). Int J Infect Dis. 2008 Jul;12(4):380-6.
Correspondência
Clóvis Paniz
E-mail: [email protected]
