Perfil de suscetibilidade antimicrobiana em infecções do sítio cirúrgico em um hospital público de traumato-ortopedia no Nordeste do Brasil
Antimicrobial susceptibility profile in surgical site infections in the trauma and orthopedic service of a public hospital in the Brazilian Northeast region
Jair Figueredo dos Santos1
Júlio César Gomes da Silva2
Maria Amália Ribeiro de Amorim Vasconcelos3
Sylvia Maria de Lemos Hinrichsen4
1 Biomédico/Universidade Federal de Pernambuco, Mestre em Biologia Celular e Molecular Aplicada BCMA/UPE.
2 Biomédico/Centro Universitário Tiradentes de Pernambuco. Mestrando em Morfotecnologia – PPGM/UFPE.
3 Farmacêutica/Bioquímica. Especialista em Patologia Clínica – Universidade de Pernambuco – UPE.
4 Professora, Doutora. Universidade Federal de Pernambuco – UFPE.
Instituição: Universidade Federal de Pernambuco – UFPE. Recife, PE, Brasil.
Recebido em 06/04/2020
Aprovado em 07/05/2021
DOI: 10.21877/2448-3877.202101978
INTRODUÇÃO
As infecções de sítios cirúrgicos (ISC), definida como infecções decorrentes de procedimentos cirúrgicos, representam entre 14% e 16% das infecções em pacientes internados em unidades de saúde no Brasil.(1) Em países europeus e países da América do Norte, as ISC variam em aproximadamente 2% a 5% para pacientes submetidos a procedimentos cirúrgicos. Por ano, nos Estados Unidos o número de ISC gira em torno de 500.000 casos.(2,3)
As ISC estão consideravelmente aumentadas em pacientes submetidos a procedimentos cirúrgicos ortopédicos devido, muitas vezes, a necessidade de utilização de materiais de implantes.(4) A presença de próteses articulares, parafusos, fixadores externos, dentre outros materiais utilizados para estabilizar estruturas ósseas ou reparar fraturas, pode facilitar processos de infecção por meio da contaminação local ou disseminação via corrente sanguínea, o que consequentemente eleva as taxas de morbimortalidade para esses pacientes. As ISC têm tornado ainda mais prolongado o processo de recuperação da saúde aumentando consequentemente, aumentando os custos relacionados ao tempo de internação para o Sistema Único de Saúde (SUS), além de comprometer a qualidade de vida dos pacientes ortopédicos.(4,5)
Fatores de risco relacionados ao desenvolvimento das ISC são classificados em intrínsecos e extrínsecos. Fatores que se correlacionam diretamente com o paciente, como idade, presença de comorbidades, processos infecciosos diversos, obesidade, imunossupressão, além de tempo prolongado do pré e pós-operatório, são ditos como fatores intrínsecos. Já os fatores relacionados ao ambiente, tais como superfícies hospitalares, materiais cirúrgicos, antissepsia de mãos e uso adequado de equipamentos de proteção pelos profissionais de saúde, são considerados fatores extrínsecos.(4,6,7)
O início dos sintomas, a gravidade e a manutenção da infecção estão diretamente relacionados ao tipo de microrganismo que coloniza um sítio cirúrgico ortopédico.(5) Grande parte das ISC ortopédicas estão relacionadas a bactérias que constituem a microbiota normal da pele, dentre eles Staphylococcus ssp./ Staphylococcus aureus.(8) Outros microrganismos comumente encontrados são Enterococcus spp., assim como uma variedade de bactérias Gram-negativas, com destaque para Pseudomonas aeruginosas, Enterobacter spp., e Klebsiella spp.(9)
A presença de bactérias como S. aureus e S. epidermidis pode levar ao desenvolvimento de biofilmes, que contribuirão para a patogenicidade da bactéria na infecção.(5) O biofilme é formado pela associação de bactérias que desenvolvem uma matriz extracelular altamente aderente, proporcionando sua fixação a superfícies do hospedeiro ou materiais de implantes ortopédicos presentes no sítio cirúrgico. Inicialmente as bactérias aderem à superfície gerando acúmulo e associação a outras bactérias, formando assim camadas, e produção de matriz extracelular. Uma vez formado, o biofilme se mantém no local inicial da infecção e pode também se desmembrar e seguir o ciclo para formação de novas placas de biofilme em outros sítios.(10) Dentro da cápsula de biofilme, as bactérias adquirem propriedades diferentes daquelas que vivem de forma livre. Essa cápsula é capaz de proteger as bactérias da ação direta de antibióticos bem como de mecanismos de defesa do sistema imunológico do hospedeiro.(5,10)
A identificação correta dos microrganismos bem como a determinação do perfil de suscetibilidade aos antibióticos são necessárias para o combate às ISC e, consequentemente, para o sucesso terapêutico.(1) Dessa forma, não é recomendado o uso de swabs para coleta de material e avaliação microbiológica, sendo preferível a realização de aspirados líquidos ou biópsia do tecido. Ainda, é recomendável que líquidos provenientes de articulações sejam cultivados em garrafas para hemocultura. Materiais como próteses articulares, ossos, parafusos e placas devem ser submetidos a processo de sonicação e/ou vórtex no intuito de romper possíveis biofilmes formados aderidos à superfície desses materiais e, assim, ocorrer a liberação de microrganismos viáveis para isolamento e identificação microbiológica.(11)
ISC de pacientes ortopédicos podem comprometer o sucesso da recuperação no pós-operatório e estão relacionadas à capacidade do sistema imunológico do indivíduo de combate a infecção, bem como à presença de resistência bacteriana por meio da formação de biofilmes. A manutenção da infecção acarreta internações prolongadas e maior número de intervenções cirúrgicas que elevam as taxas de morbimortalidade para pacientes ortopédicos.(12)
A ANVISA preconiza que as amostras sejam obtidas por procedimento cirúrgico ou mesmo por punção aspirativa de forma asséptica. A quantidade de amostra deve ser suficiente para a realização de uma bacterioscopia pela técnica de coloração de Gram ou Ziehl-Neelsen, cultivo de bactérias aeróbicas e facultativas, adicionalmente, de acordo com a suspeita, cultura de fungos, micobactérias e bactérias anaeróbicas.(13)
Nesse contexto, o presente trabalho objetivou identificar a frequência de infecções bacterianas de sítios cirúrgicos e o perfil de suscetibilidade antimicrobiana a partir de resultados de cultura de pacientes atendidos no serviço de ortopedia e traumatologia de um hospital público de referência na cidade do Recife.
MATERIAIS E MÉTODOS
Trata-se de um estudo retrospectivo, descritivo, transversal de abordagem quantitativa, desenvolvido no laboratório de microbiologia do serviço de patologia clínica de um hospital público geral de alta complexidade, referência no Estado de Pernambuco, na área de ortopedia e traumatologia. Realizado no período de agosto de 2016 a setembro de 2018.
Foram analisados laudos com resultados de culturas de amostras provenientes de pacientes internados no serviço de ortopedia e traumatologia de um hospital público geral de alta complexidade. Os dados foram coletados a partir de resultados do sistema automatizado de identificação e suscetibilidade antimicrobiana do VITEK® 2 compact (bioMérieux), liberados pela equipe técnica e registrados em livros arquivados no serviço de microbiologia do laboratório de patologia clínica de um hospital público geral de alta complexidade. Informações adicionais sobre dados demográficos dos pacientes foram coletados no sistema Soul MV, utilizando o número de prontuário do paciente.
A utilização de meio de cultura líquida BHI (Brain Heart Infusion) ou salina foi necessária para melhor liberação das bactérias em materiais secos ou com grande potencial de formação de biofilmes como fragmentos ósseos, parafusos e placas, dentre outros, submetidos ao vórtex, proporcionando, desta forma, o enriquecimento do meio e melhor recuperação de microrganismos viáveis. Os dados dos livros de registros de cultura de secreções gerais e materiais diversos foram gerados pelo setor de microbiologia, a partir do semeio de amostras diversas (partes moles, fragmentos ósseos de diversos sítios anatômicos, material de síntese, parafusos, dentre outros) em meios sólidos em placas (ágar sangue e meio cromogênico) com incubação em estufa a 35ºC ± 1ºC por 24 a 48 horas.
Para a identificação após o crescimento bacteriano nos meios semeados, foi realizada uma observação para identificação presuntiva de Gram-negativo (GN), Gram-positivo (GP) e fungo com posterior identificação do sistema VITEK® 2 compact (bioMérieux), um método automatizado que se baseia em reações bioquímicas e utilização da espectrofotometria para identificação dos microrganismos em cartões de 64 poços contendo substratos e antibióticos.(14,15)
Por meio dos cartões VITEK®2 GN e GP foram realizadas as identificações de espécies de GN e GP de importância clínica. Para identificar a suscetibilidade aos antimicrobianos foram utilizados VITEK® 2 AST (Antimicrobial Susceptibility Testing) para GN e GP.
Os dados obtidos foram catalogados utilizando o programa Microsoft® Office Excel para Mac versão 2016 e Graphpad Prism versão 5.0, de acordo com as variáveis: gênero, idade, número de amostras positivas, espécies de microrganismos identificados e perfil de suscetibilidade antimicrobiana tanto para GN quanto para GP. As frequências das variáveis foram analisadas a partir do quociente do valor total de isolados analisados e pela frequência absoluta encontrada para cada variável, apresentadas em forma de percentual.
Este estudo teve seu delineamento e metodologia em consonância com os princípios bioéticos e morais previstos na Resolução 466/12 do Conselho Nacional de Saúde (CNS). E teve aprovação pelo Comitê de Ética em Pesquisa (CEP) do Complexo Hospitalar HUOC/PROCAPE, sob o seguinte número de CAAE: 98574918.6.0000.5192.
RESULTADOS
No período de janeiro de 2016 a dezembro de 2018, de acordo com dados obtidos no sistema SoulMV (Sistema de Gerenciamento de Internação) foram realizadas 394 internações na clínica traumatológica, 324 na clínica ortopédica e 835 na clínica de ortopedia C de apoio ao trauma.
No período em estudo, de agosto de 2016 a setembro de 2018, houve recebimento de 258 amostras de pacientes provenientes das referidas enfermarias, com suspeita clínica de infecção. Desse total, 138 amostras (53,5%) apresentaram crescimento microbiano, sendo caracterizadas como amostras positivas (Figura 1). Das 138 amostras positivas, 116 (84%) foram pacientes do sexo masculino, com idades que variaram entre 16 a 85 anos; 22 (16%) eram do sexo feminino com idades entre 25 e 77 anos (Figura 2). A média geral de idade dos pacientes foi de 40 anos.
Após a conclusão do diagnóstico laboratorial por meio do sistema automatizado VITEK® 2 compact (bioMérieux), foram identificadas 31 diferentes espécies de bactérias de diversos gêneros, sendo a mais frequente o Staphylococcus aureus (25,2%) seguido de Enterococcus faecalis (10,8%), Escherichia coli (9,9%) e Pseudomonas aeruginosa (9,9%). Os demais microrganismos encontrados foram: Klebsiella pneumoniae (8,1%), Enterobacter cloacae (7,7%), Proteus mirabilis (4,1%), Acinetobacter baumannii (4,1%), Morganella morganii (3,2%), Staphylococcus epidermidis (2,7%), Aeromonas hydrophila (1,8%) e Serratia marcescens (1,4%). Microrganismos com prevalência de isolamento inferior a 3 casos foram considerados em outros (11,3%) (Figura 3). Em 52 amostras, foram isolados mais de um microrganismo, dentre estas 32 tinham associadas bactérias GN e GP, 18 amostras tiveram duas GN ou mais e apenas 2 apresentaram duas GP ou mais.
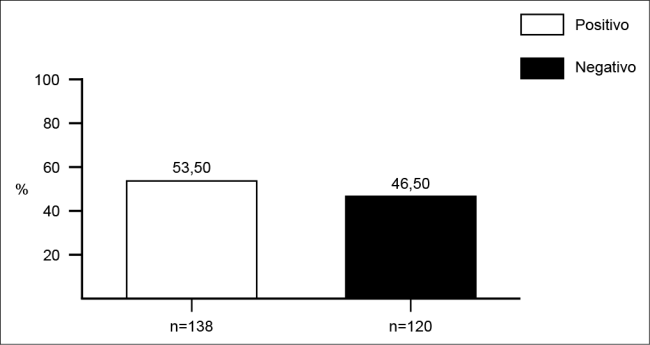
Figura 1. Positividade de culturas realizadas para pacientes das clínicas de traumatologia e ortopedia no laboratório de microbiologia de um hospital público de alta complexidade, referência em trauma e ortopedia, na cidade do Recife, no período de agosto de 2016 a setembro de 2018.
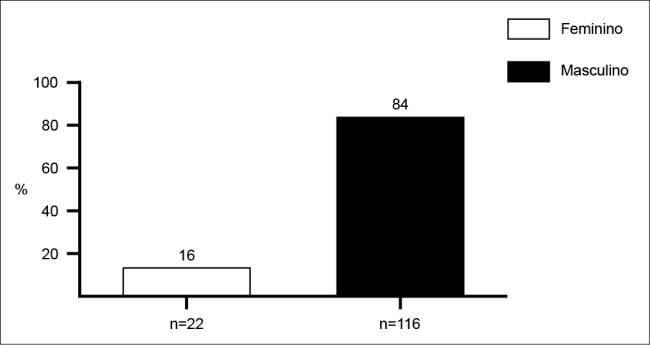
Figura 2. Distribuição por gênero dos pacientes das clínicas de ortopedia e traumatologia com culturas positivas realizadas no laboratório de microbiologia de um hospital público de alta complexidade, referência em trauma e ortopedia, na cidade do Recife, no período de agosto de 2016 a setembro de 2018.

Figura 3. Frequência de agentes patogênicos isolados de 138 amostras de sítios cirúrgicos de pacientes atendidos no serviço de ortopedia e traumatologia de um hospital público de alta complexidade referência em trauma e ortopedia, na cidade do Recife, no período de agosto de 2016 a setembro de 2018.
Para o teste de suscetibilidade aos antimicrobianos, a análise do perfil de resistência/sensibilidade foi realizada para os microrganismos GN e GP isolados com maior frequência. Foram considerados os seguintes antibióticos para o representante GP, Staphylococcus aureus: Gentamicina, Rifampicina, Cefoxitina, Teicoplanina, Vancomicina, Trimetropina/sulfametoxazol, Clindamicina, Eritromicina, Linezolida, Oxacilina, Benzilpenicilina, Ampicilina, Ciprofloxacina, Moxifloxacina e Tigeciclina, apresentados na Tabela 1.
Para o principal representante dos GN, a Escherichia coli, foram considerados os seguintes antibióticos: Ampicilina, Ampicilina/sulbactam, Piperacilina/tazobactam, Cefuroxina, Cefuroxina Axetil, Cefoxitina, Ceftazidima, Ceftriaxona, Cefepima, Ertapenem, Imipenem, Meropenem, Amicacina, Gentamicina, Ciprofloxacina, Levofloxacina, Tigeciclina, Colistina, apresentados na Tabela 2.
Tabela 1 – Perfil de suscetibilidade de Staphylococcus aureus isolados de amostras de pacientes atendidos no período de agosto de 2016 a setembro de 2018 nas enfermarias de ortopedia, traumatologia e apoio ao trauma de um hospital público de alta complexidade, referência em trauma e ortopedia, na cidade do Recife.
| Classe de antimicrobianos | Antibiótico | Sensíveis | % | Resistentes | % |
| Aminoglícosideo | Gentamicina | 28 | 50,0 | 28 | 50,0 |
| Ansamicina | Rifampicina | 3 | 5,4 | 53 | 94,6 |
| Cefalosporina | Cefoxitina | 1 | 1,8 | 55 | 98,2 |
| Glicopepitídeos | Teicoplanina | 55 | 98,2 | 1 | 1,8 |
| Vancomicina | 54 | 96,4 | 2 | 3,6 | |
| Inibidores do ácido fólico | Trimetoprim/ sulfametoxazol | 33 | 58,9 | 23 | 41,1 |
| Macrolídeos | Clindamicina | 6 | 10,7 | 50 | 89,3 |
| Eritromicina | 3 | 5,4 | 53 | 94,6 | |
| Oxazolidinona | Linezolida | 54 | 96,4 | 2 | 3,6 |
| Penicilina | Oxacilina | 7 | 12,5 | 49 | 87,5 |
| Benzilpenicilina | 0 | 0,0 | 56 | 100,0 | |
| Ampicilina | 0 | 0,0 | 56 | 100,0 | |
| Quinolonas | Ciprofloxacina | 7 | 12,5 | 49 | 87,5 |
| Moxifloxacina | 5 | 8,9 | 51 | 91,1 | |
| Tetraciclina | Tigeciclina | 36 | 64,3 | 18 | 32,1 |
Tabela 2 – Perfil de suscetibilidade de Escherichia coli isolados de amostras de pacientes atendidos no período de agosto de 2016 a setembro de 2018 nas enfermarias de ortopedia, traumatologia e apoio ao trauma de um hospital público de alta complexidade, referência em trauma e ortopedia, na cidade do Recife. SSD*= sensível dose dependente.
| Classe de antimicrobianos | Antibiótico | Sensíveis | % | Resistentes | % | Intermediário |
| Penicilinas | Ampicilina | 2 | 10 | 16 | 80 | 2 (10%) |
| b-lactâmico/ inibidores de b-lactamase | Ampicilina/ sulbactam | 7 | 35 | 12 | 60 | 1 (5%) |
| Piperaciclina/ tazobactam | 14 | 70 | 6 | 30 | ||
| Cefalosporinas | Cefuroxina | 0 | 0 | 20 | 100 | |
| Cefuroxina/Axetil | 0 | 0 | 20 | 100 | ||
| Cefoxitina | 6 | 30 | 14 | 70 | ||
| Ceftazidima | 5 | 25 | 15 | 75 | ||
| Ceftriaxona | 6 | 30 | 14 | 70 | ||
| Cefepima | 15 | 75 | 4 | 20 | SDD*
1(5%) |
|
| Carbapenêmicos | Ertapenem | 15 | 75 | 5 | 25 | |
| Imipenem | 15 | 75 | 5 | 25 | ||
| Meropenem | 17 | 85 | 3 | 15 | ||
| Aminoglicosídeos | Amicacina | 13 | 65 | 7 | 35 | |
| Gentamicina | 12 | 60 | 8 | 40 | ||
| Quinolonas e fluoroquinolonas | Ciprofloxacina | 7 | 35 | 13 | 65 | |
| Levofloxacina | 8 | 40 | 12 | 60 | ||
| Tetraciclina | Tigeciclina | 11 | 55 | 9 | 45 | |
| Polimixina | Colistina | 12 | 60 | 8 | 40 |
DISCUSSÃO
Dentro das ISC, as infecções relacionadas a procedimentos cirúrgicos ortopédicos se destacam por serem consideradas de altíssima gravidade. Por se utilizarem de materiais de implantes, o risco de surgimento de processos infecciosos pode levar à necessidade de novas intervenções cirúrgicas, que por sua vez aumentam o risco de perda do membro, os índices de disseminação da infecção para outros sítios levam a um provável surgimento de sepse ou até mesmo levar o paciente a óbito.(4,6)
O conhecimento do tipo de microrganismo bem como de seu perfil de suscetibilidade aos antimicrobianos é de extrema importância para entendimento da gravidade, da evolução e do prognóstico das infecções relacionadas à implementação de dispositivos ortopédicos, bem como das infecções associadas a sítios cirúrgicos em procedimentos ortopédicos. Esse conhecimento também contribui para evitar o risco de disseminação de resistência bacteriana e consequente persistência da infecção por meio da utilização adequada dos antimicrobianos.(16)
Estudo realizado por García e colaboradores (2019) destaca as infecções associadas a dispositivos ortopédicos e ISC em ortopedia, nas quais microrganismos GP, aqueles que compõem a microbiota normal da pele, como Staphylococcus aureus e outras Staphylococcus coagulase negativas, são os principais agentes causadores para esses tipos de infecções, e isso ocorre devido ao aspecto oportunista da bactéria. Porém, outros microrganismos como Enterococcus e bacilos Gram-negativos, com destaque para Escherichia coli e, adicionalmente, Pseudomonas aeruginosas, Enterobacter spp. e Klebsiella spp. foram isolados frequentes de infecções ortopédicas neste estudo.(17)
No presente estudo, dos 258 exames de amostras diversas enviadas das enfermarias de ortopedia e traumatologia ao laboratório de microbiologia, no período de agosto de 2016 a setembro de 2018, 53,5% (n=138) dos isolados apresentaram crescimento positivo. A maior frequência foi encontrada em pacientes do sexo masculino, total de 116 (84%), fator esse relacionado à característica das clínicas de ortopedia e traumatologia, que atendem com mais frequência pacientes do sexo masculino. Santos e colaboradores (2016), em estudo epidemiológico do trauma ortopédico em um serviço público de emergência, encontraram resultados similares, nos quais pacientes do sexo masculino corresponderam por cerca de 81% dos usuários atendidos, fato este justificado por um maior envolvimento dessa população em acidentes de trânsito.(18)
Neste estudo, foi observado que Staphylococcus aureus é o patógeno mais frequente, o qual esteve presente em 56 (25,2%) dos isolados de amostras da população estudada. O estudo de suscetibilidade antimicrobiana revelou que 49 (87,5%) dos Staphylococcus aureus isolados eram resistentes a Oxacilina ORSA (Staphylococcus aureus resistentes a oxacilina) ou MRSA (Staphylococcus aureus resistentes a meticilina). De forma geral, a maior parte dos Staphylococcus aureus apresentou boa sensibilidade para Vancomicina (96,4%) e Teicoplanina (98,2%), que são os glicopeptídeos de escolha para infeções causadas por MRSA, além da Linezolida (96,4%) e Tigeciclina (64,3%).(19)
A variação de frequência de MRSA relacionada a sítios de infecções cirúrgicas em ortopedia apresentada na literatura foi de 29,11% a 63,0%.(9,20) Um estudo de Silvia e colaboradores (2013) evidenciou que do total de infecções adquiridas dentro do ambiente hospitalar, 26 (14,86%) foram causadas por Staphylococcus aureus e, destes, 17 (65,38%) eram MRSA.(21) Uma vez que os principais sítios anatômicos fonte de MRSA são as fossas nasais e mãos, a principal forma de disseminação de MRSA no ambiente hospitalar ocorre pelas mãos dos diversos profissionais de saúde.(22,23)
Um estudo de ordem econômica sobre custos das ISC realizado por Stone (2009) evidenciou que o custo médio mensal por infecção era de $ 25. 546, 000 dólares para hospitais nos Estados Unidos. Quando a infecção é causada por microrganismos multidroga-resistente como por MRSA, o custo por infecção pode aumentar em aproximadamente $ 4.000 dólares quando comparada às infecções por Staphylococcus aureus suscetíveis a meticilina/oxacilina.(24) Este aumento do custo pode ser atribuído a um estendido período de hospitalização, necessidade de utilização de antimicrobianos mais caros e a gastos, de maneira mais indireta, oriundos de medidas de prevenção e controle da infecção.(19)
Considerando a frequência de isolamento de bactérias Gram-negativas, este estudo mostrou que houve uma frequência similar entre Escherichia coli (9,9%) e Pseudomonas aeruginosa (9,9%), seguida de Klebsiella pneumoniae (8,1%). Achados similares foram relatados por García e colaboradores (2019), porém há maior destaque para Escherichia coli por ser a bactéria mais frequente em sua população de estudo (García et al., 2019). Em uma revisão integrativa realizada por Santos e colaboradores, foi observada uma frequência similar entre Escherichia coli, Pseudomonas aeruginosa e Klebsiella pneumoniae, sendo estes, os patógenos mais frequentes em infecções de sítios cirúrgicos, com 7,7% cada.(25)
Em relação ao perfil de suscetibilidade aos antimicrobianos, o presente estudo verificou que a bactéria Escherichia coli apresentou as taxas de resistência à ampicilina (80%), Ampicilina/sulbactam (60%), Cefuroxima (100%), Cefuroxima Axetil (100%), Cefoxitina (70%), ceftazidima (75%) e às quinilonas: Ciprofloxacina (65%) e Levofloxacina (60%). Um estudo por Iroha e colaboradores (2017) também evidenciou altas taxas de resistência aos antimicrobianos por Escherichia coli isoladas de ISC em pacientes ortopédicos. Dentre eles resistência às cefalosporinas (Ceftazidima e Cefoxitina com taxa de 96% e 97% respectivamente) e penicilina (Amoxilina, com taxa de 90%).(26)
Outra grande preocupação em decorrência de ISC em ortopedia é a grande possibilidade de formação de biofilmes, que proporcionam uma maior proteção para as bactérias frente aos efeitos dos antimicrobianos e da atuação do sistema imune do hospedeiro no combate ao patógeno. Além disso, configuram um grande problema por proporcionarem maior dificuldade para isolamento e identificação das bactérias em amostras provenientes da ortopedia, devido ao fato de sua alta adesão às superfícies e necessidade de sonicação ou utilização de vórtex para sua liberação. A sonicação, por ser uma técnica mais sofisticada, está muitas vezes indisponível na maioria dos laboratório de microbiologia.(27)
Jamal (2015) apresenta uma lista das principais bactérias associadas à formação do biofilme, dentre elas o Staphylococcus aureus é o quarto microrganismo mais comum em formação de biofilmes, perdendo apenas para Staphylococcus epidermidis (3º), Pseudomonas aeruginosa (2º) e Escherichia coli (1º).(28) Os dados obtidos no presente estudo evidenciaram o Staphylococcus aureus, Pseudomonas aeruginosa, e Escherichia coli figurando entre os mais prevalentes, o que indica alta possibilidade para formação de biofilmes nas amostras da população estudada, podendo os altos índices de casos negativos (46,5%) apresentados no estudo estar associados à dificuldade no isolamento devido ao mecanismo de formação de biofilme, além da disponibilidade apenas de vórtex para processar as amostras no laboratório do estudo. Em seu estudo Tampuz e colaboradores (2012) demonstraram que o emprego da sonicação apresenta melhor eficiência quando utilizado para o diagnóstico microbiológico em casos de infecção de próteses ortopédicas.(29)
CONCLUSÃO
A partir de resultados obtidos podemos concluir que o Staphylococcus aureus continua sendo o principal causador de infeções em sítios cirúrgicos de pacientes submetidos a procedimentos ortopédicos. O perfil de suscetibilidade antimicrobiana do Staphylococcus aureus apresentou uma taxa acima da média para resistência à meticilina, portanto MRSA multidroga resistente. Escherichia coli e Pseudomonas aeruginosa foram as bactérias Gram-negativas mais frequentes, sendo a E. coli altamente resistente às cefalosporinas e às penicilinas, evidenciando, assim, uma alta taxa de resistência bacteriana aos antimicrobianos na população estudada. As três bactérias citadas estão entre as mais comumente encontradas formando biofilmes, o que indica a necessidade de maiores cuidados de biossegurança pelos profissionais de saúde quanto ao risco de infecção devido a facilidade dessas bactérias em formar biofilmes em materiais e sítios cirúrgicos ortopédicos.
A análise do perfil microbiológico e suscetibilidade aos antimicrobianos é uma ferramenta que contribui na tomada de decisões quanto à antibioticoterapia mais adequada dentro da população em estudo. Além de ser importante para conscientizar sobre a necessidade da detecção de resistência bacteriana, evitando sua propagação e consequente melhor recuperação do paciente, com o uso adequado de antimicrobianos específicos para bactérias causadoras de infecções.
REFERÊNCIAS
- Brasil. Agência Nacional de Vigilância Sanitária. Medidas de prevenção de infecção relacionada à assistência à saúde. Brasília: Anvisa, 2013[Internet]. disponível em: http://bvsms.saude.gov.br/bvs/publicacoes/medidas_prevencao_infeccao_relacionada_assistencia_saude.pdf
- Dudeck MA, Horan TC, Peterson KD, Allen-Bridson K, Morrell G, Pollock DA, et al. National Healthcare Safety Network (NHSN) Report, data summary for 2010, device-associated module. American Journal of Infection Control. 2011 Dec 1;39(10):798–816.
- Klompas M. Eight initiatives that misleadingly lower ventilator-associated pneumonia rates. American Journal of Infection Control. 2012 Jun 1;40(5):408–10.
- Franco LMC, Ercole FF. Infecção de sítio cirúrgico em pacientes submetidos a cirurgias ortopédicas em um hospital público de Minas Gerais. Revista Mineira de Enfermagem. 2011;15(3):399–405.
- Greene LR. Guide to the elimination of orthopedic surgery surgical site infections: An executive summary of the Association for Professionals in Infection Control and Epidemiology elimination guide. American Journal of Infection Control. 2012 May 1;40(4):384–6.
- Lima ALLM, Zumiotti AV, Uip DE, Silva J dos S. Predictable factors of infection in patients with open fractures in lower limbs. Acta Ortopédica Brasileira. 2004 Mar;12(1):32–9.
- Knobben BAS, van Horn JR, van der Mei HC, Busscher HJ. Evaluation of measures to decrease intra-operative bacterial contamination in orthopaedic implant surgery. J Hosp Infect. 2006 Feb;62(2):174–80.
- Saadatian-Elahi M, Teyssou R, Vanhems P. Staphylococcus aureus, the major pathogen in orthopaedic and cardiac surgical site infections: A literature review. International Journal of Surgery. 2008 Jan 1;6(3):238–45.
- Al-Mulhim FA, Baragbah MA, Sadat-Ali M, Alomran AS, Azam MQ. Prevalence of Surgical Site Infection in Orthopedic Surgery: A 5-year Analysis. Int Surg. 2014;99(3):264–8.
- Arciola CR, Campoccia D, Ehrlich GD, Montanaro L. Biofilm-based implant infections in orthopaedics. Adv Exp Med Biol. 2015;830:29–46.
- Miller JM, Binnicker MJ, Campbell S, Carroll KC, Chapin KC, Gilligan PH, et al. A Guide to Utilization of the Microbiology Laboratory for Diagnosis of Infectious Diseases: 2018 Update by the Infectious Diseases Society of America and the American Society for Microbiology. Clin Infect Dis. 2018 Jun 28;
- Zoubos AB, Galanakos SP, Soucacos PN. Orthopedics and biofilm–what do we know? A review. Med Sci Monit. 2012 Jun;18(6):RA89-96.
- Sanitária (Brasil) AN de V. Manual de microbiologia clínica para o controle de infecção em serviços de saúde [Internet]. 2004 [cited 2020 Feb 19]. Available from: http://bvsms.saude.gov.br/bvs/publicacoes/manual_microbiologia_completo.pdf
- Shetty N, Hill G, Ridgway GL. The Vitek analyser for routine bacterial identification and susceptibility testing: protocols, problems, and pitfalls. J Clin Pathol. 1998 Apr;51(4):316–23.
- Steward CD, Raney PM, Morrell AK, Williams PP, McDougal LK, Jevitt L, et al. Testing for Induction of Clindamycin Resistance in Erythromycin-Resistant Isolates of Staphylococcus aureus. Journal of Clinical Microbiology. 2005 Apr 1;43(4):1716–21.
- Negi V, Pal S, Juyal D, Sharma MK, Sharma N. Bacteriological Profile of Surgical Site Infections and Their Antibiogram: A Study From Resource Constrained Rural Setting of Uttarakhand State, India. J Clin Diagn Res. 2015 Oct;9(10): DC17–20.
- García FFS. Microorganisms associated with surgical site infections and orthopedic devices at the orthopedic spine service, orthopedics hospital. MOJ Orthop Rheumatol. 2019 Jan;2.
- Santos L de F da S, Fonseca JMA da, Cavalcante BLS, Lima CM, et al. Epidemiologic of orthopedic trauma study in a public emergency. Cadernos Saúde Coletiva. 2016 Dec;24(4):397–403.
- Rossi F, Andreazzi DB. Resistência bacteriana: interpretando o antibiograma [Internet]. Resistência bacteriana: interpretando o antibiograma. 2005 [cited 2020 Feb 19]. Available from: http://pesquisa.bvs.br/brasil/resource/pt/lil-441615
- Patted SM, Chinagudi S, Soragavi VR, Bhavi SB. The prevalence of MRSA infection in orthopaedic surgery in a Medical College Hospital: A 2-year analysis. Biomedical Research [Internet]. 2013 [cited 2020 Feb 19];24(1). Available from: http://www.alliedacademies.org/abstract/the-prevalence-of-mrsa-infection-in-orthopaedic-surgery-in-a-medicalcollege-hospital-a-2year-analysis-1058.html
- Silva PM de F e, Feitosa RJP, Pimentel MC, Pereira H dos S, Catão RMR. Prevalence of hospital-acquired infections caused by Staphylococcus aureus and antimicrobial susceptibility profile. Journal of Nursing UFPE on line – ISSN: 1981-8963. 2013 Jul 21;7(8):5257–64.
- Breves A, Miranda CAC, Flores C, Filippis I de, Clementino MM, Breves A, et al. Methicillin- and vancomycin-resistant Staphylococcus aureus in health care workers and medical devices. Jornal Brasileiro de Patologia e Medicina Laboratorial. 2015 Jun;51(3):143–52.
- Lima MFP, Borges MA, Parente RS, Júnior RCV, Oliveira MED. Staphylococcus aureus e as infecções hospitalares – Revisão de literatura. Revista Uningá Review [Internet]. 2018 Jan 17 [cited 2019 Feb 4];21(1). Available from: http://revista.uninga.br/index.php/uningareviews/article/view/1616
- Stone PW. Economic burden of healthcare-associated infections: an American perspective. Expert Rev Pharmacoecon Outcomes Res. 2009 Oct;9(5):417–22.
- Santos G do C, Baylão AFG, Borges SCF, Silva LA da, Batista MH de J, Leite GR. Incidência e fatores de risco de infecção de sítio cirúrgico: Revisão integrativa. 1 [Internet]. 2015 Feb 25 [cited 2020 Feb 19];11(1). Disponível em: https://www.revistas.ufg.br/rir/article/view/34142
- Iroha IR, Okoye E, Osigwe CA, Moses IB, Ejikeugwu and Nwakaeze AE. Isolation, Phenotypic Characterization and Prevalence of ESBL-Producing Escherichia Coli and Klebsiella Species from Orthopedic Wounds in National Orthopedic Hospital Enugu (NOHE), South East Nigeria. Journal of Pharmaceutical Care & Health Systems [Internet]. 2017 [cited 2020 Feb 19];04(04). Available from: https://www.omicsonline.org/open-access/isolation-phenotypic-characterization-and-prevalence-of-esblproducing-escherichia-coli-and-klebsiella-species-from-orthopedic-woun-2376-0419-1000184.php?aid=93796
- Drago L, Toscano M. 2 – Biofilm formation and the biological response. In: Arts JJC, Geurts J, editors. Management of Periprosthetic Joint Infections (PJIs) [Internet]. Woodhead Publishing; 2017 [cited 2020 Feb 19]. p. 25–39. Available from: http://www.sciencedirect.com/science/article/pii/B9780081002056000021
- Jamal M, Tasneem U, Hussain T, Andleeb S. Bacterial Biofilm: Its Composition, Formation and Role in Human Infections. Research & Reviews: Journal of Microbiology and Biotechnology [Internet]. 2015 Jul 20 [cited 2020 Feb 20];4(3). Available from: http://www.rroij.com/peer-reviewed/bacterial-biofilm-its-composition-formation-and-role-in-human-infections-61426.html
- Trampuz A, Piper KE, Jacobson MJ, Hanssen AD, Unni KK, Osmon DR, et al. Sonication of removed hip and knee prostheses for diagnosis of infection. N Engl J Med. 2007 Aug 16;357(7):654–63.
Correspondência
Jair Figueredo dos Santos
Rua Arnóbio Marques, 310 – Santo Amaro
CEP 50100-130- Recife – PE – Brasil.
E-mail: [email protected]
