Pesquisa de bacilos Gram negativos não fermentadores no interior do corpo de torneiras de um hospital público de Volta Redonda, RJ
Research of non-fermenting Gram negative bacilli inside the body of taps in a public hospital in Volta Redonda, RJ
Hellen Avelar Duarte1
Ester Albuquerque Lourenço2
Nathália Cristinne Pereira de Souza2
Leoni Ferreira da Silva2
Gabriel José Ribeiro2
Jéssica Rizkalla Correa Medeiros2
Carlos Alberto Sanches Pereira3
1Graduada em Ciências Biológicas – Centro Universitário de Volta Redonda – UniFOA – Volta Redonda, RJ, Brasil.
2Estudante de Medicina – Centro Universitário de Volta Redonda – UniFOA – Volta Redonda, RJ, Brasil.
3Doutor, Professor Universitário – Universidade de São Paulo – USP – São Paulo, SP, Brasil.
Instituição: Centro Universitário de Volta Redonda – UniFOA – Volta Redonda, RJ, Brasil.
Artigo recebido em 29/10/2013
Artigo aprovado em 29/01/2016
Resumo
Objetivo: O presente trabalho teve como objetivo o isolamento e a identificação de bacilos Gram negativos não fermentadores presentes no interior do “corpo” das torneiras em um hospital público de Volta Redonda, RJ. Métodos: Para tanto, foram coletados com auxílio de swabs material biológico do interior do corpo de 225 torneiras desse hospital. Após a coleta, o material foi armazenado em meio de transporte à temperatura ambiente e processado. Dessa forma, os mesmos foram semeados em placas de Petri, contendo agar MacConkey e agar Sangue. As placas foram incubadas por até 48 horas a 37°C. Resultados: Das 225 amostras analisadas, 65 (28%) apresentaram crescimento microbiano e 160 não exibiram crescimento algum. Dos 65 microrganismos encontrados, 22 (25%) eram bacilos Gram negativos não fermentadores. Conclusão: A partir dos resultados encontrados, o gênero Pseudomonas é o principal colonizador de torneiras hospitalares.
Palavras-chave
Bactérias Gram negativas; Hospital; Torneiras; Contaminação
INTRODUÇÃO
A higienização hospitalar é um dos pontos mais importantes para redução de microrganismos causadores de infecções nosocomiais. Entretanto, uma atenção especial deve ser dada à água e os seus condutores (torneiras) que não são levados em conta em todas as unidades existentes em um ambiente hospitalar.
Embora todos os esforços sejam feitos para eliminar ou impedir o crescimento de microrganismos no hospital, o ambiente hospitalar é um importante reservatório para uma variedade de patógenos, e certos membros da microbiota normal do corpo humano são oportunistas e apresentam um risco intenso para os pacientes hospitalizados.(1)
Os profissionais da saúde contribuem para a infecção do paciente devido à falta de higienização correta das mãos e a manipulação inadequada dos procedimentos. Outros indivíduos que contribuem indiretamente são os visitantes que ingressam ao ambiente hospitalar trazendo microrganismos do meio externo, e, ao sair, levando os mesmos do hospital para suas residências, trabalhos e lugares públicos.(2)
As torneiras, de um modo geral, apresentam um ambiente em seu “corpo” que pode ser favorável à proliferação de bacilos Gram negativos não fermentadores (BGNNF), entre outras bactérias. Assim sendo, a limpeza periódica dessas torneiras poderia controlar a proliferação desses microrganismos.
As infecções relacionadas à assistência à saúde (IRAS) consistem em eventos adversos ainda persistentes nos serviços de saúde. As principais IRAS descritas são as do trato respiratório, trato urinário, corrente sanguínea e, por fim, as infecções cirúrgicas.(3)
A transmissão de microrganismos patogênicos ocorre na maioria das vezes por contato direto (transmitido de pessoa a pessoa pelo contato direto com as mãos) ou através do contato indireto (objetos e superfícies contaminadas).(4)
Os BGNNF são microrganismos aeróbios, não esporulados, que se caracterizam pelo fato de serem incapazes de utilizar carboidratos como fonte de energia pela fermentação, degradando-os pela via oxidativa.(3)
De modo geral, os BGNNF apresentam baixa virulência e são raros na microbiota humana, sendo considerados patógenos oportunistas. Sua maior importância está relacionada a IRAS, onde representam cerca de 10% dos bacilos Gram negativos isolados em espécimes clínicos e, apesar da diversidade de gêneros e espécies nesse grupo, os mais frequentes envolvidos em caso de colonização/infecção são a Pseudomonas aeruginosa, Acinetobacter baumannii, Stenotrophomonas maltophilia e o complexo Burkholderia cepacia.(5)
O presente trabalho teve como objetivo o isolamento e a identificação de bacilos Gram negativos não fermentadores presentes no interior do “corpo” das torneiras em um hospital público de Volta Redonda, RJ.
MATERIAL E MÉTODOS
Foram coletadas amostras do interior do corpo de 225 torneiras de um hospital público da cidade de Volta Redonda, dos seguintes setores: Ambulatório, Ambulatório FOA, Banco de Leite, Banco de Olhos, Centro Cirúrgico, Centro Cirúrgico Obstétrico, Clínica Cirúrgica, Direção, Faturamento, Gerência de Enfermagem, Hemonúcleo, Laboratório, Lactário, Lavanderia, Maternidade, Pronto Socorro Adulto, Pronto Socorro Infantil, Quarto Médico, Raio X, Serviço de Nutrição Dietética Alimentar, Tomografia/Ultrassonografia, Unidade de Terapia Intensiva Adulto, Unidade de Terapia Intensiva Neonatal, Unidade Intensiva Adulto, Unidade Intensiva Neonatal, Varanda.
Coleta das amostras
As amostras foram colhidas no interior dos corpos de torneira com o uso de swab estéril. Após a coleta, o swab foi colocado em meio de transporte e enviado a temperatura ambiente para ao laboratório, onde foi processado. O meio para o transporte das amostras foi o Amies, pois nele o oxigênio e os radicais livres são absorvidos e neutralizados por substâncias químicas incorporadas à sua fórmula. Essa ação interrompe a oxidação, assegurando um ótimo desempenho para bactérias.(6)
Isolamento, identificação e armazenamento
No laboratório, as amostras foram semeadas em placas de Petri contendo agar MacConkey e agar Sangue. Essas amostras foram incubadas por até 48 horas a 37°C, sendo, posteriormente, selecionadas colônias para a coloração de Gram.
Após a semeadura, os swab foram inoculados em 2 mL de caldo Brain Hearth Infusion – BHI (Himedia®). Os tubos foram incubados em estufa bacteriológica à temperatura de 37°C por 24 horas.(7)
Todas as colônias identificadas como bacilos Gram negativos foram submetidas ao teste da oxidase e catalase. As que obtiveram resultados positivos foram submetidas à identificação pelo sistema Vitek2 (BioMérieux®). As colônias identificadas como cocos Gram positivos foram submetidas ao teste de catalase e tanto as catalase positivas quanto as negativas foram também submetidas à identificação pelo sistema Vitek2 (BioMérieux®).
Todas as amostras foram armazenadas em tubos do tipo criotubos contendo caldo BHI com glicerol a 20% e mantidas a -20ºC para posterior utilização.(8)
RESULTADOS
Das 225 amostras analisadas, houve crescimento em 65 delas (28%). A maior parte (72%), contudo, não mostrou crescimento microbiano. Relativamente aos 26 setores hospitalares, 19 (73%) apresentaram crescimento em pelo menos uma torneira. Os setores cujas torneiras não exibiram crescimento bacteriano foram: Centro Cirúrgico Obstétrico, Direção, Pronto Socorro Infantil, Quarto dos Médicos, Unidade de Terapia Intensiva Neonatal, Unidade Intensiva Neonatal e Varanda, conforme mostrado na Figura 1.
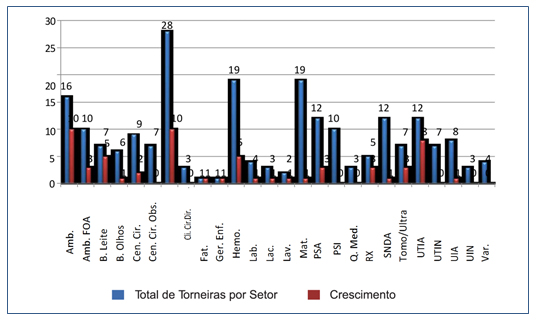 Figura 1. Crescimento microbiológico por setor.
Figura 1. Crescimento microbiológico por setor.
Amb.: Ambulatório; Amb. FOA : Ambulatório FOA; B. Leite: Banco de Leite; B. Olhos: Banco de Olhos; Cen. Cir.: Centro Cirúrgico; Cen.
Cir. Obs.: Centro Cirúrgico Obstétrico; Cli. Cir.: Clínica Cirúrgica; Dir.: Direção; Fat.: Faturamento; Ger. Enf.: Gerência de Enfermagem;
Hemo.: Hemonúcleo; Lab.: Laboratório; Lac.: Lactário; Lav.: Lavanderia; Mat.: Maternidade; PSA: Pronto Socorro Adulto; PSI: Pronto
Socorro Infantil; Q. Med.: Quarto Médico; RX: Raio X; SNDA: Serviço de Nutrição Dietética Alimentar; Tomo/Ultra: Tomografia e
Ultrassonografia; UTIA: Unidade de Tratamento Intensivo Adulto; UTIN: Unidade de Tratamento Intensivo Neonatal; UIA: Unidade
Intensiva Adulto; UIN: Unidade Intensiva Neonatal; Var.: Varanda.
Seis setores apresentaram mais de 50% das torneiras colonizadas, conforme mostrado na Figura 2.
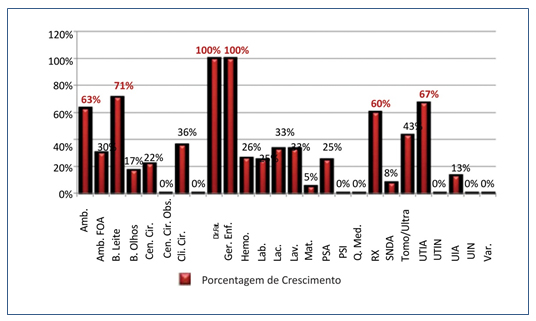
Figura 2. Porcentagem de torneiras colonizadas por setor.
Amb.: Ambulatório; Amb. FOA: Ambulatório FOA; B. Leite: Banco de Leite; B. Olhos: Banco de Olhos; Cen. Cir.: Centro Cirúrgico; Cen.
Cir. Obs.: Centro Cirúrgico Obstétrico; Cli. Cir.: Clínica Cirúrgica; Dir.: Direção; Fat.: Faturamento; Ger. Enf.: Gerência de Enfermagem;
Hemo.: Hemonúcleo; Lab.: Laboratório; Lac.: Lactário; Lav.: Lavanderia; Mat.: Maternidade; PSA: Pronto Socorro Adulto; PSI: Pronto
Socorro Infantil; Q. Med.: Quarto Médico; RX: Raio X; SNDA: Serviço de Nutrição Dietética Alimentar; Tomo/Ultra: Tomografia e
Ultrassonografia; UTIA: Unidade de Tratamento Intensivo Adulto; UTIN: Unidade de Tratamento Intensivo Neonatal; UIA: Unidade
Intensiva Adulto; UIN: Unidade Intensiva Neonatal; Var.: Varanda.
Com exceção dos setores que possuíam apenas uma torneira, o percentual de colonização variou entre 60% e 71%.
Dentre os setores que apresentaram colonização, dois (0,5%) tiveram crescimento observado em todas torneiras, o Gerenciamento de Enfermagem e o Faturamento, ambos com apenas uma torneira.
As espécies bacterianas isoladas no presente estudo podem ser visualizadas na Figura 3.
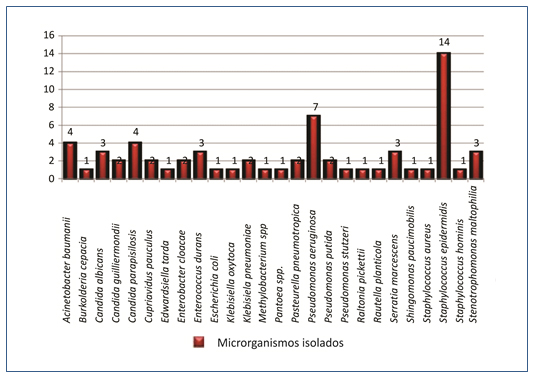
Figura 3. Identificação de microrganismos isolados de torneiras de uma unidade hospitalar
Dos 65 microrganismos recuperados, 22 (25%) faziam parte do grupo dos bacilos Gram negativos não fermentadores e os 43 (75%) restantes pertenciam a outros grupos bacterianos (Figura 4).
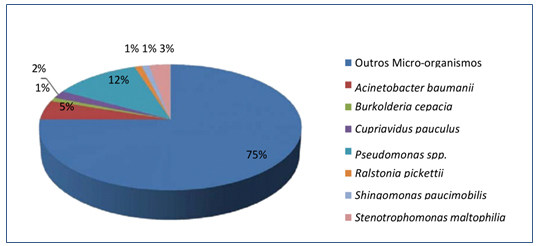 Figura 4. Percentual de BGNNF encontrados nas torneiras da unidade hospitalar.
Figura 4. Percentual de BGNNF encontrados nas torneiras da unidade hospitalar.
Quanto à quantidade de BGNNF encontradas por setor observou-se crescimento dessas bactérias em 12 setores (46%), sendo três na UTIA (Stenotrophomonas maltophilia, Pseudomonas aeruginosa, Cupriavidus pauculus), três na Clínica Cirúrgica (Pseudomonas aeruginosa, Pseudomonas stutzeri, Shingomonas paucimobilis), três no Ambulatório FOA (Pseudomonas putida e dois Pseudomonas aeruginosa, um no PSA (Burkoldeira cepacia), dois no SNDA (Stenotrophomonas maltophilia, Acinetobacter baumannii), um no Ambulatório (Cupriavidus pauculus), um no RX (Pseudomonas putida), um no Tomo/Ultra (Acinetobacter baumannii), dois no Banco de Leite (Acinetobacter baumannii), três no Hemonúcleo (Stenotrophomonas maltophilia, Ralstonia pickettii, Pseudomonas aeruginosa) um no Banco de Olhos (Pseudomonas aeruginosa) e um na Lavanderia (Pseudomonas aeruginosa) (Figura 5).
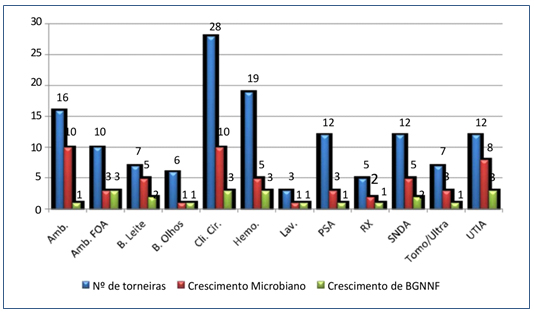
Figura 5. Número de torneiras por setor que se apresentaram colonizadas por BGNNF.
Amb.: Ambulatório; Amb. FOA : Ambulatório FOA; B. Leite: Banco de Leite; B. Olhos: Banco de Olhos; Cli. Cir.: Clínica Cirúrgica;
Hemo.: Hemonúcleo; Lav.: Lavanderia; PSA: Pronto Socorro Adulto; RX: Raio X; SNDA: Serviço de Nutrição Dietética Alimentar;
Tomo/Ultra: Tomografia e Ultrassonografia; UTIA: Unidade de Tratamento Intensivo Adulto
DISCUSSÃO
Diversos microrganismos podem sobreviver em condições adversas, sendo necessário apenas um local com humidade e mínimo fornecimento de nutrientes para a sua viabilidade. Os BGNNF têm grande afinidade e capacidade de sobrevivência na água.(7)
Conforme Deliberali et al.,(9) os BGNNF são bactérias de grande importância médica uma vez que são potenciais causadores de IRAS. Por serem oportunistas podem representar um risco em ambientes como a Clínica Cirúrgica, pois, nesse local, se encontram pacientes em estado fragilizado, em recuperação pós-cirúrgica e sob cuidados intensivos.
Em concordância com os resultados obtidos por Pereira et al.,(7) o percentual quantitativo de BGNNF isolado foi considerável. Todavia, na pesquisa citada, a prevalência foi de Chryseomonas luteola e Roseomonas Genomovar e, na presente pesquisa, a prevalência foi de Pseudomonas spp.
Diversos microrganismos são prevalentes em superfícies inanimadas de ambientes nosocomiais, entre eles os BGNNF, com destaque para Pseudomonas aeruginosa e Acinetobacter baumannii. Tendo em vista os resultados obtidos por Oliveira e Damasceno,(10) constatou-se que no ambiente nosocomial, superfícies como as do interior de torneiras são potenciais reservatórios de vários microrganismos.
Um dos principais problemas para o tratamento de BGNNF, quando em pacientes de UTI, por exemplo, é a sensibilidade antimicrobiana diminuída. Laranjeira et al.(11) afirmam que esse quadro tem afetado a eficácia do tratamento, uma vez que essas bactérias progressivamente têm exibido resistência aumentada frente aos antibióticos de uso clínico. Essa resistência aumentada tem sido associada a casos de bacteremia, pneumonia em ventilação mecânica, infecções do trato urinário, meningites e infecções de feridas cirúrgicas.(9)
De acordo com Pereira et al.,(7) a higienização dos ambientes hospitalares, frequentemente, tem sido negligenciada por falta de conhecimento acerca da história natural dos organismos nosocomiais. Paniz & Picoli(12) afirmam que infeções hospitalares e seus agentes etiológicos representam um grave problema de saúde pública.
Conforme observado no presente trabalho, no setor de Raio X ocorreu um índice de contaminação maior do que 50%. De acordo com a Anvisa,(3) esse setor, mesmo não sendo realizados procedimentos invasivos, recebe pacientes politraumatizados, que são naturalmente suscetíveis aos microrganismos em geral.
Reforçando o relatado no presente trabalho, Pseudomonas aeruginosa e Acinetobacter sp. vêm adquirindo importância como agentes de IRAS, devido à crescente resistência às drogas antimicrobianas. Esses organismos são agentes etiológicos de quase todas as infecções adquiridas na UTI, em particular as do trato respiratório. São responsáveis, ainda, pelas altas taxas de mortalidade e aumento do tempo de internação, com elevados custos para o hospital.(11)
Segundo a Anvisa,(3) as infecções primárias da corrente sanguínea são provocadas por bactérias presentes na pele, após terem formados biofilmes, na face externa de dispositivos, como cateteres de longa permanência. A formação desses biofilmes, que são matrizes biológicas ativas compostas por células e material extracelular depositado sobre uma superfície sólida, tem sido um desafio para os profissionais da saúde. Biofilmes podem ser formados em qualquer superfície sólida com ambiente propício para sua proliferação, incluindo cateteres e corpos de torneiras e chuveiros. Uma vez formados os biofilmes, a probabilidade das bactérias passarem para a água e causarem contaminação é elevada, já que essa água poderá ser utilizada para o banho de pacientes com feridas expostas ou mesmo para a higienização das mãos de profissionais de saúde, em procedimentos pré-operatórios, o que aumenta a chance de contaminação do paciente.
O isolamento de Pseudomonas aeruginosa em achados clínicos tem sido frequente nos últimos anos. Vários agentes antimicrobianos têm se tornado menos ativos, reduzindo o número de opções terapêuticas e aumentando o impacto clínico de infecções nosocomiais, principalmente pela produção de metalo-beta-lactamase.(13)
O Complexo Acinetobacter é considerado um patógeno oportunista relevante, no contexto hospitalar. A incidência de infecções graves, tendo as bactérias desse grupo (A. calcoaceticus, A. baumanni,) como seus causadores tem aumentado mundialmente.(12)
Segundo Paniz e Picoli,(12) o complexo Burkholderia cepacia é considerado um dos mais versáteis do grupo de BGNNF; esse microrganismo tem como reservatório o solo, água e plantas. Os organismos desse complexo apresentam variedade de mecanismos de virulência, e pacientes infectados por uma mesma cepa apresentam evolução clinica diferente.
Stenotrophomonas maltophilia tem se tornado amplamente conhecido como causador de IRAS em pacientes imunodeprimidos. São isolados encontrados em grande variedade de ambientes hospitalares, tendo como fonte água de torneira, pias, respiradores, cateteres de sucção arterial, monitores de pressão e equipamentos de diálise.(12)
A bactéria Ralstonia sp. é considerada de baixa virulência, porém, ao entrar em contato com pacientes críticos pode ser de difícil manejo. Essa bactéria já foi isolada de infecções como a bacteremia, meningite, endocardite, osteomielite e do trato respiratório de pacientes com fibrose cística.(14)
Assim como a Ralstonia sp., a Cupriavidu sp. raramente tem sido associada a infecções humanas, por conta de sua baixa patogenicidade. No entanto, ao ser encontrada no ambiente hospitalar, tem se apresentado, muitas vezes, refratária ao tratamento. Inclusive, conforme Karafin et al.,(14) já foi informado caso fatal de sepse causada por essa bactéria.
Kilic et al.(15) relataram casos de Shingomonas paucimobilis em infecções nosocomiais que surgiram em decorrência de água contaminada empregada para higienização de funcionários de um hospital. Essas bactérias foram isoladas de amostras provenientes de torneira de banheira localizada na unidade de hematologia e de amostras de hemocultura de quatro pacientes.
Diante dos resultados é possível concluir que:
- Doze dos 26 setores apresentaram, pelo menos, uma torneira colonizada por BGNNF;
- O gênero Pseudomonas foi encontrado colonizando a maioria das torneiras quando comparado a outros BGNNF;
- A correta e frequente limpeza dos corpos de torneira é de fundamental importância para o controle desses organismos nos ambientes hospitalares.
Abstract
Objective: The present work had as objective the isolation and identification of Gram negative non-fermenting bacilli present inside the body of the taps in a public hospital in Volta Redonda, RJ. Methods: using swabs, they were collected biological material from 225 tap bodies of this hospital. After collecting the material was stored in transport medium at room temperature and processed. Thus, they were seeded in Petri plates containing MacConkey agar and blood agar. The plates were incubated for 48 hours at 37°C. Results: Of the 225 analyzed samples, 65 (28%) had bacterial growth and 160 showed no growth. Of the 65 micro-organisms found, 22 (25%) were Gram negative non-fermenters. Conclusion: By the found results, the Pseudomonas genus is the main colonizer of tap bodies.
Keywords
Gram negative bacteria; Hospital; Taps; Contamination
REFERÊNCIAS
- Tortora GJ, Funke BR, Case CL. Microbiologia, Porto Alegre: ArtMed, 8ª edição, 2005. 894p.
- Cassettari VC, Silveira IR, Balsamo AC, Franco F. Outbreak of extended-spectrum beta-lactamase-producing Klebsiella pneumoniae in an intermediate-risk neonatal unit linked to onychomycosis in a healthcare worker. J Pediatr (Rio J). 2006 Jul-Aug; 82 (4): 313-6.
- Anvisa. Manual de Microbiologia Clínica para o Controle de Infecção Relacionada à Assistência à Saúde. Módulo 6 : Detecção e identificação de bactérias de importância médica Agência nacional de vigilância sanitária., 9aed. Brasília. Ed. Ag. Nac. de Vig. Sanit., 2013.
- Silva PF, Padoveze MC. Infecções relacionadas a serviço de saúde – orientações para público geral. Conhecendo um pouco mais sobre as precauções específicas. São Paulo: Centro de Vigilância Epidemiológica; 2012 [citado 2013 Fev 02]. Available from: http://www.cve.saude.sp.gov.br/htm/ih/pdf/IRAS12_LEIGOS_ PRECAUCAO.pdf
- Santos LF. Identificação de bastonetes Gram negativos não fermentadores. Manual de Microbiologia Clínica. 4ª edição, João Pessoa-PB, 2006. Pag. 221, 222, 223.
- Simões JÁ, Poletti GB, Portugal PM, Brolazo EM, Discacciati MG, Crema GD. Influência do conteúdo vaginal de gestantes sobre a recuperação do estreptococo do grupo B nos meios de transporte Stuart e Amies. Rev Bras Ginecol Obstet. 2005 Nov;27(11): 672-76.
- Pereira CA S, Alvarenga J, Barros AL, Silva AO. Pesquisa de bacilos Gram negativos não fermentadores presentes em torneiras de um hospital privado do Município de Volta Redonda, RJ. Revista Episteme Transversalis. 2012; 3(1).
- Pereira CAS, Luchese RH, Valadão RC. Potencial probiótico de linajes de Lactobacillus plantarum y Lactobacillus fermentum. Alimentaria. 2004;352: 53-9.
- Deliberali B, Myiamoto KN, Winckler Neto CHDP, Pulcinelli RSR, Aquino ARC, et al. Prevalência de bacilos gram-negativos não fermentadores de pacientes internados em Porto Alegre, RS. J Bras Patol Med Lab. 2011;47(5):529-34.
- de Oliveira AC, Damasceno QS. Surfaces of the hospital environment as possible deposits of resistant bacteria: a review. Rev Esc Enferm USP. 2010 Dec;44(4):1118-23. [Article in Portuguese]
- Laranjeira V dos S, Marchetti DP, Steyer JR, Corção G, Picoli SU. Investigation of metallo-beta-lactamase-producing Acinetobacter sp and Pseudomonas aeruginosa at an emergency hospital in Porto Alegre, State of Rio Grande do Sul, Brazil. Rev Soc Bras Med Trop. 2010 Jul-Aug;43(4):462-4. [Article in Portuguese]
- Paniz R, Picoli SU. Infecções nosocomiais por bacilos gram-negativos não fermentadores de glicose em um hospital público de Caxias do Sul-RS. Monografia (Especialização em Microbiologia Clínica) Universidade de Novo Hamburgo, Caxias do Sul, RS. (78) 2012.
- Gonçalves DC, Lima AB, Leão LS, Filho JR, Pimenta FC, Vieira JD. Detection of metallo-beta-lactamase in Pseudomonas aeruginosa isolated from hospitalized patients in Goiânia, State of Goiás. Rev Soc Bras Med Trop. 2009 Jul-Aug;42(4):411-4. [Article in Portuguese]
- Karafin M, Romagnoli M, Fink DL, Howard T, Rau R, Milstone AM, et al. Fatal infection caused by Cupriavidus gilardii in a child with aplastic anemia. J Clin Microbiol. 2010 Mar;48(3):1005-7.
- Kilic A, Senses Z, Kurekci AE, Aydogan H, Sener K, Kismet E, et al. Nosocomial outbreak of Sphingomonas paucimobilis bacteremia in a hemato/oncology unit. Jpn J Infect Dis. 2007 Nov;60(6):394-6.
Correspondência
Carlos Alberto Sanches Pereira
Avenida Paulo Alves Erlei Abrantes, 1325 – Três Poços
27240-560 – Volta Redonda, RJ
