Pesquisa de bacilos Gram negativos não fermentadores no interior do corpo de torneiras em hospital privado
Research of non-fermenting Gram negative bacilli isolated from the interior of taps bodies of a private hospital unit
Alexandre Oliveira da Silva1
Josely Alvarenga2
Marcelo Ribeiro de Almeida Guedes1
Rosangela Firmino3
Carlos Alberto Sanches Pereira4
1Especialista em Microbiologia Clínica – Centro Universitário Geraldo Di Biase – UGB – Volta Redonda, RJ, Brasil.
2Pós-graduanda em Microbiologia Clínica – Centro Universitário Geraldo Di Biase – UGB – Volta Redonda, RJ, Brasil.
3Microbiologista do Laboratório do Hospital Unimed-VR – Volta Redonda, RJ, Brasil.
4Professor/Coordenador da Pós-graduação em Microbiologia Clínica do Centro Universitário Geraldo Di Biase – UGB – Volta Redonda, RJ, Brasil.
Artigo recebido em 29/06/2013
Artigo aprovado em 11/09/2014
Resumo
Objetivo: Avaliar a presença de bacilos Gram negativos não fermentadores no interior do corpo de torneiras de uma unidade hospitalar privada do município de Volta Redonda, RJ. Métodos: Um total de 53 amostras foi coletado do corpo de torneiras das unidades: UTI, Centro Cirúrgico, Clínica Cirúrgica, Clínica Médica e Pronto-Socorro, introduzindo swab estéril em movimentos giratórios. As amostras foram esgotadas em placa de Petri contendo agar MacConkey e agar BHI (Himedia®) acrescido de 5% de sangue de carneiro e incubados em estufa bacteriológica em temperatura de 35°C por até 48 horas. Os microrganismos isolados foram submetidos à coloração de Gram e aos testes da catalase e oxidase e identificados através dos sistemas Painel NF III e Painel para Enterobactérias (Probac®) e pelo Sistema API®Staph (bioMérieux). Resultados: Os percentuais de culturas positivas e negativas foram de 60% (32) e 40% (21), respectivamente. Os resultados mostram que os BGNNF correspondem a 67% dos isolados, seguidos pelas enterobactérias (21%) e cocos Gram positivos (12%). Conclusão: Os sistemas de distribuição de água do ambiente hospitalar, especialmente o corpo das torneiras, necessitam de vigilância microbiológica, pois podem tornar-se veículos de propagação e disseminação de microrganismos patogênicos.
Palavras-chave
Infecção hospitalar; Pseudomonas aeruginosa; Contaminação
Introdução
Os bacilos Gram negativos não fermentadores (BGNNF) são microrganismos frequentemente envolvidos em casos de infecções adquiridas nas Unidades de Tratamento Intensivos (UTIs), principalmente nas infecções do trato respiratório, devido à sua ampla distribuição ambiental e sua capacidade de se manter viável nestes ambientes, particularmente na água e em seus sistemas de distribuição.(1)
Práticas adequadas de higiene e desinfecção ambiental são fundamentais para o controle destas infecções. Tais práticas incluem a higienização de superfícies inanimadas, ar e água.(2-4)
A emergência de BGNNF, em ambiente nosocomial, com sensibilidade antimicrobiana diminuída, vem adquirindo importância como agentes de IRAS. O uso indiscriminado de antimicrobianos é um fator de risco importante para o surgimento e disseminação de resistência, fazendo com que o controle da infecção hospitalar seja um desafio para os profissionais da área da saúde.(5,6)
Pseudomonas aeruginosa tem sido um dos principais patógenos envolvidos em casos de IRAS, mas outros BGNNF, como Acinetobacter baumannii e Stenotrophomonas maltophilia também são constantemente reportados. Alguns estudos demonstraram que uma considerável parcela dos pacientes internados em UTI, com infecção nosocomial por P. aeruginosa, estavam infectados pelo mesmo clone presente no interior das torneiras daquele ambiente.(7-11)
Devido à persistência destes microrganismos em superfícies inanimadas expostas ao ambiente, o estudo de material coletado do interior de torneiras do âmbito hospitalar é de interesse para a segurança do paciente hospitalizado.(12,13)
O objetivo deste trabalho foi avaliar a presença de bacilos Gram negativos não fermentadores no interior do corpo de torneiras de uma unidade hospitalar privada do município de Volta Redonda, RJ.
MATERIAL E MÉTODOS
A coleta das amostras foi realizada no interior das torneiras da Unidade de Terapia Intensiva, Clínica Médica, Clínica Cirúrgica, Pronto Socorro e Centro Cirúrgico de uma Unidade Hospitalar privada da cidade de Volta Redonda, RJ.
As torneiras estavam assim distribuídas: Clínica Cirúrgica, 12 torneiras; Clínica Médica, 18; UTI, 9; Pronto Socorro, 9 e Centro Cirúrgico, 5.
As coletas foram realizadas retirando-se o aerador das torneiras e introduzindo-se no interior do seu corpo swab estéril em movimentos giratórios. Este movimento foi repetido quatro vezes. Posteriormente, os swabs foram inoculados em meio de transporte de Stuart e encaminhados ao laboratório de microbiologia do Centro Universitário Geraldo Di Biase, onde as amostras foram processadas.
Com o auxílio de alça bacteriológica, uma alíquota da amostra de cada swab foi esgotada em placa de Petri contendo agar MacConkey (Himedia®), preparado de acordo com as instruções do fabricante e também em agar BHI (Himedia®) acrescido de 5% de sangue de carneiro. Os swabs foram inoculados em tubos contendo 2 mL de caldo BHI, para controle da recuperação dos microrganismos. As placas de Petri e os tubos foram incubados em estufa bacteriológica, em temperatura de 35°C, por até 48 horas.
Decorrido o período de incubação, as placas e tubos foram observados para confirmação de crescimento. As placas que não apresentaram crescimento e os tubos correspondentes foram analisados para confirmação e descarte de crescimento de microrganismo.
Os microrganismos em colônias isoladas foram submetidos à coloração de Gram e aos testes da catalase e oxidase. Um novo repique em 2 mL de caldo BHI foi feito por três vezes para posterior congelamento em tubos criogênicos.
Após o congelamento de todas as amostras, iniciou-se a etapa de identificação. Para isso, as amostras foram descongeladas, ativadas em caldo BHI e o repique feito por três vezes consecutivas. As amostras de microrganismos Gram negativos com resultado positivo para o teste da oxidase foram inoculadas em Painel NF III (Probac®) e as amostras negativas para o teste da oxidase foram inoculadas em Painel para Enterobactérias (Probac®). A identificação dos cocos Gram positivos foi feita com Sistema API®Staph (bioMérieux®).
RESULTADOS
Foram coletadas amostras da parte interior do corpo de 53 torneiras em todos os setores da unidade hospitalar. Deste total, 60% (32) apresentaram crescimento bacteriano, onde foram isolados BGNNF, enterobactérias e cocos Gram positivos, ao passo que 40% (21) não apresentaram crescimento bacteriano. O setor que apresentou a maior taxa de crescimento bacteriano foi a Clínica Cirúrgica (Tabela 1).

Na Clínica Cirúrgica, amostras coletadas de duas torneiras apresentaram crescimento de mais de uma espécie de microrganismos. Em uma destas torneiras, foram isolados Chryseomonas luteola e Complexo Burkholderia cepacia, e, na outra, Chryseobacterium indologenes e Chryseomonas luteola. Todos os isolados deste setor foram BGNNF, entre eles: Stenotrophomonas maltophylia, Pseudomonas aeruginosa e Burkholderia sp.
Na Clínica Médica, foi recuperada apenas uma espécie de bactéria por torneira. Este setor foi o que apresentou maior diversidade de microrganismos; além dos BGNNF, foram isoladas enterobactérias e cocos Gram positivos. O Staphylococcus epidermidis e Chryseomonas luteola foram os microrganismos mais prevalentemente encontrados, somando três isolados cada espécie, seguidos por Roseomonas sp. (2), Proteus mirabilis (1) e Micrococcus luteus (1).
Nas torneiras da Unidade de Terapia Intensiva foram encontrados apenas membros da família Enterobacteriaceae num total de seis isolados. Foram encontrados dois membros do Grupo Entérico 137 e duas Raoultela ornithinolytica e um isolado de Klebsiella pneumoniae e Klebsiella oxytoca.
O Pronto Socorro, assim como o Centro Cirúrgico apresentou crescimento bacteriano de apenas uma espécie de microrganismo – Roseomonas sp. No Pronto Socorro quatro torneiras apresentaram crescimento bacteriano e, no Centro Cirúrgico, apenas uma torneira.
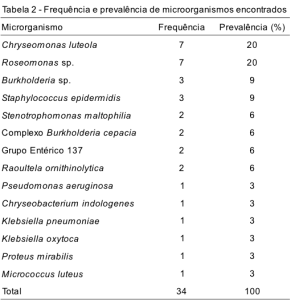
Os BGNNF mais prevalentemente encontrados foram Chryseomonas luteola e Roseomonas sp., ambas com sete isolados (20%), acompanhadas por Burkholderia sp., três (9%), Stenotrophomonas maltophilia e Complexo Burkholderia cepacia, ambas com dois isolados (6%), Pseudomonas aeruginosa, um (3%) e Chryseobacterium indologenes, um (3%) (Tabela 2). Os BGNNF representam 67% das bactérias isoladas, seguidos pelas enterobactérias (21%) e cocos Gram positivos (12%).
DISCUSSÃO
Os microrganismos encontrados no interior do corpo das torneiras, como, por exemplo, Klebsiella pneumoniae, Pseudomonas aeruginosa e Proteus mirabilis, têm sido notadamente considerados patógenos relacionados a IRAS, principalmente em pacientes hospitalizados. Stenotrophomonas maltophilia é um microrganismo emergente, promotor de surtos em unidades de terapia intensiva cujo agravante principal é a resistência intrínseca a vários antimicrobianos, gerando altas taxas de mortalidade.(14,15)
Os sistemas de distribuição de água, especialmente, em edificações antigas (como o é caso do hospital onde o trabalho foi realizado), ou de grande porte, podem conter elevados níveis de material orgânico. Esses sistemas são geralmente complexos, podendo haver ramais interrompidos, onde a água não circula, e partes corroídas, o que pode propiciar um ambiente em que bactérias e outros microrganismos possam colonizar e ser continuamente liberados na coluna de água.(16)
Os sistemas de distribuição de água em ambientes de saúde pode representar uma das fontes mais negligenciadas de IRAS, e surtos derivados de saídas de água têm sido relatados com frequência cada vez maior. A quantidade de células bacterianas liberadas na água é pequena, mas devem-se levar em consideração fatores como o potencial de patogenicidade e virulência do microrganismo e as condições dos cuidados de higienização, tanto do ambiente quanto dos paramentos e mãos dos profissionais de saúde e as condições imunológicas do paciente em tratamento.(16,17)
Tal premissa reforça a ideia de que, muitas vezes, os profissionais, após procedimentos com pacientes, não se atêm à importância da higienização das mãos e retornam às atividades sem se dar conta da possibilidade de disseminar microrganismos. A contaminação de locais aparentemente limpos reforça a possibilidade da disseminação de patógenos. Tais locais são definidos como superfícies limpas, sem aparente sujidade, fazendo com que muitas vezes sejam ignoradas medidas eficazes de limpeza. O trânsito de pessoas, como equipe de saúde e visitantes, na unidade, e, consequentemente, o contato com os pacientes, objetos e superfícies diversas confere possibilidades de disseminação de patógenos se não forem observadas as devidas precauções, com destaque para a higienização das mãos. Entretanto, outras vias podem contribuir na transferência de patógenos.(18,19)
Os microrganismos liberados na água, a partir da colonização, dos encanamentos representam um risco de infecção para os usuários. Estes microrganismos patogênicos incluem Pseudomonas aeruginosa, Legionella pneumophila, Micobactérias não tuberculosas, Stenotrophomonas maltophilia, Acinetobacter baumannii e espécies de Klebsiella, bem como várias espécies de fungos, incluindo o Aspergillus. Esses microrganismos podem ser encontrados tanto no armazenamento central como nas águas periféricas dos sistemas de distribuição. Pseudomonas aeruginosa é a principal causadora de infecções graves em unidades de cuidados intensivos e é comumente encontrada em águas periféricas.(8)
A frequência de contaminação nos diversos setores estudados é coerente com a sua estrutura física. Elevada quantidade de equipamento e as condições críticas dos pacientes em cuidados intensivos levam a fatores de risco e maiores taxas de infecção. Nesses ambientes, a aquisição de infecções pode se dar a partir de fontes externas, como as das torneiras. Desta forma, deve-se aumentar o cuidado com essas possíveis fontes, evitando de forma efetiva a presença de IRAS no ambiente hospitalar.(3)
CONCLUSÕES
Os sistemas de distribuição de água do ambiente hospitalar, especialmente o “corpo” das torneiras, necessitam de vigilância microbiológica, pois podem tornar-se veículos de propagação e disseminação de microrganismos patogênicos como os aqui relatados.
Abstract
Objective: Evaluate the presence of Non-Fermenting Gram Negative Bacilli in the interior of faucets’ bodies of a private hospital unit of the municipality of Volta Redonda, RJ. Methods: A total of 53 samples were collected from the body of faucets of the following units: ICU, Surgical Center, Surgical Clinic, Medical Clinic and Emergency Room, introducing sterile swab in rotating movements. The samples were placed on Petri diches containing MacConkey agar and BHI (Himedia®) agar plus 5% of ram’s blood and incubated in bacteriologic stove at 35ºC for up to 48 hours. The isolated microorganisms were submited to Gram Staining and to the Catalase and Oxidase tests and identified through the NF III Panel and Panel for Enterobacteria (Probac®) systems and by the API®Staph (bioMérieux®) system. Results:The percentuals of positive and negative cultures were 60% (32) and 40% (21), respectively. The results showed that the NFGNB measure up 67% of the isolated, followed by the enterobacteria (21%) and Gram positive coccus (12%). Conclusion: The water distribution systems from the hospital environment, specially the faucet’ body, need microbiologic survaillance for it can become propagation and dissemination vectors of pathogenic microorganisms.
Keywords
Infection Hospital; Pseudomonas aeruginosa; Contamination
Referências
- Anvisa. Agência Nacional de Vigilância Sanitária. Detecção e identificação de bactérias de importância médica, 2004. Disponível em: http://www.anvisa.gov.br/servicosaude/manuais/microbiologia/mod_5_2004.pdf. Acesso em 14 Abr. 2013.
- Andrade D, Angerami ELS, Padovani CR. Condição microbiológica dos leitos hospitalares antes e depois de sua limpeza. Rev. Saude Publica. 2000;34(2):163-9.
- CDC. Centers for Disease Control and Prevention. Guidelines for Infection Control in Health-Care Facilities: Recommendations of CDC and the Healthcare Infection Control Practices Advisory Committee (HICPAC), 2003. Disponível em: http://www.cdc.gov/hicpac/pdf/guidelines/eic_in_hcf_03.pdf. Acesso em 14 Abr. 2013.
- Guimarães MA, Tibana A, Nunes MP, Santos KRN. Disinfectant and antibiotic activities: a comparative analysis in Brazilian hospital bacterial isolates. Braz J Microbiol. 2000;31(1): 193-9.
- Chang MR, Carvalho NC, Oliveira AL, Moncada PM, Moraes BA, Asensi MD. – Surveillance of pediatric infections in a teaching hospital in Mato Grosso do Sul, Brazil. Braz J Infect Dis. 2003; 7(2):149-60.
- Laranjeira VS, Marchetti DP, Steyer JR, Corção G, Picoli SU. Pesquisa de Acinetobacter sp e Pseudomonas aeruginosa produtores de metalo-beta-lactamase em hospital de emergência de Porto Alegre, Estado do Rio Grande do Sul, Brasil. Rev Soc Bras Med Trop. 2010;43(4):462-4.
- Blanc DS, Nahimana I, Petignat C, Wenger A, Bille J, Francioli P. Faucets as a reservoir of endemic Pseudomonas aeruginosa colonization/infection in intensive care units. Intensive Care Med. 2004 Oct;30(10):1964-8.
- Boyer A, Doussau A, Thiébault R, Venier AG, Tran V, Boulestreau H, et al. Pseudomonas aeruginosa acquisition on an intensive care unit: relationship between antibiotic selective pressure and patients’ environment. Crit Care. 2011;15(1):R55.
- Petignat C, Francioli P, Nahimana I, Wenger A, Bille J, Schaller MD, et al. Exogenous sources of Pseudomonas aeruginosa in intensive care unit patients: implementation of control measures and follow-up with molecular typing. Infect Control Hosp Epidemiol. 2006 Sep;27(9):953-7
- Trautmann M, Michalsky T, Wiedeck H, Radosavljevic V, Ruhnke M. Tap water colonization with Pseudomonas aeruginosa in a surgical intensive care unit (ICU) and relation to Pseudomonas infections of ICU patients. Infect Control Hosp Epidemiol. 2001 Jan;22(1):49-52.
- Vidal F, Mensa J, Almela M, Olona M, Martínez JA, Marco F. Bacteremia in adults due to glucose non-fermentative Gram-negative bacilli other than P. aeruginosa. QJM. 2003 Mar;96(3): 227-34.
- Kramer A, Schwebke I, Kampf G. How long do nosocomial pathogens persist on inanimate surfaces? A systematic review. BMC Infect Dis. 2006 Aug 16;6:130.
- Oliveira AC, Damasceno QS. Superfícies do ambiente hospitalar como possíveis reservatórios de bactérias resistentes: uma revisão. Rev Esc Enferm USP. 2010; 44(4):1118-23.
- Almeida MTG, Érika CPB, Rossit ARB, Bertollo EMG, Martinez MB. Infecções hospitalares por Stenotrophomonas maltophilia: aspectos clínico-epidemiológicos e de resistência antimicrobiana. Arq Ciênc Saúde. 2005;12(3):141-5.
- Anvisa. Agência Nacional de Vigilância Sanitária. Investigação e Controle de Bactérias Multirresistentes, 2007. Disponível em: http://www.anvisa.gov.br/servicosaude/controle/reniss/manual%20_controle_bacterias.pdf. Acesso em 14 Abr. 2013.
- Lindsay D, von Holy A. Bacterial biofilms within the clinical setting: what healthcare professionals should know. J Hosp Infect. 2006 Dec;64(4):313-25.
- Anaissie EJ, Penzak SR, Dignani MC. The hospital supply as a source of nosocomial infections. Arch Intern Med. 2002 Jul 8; 162(13):1483-92.
- Hayden MK, Blom DW, Lyle EA, Moore CG, Weinstein RA. Risk of hand or glove contamination after contact with patients colonized with vancomycin-resistant Enterococcus or the colonized patient’s environment. Infect Control Hosp Epidemiol. 2008 Feb; 29(2):149-54.
- Scott P, Deye G, Srinivasan A, Murray C, Moran K, Hulten E, et al. An outbreak of multidrug-resistant Acinetobacter
baumannii-calcoaceticus complex infection in the US military health care system associated with military operations in Iraq.
Clin Infect Dis. 2007 Jun 15;44(12):1577-84.
Correspondência
Alexandre Oliveira da Silva
Rua Governador Luís Monteiro Portela, 81 – Aterrado
27213-080 – Volta Redonda, RJ, Brasil
