Presença de RNA do SARS-CoV-2 em fezes de pacientes com COVID-19
Presence of SARS-CoV-2 RNA in faeces of COVID-19 patients
Cleonice Maria Michelon1
Alexandre Piccinini2
1Doutora, Docente do Departamento de Análises Clínicas da Universidade Federal de Santa Catarina (UFSC). Florianópolis-SC, Brasil.
2Mestre. Prefeitura Municipal de Florianópolis – PMF. Florianópolis-SC, Brasil.
Universidade Federal de Santa Catarina (UFSC). Florianópolis-SC, Brasil.
Recebido em 28/07/2020
Artigo aprovado em 12/08/2020
DOI: 10.21877/2448-3877.20200018
INTRODUÇÃO
Os números relacionados com a pandemia pelo novo Coronavírus (nCoV ou SARS-CoV-2) continuam crescendo. Segundo dados da Universidade Johns Hopkins, o número de casos de COVID-19 no mundo já ultrapassa os 12 milhões.(1) Desde o surgimento dos primeiros casos na China, pesquisadores de diferentes países se esforçam para compreensão da fisiopatologia da doença e na busca de métodos diagnósticos sensíveis e rápidos, intervenções terapêuticas e métodos preventivos eficazes.
A doença causada pelo SARS-CoV-2 se manifesta classicamente através de febre, tosse e dispneia ao esforço. Contudo, sintomas gastrintestinais como náuseas, vômito, diarreia e desconforto abdominal têm sido identificados em pacientes com COVID-19.(2-4) Segundo revisão realizada por Tian et al., o sintoma gastrintestinal mais comum em adultos e crianças é a diarreia, relatado antes ou após diagnóstico da COVID-19.(5)
Estudos prévios evidenciaram o tropismo do SARS-CoV pelo trato gastrintestinal, verificado pela detecção do vírus em amostras de biópsia intestinal e fezes.(6) O SARS-CoV-2 apresenta uma glicoproteína de superfície (proteína S) responsável pela ligação do vírus à célula hospedeira, permitindo sua entrada.(7) A fisiopatologia da COVID-19 não está completamente esclarecida, entretanto está confirmado que o vírus invade as células humanas através da ligação da proteína S ao receptor da enzima conversora de angiotensina-2 (ECA2).(8) Avaliando-se os níveis de expressão de ECA2, os órgãos considerados mais vulneráveis à infecção pelo SARS-CoV-2 incluem pulmão, coração, esôfago, rins, bexiga e intestino,(7) sugerindo que outras vias de transmissão, além da respiratória, podem ser possíveis.(5,7)
A presença do RNA viral nas fezes alerta para a possibilidade de transmissão do SARS-CoV-2 pela via fecal-oral e aventa também a expectativa de se utilizar essa amostra biológica para fins diagnósticos. Esta possibilidade se baseia no fato de pesquisadores terem identificado que a positividade em amostras de fezes pode preceder a detecção em amostras respiratórias(9) e manter-se positiva após decaimento dos sintomas.(10,11) Esta revisão buscou rastrear as publicações mais recentes em que houve investigação da presença do RNA do SARS-CoV-2 em amostras de fezes, com o objetivo de identificar a média de positividade e verificar a viabilidade dessa amostra biológica para diagnóstico da COVID-19.
MATERIAL E MÉTODOS
Pesquisa na literatura
Os dados foram coletados por meio de busca de artigos publicados no site da PubMed pela combinação dos termos “COVID-19”, “SARS-CoV-2” e “faeces” ou “stool”. Após a busca inicial foram excluídas as duplicidades e também os estudos que não atenderam aos critérios de inclusão.
Critérios de inclusão e exclusão
Foram incluídos artigos publicados a partir do mês de maio de 2020. Devido à baixa familiaridade com outros idiomas, foram incluídos somente artigos em Inglês. Artigos de pacientes diagnosticados com COVID-19 cujas amostras de fezes tenham sido testadas para presença do vírus SAR-CoV-2 foram incluídos. Artigos de revisão, relatos de casos e estudos com animais ou amostras ambientais foram excluídos.
Extração de dados
Os artigos selecionados foram revisados e os dados extraídos foram: local da investigação; número, sexo e faixa etária dos participantes; número de pacientes testados e número com amostra de fezes positiva para RNA do SARS-CoV-2; pacientes com amostra de fezes positiva e amostra de nasofaringe negativa para RNA do SARS-CoV-2; persistência da positividade na amostra de fezes após swab de nasofaringe negativo.
Resultados
A pesquisa na base PubMed resultou em 515 títulos. Retiradas as duplicidades restaram 202 publicações. Aplicando-se os critérios de exclusão, 12 artigos foram elegíveis (Quadro 1).
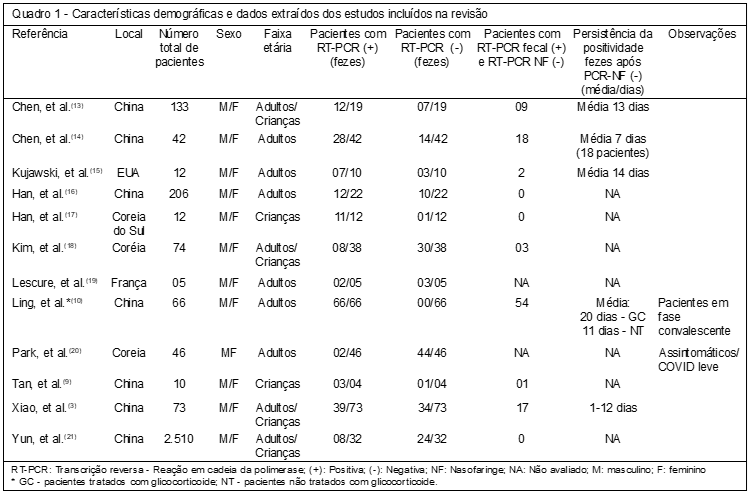
Os estudos elencados foram realizados em quatro países diferentes, sendo a maioria na China e tiveram a participação de 3.189 indivíduos. Do total de participantes, foram testados nos diferentes protocolos de estudo amostras de fezes de 369 indivíduos, incluindo adultos e crianças de ambos os sexos. As amostras de fezes avaliadas foram coletadas em diferentes fases e graus de severidade da doença, em populações heterogêneas, incluindo indivíduos com fatores de risco e comorbidades, que apresentavam ou não sintomas gastrintestinais. Essas diferenças na maioria dos estudos não estavam especificadas nos resultados, dificultando a extração de dados estratificados.
A presença do RNA do SARS-CoV-2 nos estudos avaliados foi realizada através de abordagem molecular utilizando a técnica de Transcrição Reversa seguida de Reação em Cadeia da Polimerase (do Inglês reverse-transcriptase polymerase chain reaction – RT-PCR), considerada padrão ouro para o diagnóstico da COVID-19.
O teste de RT-PCR para COVID19 geralmente avalia secreções respiratórias, coletadas por meio de swabs de orofaringe (garganta) ou nasofaringe (nariz). Entretanto, outros materiais biológicos podem ser analisados, incluindo amostras de fezes e swabs retais.(12)
Dos 369 pacientes que tiveram suas amostras de fezes avaliadas, 198 pacientes (53,6%) foram positivos para a presença do RNA do SARS-CoV-2 em pelo menos uma amostra. Em 104 (52,5%) destes pacientes, as amostras de fezes foram positivas para presença do RNA viral, enquanto que as amostras de nasofaringe, consideradas padrão para o diagnóstico da COVID-19, estavam negativas. Considerando a população total (369) que foi testada para presença de RNA do vírus nas fezes, os indivíduos positivos com pesquisa negativa em nasofaringe (104) representaram 28,2%.
A persistência da positividade para presença de RNA do SARS-CoV-2 em amostras de fezes, após negatividade do teste em amostras de nasofaringe, foi verificada em alguns estudos e variou de um a vinte dias. A maior parte dos estudos avaliados foi retrospectiva, fornecendo apenas dados de avaliações pontuais realizadas conforme os diferentes protocolos hospitalares de manejo dos pacientes com COVID-19.
Discussão
Esta revisão demonstrou que o RNA do SARS-CoV-2 pode ser detectado em amostras de fezes de pacientes com COVID-19 em alguns casos antes da detecção nas amostras de trato respiratório, podendo ainda persistir após negativação das mesmas. A presença do RNA viral em amostras de fezes pode ter implicações importantes tanto na propagação da doença quanto em seu diagnóstico, devendo ser considerada na elaboração de medidas preventivas e na elaboração de protocolos diagnósticos e de manejo dos pacientes com COVID-19.
Segundo os estudos avaliados nesta revisão, a positividade para RNA do SARS-CoV-2 em amostras de fezes foi de 53,6%. Em revisões realizadas por Gupta et al. e Tian et al., que também avaliaram esse mesmo parâmetro, o percentual de positividade das amostras para RNA viral foi semelhante.(5,22) Pequenas diferenças podem estar relacionadas às particularidades dos artigos avaliados (número de participantes e de amostras avaliadas, fase da doença, etc.) e ao fato de a inclusão, pelos autores, de publicações como estudos de caso, em que 100% dos participantes apresentavam positividade para o RNA viral em amostras de fezes.
Vários autores têm sugerido a possibilidade de transmissão da COVID-19 por via fecal-oral.(3,14,23) Essa hipótese necessita ser considerada, uma vez que, além da presença do RNA viral nas fezes de um número significativo de pacientes, a persistência da positividade chama atenção. Estudos demonstraram que o RNA viral pode estar presente nas fezes de pacientes COVID-19, sintomáticos e assintomáticos, por longo período de tempo.(7,14,20,24,25) Revisão publicada por Santos et al. sugeriu que, em crianças, o material genético viral pode ser detectado por maior tempo em amostra de fezes do que nas amostras de trato respiratório.(26) Liu et al. identificaram a presença de material genético do vírus em fezes de um paciente por 46 dias após alta hospitalar.(25) Wang et al. relataram três casos em que a persistência de infecção intestinal por SARS-CoV-2 após resolução da pneumonia levou à reinternação dos pacientes.(11) Na presente revisão, a maior persistência de RNA viral em amostra de fezes foi observada em estudo realizado por Ling et al., que avaliaram pacientes em fase de convalescência, ou seja, pacientes recuperados, não febris, sem sintomas respiratórios e que tiveram dois resultados de RT-PCR negativos em swabs orofaríngeos. Nesse estudo, o grupo de pacientes que recebeu tratamento com glicocorticoides apresentou tempo médio de depuração do RNA do SARS-CoV-2 de 20 dias e 11 dias no grupo não tratado com glicocorticoides.(10) Segundo os autores, o tratamento com glicocorticoides deveria ser evitado no período de replicação viral, especialmente em pacientes com doença leve, uma vez que atrasa a eliminação do vírus.(10) Ling et al. observaram ainda correlação entre a contagem de linfócitos T CD4+ e a depuração do RNA do SARS-CoV-2, destacando que quanto menor o valor absoluto dos linfócitos T CD4+ maior a duração da excreção do vírus nas fezes do paciente, sugerindo papel importante da imunidade celular na COVID-19.(10)
Apesar da confirmação da presença do RNA do vírus em amostras de fezes, muitas vezes por tempo superior à detecção em amostras de trato respiratório, a escassez de estudos relacionados à viabilidade do vírus SARS-CoV-2 nessas amostras, comprovando sua infectividade, precisa ser enfatizada. Identificou-se somente um estudo publicado em que SARS-CoV-2 viável foi isolado de dois pacientes(2) e duas divulgações por laboratórios chineses, que afirmaram ter isolado com sucesso o SARS-CoV-2 de fezes de pacientes COVID-19 (não publicado).(27)
Resultados publicados por alguns autores tornam possível inferir que não existe correlação entre a presença de sintomas gastrintestinais e a presença de RNA do SARS-CoV-2 nas fezes, uma vez que o RNA viral foi identificado em amostras de fezes de indivíduos assintomáticos,(20,23) com sintomas respiratórios leves(28) e com pneumonia,(29) sem referência a manifestações gastrintestinais. Nesta revisão, não foi possível identificar a presença ou ausência de sintomas gastrintestinais nos pacientes positivos para presença de RNA viral nas fezes, pois nos artigos avaliados as populações eram heterogêneas e os resultados não traziam essa discriminação.
A presença do RNA do SARS-CoV-2 em amostras de fezes despertou para a possibilidade de utilização dessa amostra para o diagnóstico da COVID-19. Um estudo multicêntrico realizado na Alemanha comparou 11 diferentes sistemas de RT-PCR utilizados no diagnóstico da COVID-19. Diferentes diluições de RNA viral extraído de amostra de fezes de uma criança positiva para COVID-19 foram testadas e a maioria dos protocolos detectou o vírus com segurança na amostra com diluição equivalente a cinco cópias de RNA, mostrando bom desempenho e alta sensibilidade.(30)
Devido ao alto índice de positividade de RNA viral em pacientes após alta hospitalar, vários autores sugeriram a inclusão da avaliação de fezes nos protocolos clínicos da COVID-19.(10,16,21,31) Avaliando-se os dados sobre percentual de positividade das amostras de fezes extraídos das publicações exploradas nesta revisão, observou-se que a positividade foi inferior em comparação às amostras de nasofaringe. No entanto, o fato de alguns pacientes testarem positivo em amostras de fezes sem apresentarem resultados positivos em avaliações de amostras de trato respiratório, em diferentes fases da doença, apontam para a importância dessa análise em pacientes COVID-19.
Considerações finais
O RNA do SARS-CoV-2 pode ser detectado em amostras de fezes de um percentual significativo de pacientes com COVID-19. A positividade das amostras de fezes de forma isolada pode ocorrer antes da detecção do RNA viral em amostras nasofaríngeas ou após negativação das mesmas ou resolução dos sintomas do paciente. Em muitos indivíduos, a presença de RNA viral nas fezes persiste por semanas após alta hospitalar alertando para um possível risco de transmissão. Nesse contexto, considera-se que a inclusão da pesquisa de RNA viral em amostra de fezes, na triagem e alta do paciente, seria uma boa estratégia para melhorar os índices de diagnóstico da COVID-19 e reduzir a propagação do vírus.
Limitações do estudo
Aspectos como número e características dos pacientes, momento da coleta de materiais biológicos, carga viral, dentre outros podem influenciar os resultados e precisam ser considerados na sua interpretação. Portanto, apesar da presente revisão ter identificado 53,6% de positividade para RNA de SARS-CoV-2 em amostras de fezes, não podemos confirmar esta prevalência populacional como verdadeira devido à grande variabilidade no desenho dos estudos incluídos na revisão.
Abstract
COVID-19, the disease caused by the new Coronavirus, has spread rapidly across all continents promoting a pandemic. Related studies to the pathophysiology of COVID-19 have shown that the cells of intestinal mucosa are invaded by SARS-CoV-2, being in faeces excreted, suggesting a potential faecal-oral transmission route. The presence of the virus in faeces also raised the expectation of using this biological sample for diagnostic purposes. In this mini review, we summarize recent studies related to research of the presence of the SARS-CoV-2 RNA in the faeces of COVID-19 patients.
Keywords
Coronavirus infections; RNA; Faeces, SARS-CoV-2, COVID-19
REFERÊNCIAS
- Johns Hopkins University. COVID-19 [Internet]. 2020. Available at: https://coronavirus.jhu.edu/map.html
- Wang W, Xu Y, Gao R, Lu R, Han K, Wu G, et al. Detection of SARS-CoV-2 in different types of clinical specimens. JAMA [Internet]. 11 de março de 2020; Available at: https://jamanetwork. com/journals/jama/fullarticle/2762997
- Xiao F, Tang M, Zheng X, Liu Y, Li X, Shan H. Evidence for Gastrointestinal Infection of SARS-CoV-2. Gastroenterology [Internet]. maio de 2020;158(6):1831-1833.e3. Available at: https://linkinghub. elsevier.com/retrieve/pii/S0016508520302821
- Zhang W, Du R-H, Li B, Zheng X-S, Yang X-L, Hu B, et al. Molecular and serological investigation of 2019-nCoV infected patients: implication of multiple shedding routes. Emerg Microbes Infect [Internet]. 1 de janeiro de 2020;9(1):386-9. Available at: https://www. tandfonline.com/doi/full/10.1080/22221751.2020.1729071.
- Tian Y, Rong L, Nian W, He Y. Review article: gastrointestinal features in COVID-19 and the possibility of faecal transmission. Aliment Pharmacol Ther [Internet]. maio de 2020;51(9):843-51. Available at: http://doi.wiley.com/10.1111/apt.15731.
- Leung WK, To K, Chan PKS, Chan HLY, Wu AKL, Lee N, et al. Enteric involvement of severe acute respiratory syndrome-associated coronavirus infection. Gastroenterology [Internet]. outubro de 2003;125(4):as0016508503012150. Available at: http://www.mosby. com/scripts/om.dll/serve?action=searchDB& searchDBfor=art&artType=abs&id=as0016508503012150.
- Chen Y, Guo Y, Pan Y, Zhao ZJ. Structure analysis of the receptor binding of 2019-nCoV. Biochem Biophys Res Commun [Internet]. abril de 2020;525(1):135-40. Available at: https://linkinghub. elsevier. com/retrieve/pii/S0006291X20303399.
- Lu R, Zhao X, Li J, Niu P, Yang B, Wu H, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet [Internet]. fevereiro de 2020;395(10224):565-74. Available at: https://linkinghub.elsevier. com/retrieve/pii/S0140673620302518.
- Tan Y, Tan B, Pan J, Wu J, Zeng S, Wei H. Epidemiologic and clinical characteristics of 10 children with coronavirus disease 2019 in Changsha, China. J Clin Virol [Internet]. junho de 2020; 127: 104353. Available at: https://linkinghub.elsevier. com/retrieve/pii/S1386653220300950.
- Ling Y, Xu S-B, Lin Y-X, Tian D, Zhu Z-Q, Dai F-H, et al. Persistence and clearance of viral RNA in 2019 novel coronavirus disease rehabilitation patients. Chin Med J (Engl) [Internet]. maio de 2020;133(9):1039-43. Available at: http://journals.lww.com/10.1097/CM9. 0000000000000774.
- Wang X, Zhou Y, Jiang N, Zhou Q, Ma W-L. Persistence of intestinal SARS-CoV-2 infection in patients with COVID-19 leads to re-admission after pneumonia resolved. Int J Infect Dis [Internet]. junho de 2020;95:433-5. Available at: https://linkinghub. elsevier.com/retrieve/pii/S1201971220302794.
- Brasil. Anvisa. Agência Nacional de Vigilância Sanitária. Testes para COVID-19 – Perguntas e Respostas [Internet]. 2020. Available at: http://portal.anvisa.gov.br/documents/219201/4340788/Perguntas+e+respostas+-+testes+para+Covid-19.pdf/9fe182c3-859b-475f-ac9f-7d2a758e48e7.
- Chen C, Gao G, Xu Y, Pu L, Wang Q, Wang L, et al. SARS-CoV-2-Positive sputum and feces after conversion of pharyngeal samples in patients with COVID-19. Ann Intern Med [Internet]. 16 de junho de 2020;172(12):832-4. Available at: https://www. acpjournals.org/doi/10.7326/M20-0991.
- Chen Y, Chen L, Deng Q, Zhang G, Wu K, Ni L, et al. The presence of SARS-CoV-2 RNA in the feces of COVID-19 patients. J Med Virol [Internet]. 25 de julho de 2020;92(7):833-40. Available at: https: //onlinelibrary.wiley.com/doi/abs/10.1002/jmv.25825.
- COVID-19 Investigation Team. Clinical and virologic characteristics of the first 12 patients with coronavirus disease 2019 (COVID-19) in the United States. Nat Med [Internet]. 23 de junho de 2020; 26(6):861-8. Available at: http://www.nature.com/articles/s41591-020-0877-5. doi:10.1038/s41591-020-0877-5.
- Han C, Duan C, Zhang S, Spiegel B, Shi H, Wang W, et al. Digestive symptoms in COVID-19 patients with mild disease severity. Am J Gastroenterol [Internet]. junho de 2020;115(6):916–23. Available at: https://journals.lww.com/10.14309/ajg.0000000000000664.
- Han MS, Seong M-W, Kim N, Shin S, Cho SI, Park H, et al. Viral RNA load in mildly symptomatic and asymptomatic children with COVID-19, Seoul. [published online ahead of print, 2020 Jun 4]. Emerg Infect Dis. 2020;26(10):10.3201/eid2610.202449. doi:10.3201/eid2610. 202449.
- Kim J-M, Kim HM, Lee EJ, Jo HJ, Yoon Y, Lee N-J, et al. Detection and isolation of SARS-CoV-2 in serum, urine, and stool specimens of COVID-19 patients from the Republic of Korea. Osong Public Heal Res Perspect [Internet]. 30 de junho de 2020;11(3):112-7. Available at: http://ophrp.org/journal/view.php?doi=10.24171/j.phrp.2020.11.3.02.
- Lescure F-X, Bouadma L, Nguyen D, Parisey M, Wicky P-H, Behillil S, et al. Clinical and virological data of the first cases of COVID-19 in Europe: a case series. Lancet Infect Dis [Internet]. junho de 2020;20(6):697-706. Available at: https://linkinghub.elsevier. com/retrieve/pii/S1473309920302000. doi:10.1016/S1473-3099(20) 30200-0.
- Park S, Lee C-W, Park D-I, Woo H-Y, Cheong HS, Shin HC, et al. Detection of SARS-CoV-2 in fecal samples from patients with asymptomatic and mild COVID-19 in Korea. [published online ahead of print, 2020 Jun 10]. Clin Gastroenterol Hepatol. 2020;S1542-3565(20)30777-1. doi:10.1016/j.cgh.2020.06.005.
- Yun H, Sun Z, Wu J, Tang A, Hu M, Xiang Z. Laboratory data analysis of novel coronavirus (COVID-19) screening in 2510 patients. Clin Chim Acta. 2020;507:94-97. doi:10.1016/j.cca.2020.04.018.
- Gupta S, Parker J, Smits S, Underwood J, Dolwani S. Persistent viral shedding of SARS?CoV-2 in faeces – a rapid review. Color Dis [Internet]. 4 de junho de 2020;22(6):611-20. Available at: https://onlinelibrary.wiley.com/doi/abs/10.1111/codi.15138.
- Tang A, Tong Z, Wang H, Dai Y, Li K, Liu J, et al. Detection of Novel Coronavirus by RT-PCR in Stool Specimen from Asymptomatic Child, China. Emerg Infect Dis. 2020;26(6):1337-1339. doi:10.3201/eid2606.200301.
- Kipkorir V, Cheruiyot I, Ngure B, Misiani M, Munguti J. Prolonged SARS-Cov-2 RNA detection in anal/rectal swabs and stool specimens in COVID-19 patients after negative conversion in nasopharyngeal RT-PCR test. J Med Virol [Internet]. 13 de maio de 2020;jmv.26007. Available at: https://onlinelibrary.wiley.com/doi/abs/10.1002/jmv.26007.
- Liu P, Cai J, Jia R, Xia S, Wang X, Cao L, et al. Dynamic surveillance of SARS-CoV-2 shedding and neutralizing antibody in children with COVID-19. Emerg Microbes Infect [Internet]. 1 de janeiro de 2020;9(1):1254-8. Available at: https://www.tandfonline.com/ doi/full/10.1080/22221751.2020.1772677.
- Santos VS, Gurgel RQ, Cuevas LE, Martins-Filho PR. Prolonged fecal shedding of SARS-CoV-2 in pediatric patients. A quantitative evidence synthesis. J Pediatr Gastroenterol Nutr [Internet]. 22 de maio de 2020; Publish Ah. Available at: https://journals.lww.com/ 10.1097/MPG.0000000000002798.
- Gu J, Han B, Wang J. COVID-19: Gastrointestinal Manifestations and Potential Fecal-Oral Transmission. Gastroenterology. 2020; 158(6):1518-1519. doi:10.1053/j.gastro.2020.02.054.
- Nicastri E, D’Abramo A, Faggioni G, De Santis R, Mariano A, Lepore L, et al. Coronavirus disease (COVID-19) in a paucisymptomatic patient: epidemiological and clinical challenge in settings with limited community transmission, Italy, February 2020. https://www.eurosurveillance.org/content/10.2807/1560-7917.ES. 2020. 25.11.2000230.
- Zhang J, Wang S, Xue Y. Fecal specimen diagnosis 2019 novel coronavirus-infected pneumonia. J Med Virol [Internet]. 12 de junho de 2020;92(6):680-2. Available at: https://onlinelibrary.wiley. com/doi/abs/10.1002/jmv.25742.
- Muenchhoff M, Mairhofer H, Nitschko H, Grzimek-Koschewa N, Hoffmann D, Berger A, et al. Multicentre comparison of quantitative PCR-based assays to detect SARS-CoV-2, Germany, March 2020. Eurosurveillance [Internet]. 18 de junho de 2020;25(24). Available at: https://www.eurosurveillance.org/content/10.2807/1560-7917.ES.2020.25.24.2001057.
- Li Y, Hu Y, Yu Y, Zhang X, Li B, Wu J, et al. Positive result of Sars-Cov-2 in faeces and sputum from discharged patient with COVID-19 in Yiwu, China. [published online ahead of print, 2020 Apr 20]. J Med Virol. 2020;10.1002/jmv.25905. doi:10.1002/jmv.25905.
Correspondência
Cleonice Maria Michelon
Departamento de Análises Clínicas, Centro de Ciências da Saúde
Universidade Federal de Santa Catarina
Campus Universitário Reitor João David Ferreira Lima – Trindade
88 040-900 – Florianópolis -SC, Brasil
