Prevalência de bastonetes Gram-negativos não fermentadores isolados em amostras de hemoculturas
Prevalence of non-fermenter Gram-negative bacilli isolated in blood culture samples
Mayara Silveira Leal1
Adrieli Alves Carneiro2
Patrícia Guedes Garcia3
1 Especialista em Análises Clínicas/Faculdade de Ciências Médicas e da Saúde de Juiz de Fora.
2 Microbiologista/ Faculdade de Ciências Médicas e da Saúde de Juiz de Fora.
3 Doutora/ Universidade Federal de Juiz de Fora.
Instituição: Faculdade de Ciências Médicas e da Saúde de Juiz de Fora, Minas Gerais, Brasil.
Recebido em 17/05/2020
Aprovado em 02/09/2020
DOI: 10.21877/2448-3877.202001994
INTRODUÇÃO
As infecções de corrente sanguínea (ICS), de condição clínica grave, são responsáveis por elevada taxa de morbimortalidade.(1,2) Segundo a Agência Nacional de Vigilância Sanitária (ANVISA), entre os pacientes com ICS, 40% deles evoluem a óbito.
A presença de agente infeccioso na circulação promove uma resposta inflamatória sistêmica, à qual dá-se o nome de sepse.(3) A sepse, uma vez instalada, promove uma disfunção orgânica e coloca em risco a vida do paciente.(2,4-7) Essa síndrome é considerada um grande problema de saúde pública em unidades de terapia intensiva (UTIs), pois é uma das principais causas de mortalidade no mundo e, por isso, foi listada como uma prioridade global da saúde pela Organização Mundial de Saúde (OMS).(8) Além disso, incorre em aumento dos custos hospitalares e prolonga o tempo de internação, onerando os sistemas de saúde.(1,9,10)
A detecção de microrganismos viáveis na circulação é realizada pelo exame de hemocultura, que é padrão-ouro para o diagnóstico da bacteremia.(2,5,6,11) Sendo assim, a hemocultura é considerada um exame com elevado valor preditivo de infecção e, portanto, é um relevante indicador de ICS. A identificação do patógeno causador da infecção torna-se extremamente necessária para a escolha da correta terapia antimicrobiana.(5,6) De acordo com Nieman et al. (2016),(2) o rápido diagnóstico da sepse e o início precoce do tratamento reduz significativamente a morbimortalidade, com uma taxa de sobrevida de 80%.
Diversos microrganismos podem provocar as ICS, e dentre eles encontram-se as bactérias Gram-negativas não fermentadoras. Essas bactérias são facilmente encontradas no ambiente e são cada vez mais isoladas nas amostras clínicas. Especialmente em pacientes imunocomprometidos, as bactérias não fermentadoras agem como patógenos oportunistas e são difíceis de tratar devido a sua resistência a diversas classes de antimicrobianos.(12)
Perante o exposto, o presente estudo teve por objetivo avaliar a prevalência de bactérias não fermentadoras, isolados em amostras de hemoculturas de indivíduos provenientes das UTIs e UC de um hospital privado de Juiz de Fora – MG. Também faz parte do objetivo do presente trabalho investigar o perfil de suscetibilidade aos antimicrobianos das cepas bacterianas prevalentes visando contribuir para pesquisas na área de prevenção das ICS, além do incentivo ao uso racional de medicamentos.
MÉTODOS
Trata-se de um estudo descritivo, retrospectivo, em que os dados analisados foram coletados no período de janeiro de 2017 a janeiro de 2019.
Como critério de inclusão considerou-se todas as amostras de hemoculturas cujos resultados foram positivos para microrganismos Gram-negativos não fermentadores. Os dados que fazem parte da pesquisa foram obtidos através dos arquivos digitais do software laboratorial Shift Lis® utilizado pelo laboratório do referido hospital.
As hemoculturas incluídas no presente estudo foram previamente detectadas de forma automatizada pelo aparelho BACT/ALERT® 3D 60 da empresa bioMérieux, com posterior identificação e antibiograma no sistema VITEK® 2 compact da bioMérieux com os cartões de identificação GN para Gram-negativos fermentadores e não fermentadores e com cartões de antibiograma AST-238 e AST-239.(13)
Esse estudo foi previamente aprovado pelo Comitê de Ética em Pesquisa da Faculdade de Ciências Médicas e da Saúde de Juiz de Fora – CEP/FCMS-JF, de acordo com a Resolução 466/12 do Conselho Nacional de Saúde sob o Parecer nº 3.735.713.
Análise estatística
As análises descritivas dos dados foram realizadas utilizando o Microsoft Excel 2007.
RESULTADOS
Foram analisados resultados de 3.535 amostras de hemoculturas provenientes das UTIs e UC no período de dois anos, sendo 2.591 (73,3%) da UTI adulto, 539 (15,2%) da UTI neonatal e 405 (11,5%) da UC. Do total de amostras, 1.071 (30,3%) apresentaram crescimento positivo e destas, 44 (4,1%) apresentaram crescimento de pelo menos dois microrganismos, totalizando 1.116 cepas. No entanto, apenas 77 cepas (6,9%) eram de bactérias não fermentadoras, logo, esses foram os resultados contemplados no presente estudo.
Do total de amostras positivas, 80,8% (866) eram provenientes da UTI adulto. Dos Gram-negativos não fermentadores contemplados na pesquisa, 91% (70) também foram provenientes da mesma unidade; enquanto 5,1% (4) eram da UTI neonatal e 3,9% (3) da UC.
O gráfico 1 mostra a prevalência de bactérias não fermentadoras isoladas nas amostras de hemoculturas dos pacientes da UTI adulto. Foram isoladas 40 cepas de Acinetobacter baumannii (57,1%), 20 cepas de Pseudomonas aeruginosa (28,6%), 5 cepas de Pseudomonas spp. (7,1%), 2 cepas de Stenotrophomonas maltophilia (2,9%), 2 cepas de Acinetobacter spp. (2,9%) e 1 cepa do Complexo Burkholderia cepacia (1,4%).
Gráfico 1. Prevalência de bactérias não fermentadora na UTI adulto.
Fonte: elaborada pelos autores
Os dados de prevalência das bactérias não fermentadoras identificadas nas hemoculturas da UTI neonatal e da UC estão representados no Gráfico 2.
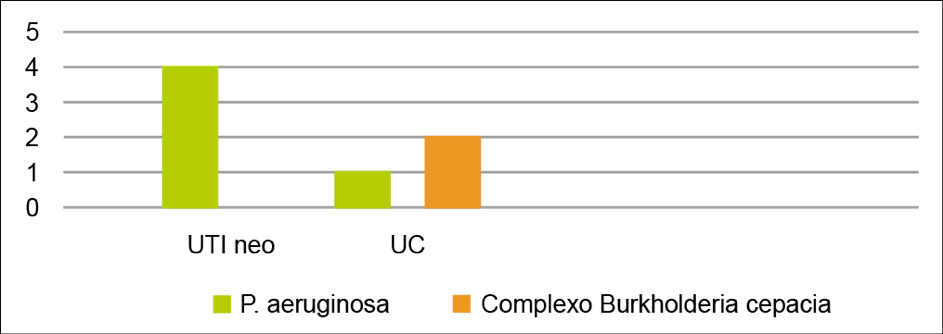
Gráfico 2. Prevalência de bactérias não fermentadoras na UTI neo e na UC.
Fonte: elaborada pelos autores
Após a análise dos Gráficos 1 e 2, foi possível determinar a prevalência geral das bactérias não fermentadoras nas UTIs e UC. Foram isoladas 40 cepas de A. baumannii (51,9%) e 25 cepas de P. aeruginosa (32,5%). Outros Gram-negativos não fermentadores foram isolados em menor quantidade, sendo eles: 5 cepas de Pseudomonas spp. (6,5%), 3 cepas do Complexo Burkholderia cepacia (3,9%), 2 cepas de Stenotrophomonas maltophilia (2,6%) e 2 de Acinetobacter spp. (2,6%) conforme o Gráfico 3.
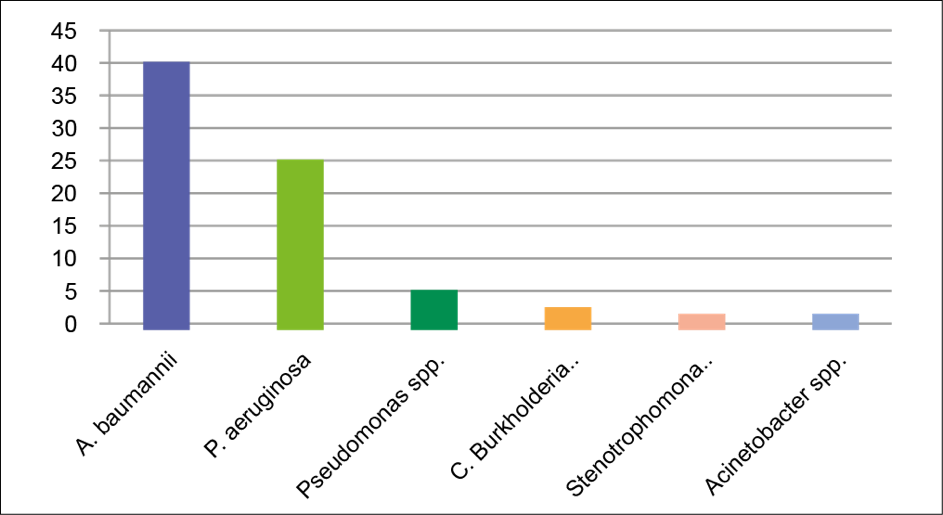
Gráfico 3. Prevalência geral de bactérias não fermentadora nas UTIs e UC.
Fonte: elaborada pelos autores
As cepas de A. baumannii mostraram sensibilidade reduzida à maioria dos antimicrobianos testados onde 100% delas apresentaram-se resistentes às penicilinas; 88,5% às cefalosporinas; 87,5% aos carbapenêmicos; 85,0% às quinolonas e 72,5% à penicilina associada ao inibidor de β-lactamase. Apesar da resistência às diversas classes de antimicrobianos, a colistina foi o agente antimicrobiano mais ativo, seguido pela tigeciclina, com sensibilidade de 100% e 80%, respectivamente, conforme apresentado na Tabela 1.
Tabela 1 – Perfil de suscetibilidade Acinetobacter baumannii.
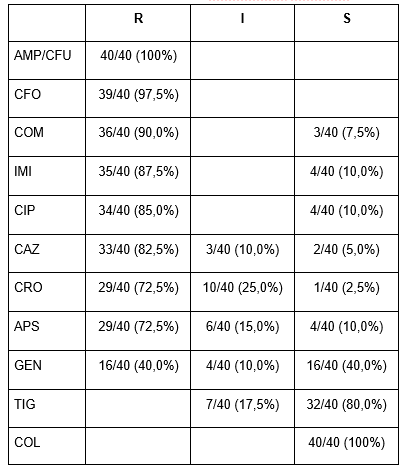
Fonte: elaborada pelos autores.
Legenda: R – Resistente; I – Intermediário; S – SensívelFonte: elaborada pelos autores.
AMP – Ampicilina; CAZ – Ceftazidima; CIP – Ciprofloxacino; CFO – Cefoxitina; COL – Colistina; CPM – Cefepime; CRO – Ceftriaxona; GEN – Gentamicina; IPM – Imipenem; APS – Ampicilina com sulbactam; TIG – Tigeciclina.
As cepas de P. aeruginosa estudadas apresentaram sensibilidade reduzida à maioria das cefalosporinas, com resistência variando de 96% (cefoxitina) a 100% (cefuroxima). Ainda em relação às cefalosporinas, mais da metade das cepas apresentaram resistência à ceftazidima e ao cefepime (52%). Dos aminoglicosídeos testados, a resistência foi de aproximadamente 60% à gentamicina. No grupo das penicilinas, 100% das cepas foram resistentes à ampicilina e 96% à ampicilina associada com tazobactam. Em relação à tigeciclina, 96% das cepas foram resistentes. A colistina foi o antimicrobiano que apresentou maior sensibilidade contra as cepas de P. aeruginosa com 96% de sensibilidade, conforme a Tabela 2.
Tabela 2 – Perfil de suscetibilidade Pseudomonas aeruginosa.
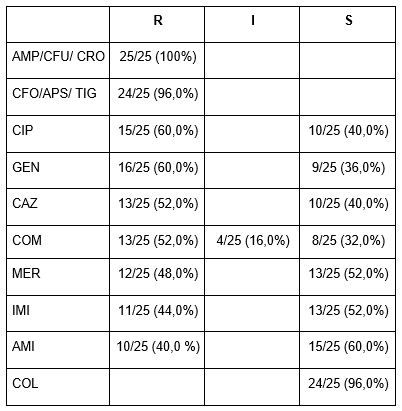 Fonte: elaborada pelos autores.
Fonte: elaborada pelos autores.
Legenda: R – Resistente; I – Intermediário; S – Sensível
AMI – Amicacina; AMP – Ampicilina; CAZ – Ceftazidima; CIP – Ciprofloxacino; CFO – Cefoxitina; CFU – Cefuroxima; COL – Colistina; CPM – Cefepime; CRO – Ceftriaxona; GEN – Gentamicina; IPM – Imipenem; MER – Meropenem; APS – Ampicilina com sulbactam; TIG – Tigeciclina.
DISCUSSÃO
A taxa de positividade das hemoculturas observadas no presente estudo foi de aproximadamente 30%, resultado similar ao descrito por Rodriguez et al. (2011)(14) e La Rosa et al. (2016)(15) cuja positividade encontrada foi de aproximadamente 36%; e, foi superior aos 20% de positividade observado por Morello et al. (2019).(16) A taxa de positividade das hemoculturas varia de 10% a 30%.(17,18) Portanto, é possível afirmar que os resultados obtidos no estudo em questão foram compatíveis com a literatura.
Os bacilos Gram-negativos não fermentadores mais isolados nas UTIs foram Acinetobacter baumanni (51,9%) e Pseudomonas aeruginosa (32,5%).
A prevalência das bactérias não fermentadoras encontrada foi semelhante à reportada por Chmielarczyk et al. (2018),(19) que também observaram A.baumannii e P. aeruginosa como prevalentes nas unidades de terapia intensiva.
As cepas de A. baumannii são intrinsecamente resistentes às penicilinas e praticamente resistentes a todos os antimicrobianos usados para tratar as infecções causadas por bactérias Gram-negativas, como os pertencentes às classes de fluoroquinolonas, aminoglicosídeos e cefalosporinas.(20) A resistência múltipla fez com que os carbapenêmicos se tornassem a droga de escolha para o tratamento de infecções provocadas por esses microrganismos.(22) No entanto, Mota et al. (2018)(23) descreveram em seu estudo uma taxa de resistência importante ao imipenem de 77,1% e dados da ANVISA apontam 80% das ICS por A. baumannii sendo resistentes aos carbapenêmicos.
No presente estudo, a taxa de resistência ao imipenem foi de 87,5%, corroborando com o estudo realizado por Mota et al. (2018).(23) Também observamos uma elevada taxa de resistência às cefalosporinas de 2a, 3a e 4a geração e às quinolonas sendo semelhante às descritas por Gomes et al. (2016).(24)
A colistina foi o antimicrobiano mais ativo contra as cepas de A. baumannii, onde 100% das cepas apresentaram-se sensíveis, taxa semelhante à apresentada por Gales et al. (2019),(20) seguido pela tigeciclina, cuja sensibilidade foi de 80%, corroborando com os estudos de WU et al. (2018),(21) cuja sensibilidade foi de 100%.
Em relação às cepas de P. aeruginosa, as drogas que apresentaram maior resistência de acordo com Manyahi et al. (2020)(25) foram as cefalosporinas de 3ª geração, representada pela cefotaxima, cuja resistência foi de 100%. A suscetibilidade dessas cepas também foi reduzida em relação à gentamicina, à ceftazidima e ao ciprofloxacino, onde a taxa de resistência observada foi de 73%, 70% e 64%, respectivamente. Quanto aos carbapenêmicos, a resistência relatada foi de 46% para o meropenem.
No presente estudo a taxa de resistência, à ceftazidima foi de 52%, mostrando-se inferior à descrita por Manyahi et al. (2020).(25) Quanto aos aminoglicosídeos e ao ciprofloxacino, a taxa de resistência foi semelhante.
De acordo com Moyo et al. (2015),(26) o uso dos carbapenêmicos tem sido cada vez mais utilizado para tratar infecções por P. aeruginosa resistentes aos β-lactâmicos, entretanto o aparecimento de cepas resistentes a eles já tem sido observado assim como descrito por Aydin Teke et al. (2017)(27) que observaram uma resistência ao imipenem de aproximadamente 41% e por Manyahi et al. (2020)(25) que descreveram uma resistência ao meropenem de 46%; no presente estudo, a taxa de resistência observada foi de 44% ao imipenem e de 48% ao meropenem.
Segundo Fritzenwanker et al. (2018)(28) as cepas de P. aeruginosa são vistas como resistentes à tigeciclina, e no presente estudo esse também foi o antibiótico que apresentou uma elevada taxa de resistência.
Apesar do elevado grau de resistência associado às cepas de P. aeruginosa, algumas drogas apresentaram boa taxa de suscetibilidade. Dentre os fármacos considerados antipseudomoniais, a taxa de suscetibilidade foi de 60% para amicacina, semelhante à descrita por Dallacorte et al. (2016),(29) que foi de 57%; e em relação à colistina, a sensibilidade observada no presente estudo foi de 96%, taxa semelhante à observada por Kim et al. (2017)(30) e por Malekzadegan et al. (2019),(31) que foi de 100%.
Em relação às cepas de Burkholderia cepacia prevalentes na UC, seu perfil de suscetibilidade não foi detalhadamente abordado, devido ao reduzido número de amostras nesta unidade e, portanto, não apresentou uma relevância significativa em relação ao número total de amostras analisadas. No entanto, é possível afirmar que no presente estudo, 100% das cepas isoladas nesta unidade foram sensíveis à sulfametaxazol com trimetropim e à ceftazidima, drogas de primeira escolha para o tratamento de infecções causadas por essas bactérias.
CONCLUSÃO
As bactérias não fermentadoras de maior prevalência foram Acinetobacter baumannii e Pseudomonas aeruginosa. Em relação ao teste de sensibilidade aos antimicrobianos, foi observada uma múltipla resistência em relação às quinolonas, β-lactâmicos, inclusive, carbapenêmicos.
Diante do surgimento de cepas com resistência a diversas classes de antimicrobianos, é de suma importância que haja um controle rigoroso por parte da equipe hospitalar, com medidas educativas que visem à prevenção das ICS e, consequentemente, promovam uma redução na disseminação desses microrganismos.
O relato do surgimento de cepas resistentes à colistina desafia ainda mais as medidas de controle de infecção e torna a investigação completa dos surtos uma ação indispensável. Medidas de biossegurança, como a higienização sistemática das mãos, é de grande importância no controle das infecções relacionadas à assistência à saúde.
REFERÊNCIAS
- Agência Nacional de Vigilância Sanitária. Medidas de Prevenção de Infecção Relacionada à Assistência à Saúde. Brasília: Agência Nacional de Vigilância Sanitária, 2017.
- Nieman AE, Savelkoul PHM, Beishuizen A, Henrich B, Lamik B, MacKenzie CR, Kindgen-Milles D, Helmers A, Diaz C, Sakka SG and Schade RP. A prospective multicenter evaluation of direct molecular detection of blood stream infection from a clinical perspective. BMC Infectious Diseases (2016) 16:314.
- Mustafić S, Brkić S, Prnjavorac B, Sinanović A, Porobić Jahić H, Salkić S. Diagnostic and prognostic value of procalcitonin in patients with sepsis. Med Glas (Zenica). 2018;15(2):93–100. doi:10.17392/963-18.
- Brooks D, Polubothu P, Young D, Booth MG, Smith A. (2018). Sepsis caused by bloodstream infection in patients in the intensive care unit: the impact of inactive empiric antimicrobial therapy on outcome. Journal of Hospital Infection, 98(4), 369–374. doi:10.1016/j.jhin.2017.09.031 .
- Araujo MRE. Hemocultura: recomendações de coleta, processamento e interpretação de resultados. J Infect Control. 2012; 1(1): 08-19.
- Ferreira LE, Dalposso K, Hackbarth BB, Gonçalves AR, Westphal GA, França PHC at al. Painel molecular para detecção de microrganismos associados à sepse. Rev Bras Ter Intensiva. 2011; 23(1): 36-40.
- Sitnik R, Marra AR, Petroni RC, Ramos OPS, Martino MDV, Pasternak J et al. Uso do SeptiFast para diagnóstico de sepse em doentes graves de um hospital brasileiro. Einstein. 2014; 12(2): 191-7.
- Leal HF, Azevedo J, Silva GEO, et al. Bloodstream infections caused by multidrug-resistant gram-negative bacteria: epidemiological, clinical and microbiological features. BMC Infect Dis. 2019;19(1):609. Published 2019 Jul 11. doi:10.1186/s12879-019-4265-z.
- Cantón-Bulnes ML, Garnacho-Montero J. Practical approach to the management of catheter-related bloodstream infection. Rev Esp Quimioter. 2019;32 Suppl 2 (Suppl 2):38–41.
- da Costa TM, Cuba GT, Morgado PGM, et al. Pharmacodynamic comparison of different antimicrobial regimens against Staphylococcus aureus bloodstream infections with elevated vancomycin minimum inhibitory concentration. BMC Infect Dis. 2020;20(1):74. Published 2020 Jan 23. doi:10.1186/s12879-020-4782-9.
- Martinez RM, Wolk DM. Bloodstream Infections. (n.d.). Diagnostic Microbiology of the Immunocompromised Host, Second Edition, 653–689. doi:10.1128/microbiolspec.dmih2-0031-2016.
- Whistler T, Sangwichian O, Jorakate P, Sawatwong P, Surin U, Piralam B, et al. (2019) Identification of Gram negative non-fermentative bacteria: How hard can it be? PLoS Negl Trop Dis 13(9): e0007729. https://doi.org/10.1371/journal.pntd.0007729.
- bioMérieux Brasil. Produtos e Serviços. Disponível em: URL: http://www.biomerieux.com.br/diagnostico-clinico/produtos-e-servicos. Acesso em 3 dezembro 2019.
- Rodriguez F, Barrera L, De La Rosa G, Dennis R, Duenas C, Granados M, et al. The epidemiology of sepsis in Colombia: a prospective multicenter cohort study in tem university hospitals. Crit Care Med. 2011; 39(7):1675-82.
- De La Rosa G, León AL, Jaimes F. Epidemiología y pronóstico de pacientes con infección del torrente sanguíneo en 10 hospitales de Colombia [Epidemiology and prognosis of patients with bloodstream infection in 10 hospitals in Colombia]. Rev Chilena Infectol. 2016;33(2):141–149. doi:10.4067/S0716-10182016000200003
- Morello LG, Dalla-Costa LM, Fontana RM, Netto AC, Petterle RR, Conte D, et al. Avaliação das características clínicas e epidemiológicas de pacientes com e sem sepse nas unidades de terapia intensiva de um hospital terciário. Einstein (São Paulo). 2019; 17(2): eAO4476. http://dx.doi.org/10.31744/einstein_journal/ 2019AO4476.
- Chen XC, Yang YF, Wang R, Gou HF, Chen XZ. Epidemiology and microbiology of sepsis in mainland China in the first decade of the 21st century.Int J Infect Dis. 2015; 3: 9-14.
- Weiss SL, Fitzgerald JC, Pappachan J, et al. Global epidemiology of pediatric severe sepsis: the sepsis prevalence, outcomes, and therapies study [published correction appears in Am J Respir Crit Care Med. 2016 Jan 15;193(2):223-4]. Am J Respir Crit Care Med. 2015;191(10):1147–1157. doi:10.1164/rccm.201412-2323OC
- Chmielarczyk A, Pobiega M, Romaniszyn D, Wójkowska-Mach J. Multi-locus sequence typing (MLST) of non-fermentative Gram-negative bacilli isolated from bloodstream infections in southern Poland. Folia Microbiol (Praha). 2018;63(2):191–196. doi:10.1007/s12223-017-0550-7.
20-Gales AC, Seifert H, Gur D, Castanheira M, Jones RN, Sader HS. Antimicrobial Susceptibility of Acinetobacter calcoaceticus-Acinetobacter baumannii Complex and Stenotrophomonas maltophilia Clinical Isolates: Results From the Sentry Antimicrobial Surveillance Program (1997-2016). Open Forum Infect Dis. 2019;6(Suppl 1):S34–S46. Published 2019 Mar 15. doi:10.1093/ofid/ofy293.
- Wu HG, Liu WS, Zhu M, Li XX. Research and analysis of 74 bloodstream infection cases of Acinetobacter baumannii and drug resistance. Eur Rev Med Pharmacol Sci. 2018;22(6):1782-1786. doi:10.26355/eurrev_201803_14597
- Al-Lawama M, Aljbour H, Tanash A, Badran E. Intravenous Colistin in the treatment of multidrug-resistant Acinetobacter in neonates. Ann Clin Microbiol Antimicrob. 2016;15:8. Published 2016 Feb 12. doi:10.1186/s12941-016-0126-4.
- Mota FS, Oliveira HÁ, Souto RCF. Perfil e prevalência de resistência aos antimicrobianos de bactérias Gram-negativas isoladas de pacientes de uma unidade de terapia intensiva. Rev Bras Anal Clin. 2018; 50(3): 270-2.
- Gomes DBC, Genteluci GL, Carvalho KR, Medeiros LM, Almeida VC, Castro EAR, et al. Acinetobacter baumannii multirresistentes: emergência de resistência à polimixina no Rio de Janeiro. Rev Visa em Debate. 2016;4(3):28.
- Manyahi J, Kibwana U, Mgimba E, Majigo M. Multi-drug resistant bacteria predict mortality in bloodstream infection in a tertiary setting in Tanzania. PLoS One. 2020;15(3):e0220424. Published 2020 Mar 4. doi:10.1371/journal.pone.0220424.
- Moyo S, Haldorsen B, Aboud S, Blomberg B, Marselle SY, Sundsfjord A, Langeland N and Samuelsen O. Identification of VIM-2-Producing Pseudomonas aeruginosa from Tanzania Is Associated with Sequence Types 244 and 640 and the Location of blaVIM-2 in a TniC Integron. Antimicrob Agents Chemother. 2015;59(1):682–685. doi:10.1128/AAC.01436-13.
- Aydın Teke T, Tanır G, Bayhan Gİ, Öz FN, Metin Ö, Özkan Ş. Clinical and microbiological features of resistant gram-negative bloodstream infections in children. J Infect Public Health. 2017;10(2):211-218. doi:10.1016/j.jiph.2016.04.011.
- Fritzenwanker M, Imirzalioglu C, Herold S, Wagenlehner FM, Zimmer KP, Chakraborty T. Opções de tratamento para infecções Gram-negativas resistentes a Carbapenem. Dtsch Arztebl Int. 2018; 115 (20-21): 345-352. doi: 10.3238 / arztebl.2018.0345.
- Dallacorte TS, Indras DM, Teixeira JJV, Peder LD, Silva CM. Prevalência e perfil de sensibilidade antimicrobiana de bactérias isoladas de hemoculturas realizadas em hospitais particulares. Rev Inst Adolfo Lutz. São Paulo 2016; 75:1702.
- Kim HS, Park BK, Kim SK, et al. Clinical characteristics and outcomes of Pseudomonas aeruginosa bacteremia in febrile neutropenic children and adolescents with the impact of antibiotic resistance: a retrospective study. BMC Infect Dis. 2017;17(1):500. Published 2017 Jul 17. doi:10.1186/s12879-017-2597-0.
- Malekzadegan Y, Abdi A, Heidari H, Moradi M, Rastegar E, Sedigh Ebrahim-Saraie H. In vitro activities of colistin, imipenem and ceftazidime against drug-resistant Pseudomonas aeruginosa and Acinetobacter baumannii isolates in the south of Iran. BMC Res Notes. 2019;12(1):301. Published 2019 May 28. doi:10.1186/s13104-019-4344-7.
Correspondência
Mayara Silveira Leal
Faculdade de Ciências Médicas e da Saúde de Juiz de Fora
Alameda Salvaterra, 200 – Salvaterra, Juiz de Fora – MG, 36033-003
E-mail: [email protected]
