Prevalência de infecção do trato urinário em pacientes ambulatoriais e sua relação com os valores de nitrito e leucócitos
Prevalence of urinary tract infection in ambulatory patients and its relationship to nitrite values and leukocytes
Lara Cristina Alves de Oliveira1
Renata Carneiro Ferreira Souto2
1Acadêmica. Pontifícia Universidade Católica de Goiás – Goiânia-GO, Brasil.
2Doutora. Pontifícia Universidade Católica de Goiás – Goiânia-GO, Brasil.
Instituição: Pontifícia Universidade Católica de Goiás. Escola de Ciências Médicas, Farmacêuticas e Biomédicas – Goiânia-GO, Brasil.
Recebido em 17/05/2018
Artigo aprovado em 06/11/2018
DOI: 10.21877/2448-3877.201800705
INTRODUÇÃO
A infecção do trato urinário (ITU) pode ser definida como a presença de microrganismos patogênicos em qualquer parte do trato urinário alto e/ou baixo, gerando uma resposta imunológica do urotélio.(1,2) Fisiologicamente, o aparelho urinário não é constituído de microbiota, com exceção da parte distal da uretra, que pode apresentar bactérias aeróbias e anaeróbias que contribuem para proteção contra agentes patogênicos nesta região.(3,4)
Pode acometer indivíduos de todas as idades, contudo, a incidência se apresenta maior em crianças, mulheres sexualmente ativas, gestantes, mulheres menopausadas, idosos e pessoas hospitalizadas, principalmente aquelas que fazem uso de cateter urinário.(5,6) Entre os principais sintomas clínicos podem ser destacados a polaciúria, disúria, dor lombar, urgência miccional, febre, alteração de cor e odor da urina.(7,8)
As ITU são comumente causadas por bacilos Gram-negativos (BGN) com prevalência acima de 80%, destacando-se como principal representante deste grupo a Escherichia coli, seguida por Klebsiella spp., Proteus spp., Enterobacter spp. e Citrobacter spp. Já em relação aos cocos Gram-positivos (CGP), é observada uma menor frequência, em torno de 10% a 20%, sendo que, destes, os agentes mais prevalente são Staphylococcus saprophyticus, seguido por Enterococcus faecalis, S. aureus.(3,9)
O diagnóstico laboratorial tem como base a realização de dois procedimentos. Um teste de triagem, denominado exame de Elementos e Sedimentos Anormais (EAS) e a cultura de urina, onde é possível determinar a presença e identificar as bactérias associadas à ITU. O EAS consiste em uma análise dos aspectos físicos, químicos e microscópicos da amostra urinária, sendo que a química é obtida a partir do uso da fita reativa, avaliando-se dez parâmetros, incluindo dados de nitrito e leucócitos, sendo o último confirmado pela sedimentoscopia. Esses são considerados possíveis indicadores de infecção urinária causada por bactérias.(9,10)
O nitrito urinário é um produto da conversão de nitrato a nitrito por algumas bactérias, principalmente os BGN. Este é detectado pela reação de Greiss, sendo que o nitrito em pH ácido reage com a amina aromática para posterior formação de um composto diazônico, reagindo com compostos tetrahidrobenzoquinolina, produzindo um diazo róseo. A reação de Greiss é calibrada para contagem bacteriana maior ou igual a 100.000 unidades formadoras de colônia por mililitro (UFC/mL).(11) Entretanto, estudos já comprovaram a baixa sensibilidade do nitrito frente a casos de ITU; porém, quanto à especificidade do teste, este apresenta um alto índice. Mesmo que a maioria das ITU seja oriunda de colonização por BGN, há uma pequena ocorrência associada à presença de CGP.(1,3,10)
Alguns fatores podem contribuir para a baixa sensibilidade do nitrito no exame químico do EAS, como, por exemplo, a inabilidade de certas bactérias reduzirem nitrato a nitrito, principalmente CGP, como Streptococcus agalactiae e S. saprophyticus. Outras limitações seriam o tempo reduzido de contato entre agente microbiano e nitrato, o uso da antibioticoterapia ou, ainda, por baixas concentrações de nitrato presente na amostra urinária.(3,12)
Já os leucócitos, ou glóbulos brancos (GB), são um grupo de células sanguíneas diferenciadas, formadas em parte na medula óssea e no tecido linfoide. Atuam principalmente nos processos inflamatórios com a função de identificar, neutralizar e destruir patógenos, sejam eles exógenos (bacteriano, viral, fúngico) ou endógenos.(13) O número de leucócitos presentes na amostra, obtidos por meio da sedimentoscopia urinária, contribui para triagem de ITU, sendo que uma contagem superior a 10.000 leucócitos/mL é considerada possível indicador de infecção urinária bacteriana.(14)
A urocultura é um método de escolha para confirmar a ocorrência de ITU, sendo considerada positiva quando a contagem bacteriana for superior a 100.000 UFC/mL, havendo ainda a necessidade de se realizarem o isolamento e a identificação do agente patogênico, com a possibilidade de se investigar o perfil de susceptibilidade às drogas antimicrobianas por meio da realização do antibiograma. Contudo, estes são métodos onerosos e apresentam um tempo de execução prolongado.(9,10)
O estudo da infecção do trato urinário é de grande importância não apenas pelo fato de sua alta prevalência, tanto em comunidade quanto em ambiente nosocomial, mas também pela possibilidade de complicações que podem estar associadas, visto que esta infecção pode apresentar-se de forma assintomática ou sintomática, podendo ainda evoluir para cistite, pielonefrite ou mesmo sepse.(15,16)
O objetivo desse estudo foi verificar a frequência de infecção do trato urinário (ITU) causada por bactérias em pacientes atendidos no laboratório de análises clínicas de uma instituição de ensino em Goiânia, Goiás, no ano de 2017, e a relação entre uroculturas positivas e os dados referentes à presença ou ausência de nitrito e leucocitúria nas amostras dos mesmos.
MATERIAL E MÉTODOS
Este foi um estudo transversal do tipo retrospectivo, realizado a partir da análise de dados dos pacientes ambulatoriais atendidos no Laboratório de Análises Clínicas e Posto de Coleta da Região Noroeste, da Pontifícia Universidade Católica de Goiás (PUC-GO), no período de janeiro a dezembro de 2017.
Foram analisados fatores como idade, sexo e resultados das análises química (nitrito), microscópica (número de leucócitos) e microbiológica (cultura bacteriana negativa ou positiva, isolamento e identificação do agente patogênico), obtidos a partir das amostras urinárias analisadas.
A detecção de nitrito urinário foi realizada utilizando-se fita reagente (Combur10 Test® M, Roche) com leitura em equipamento semiautomatizado (Urisys 1100®, Roche). O resultado foi obtido por comparação com os padrões da fita pelo equipamento. Já as características microscópicas foram observadas após centrifugação por cinco minutos em 2.000-2.500 rpm, com posterior análise do sedimento urinário utilizando-se câmara de Neubauer e leitura realizada em objetiva de 40x. Após a contagem das células e estruturas presentes, foi aplicada a fórmula de ADDIS modificado, para se obter o número final de células e estruturas, por mililitro.(11)
Para urocultura foi realizada a semeadura da amostra de urina por duas técnicas de inoculação. A primeira consistiu na técnica de varredura em meio cistina lactose deficiente em eletrólitos (CLED), com o objetivo de quantificar o agente bacteriano por mililitro de amostra avaliada. Após inoculação e incubação a 36ºC por 24 horas, foram consideradas positivas aquelas com contagem superior a 100.000 UFC/mL; houve ainda a observação da fermentação de lactose a partir da mudança da coloração inicial do meio. Já a segunda semeadura foi realizada a partir da técnica de esgotamento de alça em ágar Mac Conkey (MK), com intuito de isolar colônias de bactérias Gram-negativas, sendo que estas foram submetidas à incubação semelhante à descrita acima. Aquelas que apresentaram colônias incolores ou marrons indicaram a não fermentação de lactose, portanto para estas foi realizado o teste da oxidase (Laborclin). A partir destes resultados, os microrganismos isolados foram identificados utilizando-se painéis automatizados (Neg Combo 66 MicroScan, Beckman Coulter®).
No entanto, para as amostras que apresentaram crescimento apenas em ágar CLED, as colônias foram analisadas visualmente e submetidas à bacterioscopia pós-cultura. Se observada presença de CGP em microscopia e formação de macro ou micro colônias em ágar, estas foram inoculadas por esgotamento de alça em ágar Manitol Salgado e ágar Sangue de Carneiro, respectivamente. Em seguida, estas foram incubadas à temperatura de 36°C por 24 horas. Para a identificação de ambos foi utilizado painel Pos Combo 41 (MicroScan Beckman Coulter®). A leitura dos painéis foi realizada por meio de automação (AutoScan 4®) e os laudos liberados utilizando-se o software Lab Pro 3.0®.
Como critérios de inclusão foram analisados os prontuários de pacientes que realizaram EAS e cultura de urina em um mesmo momento, no período do estudo. Foram excluídos aqueles prontuários de pacientes que não realizaram EAS e cultura de urina concomitantemente, que apresentaram falhas ou ausência de informações. Os dados obtidos foram analisados estatisticamente utilizando-se o programa Microsoft Office Excel (versões 2007 e 2010).
Este estudo foi aprovado pelo Comitê de Ética e Pesquisa da Pontifícia Universidade Católica de Goiás (CEP/PUC Goiás), sob o protocolo: 08254212.5.0000.0037, número de parecer 235.276 e data da relatoria em 20 de março de 2013. Essa pesquisa não recebeu financiamento para sua realização.
RESULTADOS
Foram analisados dados de 3.070 pacientes que realizaram EAS e urocultura concomitantemente. Destes, 13,4% (411/3070) obtiveram contagem de colônias superior a 100.000 UFC/mL, sendo que em 87,4% (359/411) das amostras foram isolados e identificados BGN, e apenas em 12,6% (52/411) os CGP (Figura 1).
Considerando a população estudada, verificou-se uma prevalência de 88,3% (363) de uroculturas positivas em pacientes do sexo feminino, e de 11,7% (48) para o masculino. A média de idade observada foi de 42 e 52 anos, respectivamente.
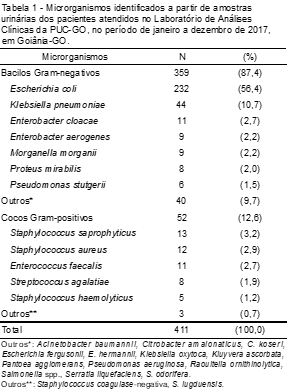
Considerando a identificação dos BGN associados à ITU, o patógeno que apresentou maior frequência foi a E. coli (56,4%), seguida por K. pneumoniae (10,7%) e E. cloacae (2,7%). Já em relação aos CGP, estes obtiveram crescimento em 52 (12,6%) amostras analisadas, sendo os mais prevalentes o S. saprophyticus (3,2%), S. aureus (2,9%) e E. faecalis (2,7%) (Tabela 1).
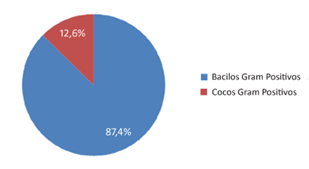
Figura 1. Frequência de microrganismos, segundo característica morfotintorial, isolados a partir de uroculturas
positivas dos pacientes atendidos no Laboratório de Análises Clínicas da PUC-GO, no período de janeiro a dezembro de 2017.
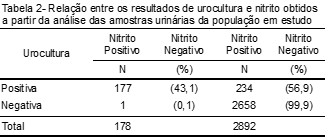
Do total de uroculturas positivas, 43,1% (177) apresentaram nitrito positivo e 56,9% (234) negativo no teste da fita reativa. Em relação às culturas de urina negativas, 0,1% (1) apresentou nitrito positivo e 99,9% (2.658) nitrito negativo (Tabela 2).
A análise do nitrito apresentou sensibilidade de 43,1%, e especificidade de 99,9%, sendo que o valor preditivo positivo (VPP) foi de 99,4% e o valor preditivo negativo (VPN) de 91,9%, em relação às uroculturas positivas.
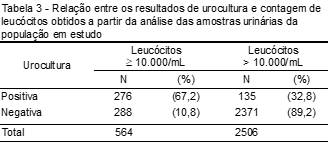
Quanto à contagem de leucócitos presentes em amostras consideradas positivas para ITU, 67,2% (276) apresentaram resultado superior a 10.000 leucócitos/mL, já em amostras cujo resultado foi negativo para ITU, apenas 10,8% (288) tiveram contagem de piócitos superior a 10.000/mL (Tabela 3).
A partir da contagem de leucócitos obtivemos uma sensibilidade de 67,2%, especificidade de 89,2%, VPP de 48,9% e VPN de 94,6%, frente às uroculturas positivas.
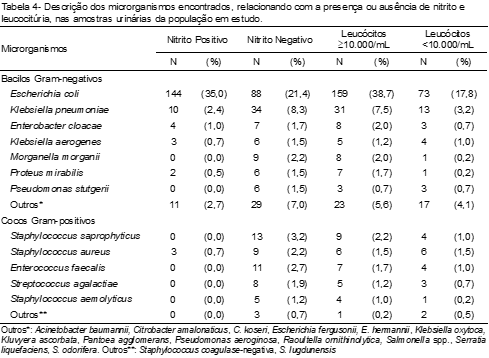
Ao relacionar as principais bactérias encontradas, com a conversão de nitrato a nitrito e a presença ou ausência de leucocitúria, foi observado que no grupo dos BGN, a E. coli apresentou 35,0% (144) de positividade para nitrito e 38,7% (159) para casos de leucocitúria.
Já em relação aos CGP, o S. aureus foi o único com a presença de nitrito em 0,7% (3) dos casos, e o S. saprophyticus apresentou leucocitúria em 2,2% (9) das amostras (Tabela 4).
DISCUSSÃO
Do total de 3.070 prontuários analisados, 13,4 % (411) foram positivos para ITU, sendo que, desses, 87,4% (359/411; IC 95%: 83,7-90,3) mostraram-se associados à presença de BGN, e 12,6% (52/411; IC 95%: 9,5-16,1) aos CGP. Um resultado semelhante ao nosso pode ser observado em um estudo realizado por Sato et al.,(9) em Maringá-PR, onde a frequência de ITU foi de 86,6% (388/448; IC 95%: 83,0-89,6) para BGN e de 13,4% (60/448; IC 95%: 10,5-16,9) para CGP, sendo que as amostras analisadas foram da primeira urina da manhã, através da técnica do jato médio de micção espontânea, semelhante à amostragem do nosso estudo.
Considerando o sexo dos pacientes, foi verificada uma maior frequência de ITU em mulheres (88,3%), corroborando com outros trabalhos já realizados.(5,7,9,14,17) Este fato deve-se à relação das características anatomofisiológicas do sexo feminino, por apresentarem proximidade do trato urinário com a região perianal e por possuírem uretra menor que a masculina, favorecendo a ascensão de enterobactérias para o interior da bexiga.(18)
Em relação ao agente etiológico da infecção, aquele com maior frequência foi a E. coli, representando 56,4% das amostras analisadas (IC 95%: 51,7-61,2), semelhante aos achados de Silveira et al.(5) (60,4%; IC 95%: 57,1-63,5), Sato et al.(9) (61,2%; IC 95%: 56,5-65,7), Huysal et al.(12) (72,1% IC 95%: 59,7-82,0) e Fonseca et al.(14) (47,5%; IC 95%: 35,3- 58,4). Essa alta prevalência se deve ao fato de que a E. coli extraintestinal possui alguns fatores de virulência, como as fímbrias do tipo 1 e P, que contribuem para sua melhor adesão nas células da uretra, podendo assim iniciar de maneira mais eficaz um quadro de infecção urinária.(18) Dentre outras enterobactérias, a Klebsiella pneumoniae foi a segunda com maior frequência (10,7%) de casos de ITU, dado semelhante ao de outros pesquisadores.(1,3,13,20) Estes microrganismos, juntamente com outras enterobactérias, são constituintes da microbiota intestinal, contribuindo na maior incidência de ITU.(19)
Em relação aos CGP isolados nas uroculturas positivas, o S. saprophyticus apresentou maior frequência (3,2%), tendo sido também relatado por Marques et al.,(10) em estudo realizado com pacientes atendidos em um pronto socorro, onde 3,0% das ITU foram causadas pelo mesmo agente bacteriano. CGP menos usuais em ITU, como S. aureus, E. faecalis, S. agalactiae, também foram identificados em menores proporções, assim como em outros estudos.(9,10,20)
O método de triagem para diagnóstico de ITU se utiliza do teste da tira reagente, onde se obtém de modo qualitativo e indireto a presença de bactérias redutoras de nitrato a nitrito.(9) As enterobactérias e outros BGN possuem a enzima nitrato redutase, que é capaz de realizar a redução de nitrato a nitrito, porém, segundo a literatura, apesar de ainda não estar bem estabelecido, CGP também podem realizar esta redução, no entanto, o S. saprophyticus não possui esta capacidade.(3,9) Assim, observamos a presença de nitrito em 43,1% (IC 95%: 38,3-48,0) dos casos de urocultura positiva, corroborando com os achados de Bortolotto et al.,(3) onde a positividade para nitrito na fita reagente foi de 32,4% (IC 95%: 26,7-38,6) das ITU na população estudada.
Em nosso estudo, observamos um maior número de casos de nitrito positivo nos BGN (42,3%), destacando-se a E. coli com um percentual de 35,0% de positividade. Em estudo realizado por Bortolotto et al.,(3) foi encontrado nitrito positivo para E. coli em 33,9% dos casos de ITU. No entanto, considerando esta positividade para os CGP, foi evidenciada uma taxa de 0,7% para nitrito, identificada apenas em cepas de S. aureus, fato esse observado também por Bortolotto et al.(3) e Sato et al.(9) Já os demais CGP não apresentaram positividade para nitrito, incluindo S. saprophyticus e S. agalactiae, que também foram isolados e identificados em outro estudo demonstrando o mesmo resultado.(9)
Quanto à contagem de leucócitos, essa se mostra sugestiva de ITU bacteriana quando acima de 10.000 leucócitos/mL.(14) Através da sedimentoscopia, 67,2% das uroculturas positivas apresentaram contagem superior à sugestiva para ITU e 32,8%, contagem inferior. Esta relação também foi encontrada por Fonseca et al.,(14) que constataram que 78% das uroculturas positivas apresentaram contagem superior a 10.000 leucócitos/mL. Apesar de não se encontrarem dados semelhantes na literatura em que se considera presença de ITU e contagem abaixo da taxa padronizada para leucócitos, é importante destacar a análise deste parâmetro como elemento utilizado para a triagem da infecção. Assim, foi verificada a presença dessas células em amostras onde houve a identificação de importantes agentes patogênicos frequentemente associados a ITU, como a E. coli (17,8%) e S. aureus (1,5%).
Sensibilidade é a proporção de verdadeiros positivos, ou seja, é a capacidade de detectar os verdadeiramente doentes em determinada população. Já especificidade é dada como a capacidade do teste em detectar os casos verdadeiramente negativos.(21) Foi observado em nosso estudo uma alta especificidade (99,9%) do nitrito em relação às urinoculturas positivas, corroborando com outros estudos.(3,10,12) O nitrito mostrou-se um indicador de baixa sensibilidade (43,1%), conforme observado por Bortolotto et al.(3) (32,4%), em estudo que também se baseou em amostras urinárias de jato médio e de micção espontânea. Uma possível explicação seria a necessidade de mais de quatro horas de retenção urinária para que a bactéria pudesse ser capaz de reduzir o nitrato a nitrito.(22)
A análise da contagem de leucócitos nos revelou maior especificidade (89,2%) do que sensibilidade (67,2%). Situação também encontrada por Huysal et al.,(12) que observaram uma especificidade de 91,1% e sensibilidade de 47,0%. Este fato pode ser justificado devido à possibilidade de leucocitúria sem bacteriúria, comum em infecções causadas por Trichomonas, leveduras ou mesmo em processos inflamatórios do tecido renal, como nefrite intersticial.(11)
Considerando a probabilidade do indivíduo estar realmente doente quando o resultado do teste é positivo (VPP) e a probabilidade de não estar doente quanto o resultado é negativo (VPN),(21) foi observado em nosso estudo que, em relação aos dados de nitrito e leucócitos, este valores foram de 99,4% e 48,9% para o VPP, e 91,9% e 94,6% para o VPN, respectivamente. Dados estes que corroboram o descrito por Marques et al.,(10) cujo resultado para VPP foi e 89,0% e 40,0%, e para VPN de 87,0% e 98,0%, respectivamente. Assim, é possível verificar a importância destes parâmetros para auxiliar no diagnóstico de ITU, como um elemento de triagem.
CONSIDERAÇÕES
De acordo com os dados, foi observada uma maior prevalência de ITU associada às enterobactérias, com destaque para a alta frequência de E. coli, um importante uropatógeno de origem intestinal. Além disso, o sexo feminino apresentou uma maior taxa de infecção, devido ao favorecimento da colonização e proliferação bacteriana associada às características anatomofisiológicas dessa população.
Embora tenha sido verificada uma alta especificidade, com elevado VPP e VPN para nitrito, a sensibilidade foi baixa, demonstrando assim que um grande número de bactérias não foi capaz de reduzir nitrato a nitrito.
Já a baixa sensibilidade apresentada pelos leucócitos deve-se ao fato de que a presença destas células na urina não é específica para ITU, mais sim um marcador de processo inflamatório ou mesmo de comprometimento renal. O VPP e o VPN mostraram que, se a contagem de leucócitos fosse um parâmetro utilizado de maneira isolada para determinar a positividade de ITU resultaria em grande número de falsos positivos e alguns falsos negativos, ressaltando-se assim a necessidade da realização da urocultura, independente da contagem leucocitária.
Este estudo mostrou que um resultado negativo para nitrito e contagem inferior a 10.000 leucócitos/mL não exclui um caso de ITU, evidenciando a importância de análise destes parâmetros juntamente com a urocultura e a clínica do paciente para um diagnóstico seguro dessa infecção.
Abstract
Objective: Urinary tract infection (UTI) is the most frequent in the population, and can affect individuals of all ages and sex, being more prevalent in females and predominantly caused by Gram-negative bacilli (BGN). The laboratory diagnosis is based on the physical examination of the elements and abnormal sediments (EAS), analysis of physical, chemical and microscopic aspects, including analysis of nitrite and leukocytes and urine culture, where it is possible to determine the pathogen associated with the infection. Thus, it is of great importance the correct diagnosis in view of the possibility of UTI presenting asymptomatic or symptomatically, even with the possibility of clinical evolution. To verify the frequency of UTI by bacteria in outpatients, relating to the results obtained for the presence of nitrite and leukocytes in the analyzed samples. Methods: This was a retrospective cross-sectional study, carried out from the outpatient data from PUC Goiás, obtained from January to December 2017, where the following variables were analyzed: age, sex, uroculture results, nitrite and leukocytes. Results: Of the 3,070 patients analyzed, 13.4% had UTI, and BGN were the main causative agents of the pathology, with a higher prevalence in the female sex. Escherichia coli was the most frequently found microorganism. Both nitrite and leukocyte data presented low sensitivity and high specificity in cases of positive uroculture. Conclusion: The results demonstrate the need to perform nitrite, leukocyte and uroculture research for the correct diagnosis of UTI.
Keywords
Prevalence; Urinary tract infections; Leukocytes
REFERÊNCIAS
- Guerra GVQL, Souza ASR, Costa BF, Nascimento FRQ, Amaral M A, Serafim ACP. Exame simples de urina no diagnóstico de infecção urinária em gestantes de alto risco. Rev Bras Ginecol e Obs. 2012;34(11):488-93.
- Ferreira RC, Barros CE, Braga AL. Profile of urinary infection associated with blood glucose rate amended. Rev. bras. anal. clin. 2016;48(4):346-51.
- Bortolotto LA, Indras DM, Silva CM, Peder LD. Presença de analitos químicos e microscópicos na urina e sua relação com infecção urinária. Saúde (Santa Maria). 2016;42(2):89-96.
- Silva JMP, Vasconcelos MM de A, Dias C dos S, Vasconcelos MA, Mendonça ACQ, Froes B, Oliveira EA. Current aspects in the diagnosis and approach to urinary tract infection. Rev Médica Minas Gerais. 2014;24(Supl 2):20-30.
- Silveira SA, Araújo MC, Fonseca FM, Okura MH, Oliveira ACS. Prevalência e suscetibilidade bacteriana em infecções do trato urinário de pacientes atendidos no hospital universitário de Uberaba. Rev. bras. anal. clin. 2010;42(3):157-60.
- Santana TCFS, Pereira EMM, Monteiro SG, Carmo MS, Turri RJG, Figueiredo PMS. Prevalência e resistência bacteriana de primeira escolha nas infecções do trato urinário no Município de São Luís-Ma. Rev Patol Trop. 2012;41(4):409-18.
- Dias IOV, Coelho ADM, Dorigon I. Infecção do trato urinário em pacientes ambulatoriais: prevalência e perfil de sensibilidade frente aos antimicrobianos no período de 2009 a 2012. Saúde (Santa Maria). 2015;41(1):209-218.
- Lo DS, Shieh HH, Ragazzi SLB, Koch VHK, Martinez MB, Gilio AE. Community acquired urinary tract infection: age and gender-dependent etiology. J Bras Nefrol. 2013;35(2):93-98.
- Sato AF, Svidzinski AE, Consolaro MEL, Boer CG. Nitrito urinário e infecção do trato urinário por cocos gram-positivos. J Bras Patol e Med Lab. 2005;41(6):397-404.
- Marques AG, Doi AM, Pasternak J, Damascena MDS, França CN, Martino MDV. Performance of the dipstick screening test as a predictor of negative urine culture. Einstein (Sao Paulo). 2017 Jan-Mar;15(1):34-39. [Article in English, Portuguese]
- Strasinger SK, Di Lorenzo MS. Análise Química da Urina. Urinálise e fluídos corporais. 5ª ed. São Paulo: LMP; 2009, p. 57-82.
- Huysal K, Budak YU, Ulusoy Karaca A, Aydos M, Kahvecioglu S, Bulut M, et al. Diagnostic accuracy of uriSed automated urine microscopic sediment analyzer and dipstick parameters in predicting urine culture test results. Biochem Medica. 2012;23(2): 211-17.
- Guyton AC, Hall JE. Resistência do Corpo à Infecção. Tratado de Fisiologia Médica. 11ª ed. Rio de Janeiro: Elsevier; 2006, p. 429-37.
- Fonseca FLA, Santos PM, Belardo TMG, Fonseca ALA, Caputto LZ, Alves BCA, et al. Análise de leucócitos em urina de pacientes com uroculturas positivas. Rev. bras. anal. clin. 2016;48 (3):258-61.
- Hackenhaar AA, Albernaz EP. Prevalência e fatores associados à internação hospitalar para tratamento da infecção do trato urinário durante a gestação. Rev Bras Ginecol Obs. 2013;35(5):199-204.
- Hachul M, Simonato NS, Filho PHG, Mendonça RR, De Oliveira SG. Infecção do trato urinário complicada. Rev Bras Med. 2015; 72(9):383-87.
- Soares LA, Nishi CYM, Wagner HL. Isolamento das bactérias causadoras de infecções urinárias e seu perfil de resistência aos antimicrobianos. Rev Bras Med Família e Comunidade. 2006;2 (6):84-92.
- Murray PR, Rosenthal KS, Pfaller MA. Enterobacteriaceae. Microbiologia Médica. 5ª ed. Rio de Janeiro: Elsevier; 2006, p. 315-330.
- Rodrigues FJB, Barroso APD. Etiologia e sensibilidade bacteriana em infeções do tracto urinário. Rev Port Saúde Pública. 2011; 29(2):123-131.
- Elias DBD, Ribeiro ACS. Perfil de sensibilidade antimicrobiana em urinoculturas de um hospital universitário do estado do Ceará no período de janeiro a junho de 2015. Rev. bras. anal. clin. 2017; 49(4): 381-9.
- Fletcher RH, Fletcher SW. Diagnóstico. Epidemiologia clínica. Elementos essenciais. 4ª ed. Porto Alegre: ARTMED, 2006. p. 60-72.
- Ferry SA, E Holm S, Ferry BM, Monsen TJ. High Diagnostic Accuracy of Nitrite Test Paired with Urine Sediment can Reduce
Unnecessary Antibiotic Therapy. Open Microbiol J. 2015;9:150-9.
Correspondência
Lara Cristina Alves de Oliveira
Pontifícia Universidade Católica de Goiás
Escola de Ciências Médicas, Farmacêuticas e Biomédicas
Avenida Universitária, 1440 – Setor Leste Universitário
74605010 – Goiânia-GO, Brasil
