Suscetibilidade a antifúngicos e fatores de virulência de Candida spp. isoladas em Russas, Ceará
Antifungal susceptibility and virulence factors of strains Candida spp. isolated in Russas, Ceará
Everardo Albuquerque Menezes1
Alana Cláudia Lima Barbosa2
Maria da Conceição dos Santos Oliveira Cunha1
Luana Guabiraba Mendes1
Francisco Afrânio Cunha1
1Laboratório de Microbiologia do Departamento de Análises Clínicas da Faculdade de Farmácia Odontologia e Enfermagem da Universidade Federal do Ceará – DACT/FFOE/UFC – Fortaleza, CE, Brasil.
2Laboratório da Prefeitura Municipal de Russas, CE, Brasil.
Artigo recebido em 24/05/2011
Artigo aprovado em 19/02/2016
Resumo
O objetivo desse estudo foi avaliar a suscetibilidade e os fatores de virulência de cepas de Candida spp. isoladas de amostras de urina de pacientes em Russas, Ceará, Brasil. As cepas foram semeadas em agar batata dextrose e incubadas a 37°C por 24/48 horas. Após esse período, as cepas foram inoculadas em meio cromogênico e incubadas a 37°C por 24/48 horas. Doze cepas de leveduras foram identificadas (Oito Candida albicans, duas Candida tropicalis, uma Candida glabrata, uma Candida parapsilosis). A produção de slime e de exoenzimas (proteinase, coagulase e fosfolipase) foram determinadas. O perfil de sensibilidade foi realizado pelo método de disco difusão em meio Mueller-Hinton agar modificado. Os discos continham: fluconazol (25 µg), itraconazol (30 µg) e anfotericina B(100 µg). As placas foram lidas após 24 horas. As zonas de inibição foram mensuradas e a interpretação foi realizada como descrita no protocolo do CLSI M44-A. C. albicans ATCC 10231, C. albicans ATCC 14053, C. parapsilosis ATCC 22019 foram incluídas no estudo. Foi observada uma elevada atividade de fosfolipase e coagulase, principalmente em cepas de C. albicans. Foi observada uma elevada proporção de cepas de C. albicans resistentes aos antifúngicos triazólicos. Todas as cepas foram sensíveis a anfotericina B. Candidúria era relativamente incomum e ignorada.
Palavras-chave
Candidúria; Fatores de virulência; Antifúngicos
Introdução
O termo candidúria, que não necessariamente envolve a presença de sinais e/ou sintomas de infecções urinárias, pode ser definido como o crescimento de Candida spp. em culturas de urina coletada por técnicas apropriadas. Trata-se de evento muito frequente entre pacientes expostos a fatores de riscos, sendo que até 20% de pacientes hospitalizados podem apresentar candidúria ao longo de sua internação, particularmente pacientes de unidade de terapia intensiva. Este achado laboratorial traz dilemas em relação à sua interpretação, visto que pode corresponder à simples contaminação da urina durante a coleta até candidúria assintomática, cistite ou pielonefrite, candidíase renal primária, bola fúngica ureteropélvica ou candidíase disseminada com manifestação renal.(1)
A incidência de fungos no trato urinário tem aumentado gradualmente e é um importante problema de saúde pública. Cerca de 10% a 15% de infecções urinárias são devidas à Candida spp.(2,3)
A capacidade patogênica das Candida spp. está relacionada a uma combinação de fatores que contribuem para a sua virulência, destacando-se a produção de enzimas extracelulares. Diversas enzimas hidrolíticas, que auxiliam no processo de invasão tecidual, são produzidas por Candida spp. Dentre essas, as principais são proteinase, fosfolipase, hialuronidase, coagulase e condroitina sulfatase.(4-6)
Antifúngicos existem em número limitado e muitos atuam na síntese do ergosterol, o principal esterol presente nas membranas fúngicas. Essas substâncias podem ainda agir em constituintes da parede celular de fungos. Agindo sobre a membrana celular, os derivados poliênicos se ligam ao ergosterol, provocando a formação de canais que ocasionam a morte da célula. Poliênicos têm sido empregados há mais de 50 anos, mas sua utilização é limitada devido à sua elevada toxicidade.(7)
Os antifúngicos azólicos, que também atuam sobre o ergosterol da membrana celular, são os mais utilizados e foram desenvolvidos acerca de duas décadas. Estes são compostos heterocíclicos que inibem a enzima fúngica lanosterol 14a-demetilase, que catalisa um passo tardio da síntese do ergosterol. Essa inibição depleta o conteúdo de ergosterol das membranas e resulta em acumulação de esteróis intermediários tóxicos que inibem o crescimento fúngico.(7-9)
O objetivo desse trabalho foi avaliar a sensibilidade de cepas de Candida spp. isoladas de urina de pacientes atendidos no Laboratório de Análises Clínicas da Prefeitura Municipal de Russas, município localizado no interior do estado do Ceará.
MATERIAL E MÉTODOS
Origem das amostras
Foram incluídas no estudo 12 amostras de Candida spp. provenientes de pacientes com candidúria atendidos no Laboratório de Análises Clínicas no município de Russas durante o período de janeiro de 2008 a dezembro de 2008. Os pacientes que apresentavam Candida spp. na urina, observadas na realização do sumário de urina, tinham a urina semeada em agar batata dextrose (ABD) com antibióticos e cicloheximida. As cepas foram incubadas a 35ºC por 24/48 horas e, após o crescimento, foram guardadas na geladeira em temperatura de 2º a 8ºC, até o momento do transporte para o Laboratório de Microbiologia da Universidade Federal do Ceará, na cidade de Fortaleza.
Identificação das amostras
As cepas foras semeadas em meio cromógeno agar Hicrome Candida® e incubadas a 35ºC, por 24/48 horas. Esse meio cromógeno identifica as cepas de leveduras de acordo com a cor produzida, a saber, verde: Candida albicans; azul: Candida tropicalis; rosa: Candida krusei; violeta: Candida glabrata; branca a rósea: outras espécies, incluindo Candida parapsilosis. A confirmação das identificações das cepas foi realizada com o teste do microcultivo em agar arroz com tween 80.(10)
Avaliação dos fatores de virulência
Proteinase e fosfolipase: A determinação da proteinase e fosfolipase foi realizada segundo a metodologia descrita por Price et al.(11) e Rüchel et al.,(12) e as leituras realizadas após cinco dias. A presença da atividade da proteinase foi verificada pela formação de um halo transparente e de fosfolipase pela formação de um halo opaco ao redor da colônia. A atividade enzimática de ambas as enzimas foi medida, e foi calculado o PZ (zona de precipitação). Quando o PZ=1,0 (não apresentava enzimática), 0,63 <PZ<1,0 (atividade enzimática moderada) e PZ<0,63 (forte atividade enzimática).(11,12)
Coagulase: Candida spp. tem a habilidade de produzir coagulase e pode ser um importante fator de virulência. Em um tubo foram colocados 500 µL de plasma humano e 100 µL de uma suspensão de leveduras 0,5 na escala de MacFarland. As cepas foram incubadas a 35°C por quatro horas. Após esse período, a formação de coágulos foi avaliada. Se coágulos não eram observados, nova incubação era procedida, por até 24 horas.(13)
Slime: O slime é um polímero de carboidrato secretado por cepas de Candida spp. que ajuda a fixação em próteses e cateteres, semelhante a um biofilme. Cada cepa foi semeada em placa de agar infusão de cérebro-coração (BHIA) suplementado com 5% de glicose e vermelho do congo. As placas foram incubadas a 35°C por 24 horas e, após a incubação, as colônias positivas para produção de slime apresentaram coloração negro-brilhante.(14)
Teste de sensibilidade a antifúngicos
A sensibilidade das cepas de Candida spp. isoladas de pacientes com candidúria foi avaliada pelo método de disco difusão em agar Mueller-Hinton suplementado com 2% glicose e 0,5 µg/mL de azul de metileno (AMHGAM). Os discos de antifúngicos testados foram: anfotericina B (100 µg), fluconazol (25 µg) e itraconazol (30 µg). As cepas foram inoculadas em meio AMHGAM e incubadas a 35ºC por 24 horas. Decorrido esse período, os halos foram medidos e as cepas foram classificadas de acordo com seu perfil de sensibilidade em sensível (S), sensível dose-dependente (SDD) e resistente (R), de acordo com o protocolo M44-A2 do CLSI.(15,16) Em todas as fases do experimento, foram utilizadas, como controle, as cepas C. albicans ATCC- 14053, C. albicans ATCC-10231 e C. parapsilosis ATCC 22019. Os testes foram realizados em triplicata.
RESULTADOS
Cepas de C. albicans são as mais comumente isoladas de amostras de urina, no entanto, outras cepas de Candida spp. começam a ser isoladas desse sítio anatômico. No presente estudo, foram isoladas 12 cepas de Candida spp. A distribuição das cepas encontradas pode ser visualizada na Figura 1.
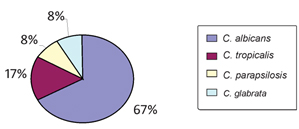
Figura 1. Identificação das cepas de Candida spp. isoladas de amostras de urina no município de Russas, Ceará.
Nos últimos anos, diferentes meios cromógenos de cultura com capacidade de diferenciar C. albicans e outras leveduras de interesse clínico têm sido comercializados. Esses meios têm como fundamento a alteração na cor desenvolvida pelas colônias através de indicadores de pH e fermentação de compostos específicos ou substratos cromógenos.(17-19)
Foram avaliados diversos fatores de virulência: proteinase, fosfolipase, coagulase e produção de slime.
Na Figura 2 são destacados os halos de precipitação em torno da colônia de Candida spp. Algumas espécies de Candida spp. não apresentam halo. A espécie de C. parapsilosis não produz fosfolipase. Das cepas de C. albicans, sete (87,5%) produziram fosfolipase com a atividade entre moderada e forte. O valor de PZ variou entre 0,63 £ PZ £ 0,88. As cepas nas condições experimentais utilizadas não apresentaram atividade proteolítica.
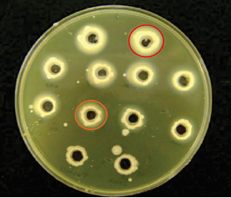
Figura 2. Teste de Fosfolipase de cepas Candida spp. isoladas de urina no município de Russas, Ceará.
Cepas de Candida spp. podem produzir coagulase responsável pela coagulação do plasma in vitro e in vivo. Setenta e cinco por cento das cepas produziram coagulase. Outro fator de virulência importante é o slime. Somente uma cepa de C. albicans produziu esse elemento.
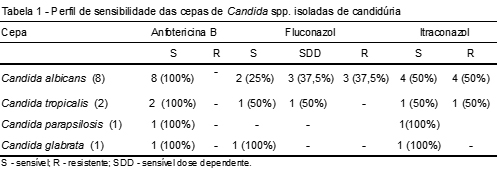
A sensibilidade de cepas de Candida spp. é importante para o acompanhamento da resistência aos antifúngicos. O perfil de sensibilidade é mostrado na Tabela 1.
Em populações que não estão expostas a fatores de risco, em indivíduos sadios e assintomáticos, a candidúria é um achado raro, podendo ser uma simples contaminação da amostra. Alguns autores sugerem que existe maior relação entre candidúria e infecção urinária quando a contagem de colônias na urina atinge valores na ordem de 103 a 104 UFC/mL.(1)
Pfaller et al.(20) avaliaram 140.767 isolados clínicos de leveduras provenientes de 127 centros médicos distribuídos entre Ásia (23), América Latina (16), Europa (74), América do Norte (12) e Oriente Médio (2).
Esses isolados foram obtidos de diferentes materiais biológicos como sangue, trato genital, trato gastrointestinal e trato respiratório, no período de janeiro de 1997 a dezembro de 2003. Mais de 16 espécies diferentes de Candida foram isoladas, sendo que C. albicans foi a espécie mais frequente (66,2%). Uma diminuição no número de isolados de C. albicans foi observada no decorrer dos sete anos de estudo, variando de 10% a 11%. Em contraste, durante este mesmo período, observou-se um aumento no número de isolados de C. tropicalis e C. parapsilosis da ordem de 2,9% e 3,1%, respectivamente. No presente trabalho foram identificados 67% de cepas de C. albicans, sendo esta a espécie mais isolada (Figura 1).
Em um estudo com cem amostras de leveduras isoladas de urina, provenientes de Hospital Público Infantil de São Paulo Brasil, no período de 1999-2004, a espécie mais prevalente foi C. albicans, seguida de C. tropicalis, C. glabrata e C. parapsilosis.(21) A segunda levedura mais isolada neste estudo foi a C. tropicalis (Figura 1).
Nos EUA, em outro estudo com um total de 67 Candida spp. isoladas de urina, foi observada a seguinte distribuição: C. albicans (54%), C. glabrata (36%) e C. tropicalis (10%).(22)
A identificação de leveduras é realizada pela utilização de meios que avaliam fermentação, assimilação de carboidratos. Esses testes são laboriosos, demandam tempo e podem apresentar resultados incertos. Os kits comerciais de identificação são caros e tornam-se de difícil aquisição para laboratórios de microbiologia de pequeno e médio porte no Brasil, ficando a identificação de leveduras das espécies a cargo de laboratórios de microbiologia de referência. Os laboratórios de microbiologia de pequeno porte realizam apenas o isolamento primário e a coloração de Gram, ou seja, técnicas que não permitem a identificação das espécies. Neste sentido, a utilização de meios seletivos e diferenciais para o isolamento de Candida spp. tem se tornado comum, nos últimos anos, em laboratórios menores. O CHROMagar Candida é um meio seletivo para o isolamento de leveduras que facilita a diferenciação e a identificação das principais espécies de Candida. As leveduras produzem enzimas que reagem com substratos cromógenos, produzindo colônias de diferentes cores. Essas enzimas são específicas e algumas leveduras podem ser identificadas em nível de espécie a partir da coloração que apresentam. Colônias de C. albicans e C. dubliniensis produzem colônias verde claro e verde escuro, respectivamente. As colônias de C. tropicalis aparecem azul metálico, colônias de C. krusei aparecem rosa claro. Outras leveduras aparecem creme ou desenvolvem um pigmento roxo.(23) Esses meios cromógenos têm demonstrado eficiência na identificação de cepas de C. albicans, C. krusei e C. tropicalis em vários estudos, sendo que a identificação da C. glabrata continua controversa.(24,25) No presente estudo foi possível a identificação, e a confirmação ocorreu com a micromorfologia.
Araújo et al.(26) observaram, em seu estudo, que o meio cromógeno se mostra útil na detecção de leveduras em material clínico que contenha cultura mista de Candida, cuja característica de crescimento em agar de Sabouraud dextrose não permite esta diferenciação. Os autores concluíram que a utilização desse meio contribui para um diagnóstico rápido das infecções causadas por leveduras do gênero Candida, favorecendo a aplicação de uma terapia antifúngica precoce e adequada.
Entre as enzimas mais importantes secretadas pela C. albicans tem-se a fosfolipase, que degrada fosfolipídios da membrana das células; a proteinase, que pode degradar anticorpos dentre outros substratos proteicos. Em relação à ação fosfolipásica, foi verificado, em estudo realizado por Menezes et al.,(5) com cepas de C. albicans isoladas de candidíase mamária, que 45,4% apresentaram atividade enzimática moderada (entre 0,64 e 0,99), e 54,6%, uma elevada atividade enzimática (PZ menor do que 0,63). As amostras não apresentaram ação da enzima proteinase. No presente trabalho, as cepas apresentaram atividade fosfolipásica e não apresentaram atividade proteolítica. A atividade enzimática de C. albicans isoladas da mucosa bucal de crianças foi avaliado por Menezes et al.(6) Foram observadas que seis (20%) cepas apresentaram PZ positiva para proteinase e dez (33%) mostraram positividade para fosfopalipase.(6)
A produção de slime e coagulase pode ser fator de virulência importante na determinação da patogenicidade de Candida. A produção de slime entre as cepas aqui estudadas foi muito pequena, apenas uma cepa foi slime-positivo. No entanto, 75% das cepas produziram coagulase.
O uso de discos de fluconazol é um método adequado para triagem e detecção de leveduras resistentes a esse antifúngico. O teste apresenta boa reprodutibilidade quando lido após 24 horas (95%).(27) Na presente análise, todos os halos foram medidos após 24 horas. O teste se mostrou de fácil execução e interpretação.
A partir dos estudos de Barry et al.,(28) foi demonstrado que o teste de disco-difusão com discos de fluconazol pode ser maximizado pelo uso de agar Mueller-Hinton com glicose e azul de metileno com incubação restrita de 24 horas. De acordo com esses autores, somente 1% das cepas não cresceram adequadamente em 24 horas. Houve boa concordância entre o método de referência microdiluição em caldo e o teste de disco difusão.
Um total de 2.949 de Candida spp. foi testado pelo método de disco difusão e pelo método de referência microdiluição em caldo. Foram obtidos concordância de 92,8% entre os métodos. O teste de disco-difusão foi adequado para detectar cepas de Candida spp. resistentes aos antifúngicos.(29) Na presente avaliação, os testes foram lidos com 24 horas e demonstraram ser reprodutíveis e de fácil execução.
Todas as cepas estudadas neste trabalho foram sensíveis à anfotericina B. Ocorreu uma elevada resistência ao fluconazol (37,5%) e ao itraconazol (50%) entre as cepas de C. albicans isoladas de amostras de urina. Foram encontradas 37,5% das cepas de C. albicans sensível dose dependente (SDD) – Tabela 1. A resistência aos antifúngicos azólicos foi mais elevada do que normalmente relatado na literatura.(1,30)
Conclusão
A partir deste estudo, realizado na cidade de Russas, Ceará, é possível concluir que:
(1) Foram isoladas em candidúria, em Russas, as seguintes leveduras: C. albicans, C. tropicalis, C. glabrata e C. parapsilosis;
(2) Foi observada uma elevada atividade de fosfolipase e coagulase, principalmente em cepas de C. albicans;
(3) Foi observada uma elevada proporção de cepas de C. albicans resistentes aos antifúngicos triazólicos;
(4) Todas as cepas foram sensíveis a anfotericina B.
Agradecimentos
Ao CNPQ pelo financiamento do projeto.
Abstract
The purpose of this study was to evaluate the susceptibility and virulence factors of strains Candida spp. isolated of urine in Russas, Ceará-Brazil. The strains were streaked onto Potato glucose agar plates at 37°C for 24/48 hours. After this period, the strains were streaked onto chromogenic media agar plates and incubated at 37°C for 24/48 hours. Twelve yeasts isolates have been evaluated (Eight Candida albicans, two Candida tropicalis, one Candida glabrata, one Candida parapsilosis). Slime and exoenzymes (proteinase, coagulase, and phospholipase) production tests and determination of their levels were performed. Susceptibility testing was evaluated in medium Mueller-Hinton agar modified was used disk diffusion testing. Paper disks containing: fluconazole (25 µg), itraconazole (30 µg) and amphotericin B (100 µg) were used. Plates were read after 24 hours. Zones of inhibition were read and interpretation of zone diameters was as described in CLSI M44-A. The following reference strains were also included in the studies: C. albicans ATCC 10231, C. albicans ATCC 14053, C. parapsilosis ATCC 22019. A higher phospholipase and coagulase activity was also observed for C. albicans. A relatively higher proportion of triazole-resistant isolates was obtained from Candida spp. isolated of urine in Russas. All strains were susceptible to amphotericin B. Candiduria was previously uncommon and largely ignored.
Keywords
Candiduria; Virulence factors; Antifungal agents
Referências
- 1. Colombo AL, Guimaraes T. Epidemiology of hematogenous infections due to Candida spp. Rev Soc Bras Med Trop. 2003;36(5):599-607.
- Alvarez-Lerma F, Nolla-Salas J, León C, Palomar M, Jordá R, Carrasco N, Bobillo F; EPCAN Study Group. Candiduria in critically ill patients admitted to intensive care medical units. Intensive Care Med. 2003 Jul;29(7):1069-76.
- Weinberger M, Sweet S, Leibovici L, Pitlik SD, Samra Z. Correlation between candiduria and departmental antibiotic use. J Hosp Infect. 2003 Mar;53(3):183-6.
- Ashman RB, Papadimitriou JM Production and function of cytokines in natural and acquired immunity to Candida albicans infection. Microbiol Rev. 1995 Dec;59(4):646-72.
- Menezes EA, et al. Candida ssp. isolation in the breast feeding mothers’ nipples from the human milk bank at the Universidade Federal do Ceará and susceptibilities to the antifungal agents tests. J Bras Patol Med Lab. 2004;40(5):299-305.
- Menezes EA, et al. Frequência e atividade enzimática de Candida albicans isoladas da mucosa bucal de crianças de uma creche da prefeitura de Fortaleza. J Bras Patol Med Lab. 2005;41(1):9-13.
- Cowen LE, Steinbach WJ. Stress, drugs, and evolution: the role of cellular signaling in fungal drug resistance. Eukaryot Cell. 2008 May;7(5):747-64.
- Atkins RA. An update on antifungal targets and mechanisms of resistance in Candida albicans. Med Mycol. 2005 Jun;43(4):285-318.
- Canon RD, Lamping E, Holmes AR, Niimi K, Tanabe K, Niimi M, Monk BC. Candida albicans drug resistance another way to cope with stress. Microbiology. 2007 Oct;153(Pt 10):3211-7.
- Lacaz CS, Porto E, Martins JEC, Heinz-Vaccari EM, Melo NT. Tratado de Micologia Médica. Lacaz. 9a edição, São Paulo, SP: Sarvier. 2002.
- Price MF, Wilkinson ID, Gentry LO. Plate method for detection of phospholipase activity in Candida albicans. Sabouraudia. 1982 Mar;20(1):7-14.
- Rüchel R, Tegeler R, Trost M. A comparison of secretory proteinases from different strains of Candida albicans. Sabouraudia. 1982 Sep;20(3):233-44.
- Rodrigues AG, Pina-Vaz C, Costa-De-Oliveira S, Tavares C. Expression of plasma coagulase among pathogenic Candida species. J Clin Microbiol. 2003 Dec;41(12):5792-3.
- Gündogan N, Citak S, Turan E. Slime production, DNAse activity and antibiotic resistance of Staphylococcus aureus isolated from raw milk, pasteurized milk and ice cream samples. Food Control. 2006;17:389-92.
- Clinical and Laboratory Standards Institute (CLSI). Methods for antifungal disk diffusion susceptibility testing of yeasts; approved standard M44-A2. Clinical and Laboratory Standards Institute, Wayne, PA, 2009.
- Espinel-Ingroff A, et al. Standardized disk diffusion method for yeasts. Clin Microbiol. Newsletter. 2007;29: 97-100.
- Carrillo-Muñoz AJ, Quindós G, Cárdenes CD, Alonso-Vargas R, Arévalo P, Brió S, Madariaga L. Evaluation of Chromalbicans Agar for presumptive identification of Candida albicans. Rev Iberoam Micol. 2001 Sep;18(3):105-8. [Article in Spanish].
- Foongladda S, Haouharn P, Sakulmaiwatana P, Chaiprasert A. Comparative evalution of Candi Select test and conventional methods for identification of Candida albicans in routine clinical isolates. Mycoses. 2002 Apr;45(3-4):75-8.
- Fotedar R, al-Hedaithy SS. Identification of chlamydospore-negative Candida albicans using CHROMagar Candida medium. Mycoses. 2003 Apr;46(3-4):96-103.
- Pfaller MA, Diekema DJ, Rinaldi MG, Barnes R, Hu B, Veselov AV, et al. Results from the Artemis Disk Global Antifungal Surveillance Study: a 6.5-year analysis of susceptibilities of Candida and other yeast species to fluconazole and voriconazole by standardized disk diffusion testing. J Clin Microbiol. 2005; 43(12): 5848-59.
- Silva V, Diaz MC, Febré N; Chilean Invasive Fungal Infections Group. Invasive fungal infections in Chile: a multicenter study of fungal prevalence and susceptibility during a 1-year period. Med Mycol. 2004 Aug;42(4):333-9.
- Jain N, Kohli R, Cook E, Gialanella P, Changt, Fries BC. Biofilm formation by and antifungal susceptibility of Candida isolates from urine. Appl Environ Microbiol. 2007 Mar;73(6):1697-703.
- Odds FC, Bernaerts R. CHROMagar Candida, a new differential isolation medium for presumptive identification of clinically important Candida species. J Clin Microbiol. 1994 Aug;32 (8): 1923-9.
- Hospenthal DR, Murray CK, Beckius ML, Green JA, Dooley DP. Persistence of pigment production by yeast isolates grown on CHROMagar Candida medium. J Clin Microbiol. 2002 Dec;40(12): 4768-70.
- Huang LU, Chen CH, Chou CF, Lu JJ, Chi WM, Lee WH. A comparison of methods for yeast identification including CHROMagar Candida, Vitek system YBC and a traditional biochemical method. Zhonghua Yi Xue Za Zhi (Taipei). 2001 Oct;64(10):568-74.
- Araújo CR, Miranda KC, Passos XS, Souza LKH, Lemos JA, Khrais Cha, et al. Identificação das leveduras do gênero Candida por métodos manuais convencionais e pelo método cromógeno chromagar candida. Rev Patol Trop. 2005; 34:37-42.
- Kirkpatrick WR, Turner TM, Fothergill AW, McCarthy DI, Redding SW, Rinaldi MG, Patterson TF. Fluconazole disk diffusion susceptibility testing of Candida species. J Clin Microbiol. 1998 Nov;36(11):3429-32.
- Barry AL, Pfaller MA, Rennie RP, Fuchs PC, Brown SD. Precision and accuracy of fluconazole susceptibility testing by broth microdilution, Etest, and disk diffusion methods. Antimicrob Agents Chemother. 2002 Jun;46(6):1781-4.
- Pfaller MA, Hazen KC, Messer SA, Boyken L, Tendolkar S, Hollis RJ, Diekema DJ. Comparison of results of fluconazole disk diffusion testing for Candida species with results from a central reference laboratory in the ARTEMIS global antifungal surveillance program. J Clin Microbiol. 2004 Aug;42(8):3607-12.
- Girmenia C, Tuccinardi C, Santilli S, Mondello F, Monaco M, Cassone A, Martino P. In vitro activity of fluconazole and voriconazole against isolates of Candida albicans from patients with haematological malignancies. J Antimicrob Chemother. 2000 Sep;46(3):479-83.
Correspondência
Everardo Albuquerque Menezes
Rua Capitão Francisco Pedro 1210 – Rodolfo Teófilo
60430-370 – Fortaleza, CE, Brasil
