Teste de sensibilidade de Candida albicans pelo método de disco-difusão: uma comparação de meios de cultura
Susceptibility testing of Candida albicans by disk diffusion method:
A comparison of culture media
Ana Cláudia Nascimento Silva1
Antônio Alexandre de Vasconcelos Júnior1
Francisco Afrânio Cunha2
Maria da Conceição dos Santos Oliveira Cunha3
Everardo Albuquerque Menezes4
1Farmacêutica (o). Universidade Federal do Ceará – UFC – Fortaleza, CE, Brasil.
2MsC/Universidade Federal do Ceará – UFC – Fortaleza, CE, Brasil.
3Bolsista PIBIC/Universidade Federal do Ceará – UFC – Fortaleza, CE, Brasil.
4PhD/ Professor Universitário. Universidade Federal do Ceará – UFC – Fortaleza, CE, Brasil.
Instituição: Departamento de Análises Clínicas e Toxicológicas do Curso de Farmácia/Universidade Federal do Ceará – Fortaleza, CE, Brasil.
Suporte financeiro: CNPq/FUNCAP
Artigo recebido em 16/09/2013
Artigo aprovado em 29/01/2016
DOI: 10.21877/2448-3877.201600209
Resumo
Objetivo: O objetivo desse estudo foi comparar o agar Mueller-Hinton utilizado no teste de sensibilidade a antifúngicos pelo método de disco-difusão suplementado com glicose a 2% e 0,5 mg/mL de azul de metileno (Protocolo M44-A) e sem suplementação. Métodos: Foram utilizados discos de cetoconazol, fluconazol, anfotericina B e nistatina frente a vinte cepas de Candida albicans. As cepas pertencem a uma coleção do Laboratório de Microbiologia de Leveduras do Departamento de Análises Clínicas e Toxicológicas da Faculdade de Farmácia da Universidade Federal do Ceará. Foram feitos o isolamento, purificação, identificação presuntiva e a confirmação da identificação das cepas. Os discos com antifúngicos foram testados nos dois meios de cultura. Resultados: Todas as cepas de C. albicans apresentaram sensibilidade aos antifúngicos testados. Conclusão: A leitura e a visualização do diâmetro dos halos formados pelos discos de antifúngicos utilizados no meio sem suplementação não foram tão simples, pois os halos não ficaram bem definidos, demandando mais tempo para sua adequada determinação.
Palavras-chave
Candida; Testes de susceptibilidade; Disco-difusão; Antifúngicos
INTRODUÇÃO
Os fungos são organismos eucariontes que possuem suas paredes celulares formadas por quitina e/ou celulose, sendo desprovidos de clorofila. Podem ser unicelulares ou multicelulares. Necessitam de uma fonte contínua de água, oxigênio, material orgânico e uma temperatura adequada para o seu crescimento e desenvolvimento.(1)
Esses microrganismos assumem um papel de extrema importância na decomposição aeróbia; certos fungos são usados na produção de alimentos e bebidas e também importantes substâncias farmacológicas foram derivadas a partir de fungos. O melhor exemplo é a penicilina, isolada a partir de Penicillium notatum (agora Penicillium chrysogenum) por Fleming, e posteriormente purificado, para utilização médica, por Florey e Chain.(2)
Vários estudos sugerem que a distribuição de fungos no ar, em termos quantitativos e qualitativos, varia entre áreas geográficas, e também é influenciada por fatores ambientais, sazonais e fatores climáticos, tais como temperatura, umidade do ar, hora do dia, velocidade e direção do vento, presença de atividade humana e tipo de ventilação em ambientes fechados.(3)
Candida albicans é um fungo dimórfico, que se apresenta sob formas leveduriformes (blastoconídios) no estado saprofítico, estando associado à colonização assintomática, ou como formas filamentosas (pseudo-hifas e hifas verdadeiras), observadas em processos patogênicos. Além disso, sob condições de crescimento subótimas, nesse fungo pode ocorrer a formação de clamidósporos (esporos arredondados que possuem uma espessa parede celular). Dessa forma, o fungo tem a capacidade de se adaptar a diferentes nichos biológicos. As leveduras do gênero Candida, em particular a C. albicans, são patógenos oportunistas frequentemente isolados das superfícies mucosas de indivíduos.(4,5)
Os testes de susceptibilidade a drogas antifúngicas vêm se tornando cada vez mais importantes, devido ao aumento das infecções fúngicas e à emergência da resistência a essas drogas. Observa-se nos últimos anos uma mudança no espectro das etiologias das candidemias, atribuída principalmente ao aumento de hospedeiros imunocomprometidos e ao longo uso de terapias antifúngicas profilática e empírica, acompanhada da emergência de espécies não albicans com menor sensibilidade ou, até mesmo, resistência a agentes antifúngicos.(5)
O Clinical Laboratory Standard Institute – CLSI elaborou, em 2006, um protocolo classificado como M27-A2, no qual estão descritos os intervalos e pontos de cortes dos antifúngicos utilizados no tratamento de infecções fúngicas sistêmicas (IFSs) causadas por Candida spp. e Cryptococcus spp. Após esse primeiro documento foram criadas diversas metodologias para avaliar a sensibilidade de Candida spp. a drogas antifúngicas.(6-8)
A evolução da resistência fúngica pode ser avaliada pelo teste de susceptibilidade a antifúngicos. Diversos protocolos existem, no entanto os mais utilizados são a microdiluição em caldo (MDC), disco-difusão (DD) e E-test. Geralmente, a MDC é um teste trabalhoso e que não é realizado, pois exige pessoal treinado, e o E-test é caro para ser aplicado na rotina laboratorial.(9,10) A alternativa é o DD, pois é uma técnica simples, barata e reprodutível, que pode ser utilizada em laboratórios clínicos.(5,11)
A metodologia de disco-difusão em agar para a avaliação da sensibilidade de cepas de Candida spp. fornece um resultado quantitativo (halo de inibição) e um resultado qualitativo (sensível ou resistente). Teste de disco-difusão em agar utilizando disco de antifúngico é um método simples, flexível, barato, de fácil execução e representa uma alternativa à metodologia de referência, que é cara e trabalhosa, sendo raramente utilizada em laboratórios clínicos de pequeno porte.(12)
MATERIAL E MÉTODOS
Microrganismos
Foram utilizadas vinte cepas de Candida albicans pertencentes ao banco de leveduras do Laboratório de Microbiologia de Leveduras da Universidade Federal do Ceará. Essas leveduras foram isoladas de amostras de clínicas, principalmente sangue, urina e lavado bronco alveolar.
Isolamento e pureza das cepas
As cepas em estoque foram descongeladas e semeadas em agar batata dextrose e incubadas a 37ºC por 24/48 horas. Após o crescimento foram inoculadas em agar sabouraud dextrose e incubadas a 37ºC por 24/48 horas para garantir a pureza das cepas.(5,11,13)
Identificação presuntiva e confirmação da identificação
As cepas foram semeadas em meio Chromo agar (Himédia – Índia) e incubadas a 35ºC por 24/48 horas, conforme instruções do fabricante e, após o período, verificou-se o crescimento das cepas. O meio cromógeno diminui o tempo de identificação de Candida albicans. A confirmação das identificações foi realizada com o teste do microcultivo em agar arroz com tween 80, onde se observou a micromorfologia característica.(5)
Antifúngicos testados
Foram testados os antifúngicos anfotericina B, nistatina, cetoconazol e fluconazol (Cecon – Brasil). Os discos continham antifúngicos nas seguintes concentrações: anfotericina B 100 mg, nistatina 100 UI, cetoconazol 50 mg e fluconazol 25 mg.
Preparação dos meios
Os meios foram preparados de duas maneiras: meio Mueller-Hinton agar suplementado com 2% de glicose e 0,5 mg/mL de azul de metileno, de acordo com o protocolo M44-A, e meio Mueller-Hinton agar sem a adição de glicose e sem azul de metileno. A confecção dos meios se deu da seguinte forma: foram pesadas as quantidades adequadas de Mueller-Hinton agar e de glicose, sendo posteriormente dissolvidos em um volume de 250 mL de água destilada, utilizando-se um Erlenmeyer para a preparação do meio. Depois, o Erlenmeyer, contendo a solução, foi aquecido até que o meio ficasse límpido. O meio então foi autoclavado e, antes de ser vertido nas placas de Petri devidamente esterilizadas, foi adicionado o azul de metileno. Aguardou-se a solidificação do meio nas placas para poderem ser utilizadas.(6) Para a confecção do meio Mueller-Hinton sem glicose e azul de metileno foi desenvolvido o mesmo procedimento operacional, sendo que a diferença está na ausência da glicose e do azul de metileno na elaboração do meio.
Antifungigrama pelo método de disco-difusão
O teste de disco-difusão foi realizado em meio Mueller-Hinton Agar suplementado com glicose a 2% e azul de metileno 0,5 mg/mL assim como em meio Mueller-Hinton sem adição de glicose e azul de metileno. Todas as cepas testadas tiveram um cultivo recente realizado em agar batata dextrose. As placas foram incubadas em estufas a 35ºC por 24 horas. No dia do teste, o inóculo foi preparado usando-se colônias de aproximadamente 1,0 mm de diâmetro para cada cepa, que foram suspensas em 4,0 mL de solução salina esterilizada. A turbidez da suspensão foi ajustada para 0,5 da escala de McFarland. As cepas foram inoculadas nas placas contendo meio e depois foram adicionados os discos de antifúngicos. As placas foram lidas visualmente após um período de incubação de 24 horas a 35ºC e foram medidos os halos formados em torno dos discos de antifúngicos e expressos em milímetros.(11,12)
Após a leitura e mensuração dos halos, em milímetros, os resultados foram comparados com a tabela fornecida pelo fabricante (Cecon). Para anfotericina B, halo > 10 mm (Sensível) e <10 mm (Resistente); nistatina, halo >10 mm (Sensível) e £10 mm (Resistente); cetoconazol, halo > 20 mm (Sensível), halo 10-20 mm (Intermediário), halo <10 mm (Resistente) e fluconazol, halo > 19 mm (Sensível), halo 14-19 mm (Intermediário) e < 14 mm (Resistente).
Todas as amostras foram guardadas sob responsabilidade do Laboratório de Microbiologia de Leveduras da Universidade Federal do Ceará.
RESULTADOS
Neste estudo foram utilizadas vinte cepas de C. albicans; as leveduras foram isoladas e identificadas em meio cromógeno e o resultado da identificação pode ser observado na Figura 1.
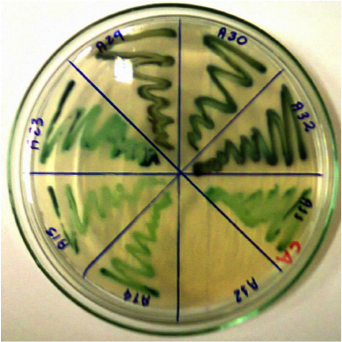
Figura 1. Candida albicans – em meio cromógeno – cepas com coloração verde.
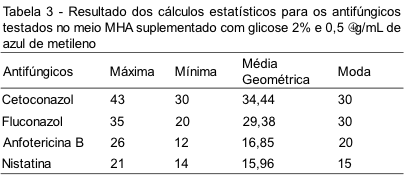
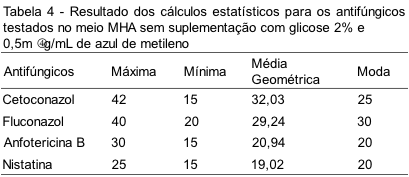
Foi realizada análise estatística e calculadas as seguintes variáveis: Média Geométrica, Intervalo, Máximo, Mínimo e Moda utilizando-se como ferramenta para os cálculos o programa Excel Microsoft® 2010.
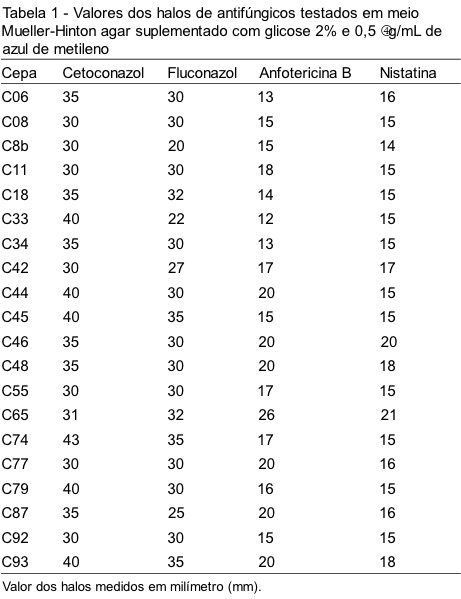
Na Tabela 1 são mostrados os halos em milímetros obtidos no Mueller-Hinton suplementado com azul de metileno e glicose.
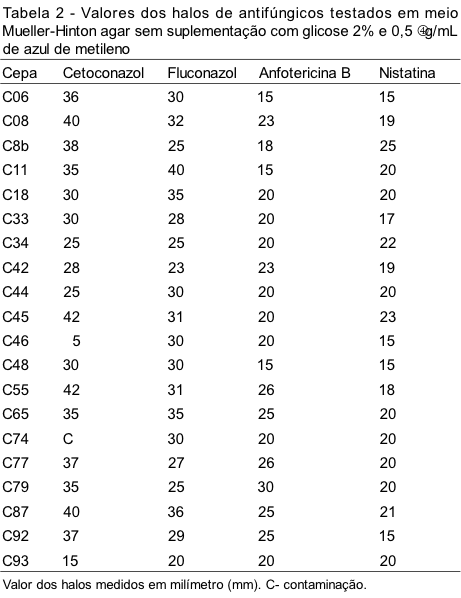
Na Tabela 2 são mostrados os halos obtidos em meio no qual não ocorreu a suplementação, é apenas Mueller-Hinton agar.
As Tabelas 3 e 4 trazem um resumo dos principais achados do nosso trabalho nos dois meios testados.
Para o cetoconazol e o fluconazol os meios não apresentaram diferenças estatisticamente significantes com p>0,05. No caso da anfotericina B e nistatina ocorreu uma diferença estatisticamente significante com p<0,05.
Nas Figuras 2 e 3 são mostrados os testes de susceptibilidade a partir dos dois meios utilizados. É possível observar que no meio suplementado a execução da leitura é muito simples de ser realizada, diferentemente da leitura no meio sem suplementação, onde os halos se apresentaram tortuosos sem margem definida, o que dificultou bastante a leitura.
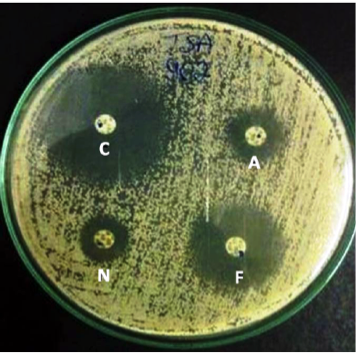
Figura 2. Halo de inibição formado pelo fluconazol e anfotericina B frente a C. albicans, pelo método de disco-difusão em meio MHA suplementado com glicose 2% e 0,5 mg/mL de azul de metileno.
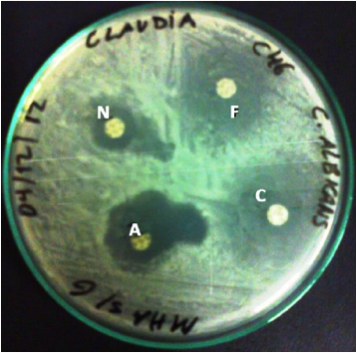
Figura 3. Halo de inibição formado pelo cetoconazol, fluconazol, anfotericina B e nistatina frente a C. albicans, pelo método de disco-difusão em meio MHA sem suplementação com glicose 2% e 0,5 mg/mL de azul de metileno.
DISCUSSÃO
O fungo mais isolado de infecções fúngicas invasivas (IFIs) continua sendo Candida spp., que faz parte da microbiota humana e pode ocasionar uma série de doenças clínicas que dependem do local de desenvolvimento do fungo e do tipo de paciente envolvido. A mortalidade associada às infecções causadas por Candida spp. situa-se entre 30%-40%.(14)
Dentro do gênero Candida, a levedura mais importante é a Candida albicans visto que é um patógeno oportunista que pode causar infecções disseminadas em grupos de pacientes específicos, ou seja, pacientes com o HIV, os que utilizam corticocosteroides, pacientes transplantados e pacientes com câncer. Essa levedura faz parte da nossa microbiota e em algum momento ela adquire a capacidade de causar doenças. Essa transição ainda não é bem compreendida, mas estudos apontam que a capacidade desse microrganismo em produzir fatores de virulência aliada ao sistema imune do hospedeiro não plenamente funcionante podem ser os fatores que auxiliam na instalação da condição patológica.(15,16)
Em um estudo realizado entre junho de 1997 e dezembro de 2005, Pfaller et al.(17) avaliaram 205.329 cepas de leveduras que foram coletadas e testadas em 134 locais de estudo; dessas, as espécies de Candida contabilizaram 95,7% de todas as cepas isoladas; um total de 22 espécies diferentes de Candida foi isolado, sendo que C. albicans foi a mais comumente encontrada, equivalendo a 65,6% de todas as Candida spp.; no entanto, apesar da grande diferença na porcentagem das espécies de Candida encontradas no estudo, atualmente outras não albicans estão ocupando lugar de destaque como causadoras de infecções fúngicas.
Entre as infecções fúngicas pode-se destacar a candidíase invasiva, que é um problema de saúde pública associada com elevada morbidade, mortalidade e custos. Candida albicans é ainda a principal espécie envolvida, causando cerca de 50%-70% dos casos. No entanto, em décadas passadas, esse percentual já foi maior e, no momento, outras espécies como C. glabrata, C. tropicalis, C. parapsilosis e C. krusei começam a emergir.(14,18,19)
CHROMagar Candida® é um meio seletivo e diferencial utilizado para rápida purificação e diferenciação de espécies de Candida isoladas de amostras clínicas. Este meio especial contém substratos cromógenos que são transformados pelas enzimas das leveduras produzindo pigmentos específicos das espécies. A diferenciação das espécies é baseada na coloração e na morfologia. A incorporação de substratos cromógenos foi um grande avanço na identificação laboratorial de leveduras, pois eles permitem observar se a amostra clínica possui mais de uma levedura, possibilitam a identificação preventiva e direcionam a escolha do tratamento antifúngico a ser estabelecido.(20,21)
A evolução da resistência fúngica pode ser avaliada pelo teste de susceptibilidade aos antifúngicos. Há diversos protocolos para este teste, no entanto, os mais utilizados são a microdiluição em caldo (MDC), disco-difusão (DD) e E-test. Geralmente, a MDC é um teste trabalhoso e menos utilizado, pois exige pessoal treinado; já o E-test é caro para ser aplicado à rotina laboratorial.(10,22) A alternativa é a técnica de DD, pois é simples, barata e reprodutível, portanto pode ser utilizada em laboratórios clínicos.(5,11)
O protocolo M44-A para teste de susceptibilidade define que deverá ser utilizado o meio Mueller-Hinton suplementado com glicose 2% e 0,5 mg/mL de azul de metileno.(6) Este método de difusão em disco é semelhante ao método de Kirby-Bauer, utilizado globalmente na rotina para os testes de susceptibilidade bacteriana.(23) O teste de disco-difusão utilizando meio Mueller-Hinton agar suplementado é adequado para procedimentos laboratoriais de triagem da resistência de cepas de Candida. Os resultados devem ser lidos após 24 horas. No nosso estudo utilizamos o meio Mueller-Hinton com e sem suplementação com o objetivo de avaliar os resultados e se os dois meios comparados forneciam resultados semelhantes.
Utilizamos no nosso trabalho quatro tipos de discos: cetoconazol, fluconazol, anfotericina B e nistatina. Nas Tabelas 1 e 2 podemos observar que todas as cepas testadas apresentaram sensibilidade às drogas testadas.
No nosso trabalho foi possível verificar que todas as cepas de C. albicans foram sensíveis ao fluconazol. Em um estudo realizado com 3.546 cepas de C. albicans, C. tropicalis e C. parapsilosis avaliadas pelo método do disco-difusão, realizado no Brasil, a susceptibilidade ao fluconazol foi maior que 95%.(24)
Em outro trabalho realizado no Brasil com 400 C. albicans isoladas de sangue, todas se mostraram susceptíveis ao fluconazol e à anfotericina B.(25) Crocco et al.(26) avaliaram a sensibilidade de cepas de C. albicans isoladas de pacientes com candidíase superficial, tendo observado para o fluconazol 86,9% de sensibilidade, 1,3% de SDD e 11,8% de resistência.
Porte et al.(27) avaliaram a sensibilidade de 110 cepas de C. albicans contra anfotericina B, fluconazol e voriconazol, sendo que, das cepas testadas, 100% foram sensíveis a anfotericina B, 91,8% ao fluconazol e 100% ao voriconazol. Em outro estudo, Quindós et al.(28) avaliaram a sensibilidade de cerca de 3.500 cepas de C. albicans á anfotericina e ao fluconazol e detectaram resistência ao fluconazol.
Pfaller et al.(17) avaliaram, em um período de oito anos, a sensibilidade de 89.750 cepas de C. albicans frente ao fluconazol utilizando a técnica de disco-difusão e constataram que 97,9% das cepas foram sensíveis ao fármaco e que 1,5% das cepas apresentaram resistência.
No nosso estudo, as cepas tiveram sensibilidade de 100% para o fluconazol e para a anfotericina B, sendo importante salientar que, como o número de amostras trabalhadas foi muito pequeno em relação aos estudos citados, nossos achados ficaram limitados.
As análises estatísticas dos resultados dos halos para esses discos encontram-se descritas nas Tabelas 3 e 4, mostrando que não ocorreu diferença significativa entre os halos dos discos de cetoconazol e fluconazol testados nos meios com e sem suplementação; no entanto, os discos de poliênicos (anfotericina B e nistatina) mostraram-se estatisticamente significantes, pois os resultados diferem de acordo com o meio utilizado.
O teste de disco-difusão é uma ferramenta valiosa para o acompanhamento da sensibilidade de leveduras. Com o aumento da prevalência de IFSs fica bem estabelecido que o laboratório de análises clínicas desenvolve um papel crucial na condução do paciente com infecção fúngica. Sendo assim, é de grande importância que a técnica seja executada da maneira mais adequada possível e seguindo sempre o protocolo, já que, como foi possível observar nas Figuras 7 e 8, a falta de suplementação produziu halos com deformação. Além do mais, vale salientar que a suplementação com glicose faz-se necessária por promover um maior suporte ao meio, promovendo um crescimento mais rápido dos microrganismos nele inoculados, e a suplementação com o azul de metileno faz com que o diâmetro dos halos seja mais bem definido, evitando também a contaminação bacteriana.
CONCLUSÃO
Com base nos nossos achados pode-se observar que a suplementação com glicose e com azul de metileno ao meio é de fundamental importância para o teste, pois facilita a leitura porque promovem um melhor suporte ao meio e uma maior definição do diâmetro dos halos formados.
No meio sem suplementação foram obtidos halos disformes sem uma nítida definição de seus diâmetros, dificultando assim a sua leitura de maneira mais rápida, podendo levar até mesmo a leituras equivocadas.
Em um laboratório de análises clínicas, a leitura dos halos em meio suplementado torna-se mais viável e mais rápida, facilitando e agilizando a liberação dos resultados demandando menos tempo na execução de sua leitura já que os halos ficam bem definidos.
Abstract
Objective: The aim of this study was to compare the means Mueller-Hinton agar used in antifungal susceptibility testing by the disk diffusion method supplemented with glucose 2% and 0.5 mg/mL of methylene blue (Protocol M44-A) and medium without supplementation. Methods: The disks were ketoconazole, fluconazole, amphotericin B and nystatin against 20 strains of Candida albicans. The strains belong to a collection of Microbiology Laboratory of Yeast Department of Clinical and Toxicological Analysis, Faculty of Pharmacy, Federal University of Ceará. We made the isolation, purification, identification and confirmation of presumptive identification of strains. Discs with antifungals were tested in both culture media. Results: All strains of C. albicans showed susceptibility to antifungal drugs tested. Conclusion: Reading and viewing the diameter of halos formed by disks of antifungals used in medium without supplementation was not so simple, because the halos were not well defined requiring more time for its proper determination.
Keywords
Candida; Sensitivity tests; Disk-diffusion; Antifungi
REFERÊNCIAS
- Sidrim JJ, Rocha MFG. Micologia médica à luz de autores contemporâneos. Rio de Janeiro, RJ: Guanabara Koogan, 2004.
- Denning WD, Hope WW. Therapy for fungal diseases: opportunities and priorities. Trends Microbiol. 2010 May;18(5):195-204.
- Cordeiro RA, Brilhante RS, Pantoja LD, Moreira Filho RE, Vieira PR, Rocha MF et al. Isolation of pathogenic yeasts in the air from hospital environments in the city of Fortaleza, northeast Brazil. Braz J Infect Dis. 2010 Jan-Feb;14(1):30-4.
- Menezes EA, Mendes LG, Cunha FA. Antifungal resistance of Candida tropicalis isolated in the State of Ceará. Rev Soc Bras Med Trop. 2009 May-Jun;42(3):354-5. [Article in Portuguese].
- Gomes CL, et al. Identificação e perfil de sensibilidade de Candida spp. isoladas de urina de pacientes com candidúria em Iguatu – Ceará. Rev. Bras. Anál. Clín. 2010:42:223-6.
- Clinical and Laboratory Standards Institute. Zone Diameter Interpretive Standards, Corresponding Minimal Inhibitory Concentration. (MIC) Interpretive Breakpoints and Quality Control Limits for Antifungal Disk Diffusion Susceptibility Testing of Yeasts: Informational Supplement, M44-S2. Clinical and Laboratory Standards Institute, Wayne, PA. 2007.
- Clinical And Laboratory Standards Institute (CLSI). Reference method for broth dilution antifungal susceptibility testing of yeasts: informational supplement, M27-A3. Clinical and Laboratory Standards Institute, Wayne, PA. 2008a.
- Clinical And Laboratory Standards Institute (CLSI). Reference method for broth dilution antifungal susceptibility testing of yeasts: informational supplement, M27-S3. Clinical and Laboratory Standards Institute, Wayne, PA. 2008b.
- Pfaller MA, Andes D, Diekema DJ, Espinel-Ingroff A, Sheehand D, The CLSI Subcommittee for Antifungal Susceptibility Testing Wild-type MIC distributions, epidemiological cutoff values and species-specific clinical breakpoints for fluconazole and Candida: Time for harmonization of CLSI and EUCAST broth microdilution methods. Drug Resistance Updates v.13, p.180-195. 2010b.
- Cuenca-Estrella M, Bassetti M, Lass-Flörl C, Rácil Z, Richardson M, Rogers TR. Detection and investigation of invasive mould disease. J Antimicrob Chemother. 2011 Jan;66 Suppl 1:i15-24.
- de Vasconcelos AA Jr, Menezes EA, Cunha FA. Chromogenic medium for direct susceptibility testing of Candida spp. isolated from urine. Mycopathologia. 2011 Aug;172(2):125-30.
- Espinel-Ingroff A. Standardized Disk Diffusion Method for Yeasts. Clinical Microbiology Newsletter. 2007;29(13).
- Menezes EA, Mendes LG, Cunha FA. Antifungal resistance of Candida tropicalis isolated in the State of Ceará. Rev Soc Bras Med Trop. 2009 May-Jun;42(3):354-5. [Article in Portuguese].
- Arendrup MC. Epidemiology of invasive candidiasis. Curr Opin Crit Care. 2010 Oct;16(5):445-52.
- Menezes EA, Cunha MCSO, Cunha FA. Identificação prelimimar de algumas espécies do gênero Candida spp. em meio cromógeno: resultados de dois anos de um estudo multicêntrico realizado no Ceará. Rev Patol Trop. 2011;40:297-303.
- Menezes EA, Marinho JA, Angelo MR, Cunha Mda C, Cunha FA, Vasconcelos Júnior AA. Isolation and antifungal susceptibility testing of Trichosporon asahii in Ceará, Brazil. Rev Inst Med Trop Sao Paulo. 2012 Jan-Feb;54(1):1-3.
- Pfaller MA, Diekema DJ, Gibbs DL, Newell VA, Meis JF, Gould IM, et al; Global Antifungal Surveillance Study. Results from the ARTEMIS DISK Global Antifungal Surveillance study, 1997 to 2005: an 8.5-year analysis of susceptibilities of Candida species and other yeast species to fluconazole and voriconazole determined by CLSI standardized disk diffusion testing J Clin Microbiol. 2007 Jun;45(6): 1735-45.
- Sampaio Camargo TZ, Marra AR, Silva CV, Cardoso MF, Martino MD, Camargo LF, et al. Secular trends of candidemia in a tertiary care hospital. Am J Infect Control. 2010 Sep;38(7):546-51.
- Kett D, Dimopoulos G, Azoulay E, Echeverria P, Vincent JL. Demographic and outcome differences in ICU patients with proven invasive candidiasis, possible invasive candidiasis and probable candida colonization: analysis of the EPIC II study population. Crit Care. 2011; 15(Suppl 1): P238.
- Sivakumar VG, Shankar P, Nalina K, Menon T. Use of CHROMagar in the differentiation of common species of Candida.. Mycopathologia. 2009 Jan;167(1):47-9.
- Alfonso C, López M, Arechavala A, Perrone Mdel C, Guelfand L, Bianchi M; Red de Micología del Gobierno de la Ciudad Autónoma de Buenos Aires. Presumptive identification of Candida spp. and other clinically important yeasts: usefulness of Brilliance Candida Agar. Rev Iberoam Micol. 2010 Jun 30;27(2):90-3. [Article in Spanish].
- Pfaller MA, Diekema DJ, Gibbs DL, Newell VA, Ellis D, Tullio V, et al; Global Antifungal Surveillance Group. Results from the ARTEMIS DISK Global Antifungal Surveillance Study, 1997 to 2007: a 10.5-year analysis of susceptibilities of Candida Species to fluconazole and voriconazole as determined by CLSI standardized disk diffusion J Clin Microbiol. 2010a Apr;48(4):1366-77.
- Fothergill AW, Rinaldi MG, Sutton DA. Antifungal susceptibility testing. Infect Dis Clin North Am. 2006 Sep;20(3):699-709.
- Azevedo AC, Bizerra FC, da Matta DA, de Almeida LP, Rosas R, Colombo AL. In vitro susceptibility of a large collection of Candida Strains against fluconazole and voriconazole by using the CLSI disk diffusion assay. Mycopathologia. 2011 Jun;171(6):411-6.
- da Matta DA, de Almeida LP, Machado AM, Azevedo AC, Kusano EJ, Travassos NF, et al. Antifungal susceptibility of 1000 Candida bloodstream isolates to 5 antifungal drugs: results of a multicenter study conducted in São Paulo, Brazil, 1995-2003. Diagn Microbiol Infect Dis. 2007 Apr;57(4):399-404.
- Crocco EI, Mimica LM J, Muramatu LH, Garcia C, Souza VM, Ruiz LRB, et al. Identificação de espécies de Candida e susceptibilidade antifúngica in vitro: estudo de 100 pacientes com candidíases superficiais. An Bras Dermatol. 2004; 79:689-97.
- Porte L, León P, Gárate C, Guzmán AM, Labarca J, García P, et al. Susceptibility to azoles and amphotericin B of isolates of Candida spp. Experience of a university health network, between 2004 and 2010. Rev Chilena Infectol. 2012 Apr; 29(2):149-55. [Article in Spanish].
- Quindós G, Carrillo-Muñoz AJ, Eraso E, Cantón E, Pemán J. In vitro antifungal activity of voriconazole: New data after the first years of clinical experience. Rev Iberoam Micol. 2007 Sep 30;24(3):198-208. [Article in Spanish].
Correspondência
Everardo Albuquerque Menezes
Rua Capitão Francisco Pedro, 1210 – Rodolfo Teófilo
60430-370 – Fortaleza, CE
