Tratamento de neoplasias linfoides com células CAR-T
Treatment of lymphoid neoplasms with CAR-T cells
Andreza de J. Silva1, Patrick Menezes2, Diogo Felipe Corecha do Nascimento3
1 Universidade do Grande Rio “Prof. José de Souza Herdy” – UNIGRANRIO AFYA, Curso de Biomedicina. Duque de Caxias, RJ, Brasil.
2 Hospital Universitário Gaffrée e Guinle (HUGG-UNIRio/Ebserh), Unidade de Laboratório de Análises Clínicas e Anatomia Patológica. Preceptor Científico do Curso de Biomedicina. Rio de Janeiro, RJ, Brasil.
3 Instituto Estadual de Hematologia Arthur de Siqueira Cavalcanti (HEMORIO), Laboratório de Citologia. Rio de Janeiro, RJ, Brasil.
Recebido em 31/01/2024
Aprovado em 21/05/2024
DOI: 10.21877/2448-3877.202500164.pt
INTRODUÇÃO
As neoplasias linfoides originam-se da transformação maligna de células do tecido linfoide em diferentes estágios do seu processo natural de maturação.(1) Desta forma, podemos destacar entre essas neoplasias a leucemia linfoblástica aguda (LLA), que tem origem em uma célula progenitora linfoide capaz de se diferenciar em linfócitos T ou B, a leucemia linfocítica crônica (LLC), que surge com a transformação de um progenitor mais maduro do linfócito B, e o mieloma, que envolve uma célula em um estágio ainda mais tardio na maturação do linfócito B.(2) A Organização Mundial de Saúde (OMS) reconhece uma variedade de neoplasias linfoides, classificadas de acordo com suas características imunofenotípicas, genéticas e clínicas.(3,4)
As neoplasias deste grupo apresentam, além de uma grande diversidade morfológica, um amplo espectro de manifestações clínicas.(1) Essa diversidade se reflete nos tratamentos aos quais essas patologias são responsivas.(1) Nos casos de falha na resposta ou recaída após o tratamento inicial, é considerado o transplante de células-tronco.(1) Doença refratária e recaída são dois dos principais desafios no tratamento de neoplasias hematológicas.(1) Diversas modalidades de imunoterapia têm se mostrado promissoras na tentativa de induzir remissão de longo prazo em neoplasias refratárias ou recaídas.(5,6)
Apesar dos evidentes avanços terapêuticos nos últimos anos, as neoplasias linfoides ainda apresentam um mau prognóstico e alternativas terapêuticas tem sido alvo de pesquisas e ensaios clínicos.(5) Nesse contexto, a terapia com células T apresentando receptor quimérico de antígeno (CAR-T) tem alcançado resultados promissores, tendo o FDA aprovado cinco tratamentos baseados em células CAR-T para neoplasias hematológicas.(5) Esse tratamento baseia-se na reprogramação das células do próprio paciente e direcionamento destas contra as células tumorais.(7)
As células CAR-T são células do sistema imunológico geneticamente modificadas (Figura 1) para expressar um receptor quimérico específico para um antígeno de superfície encontrado nas células malignas.(8) Esses receptores quiméricos são projetados para direcionar e reconhecer especificamente as células tumorais, ativando uma resposta imune direcionada e mais potente contra as células malignas (Figura 2).(9,10) No caso das neoplasias linfoides, as células CAR-T são direcionadas a antígenos específicos encontrados nas células linfoides neoplásicas.(10) Esses antígenos alvo podem variar conforme o tipo de neoplasia linfoide.(11) Ao direcionar esses antígenos, as células CAR-T podem eliminar seletivamente as células tumorais (Figura 3),(12) poupando as células saudáveis do sistema linfático.(13)
A trajetória da terapia CAR-T (Figura 4), desde suas origens até sua disseminação no Brasil, é uma narrativa de inovação e esperança no tratamento do câncer.(14) Nesse contexto, o objetivo desta revisão foi analisar estudos relacionados às células CAR-T, leucemia linfoblástica e linfoma, no período de cinco anos. A pesquisa utilizou o banco de dados PubMed como fonte de informações para se observar o estado da arte.
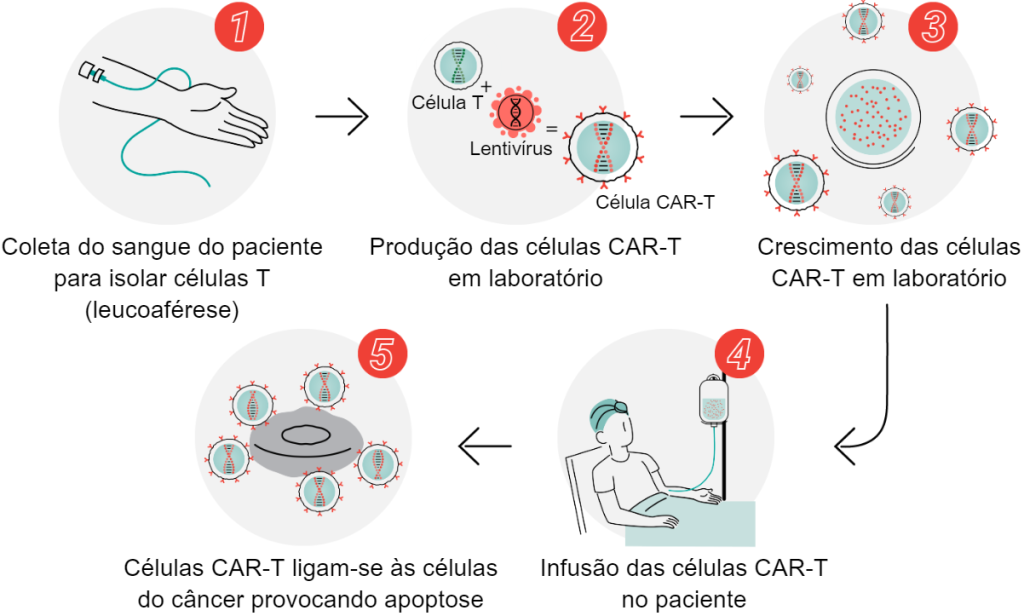
Figura 1
Processo de produção das células CAR-T.
Fonte: Adaptado de Butantan; USP; Hemocentro de Ribeirão Preto, 2022.

Figura 2
Mecanismo de ação das células CAR-T.
Fonte: Lee et al., 2020.
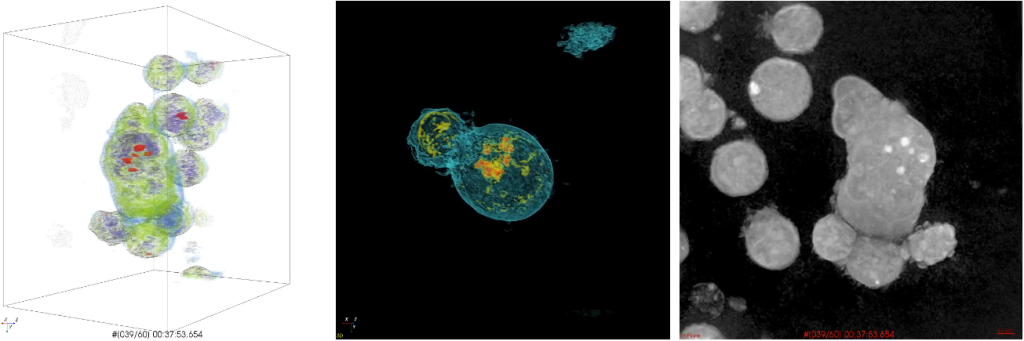
Figura 3
Visualização da holotomografia, técnica de microscopia que permite se obter imagens tridimensionais e em tempo real do comportamento das células CAR-T diante das células alvo.
Fonte: Lee et al., 2019.
| 1987 | Criado o primeiro receptor quimérico de antígeno (CAR)
Neste ano, cientistas realizaram um avanço fundamental ao desenvolver o primeiro CAR, também conhecido como Receptor Quimérico de Antígeno. Esse CAR foi incorporado às células T, criando as células CAR-T. Essas células modificadas passaram a expressar receptores específicos, permitindo que identificassem e se ligassem aos tumores. Essa descoberta desencadeou uma revolução na terapia do câncer. |
| 1992 | Uso de vetores retrovirais para introdução de genes nas células T
O imunologista americano Michael Sadelain, do MID, começou a utilizar vetores retrovirais para introduzir genes nas células T. O objetivo era modificar essas células para que atacassem tumores específicos. |
| 1994 | Isolamento de células T específicas
Pesquisadores do Memorial Sloan Kettering Cancer Center (MSK) em Nova York aprenderam a isolar células T específicas para uso em transplantes de células tronco, visando prevenir tumores causados por vírus. |
| 1998 | Introdução da molécula coestimuladora CD-28
A equipe de Michael Sadelain introduziu a molécula coestimuladora CD-28 em células T modificadas (CAR-T), o que permitiu que elas permanecessem ativas no organismo, tornando-as mais eficazes na luta contra o câncer. |
| 2002 | Construção das primeiras células CAR-T eficazes in vitro
Pesquisadores do MSK construiram as primeiras células CAR-T eficazes, direcionadas contra antígenos específicos do câncer. Essas células demonstraram a capacidade de sobreviver, se multiplicar e matar células cancerosas em testes laboratoriais, validando a viabilidade da terapia. |
| 2003 | Células CAR-T matam células de leucemia em animais
O grupo de pesquisadores do MIT demonstrou que as células CAR-T contendo a molécula coestimuladora CD-19 eram capazes de matar células leucêmicas em camundongos. |
| 2009 | Estabelecimento do processo de fabricação de células CAR-T
A mesma equipe do MIG foi pioneira no desenvolvimento do processo de fabricação de células CAR-T contendo a molécula CD-19, destinadas ao tratamento de pacientes com leucemia resistente à quimioterapia e recidiva. O sucesso do processo e a eficácia das células foram comprovados. |
| 2010 | Primeiros pacientes com leucemia curados com CAR-T
Dois pacientes com leucemia linfoblástica crônica em estágio terminal foram voluntários no primeiro ensaio clínico da terapia CAR-T, realizado na Universidade da Pensilvânia. Ambos alcançaram remissão completa e permaneceram livres do câncer até hoje. As células CAR-T ainda são detectáveis em seus organismos uma década depois. |
| 2012 | Primeira criança com leucemia recebe a CAR-T
Emily Whitehead, com 7 anos na época, se tornou a primeira criança a receber a terapia CAR-T. Ela estava internada com leucemia terminal e foi tratada com sucesso pela equipe de Stephan Grupp, no Hospital Infantil da Filadélfia. As células CAR-T salvaram sua vida, e a remissão dos tumores foi completa. |
| 2017 | Aprovação da CAR-T pela FDA
Após vários ensaios clínicos bem-sucedidos, a Food and Drug Administration (FDA) dos Estados Unidos aprovou a terapia CAR-T para o tratamento de casos terminais de leucemia e linfoma. Atualmente, a FDA já aprovou cinco terapias CAR-T diferentes. |
| 2019 | Primeiros pacientes recebem CAR-T no Brasil
O Centro de Terapia Celular do Hemocentro de Ribeirão Preto (CTC-USP) aplicou a terapia experimentalmente em pacientes com cânceres do sangue, como linfoma e leucemia, que não tinham mais opções de tratamento. A maioria desses pacientes alcançou remissão. |
| 2022 | Criação do Programa de Terapia Celular do Instituto Butantan, USP e Hemocentro
A tecnologia CAR-T se difundiu no Brasil com a criação de novos centros de produção de terapia celular para câncer pelo Instituto Butantan, pela Universidade de São Paulo (USP) e pelo Hemocentro de Ribeirão Preto. Essas unidades têm capacidade para tratar centenas de pacientes por ano, representando um marco importante no acesso à terapia CAR-T no país. |
Figura 4
Os principais marcos na jornada do tratamento com células CAR-T.
Fonte: Adaptado de Moon, 2023.(14)
MATERIAL E MÉTODOS
A pesquisa foi realizada exclusivamente com textos científicos para revisão da literatura que recorreram exclusivamente às fontes bibliográficas, de cunho acadêmico-científico, após a experiência dos autores com a temática em um centro especializado de onco-hematologia que, conforme a Resolução CNS n.° 510, de 2016, são dispensadas de registro e avaliação pelo Sistema CEP/Conep: O objetivo foi analisar estudos relacionados às células CAR-T, leucemia linfoblástica e linfoma, no período de cinco anos. A pesquisa utilizou o banco de dados PubMed como fonte de informações para se observar o estado da arte.
Para a seleção dos estudos, foram estabelecidos critérios de inclusão que englobaram a disponibilidade de texto completo gratuito e a inclusão de ensaios clínicos. Por outro lado, os critérios de exclusão abrangeram estudos que envolviam outros tipos de neoplasias.
Essa pesquisa teve como intuito fornecer uma visão atualizada sobre o uso das células CAR-T no tratamento da leucemia linfoblástica e do linfoma, explorando os ensaios clínicos disponíveis na literatura científica nos últimos cinco anos. A revisão da literatura permitiu a compilação e análise de estudos relevantes para a área, contribuindo para a compreensão dos avanços e desafios nesse campo.
RESULTADOS
Ramos et al. (2018) detalharam um caso clínico extremamente relevante envolvendo um paciente do sexo masculino, com 52 anos, que recebeu um diagnóstico de linfoma difuso de grandes células B.(10) O contexto histórico do paciente revelou informações importantes sobre sua jornada de tratamento.(10) O histórico clínico do paciente é notável por seu tratamento anterior.(10) O transplante autólogo de células-tronco é um procedimento padrão que envolve a coleta das próprias células-tronco do paciente, seguida de uma intensa quimioterapia de alta dose, e, por fim, a reinfusão das células-tronco para ajudar na recuperação do sistema hematopoiético.(10) No entanto, é preocupante observar que, apesar desse tratamento anterior, o paciente experimentou uma recaída da doença.(10) Uma recaída indica que o linfoma voltou a se manifestar após um período inicial de remissão, sugerindo que o tratamento anterior não foi suficiente para controlar a progressão da doença de forma duradoura.(10) Nesse contexto, a descrição do caso clínico sugere que as células CAR-T foram consideradas como uma opção de tratamento subsequente à falha do tratamento anterior.(10) Essa abordagem é notável porque as terapias CAR-T têm demonstrado eficácia em tratar certos tipos de linfomas, especialmente quando outros tratamentos não foram bem-sucedidos.(10)
O paciente em questão passou por um tratamento que incluiu a terapia com células CAR-T após uma etapa de quimioterapia linfodepletora.(10) A linfodepleção é um passo importante antes da infusão das células CAR-T, pois ajuda a criar um ambiente mais propício para que essas células modificadas atuem de forma eficaz, diminuindo a competição com as células do sistema imunológico do paciente.(10) Uma etapa crucial na avaliação da resposta ao tratamento foi a realização de um segundo PET scan (Figura 5), que ocorreu 6 semanas após a infusão das células CAR-T.(10) Esse exame é fundamental para monitorar a disseminação do câncer e para avaliar a eficácia do tratamento.(10) Os resultados desse segundo PET scan foram altamente encorajadores, indicando uma resposta completa (RC).(10) Uma resposta completa no PET scan é um marco significativo no tratamento de pacientes com câncer.(10) Isso significa que, segundo as imagens obtidas, não foram identificadas áreas no corpo que demonstrassem atividade metabólica anormal, o que sugere a eliminação quase completa das células cancerígenas.(10) Essa é uma conquista notável, indicando que o tratamento com células CAR-T teve um impacto extremamente positivo no controle e na regressão do linfoma difuso de grandes células.(10)
Ramos et al. (2018) também apresentam um caso clínico envolvendo um paciente masculino de 67 anos diagnosticado com linfoma difuso de grandes células B.(10) O histórico desse paciente é notável por sua trajetória complexa de tratamento.(10) Após não conseguir avançar para o transplante de células-tronco, apesar de ter passado por dois regimes de resgate, o paciente foi submetido a um protocolo que envolveu linfodepleção seguida da infusão de células CAR-T.(10) No entanto, a evolução do paciente após o tratamento com células CAR-T foi marcada por complicações notáveis.(10) Dez dias após a infusão das células CAR-T, ele desenvolveu febre e taquipneia, o que levou à sua internação no hospital.(10) A ocorrência desses sintomas é preocupante, pois pode sugerir uma reação adversa ao tratamento ou a presença de complicações associadas à terapia CAR-T.(10) Ao analisar os marcadores inflamatórios do paciente, incluindo a proteína C-reativa (PC-R), que atingiu um pico de 12,2mg/dL no 11º dia, e a interleucina 6, que aumentou de 6,3pg/mL no início do estudo para um pico de 91,2pg/mL no 11º dia, foi identificada uma elevação.(10) Esses resultados indicam que o paciente estava experimentando uma síndrome de liberação de citocinas (SLC) leve.(10)
Abdo et al. (2020) apresentaram gráficos de Kaplan-Meier que foram utilizados para comparar e analisar os resultados de dois grupos de pacientes tratados com diferentes abordagens terapêuticas relacionadas às células CAR-T.(15) Um aspecto notável desse estudo foi que os pacientes foram divididos em dois grupos distintos: um que recebeu células CAR-T recém-modificadas usando a abordagem point-of-care e outro que recebeu células CAR-T que foram expandidas durante 8 dias e cultivadas conforme o protocolo tradicional.(15)
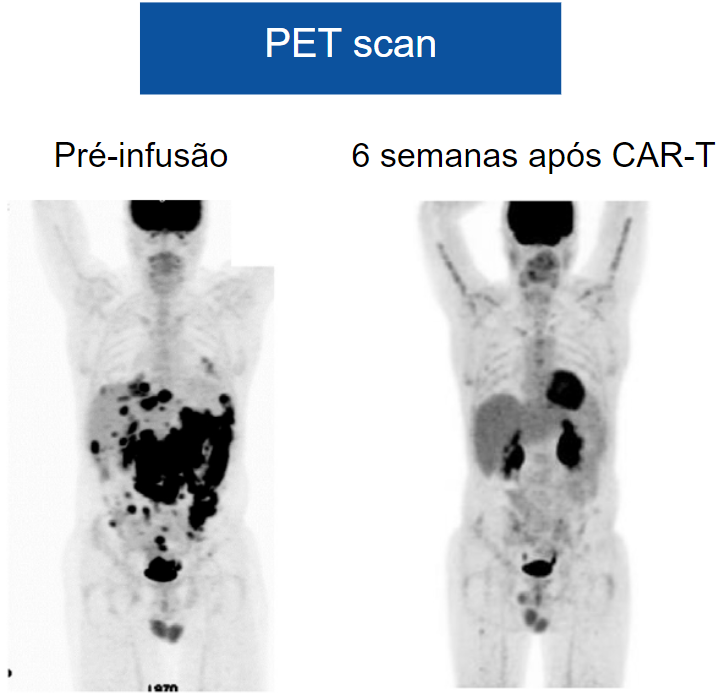
Figura 5
Visualização do PET scan na fase pré-infusão de CAR-T e 6 semanas pós-infusão apresentando uma resposta completa.
Fonte: Adaptado de Ramos et al., 2018.
DISCUSSÃO
A avaliação por estudo de imagem realizada 6 semanas após a infusão de CAR-T é uma etapa essencial no acompanhamento de pacientes submetidos a esse tratamento,(10) e normalmente é conduzida por meio de um PET scan ou tomografia por emissão de pósitrons.(10) O PET scan é uma ferramenta altamente sensível que permite a detecção de áreas do corpo que continuam metabolicamente ativas.(10) Essa atividade metabólica pode indicar a presença de células cancerígenas remanescentes, o que é fundamental para avaliar a eficácia do tratamento com células CAR-T.(10) A interpretação dos resultados do PET scan é fundamental para categorizar o progresso da doença e determinar a resposta ao tratamento.(10) Os critérios estabelecidos como resposta completa, resposta parcial, doença progressiva e doença estável, servem como uma base objetiva para avaliar a eficácia do tratamento.(10) A resposta completa indica a eliminação completa das células cancerígenas, enquanto a resposta parcial sugere uma redução significativa no tumor.(10) Por outro lado, a doença progressiva indica que a condição do paciente está piorando, e a doença estável sugere que não houve mudanças significativas na doença.(10) A combinação de tecnologia de imagem avançada, como o PET scan, e critérios de resposta bem definidos permite uma avaliação precisa e objetiva da eficácia da terapia com células CAR-T.(10) Isso, por sua vez, auxilia na tomada de decisões clínicas importantes e na adaptação do tratamento para atender às necessidades específicas de cada paciente, contribuindo assim para melhorar os resultados.(10)
A combinação da linfodepleção por quimioterapia seguida pela infusão de CAR-T, acompanhada por ensaios de citotoxicidade utilizando a proteína C-reativa (PC-R) e a interleucina 6 (IL-6), representa uma abordagem completa e integrada para o tratamento e avaliação da eficácia em pacientes que passam por terapia CAR-T.(16) A inclusão desses marcadores biológicos, PC-R e IL-6, nos ensaios clínicos pode ser significativa por várias razões importantes.(16) Primeiramente, a PC-R é uma proteína produzida em resposta a inflamações no corpo.(16) Quando os níveis de PC-R aumentam após a infusão de CAR-T, isso pode ser um indicativo de uma reação inflamatória em resposta à destruição das células cancerígenas pelas células CAR-T.(16) Essa informação é valiosa, pois pode ajudar a monitorar e entender as respostas imunológicas do paciente ao tratamento.(16) Um aumento acentuado nos níveis de PC-R pode sugerir uma resposta robusta do sistema imunológico, o que pode ser desejável em certos contextos terapêuticos, enquanto níveis moderados ou estáveis podem indicar uma resposta mais controlada.(16) Em segundo lugar, a interleucina 6 (IL-6) é uma citocina que desempenha um papel fundamental na regulação da resposta imunológica e na modulação da inflamação.(16) Medir os níveis de IL-6 pode fornecer informações importantes sobre como o sistema imunológico está sendo ativado ou modulado pelas células CAR-T.(16) Isso é essencial para entender não apenas a eficácia do tratamento, mas também os potenciais efeitos colaterais e complicações associadas à terapia CAR-T.(16) O controle adequado da resposta inflamatória e imunológica é crucial para a segurança e o bem-estar dos pacientes.(16) Portanto, a inclusão da PC-R e da IL-6 nos ensaios clínicos relacionados à terapia CAR-T fornece uma visão detalhada da resposta do corpo ao tratamento.(16) Esses marcadores podem auxiliar os profissionais de saúde a ajustar e personalizar a terapia conforme as necessidades individuais do paciente, maximizando os benefícios terapêuticos e minimizando os riscos potenciais.(16) Além disso, essa abordagem integrada contribui para o avanço do conhecimento científico na área e para o aprimoramento contínuo da terapia CAR-T como uma opção de tratamento eficaz para pacientes com câncer.(10)
Uma abordagem comum na pesquisa pré-clínica para avaliar a eficácia e a segurança da terapia CAR-T envolve a utilização de modelos de camundongos imunodeficientes que foram previamente enxertados com diferentes tipos de leucemia de células B.(15) O processo de modificação genética utilizado nesses estudos é mediado por um transposon conhecido como “Sleeping Beauty” e um aspecto notável é a aplicação da técnica point-of-care, que se refere a um processo rápido e localizado, realizado no próprio laboratório, sem a necessidade de enviar amostras ou experimentos para instalações distantes.(15)
O exame de PET scan é uma ferramenta essencial no estágio pré-infusão para mapear a disseminação do câncer e identificar áreas de atividade tumoral.(10) É um exame que utiliza uma substância radioativa chamada radiofármaco para visualizar as células do corpo que consomem mais glicose, como as células cancerosas.(10) A obtenção de uma resposta completa no PET scan após o tratamento com células CAR-T é um resultado altamente positivo e indica a eficácia do tratamento.(10) Quando falamos em uma resposta completa, estamos nos referindo ao fato de que não há evidências visíveis de atividade tumoral em nenhuma parte do corpo que tenha sido avaliada.(10) Isso significa que todas as lesões tumorais anteriores, que eram detectáveis no PET scan pré-tratamento, não estão mais presentes ou não mostram atividade metabólica, o que é um sinal encorajador de que o tratamento está sendo bem-sucedido.(10)
Comparar os resultados de um exame PET scan realizado após 6 semanas da infusão CAR- T com um estudo anterior de 6 meses pós-infusão nos permitiu avaliar duas fases distintas do tratamento e fornecer informações valiosas sobre o progresso do paciente.(17) O exame de 6 semanas avalia a resposta inicial e a eficácia aguda do tratamento.(17) Neste ponto, observa-se como as células CAR-T estão respondendo imediatamente ao câncer.(17) É uma janela crítica para identificar qualquer sinal precoce de sucesso ou desafio no tratamento.(17) Por outro lado, o estudo de 6 meses pós-infusão se concentra na estabilidade da resposta completa e na observação da remissão a longo prazo.(17) Isso é fundamental para determinar se o tratamento CAR-T está mantendo sua eficácia ao longo do tempo e se o paciente está experimentando uma remissão duradoura.(17) Ambos os momentos são cruciais no acompanhamento do progresso do paciente após a terapia CAR-T, fornecendo uma visão desde a resposta imediata até o cenário de longo prazo.(17)
Com isso, no PET scan realizado 6 semanas após a infusão das células CAR-T, a eficácia inicial é essencial para avaliar a resposta inicial ao tratamento.(17) Durante a avaliação da resposta aguda, é possível observar a eliminação da maioria das células alvo, o que resulta em uma redução significativa na atividade metabólica do tumor.(17) Já a resposta completa inicial indica que o tratamento foi eficaz, mas é importante ressaltar que ainda se faz necessário um acompanhamento a longo prazo para garantir a durabilidade dessa resposta e monitorar possíveis recidivas.(17)
Entretanto, 6 meses após a infusão das células CAR-T, a avaliação da resposta a longo prazo assume um papel crucial. Essa avaliação visa determinar a estabilidade da resposta completa ao longo do tempo.(17) Quando se observa a consolidação da remissão, isso significa que a resposta inicial persiste e se mantém, indicando uma remissão completa ao longo do tempo.(17) É importante ressaltar que o prognóstico favorável está associado à resposta completa sustentada.(17) Isso significa que, se a resposta persistir, há uma perspectiva otimista em relação ao desfecho do tratamento, com uma redução significativa do risco de recidiva, proporcionando maior esperança e qualidade de vida ao paciente.(17)
Feng et al. (2020) observaram que a ativação intensa das células CAR-T após a infusão pode desencadear a liberação de citocinas pró-inflamatórias (Figura 6) na corrente sanguínea.(16) Isso, por sua vez, pode resultar na ocorrência da síndrome de liberação de citocinas, que geralmente se manifesta nos primeiros dias após a infusão das células CAR-T.(16) Essa síndrome envolve a rápida liberação de citocinas, como a interleucina 6, e pode ser monitorada através dos níveis da proteína C-reativa, que desempenha um papel crucial na avaliação da resposta imunológica e inflamatória.(16) Portanto, é importante acompanhar de perto esses marcadores para gerenciar os efeitos colaterais potenciais da terapia com células CAR-T.(16)
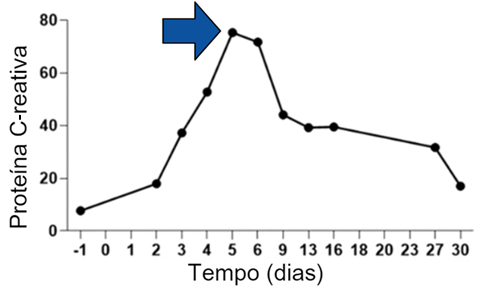
Figura 6
Medição da proteína C-reativa, demonstrando uma leve toxicidade de síndrome de liberação de citocinas de grau I após terapia com células CAR-T.
Fonte: Adaptado de Feng et al., 2020.
CONCLUSÕES
Com base nas informações e dados apresentados, conclui-se que os estudos e ensaios clínicos realizados na presente revisão da literatura científica demonstram que a terapia com células CAR-T possui o potencial de proporcionar remissão duradoura em pacientes com neoplasias linfoides e que a administração dos efeitos colaterais é um aspecto crucial no tratamento.(18,19)
A avaliação da resposta com o PET scan antes e após a infusão das células CAR-T é fundamental para avaliar a disseminação do câncer e a eficácia do tratamento.(20) Uma resposta completa no PET scan é indicativa de um tratamento eficaz e é um marco positivo no acompanhamento do paciente.(21) Comparar resultados de PET scans realizados em diferentes momentos após a infusão das células CAR-T é crucial.(22) O PET scan realizado 6 semanas após a infusão avalia a resposta inicial e a eficácia aguda do tratamento, enquanto um PET scan realizado 6 meses após a infusão examina a estabilidade da resposta completa e o prognóstico a longo prazo.(23,24)
A síndrome de liberação de citocinas é um efeito colateral potencial da terapia com células CAR-T, que está associada ao aumento dos níveis de citocinas pró-inflamatórias, como a interleucina 6, e da proteína C-reativa.(25) O monitoramento desses marcadores é importante para a identificação e o gerenciamento da SLC.(26)
Em resumo, os estudos apresentados destacam a importância da avaliação cuidadosa da resposta ao tratamento com células CAR-T, os desafios associados à síndrome de liberação de citocinas e a viabilidade do point-of-care como uma abordagem mais acessível e eficaz.(27) Esses avanços têm o potencial de melhorar significativamente o tratamento de pacientes com câncer, proporcionando melhores resultados e acessibilidade.(28)
REFERÊNCIAS
- Okikiolu J & McNamara C. (2015). Lymphoid neoplasms. Hematology (Amsterdam, Netherlands), 20(3), 182–183. https://doi.org/10.1179/1024533215z.000000000351
- Hanel W, Shindiapina P, Bond DA, Sawalha Y, Epperla N, Voorhees T, Welkie RL, et al. (2023). A phase 2 trial of ibrutinib and nivolumab in patients with relapsed or refractory classical Hodgkin’s lymphoma. Cancers, 15(5), 1437. https://doi.org/10.3390/cancers15051437
- Morton LM, Turner JJ, Cerhan JR, Linet MS, Treseler PA, Clarke CA, Jack A, et al. (2007). Proposed classification of lymphoid neoplasms for epidemiologic research from the Pathology Working Group of the International Lymphoma Epidemiology Consortium (InterLymph). Blood, 110(2), 695-708. https://doi.org/10.1182/blood-2006-11-051672
- Duffield AS, Mullighan CG & Borowitz MJ (2023). International Consensus Classification of acute lymphoblastic leukemia/lymphoma. Virchows Archiv: An International Journal of Pathology, 482(1), 11–26. https://doi.org/10.1007/s00428-022-03448-8
- Pasqui DM, Latorraca CdOC, Pacheco RL & Riera R (2022). CAR‐T cell therapy for patients with hematological malignancies. A systematic review. European Journal of Haematology, 109(6), 601-618. https://doi.org/10.1111/ejh.13851
- Tang L, Huang Z, Mei H & Hu Y (2023). Immunotherapy in hematologic malignancies: achievements, challenges and future prospects. Signal Transduction and Targeted Therapy, 8(1), 1-39. https://doi.org/10.1038/s41392-023-01521-5
- Haslauer T, Greil R, Zaborsky N & Geisberger R (2021). CAR T-cell therapy in hematological malignancies. International Journal of Molecular Sciences, 22(16), 8996. https://doi.org/10.3390/ijms22168996
- Butantan; USP; Hemocentro de Ribeirão Preto. Terapia contra o câncer com células CAR-T. Butantan, 2022. https://terapiacelular.butantan.gov.br/
- Lee M, Lee Y-H, Song J, Kim G, Jo Y, Min H, Kim CH & Park Y (2020). Deep-learning-based three-dimensional label-free tracking and analysis of immunological synapses of CAR-T cells. eLife, 9. https://doi.org/10.7554/elife.49023
- Ramos CA, Rouce R, Robertson CS, Reyna A, Narala N, Vyas G, Mehta B, et al. (2018). In vivo fate and activity of second- versus third-generation CD19-specific CAR-T cells in B cell non-Hodgkin’s lymphomas. Molecular Therapy: The Journal of the American Society of Gene Therapy, 26(12), 2727-2737. https://doi.org/10.1016/j.ymthe.2018.09.009
- Gong W-J, Qiu Y, Li M-H, Chen L-Y, Li Y-Y, Yu J-Q, Kang L-Q, et al. (2022). Investigation of the risk factors to predict cytokine release syndrome in relapsed or refractory B-cell acute lymphoblastic leukemia patients receiving IL-6 knocking down anti-CD19 chimeric antigen receptor T-cell therapy. Frontiers in immunology, 13. https://doi.org/10.3389/fimmu.2022.922212
- Lee M, Lee Y-H, Song J, Kim G, Jo Y, Min H, Kim CH & Park Y (2019). Deep-learning based three-dimensional label-free tracking and analysis of immunological synapses of chimeric antigen receptor T cells. Em bioRxiv (p. 539858). https://doi.org/10.1101/539858
- Zhao L & Cao YJ (2019). Engineered T cell therapy for cancer in the clinic. Frontiers in Immunology, 10. https://doi.org/10.3389/fimmu.2019.02250
- Moon P. A história da terapia CAR-T: 60 anos de evolução e pioneirismo em direção à cura do câncer. Butantan, 2023. https://butantan.gov.br/noticias/a-historia-da-terapia-car-t-60-anos-de-evolucao-e-pioneirismo-em-direcao-a-cura-do-cancer
- de Macedo Abdo L, Barros LRC, Saldanha Viegas M, Vieira Codeço Marques L, de Sousa Ferreira P, Chicaybam L & Bonamino MH (2020). Development of CAR-T cell therapy for B-ALL using a point-of-care approach. Oncoimmunology, 9(1). https://doi.org/10.1080/2162402x.2020.1752592
- Feng J, Xu H, Cinquina A, Wu Z, Chen Q, Zhang P, Wang X, et al. (2021). Treatment of aggressive T cell lymphoblastic lymphoma/leukemia using anti-CD5 CAR T cells. Stem Cell Reviews and Reports, 17(2), 652-661. https://doi.org/10.1007/s12015-020-10092-9
- Spiegel JY, Patel S, Muffly L, Hossain NM, Oak J, Baird JH, Frank MJ, et al. (2021). CAR T cells with dual targeting of CD19 and CD22 in adult patients with recurrent or refractory B cell malignancies: a phase 1 trial. Nature Medicine, 27(8), 1419-1431. https://doi.org/10.1038/s41591-021-01436-0
- Tudor T, Binder ZA & O’Rourke DM (2021). CAR T cells. Neurosurgery Clinics of North America, 32(2), 249–263. https://doi.org/10.1016/j.nec.2020.12.005
- Jin Z, MacPherson K, Liu Z & Vu LP (2023). RNA modifications in hematological malignancies. International Journal of Hematology, 117(6), 807-820. https://doi.org/10.1007/s12185-023-03576-0
- Swerdlow SH, Campo E, Pileri SA, Harris NL, Stein H, Siebert R, Advani R, et al (2016). The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood, 127(20), 2375-2390. https://doi.org/10.1182/blood-2016-01-643569
- Jia J, Wang X, Song Z, Meng S, Fei Y, Yu J, Liu X, et al. (2024). A retrospective analysis of mature T- and NK-cell lymphomas. Cancer biology & medicine, 21(3), 223-229. https://doi.org/10.20892/j.issn.2095-3941.2023.0464
- Ferrand C & Rambaldi A (2022). Myeloid Malignancies. Em The EBMT/EHA CAR-T Cell Handbook (p. 97-103). Springer International Publishing. https://link.springer.com/chapter/10.1007/978-3-030-94353-0_18#DOI
- Barros LRC, Couto SCF, da Silva Santurio D, Paixão EA, Cardoso F, da Silva VJ, Klinger P, et al. (2022). Systematic review of available CAR-T cell trials around the world. Cancers, 14(11), 2667. https://doi.org/10.3390/cancers14112667
- Lima MFde, Lisboa MdeO, Terceiro LEL, Rangel-Pozzo A & Mai S (2022). Chromosome territories in hematological malignancies. Cells (Basel, Switzerland), 11(8), 1368. https://doi.org/10.3390/cells11081368
- Brudno JN & Kochenderfer JN (2019). Recent advances in CAR T-cell toxicity: Mechanisms, manifestations and management. Blood Reviews, 34, 45-55. https://doi.org/10.1016/j.blre.2018.11.002
- Qi Y, Zhao M, Hu Y, Wang Y, Li P, Cao J, Shi M., et al. (2022). Efficacy and safety of CD19-specific CAR T cell–based therapy in B-cell acute lymphoblastic leukemia patients with CNSL. Blood, 139(23), 3376-3386. https://doi.org/10.1182/blood.2021013733
- Meng Y, Deng B, Rong L, Li C, Song W, Ling Z, Xu J, et al. (2021). Short-interval sequential CAR-T cell infusion may enhance prior CAR-T cell expansion to augment anti-lymphoma response in B-NHL. Frontiers in oncology, 11. https://doi.org/10.3389/fonc.2021.640166
- Polyatskin IL, Artemyeva AS & Krivolapov YA (2019). Revised WHO classification of tumors of hematopoietic and lymphoid tissues, 2017 (4th edition): lymphoid tumors. Arkhiv Patologii, 81(3), 59. https://doi.org/10.17116/patol20198103159
Correspondência
Patrick Menezes
E-mail: [email protected]
