Uso de amostras individualizadas e em pool no diagnóstico de parasitos intestinais
Use of individualized and pooled samples in the diagnosis of intestinal parasites
Juliana da Silva Matos1
Andreza Rodrigues Ramos1
Alynne da Silva Barbosa2
Otilio Machado Pereira Bastos3
Claudia Maria Antunes Uchôa4
1Discente de Graduação do Curso de Biomedicina da Universidade Federal Fluminense – UFF/RJ – Niterói – RJ, Brasil.
2Doutor. Docente da Disciplina de Parasitologia do Departamento de Microbiologia e Parasitologia (MIP), Instituto Biomédico (CMB),
Universidade Federal Fluminense – UFF/RJ e pós-doutoranda do Laboratório de Toxoplasmose, Instituto Oswaldo Cruz, Fiocruz – Rio de
Janeiro – RJ, Brasil.
3Doutor. Docente da Disciplina de Parasitologia do Departamento de Microbiologia e Parasitologia (MIP), Instituto Biomédico (CMB),
Universidade Federal Fluminense – UFF/RJ – Niterói – RJ, Brasil.
4Doutor. Professor associado. Universidade Federal Fluminense – UFF/RJ – Niterói – RJ, Brasil.
Instituição: Universidade Federal Fluminense – Instituto Biomédico. Departamento de Microbiologia e Parasitologia, Disciplina de Parasitologia – Niterói – RJ, Brasil.
Conflito de interesse: Não há conflito de interesse
Artigo recebido em 03/05/2017
Artigo aprovado em 02/10/2017
DOI: 10.21877/2448-3877.201700578
Resumo
Objetivo: O uso de amostras fecais de diferentes dias tem sido recomendado para aumentar a eficácia do diagnóstico de enteroparasitos. Porém, essa estratégia determina maior tempo de processamento e custo. Como alternativa, em algumas rotinas adota-se o uso de pool de amostras. Esse estudo teve como objetivo comparar o uso de amostras individualizadas e pool, no diagnóstico parasitológico. Métodos: Amostras de 24 indivíduos foram processadas de forma individual e em pool pelas técnicas de Ritchie modificada, Lutz e Faust et al. Resultados: Dos 24 participantes, 11 (45,8%) foram positivos para formas evolutivas de protozoários e helmintos. Em nove indivíduos positivos obteve-se concordância substancial (K=0,80) entre os resultados da análise de amostras individuais e em pool, o que foi confirmado pela análise estatística (p< 0,0001). No entanto, quando foi analisada a associação entre as abordagens empregadas, avaliando-se a análise individual vs. análise em pool, no presente estudo, foi observado que não houve diferença estatística significativa entre as taxas de positividade (p= 0,77). Quando comparado o resultado do uso de apenas uma amostra individual e do pool de amostras, a diferença não foi significativa (p= 0,75), indicando que, estatisticamente, no grupo de amostras analisadas não houve diferença entre o uso de uma amostra única ou do pool de amostras, embora o último tenha obtido maior número de amostras positivas. Conclusão: Nesse estudo, o uso do pool de amostras fecais para análises de amostras múltiplas representou uma estratégia eficaz no diagnóstico parasitológico por microscopia, reduzindo o tempo de processamento, com um melhor custo-benefício, gerando resultado eficaz e confiável.
Palavras-chave
Análise parasitológica; Fezes; Parasitos; Testes diagnósticos de rotina
INTRODUção
Parasitoses intestinais humanas são infecções causadas por helmintos e protozoários.(1) Essas infecções refletem as condições de vida de diferentes indivíduos nas comunidades, e a prevalência das mesmas é influenciada por diversos fatores, que, quando existem de formas satisfatórias, coíbem a expansão dessas parasitoses. Por mais que tenha ocorrido uma queda na prevalência de enteroparasitoses no Brasil, de maneira geral, essas ainda representam um problema de saúde em determinadas regiões do país.(2)
A maioria das enteroparasitoses é diagnosticada apenas com base em exames clínicos, contudo grande parte dos sinais e sintomas são inespecíficos, tornando, dessa forma, necessárias investigações laboratoriais para se chegar a um resultado fidedigno.(3) Os exames laboratoriais parasitológicos demonstram ser importantes procedimentos para o diagnóstico, uma vez que, na maioria das vezes, podem identificar se o indivíduo está parasitado ou não e, se positivo, qual espécie o está parasitando, direcionando assim para um tratamento específico adequado.(4)
Para o diagnóstico das doenças parasitárias intestinais, a pesquisa de parasitos nas fezes, também conhecido como exame parasitológico de fezes (EPF), é considerado fundamental, apesar de frequentemente não merecer a devida atenção por parte dos profissionais de saúde.(5)
Existem diversas técnicas que são utilizadas para o diagnóstico de protozoários e helmintos intestinais. Os procedimentos mais utilizados na rotina para diagnosticar os parasitos intestinais são as técnicas de enriquecimento coproparasitológicas, por sedimentação ou flutuação, pois permitem concentrar formas evolutivas de parasitos, determinar a sua presença e identificá-las até família, gênero ou espécie.(6)
Um ponto crítico no diagnóstico parasitológico microscópico é a amostra fecal. A análise de uma única amostra pode recuperar apenas algumas das formas evolutivas dos parasitos que estão infectando o hospedeiro. Essa situação pode estar relacionada à liberação intermitente de formas evolutivas por alguns helmintos como Schistosoma mansoni e protozoários como Giardia duodenalis.(7)
Para aumento da acurácia diagnóstica, frente à menor eficiência de uma única amostra, recomenda-se a análise de múltiplas amostras fecais, o que aumenta a probabilidade de encontro de formas evolutivas de parasitos.(7-10) A literatura preconiza a análise de três amostras fecais coletadas num intervalo de dois ou três dias durante um período de seis a dez dias.(7,11)
Todavia, a prática estabelecida de coleta de múltiplas amostras fecais eleva os custos, o tempo para obtenção de resultado e a carga de trabalho. Além disso, existe contínuo debate na literatura científica da real necessidade de análise de amostras múltiplas por paciente para a detecção confiável de parasitos intestinais. Andrews,(12) Sawitz e Faust,(13) Hiatt et al.(9) e Cartwright (14) defenderam a análise em separado de múltiplas amostras fecais no diagnóstico parasitológico, porém outros têm proposto o uso de amostras fecais em pool, resultando em um processamento único.(8,11,15-18) Baseado nesse contexto, esse estudo teve como objetivo comparar o uso de amostras individuais de diferentes dias e de pool dessas amostras no que se refere à sensibilidade do diagnóstico de parasitoses intestinais.
Material e métodos
Foram convidados para participar do estudo crianças e adultos inseridos em uma comunidade escolar durante o período de maio a junho de 2016, em Niterói, RJ. A amostragem foi por conveniência e dependente do retorno de amostra pelos indivíduos participantes. A participação foi voluntária e mediante assinatura de Termo de Consentimento Livre e Esclarecido (TCLE). Foi entregue a cada participante um kit coletor, composto por três recipientes de plástico, sendo dois com conservante Railliet-Henry e um sem conservante. O conservante foi escolhido por ser utilizado com excelentes resultados na rotina de coleta de amostras fecais do laboratório de Bioagentes Ambientais da UFF, tendo em sua composição solução salina, ácido acético e formol. Foi orientada de forma oral e por escrito a coleta de cerca de 40 gramas de fezes de dias diferentes, sendo eles consecutivos ou alternados.
Parte das amostras foi separada e processada na rotina do laboratório de Bioagentes Ambientais da UFF para determinação de positividade e negatividade, utilizando-se as técnicas de Lutz,(19) Ritchie(20) modificada por Young et al.(21) e Faust et al.(22) Outra parte foi reservada para realização desse estudo, tendo sido inseridas aquelas que apresentaram quantidade suficiente de amostra fecal.
Os resultados foram entregues na forma de laudo individual para cada participante, sendo orientado, em caso de positividade para parasitos patogênicos, a procura de atendimento médico. No caso de positividade para parasitos não patogênicos, foi informado ao participante que a presença desses parasitos não representava risco para a saúde, porém indicava baixa qualidade higiênico-sanitária, o que pode favorecer a aquisição de parasitos patogênicos.(23)
Após o diagnóstico preliminar, a amostra fecal de cada dia, coletada de forma individual, foi homogeneizada, pesada e foram separados 6 gramas para realização de todas as técnicas. Para confecção do pool, foram pesados 2 gramas adicionais da amostra de cada dia, que foram transferidos para outro coletor plástico primoutilizado e homogeneizados, totalizando 6 gramas.(18) As amostras individuais e em pool foram processadas posteriormente pelas três técnicas parasitológicas. Foi realizada a leitura de uma lâmina de cada técnica em microscópio óptico Olympus® BX41 em aumento de 100X e confirmação, quando necessária, em aumento de 400X.
Cada amostra individual e em pool, constituídas respectivamente por 6 gramas de fezes, foram eluídas em 20 mL de água destilada, sendo posteriormente filtradas em gaze dobrada quatro vezes sobre tamiz. A suspensão filtrada foi transferida para proveta graduada para aferir o volume recuperado de amostra, sendo esse ajustado para 21 mL, quando necessário, com água destilada. Padronizou-se o protocolo com 7 mL de filtrado da suspensão de material fecal para cada técnica. Para as técnicas de Ritchie modificada e Faust et al. foram transferidos 7 mL para dois tubos de fundo cônico tipo Falcon, de 15 mL, previamente identificados e, para técnica de Lutz, 7 mL foram transferidos para cálice de fundo cônico, sempre após homogeneização da amostra.
Os resultados obtidos foram analisados de forma descritiva e a concordância entre os tipos de amostras individual e em pool foram avaliados por meio do índice de concordância (Kappa). A análise da significância entre os resultados pelo uso de amostras individuais e em pool foi avaliada pelo teste Exato de Fisher, com intervalo de confiança de 5% utilizando-se o programa GraphPad QuickCalcs®.
Ética
Esse estudo fez parte do projeto “Parasitoses intestinais em escolares de Niterói, RJ: frequência, conhecimentos e profilaxia”, que obteve parecer favorável em 22 de abril de 2014 no Comitê de Ética em Pesquisa da Faculdade de Medicina/Hospital Universitário Antônio Pedro, possuindo registro de identificação no CEP, CMM/HUAP nº 621.193 e CAAE nº 25061913.0.0000.5243.
Resultados
Dos 41 indivíduos que entregaram amostras fecais, 24 foram inseridos nesse estudo, baseado na quantidade suficiente de amostra fecal enviada. Desses, nove coletaram duas amostras e 15 três amostras, totalizando 87 amostras, das quais 63 eram individuais e 24 em pool. Considerando o total de amostras e a realização de três técnicas parasitológicas distintas, realizaram-se 261 análises, das quais 189 foram nas amostras individuais e 72 nas em pool. Das 87 amostras analisadas, trinta foram positivas para formas evolutivas de parasitos intestinais. Na Tabela 1 são apresentados os resultados de positividade por amostra individual e em pool.
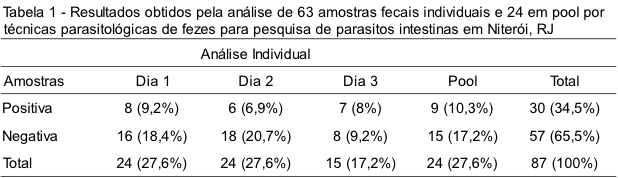
Considerando as trinta amostras positivas para alguma forma evolutiva de parasito intestinal, os mais detectados foram Blastocystis sp. e Endolimax nana, ambos diagnosticados em 13 amostras. Foram evidenciados: E. histolytica/E. dispar/E. hartmanni em oito (26,7%) amostras, Giardia duodenalis em sete (23,3%), Enterobius vermicularis em uma (3,3%). Em 22 amostras detectou-se apenas um parasito e em oito encontrou-se associação de uma ou mais espécies.
Dos 24 indivíduos participantes, 11 (45,8%) foram positivos para parasitos intestinais associando-se as duas formas de análise em pool e individual. Desses indivíduos, quatro realizaram coleta de dois dias, e sete, de três dias.
A espécie de parasito mais frequente foi Blastocystis sp., encontrada em sete (63,3%) indivíduos, seguida por E. nana em cinco (45,5%), E. histolytica/E. dispar/E. hartmani em três (27,3%), Giardia duodenalis em dois (18,2%) e Enterobius vermicularis em um (9,1%).
A concordância entre a positividade obtida por pelo menos uma amostra individual e o pool ocorreu em nove amostras (K= 0,80; P< 0,0001), sendo considerada substancial. No entanto, quando foi analisada a associação entre as abordagens empregadas no presente estudo (análise individual vs. análise em pool), foi observado que não houve diferença estatística significativa entre as taxas de positividades (P= 0,77). Foi observado que, quando as três ou duas amostras eram positivas individualmente, o pool foi positivo. Nos dois indivíduos em que o pool foi negativo, somente uma das amostras estava positiva, sendo observada nessas a presença de poucas formas evolutivas parasitárias de Blastocystis sp. Quando comparado o uso de apenas uma amostra individual e o pool, a diferença não foi significativa (P= 0,75). Nos 11 indivíduos positivos para parasitos intestinais, a análise de uma única amostra detectou o parasitismo em oito indivíduos. A segunda amostra individual detectou seis indivíduos positivos e a amostra do terceiro dia, sete. Em um participante, a positividade só foi evidenciada no segundo dia, e, em dois, no terceiro dia, considerando amostras individuais. Em uma das amostras positivas no terceiro dia, o pool foi positivo.
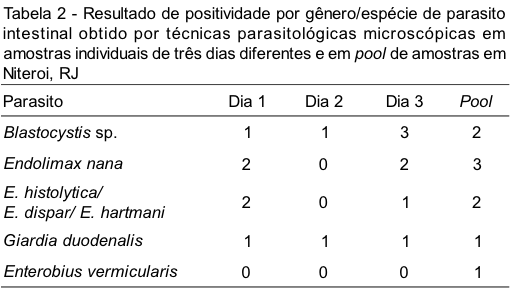
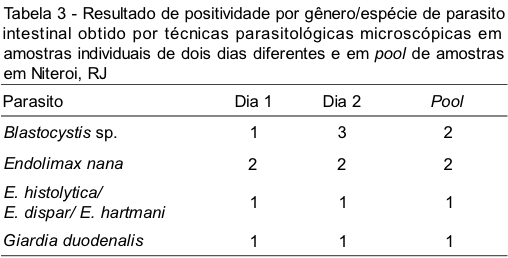
Em dois indivíduos, onde o diagnóstico do pool concordou com o das amostras individuais quanto à positividade, houve discordância com relação às espécies parasitárias, sendo detectado somente no pool de amostras, em um indivíduo, presença de ovos de Enterobius vermicularis e cistos de Endolimax nana e, em outro, forma vacuolar de Blastocystis sp. Em um terceiro indivíduo houve discordância entre as amostras individuais, tendo sido capaz de recuperar apenas no pool de amostras todas as espécies parasitárias detectadas. Os resultados obtidos por espécie parasitária com relação às amostras individuais ou em pool estão demonstrados nas Tabelas 2 e 3.
Discussão
A maioria dos indivíduos que entregaram amostra fecal coletou pouca quantidade de material, apesar das orientações orais e escritas, o que resultou na inserção nesse estudo de 24 indivíduos. A literatura aponta a importância da coleta de pelo menos 50 mL de amostra fecal ou de fezes inteiras, possibilitando que o profissional responsável pelo diagnóstico possa escolher a porção mais provável de ter o diagnóstico positivo,(7) ou realizar mais de uma técnica, aumentando a sensibilidade do diagnóstico. Tal fato fundamenta-se na dispersão heterogênea de formas evolutivas de parasitos intestinais nas fezes eliminadas pelo hospedeiro, associada à espécie parasitária.(7,23) A pouca quantidade de material fecal entregue interferiu na seleção de amostras, como também pode ter influenciado na eficácia do diagnóstico, apesar de ter sido realizada a orientação quanto à coleta de amostras. Essa situação demonstra a importância da orientação na coleta de amostras pelos profissionais de saúde como enfermeiros, técnicos em enfermagem, técnicos em laboratório de análises clínicas, farmacêuticos, biólogos e biomédicos, a fim de minimizar erros no diagnóstico parasitológico por microscopia.
Outro fator complicador no diagnóstico parasitológico é a coleta de múltiplas amostras. Apesar de autores como Andrews,(12) Sawitz e Faust,(13) Hiatt et al.(9) e Cartwright(14) defenderem que a coleta de amostras múltiplas resulta em maior eficácia no diagnóstico, esse procedimento representa um fator limitante. Hira et al.(24) relataram que o uso de amostra múltiplas nem sempre é solicitado pelo médico devido a ser inconveniente, demorar muito tempo para processamento e seu resultado não ter influência direta no tratamento, associado à relutância do paciente em realizar esse tipo de coleta, no caso de infecções por Strongyloides stercoralis. Observou-se no presente estudo que vários participantes entregaram duas amostras e que a não adesão ao estudo por outros pode ter sido associada a esse fato.
No presente estudo, houve casos de discordância entre os resultados por gênero/espécie entre as amostras individuais de dias diferentes. Essa situação pode estar relacionada à liberação intermitente de formas evolutivas por alguns parasitos intestinais, como relatado nos estudos de Tsuchiya,(25) para Giardia duodenalis, e de Vennila,(26) para Blastocystis sp.
A concordância da análise de amostras em pool e de amostras individuais mostrou-se, segundo a classificação de Landis e Koch,(27) como substancial, o que indica que houve concordância de resultados positivos em 80% das amostras. Resultados similares foram obtidos por Peters et al.,(15) que, em 123 conjuntos, verificaram maior eficiência do pool; por Wahlquist et al.,(8) que avaliaram 267 amostras em pool com os resultados de suas amostras individuais preservadas em formalina para diagnóstico de Giardia duodenalis, sugerindo que o uso de amostras em pool pode ser útil no diagnóstico de Giardia duodenalis, economizando tempo e dinheiro; por Aldeen et al.,(11) que analisaram comparativamente amostras de 265 pacientes, concluindo que o pool não promove a diluição de formas evolutivas de parasitos a ponto de não serem detectadas pelas técnicas de rotina, e Libman et al.,(16) que avaliaram 231 pares de amostras e verificaram que o pool apresentou a mesma sensibilidade para detecção da presença de protozoários quanto à análise individual das mesmas amostras, com melhor custo-benefício. A análise de amostras em pool, como já apontado pelos autores anteriormente apresentados, representa economia de tempo e de custo na rotina laboratorial.
Entretanto, a diferença estatística entre os resultados do uso de amostras individuais de dois ou três dias associados e os do em pool não foi significativa, embora numericamente os resultados do uso de amostras individuais em conjunto tenham garantido maior eficácia no diagnóstico para obtenção de resultados positivos, porém implica maior custo e tempo. De forma similar, quando se comparou o resultado do pool com o resultado da análise de apenas uma amostra individual, não houve diferença estatística significativa (P=0,75), indicando que, estatisticamente, no grupo de amostras analisadas não há diferença entre o uso de uma única amostra fecal ou do pool de amostras. Cabe ressaltar que o pool obteve, em número absoluto, um maior número de amostras positivas, o que o torna uma estratégia mais interessante do que amostra única. A diferença de resultado obtido em números absolutos representou diagnóstico positivo em maior número de indivíduos, que, em casos de parasitos patogênicos, torna-se importante na prevenção de doença e transmissão.
Branda et al.(28) propõem que, em procedimentos envolvendo múltiplas amostras, para redução de tempo e custo, deve-se analisar uma única amostra. Quando o resultado dessa amostra individual for negativo e os sintomas persistirem, deve-se analisar a segunda e/ou terceira amostra. Wahlquist et al.(8) propuseram que, em caso de pool negativo e suspeita clínica de infecção por Giardia duodenalis, deve-se fazer análise de amostras individuais de dias diferentes. Da mesma forma, sugere-se, nesse estudo, que, em casos de pool negativo em pacientes sintomáticos, seja realizada a repetição do exame nas amostras individualizadas para minimizar o efeito de diluição de formas evolutivas de parasitos determinado pelo pool de amostras fecais.
Nesse estudo foi observado que, quando apenas uma das amostras individuais era positiva, o pool de amostras apresentou resultado negativo. Quando duas ou mais amostras eram positivas, o pool de amostras também foi positivo, o que concorda com os resultados obtidos por Wahlquist et al.(8) Torna-se, dessa forma, importante que, no laboratório de análises clínicas, quando forem processadas amostras em pool, que o responsável técnico guarde parte das amostras individualizadas para repetição, caso necessário, evitando o desgaste de nova coleta pelo paciente.
Considerando a proposta de Morris et al.(29) de análise de uma única amostra fecal, nesse estudo, o exame individual de uma única amostra determinou positividade de 72,7% (8/11) dos indivíduos positivos. Esse resultado foi similar ao obtido por Cartwright (1999), que obteve com uma única amostra individual eficácia em 75,9% dos resultados e diferiram dos relatados por Morris et al.(29) que obtiveram 93,3% de eficácia e Senay e Macpherson,(30) que alcançaram 93,5%. A adição de uma segunda análise determinou positividade em 9/11 (81,8%) indivíduos, sendo similar ao obtido pelo pool. Apesar desse aumento de eficiência, os resultados obtidos foram inferiores aos obtidos por Cartwright.(14) A maior eficiência foi atingida pelo uso de três amostras de dias diferentes. Considerando o trabalho e custo de processamento de duas amostras individuais, o pool demonstrou ser a estratégia mais adequada.
A diferença de diversidade de espécies em amostras em pool quando comparadas com amostras individualizadas também foi observada por Peters et al.,(15) onde foi observada menor diversidade no pool, sendo contrário ao observado nesse estudo. O pool de amostras permitiu o diagnóstico de maior diversidade parasitária do que as amostras individuais, no presente estudo. Tal fato pode ter sido devido ao fracionamento aleatório da amostra no momento de porcionamento das alíquotas, apesar das amostras terem sido homogenizadas.
Conclusões
Os resultados obtidos, apesar do pequeno número de indivíduos inseridos no estudo, em função da quantidade enviada ao laboratório, possibilitou inferir que o uso de pool em análises de amostras múltiplas representa uma estratégia eficaz no diagnóstico parasitológico por microscopia. Essa estratégia reduz o tempo de processamento de amostras, resultando em menor custo com funcionário e infraestrutura, bem como a redução de gastos com bens de consumo e bens permanentes no laboratório de análises clínicas, gerando um resultado tão eficaz e confiável como a análise de amostra individualizada.
Abstract
Objective: The use of multiple fecal samples of different days has been recommended in order to increase the effectiveness of intestinal parasitosis diagnosis. This strategy increases processing time and costs. Alternatively, some routines adopt the analysis of samples in pool. This study aimed to compare the results of individual and pooled samples in parasitological diagnosis by microscopy. Methods: Samples of 24 individuals were processed individually and pooled by the modified Ritchie, Lutz and Faust et al. techniques. Results: Of the 24 participants, 11 (45, 8%) were positive to evolutive forms of protozoa and helminths. In nine positive samples the results between samples had a substantial agreement (K=0, 80) which was confirmed by statistical analysis (p< 0, 0001). However, when was analyzed the association between the approaches employed evaluating individual analysis vs. analysis in pool in the present study it was observed that there was no statistically significant difference between the positive rates (p=0, 77). When compared the results of using only a single sample and the pool samples, the difference was not significant, indicating that there is no difference between using a single sample or pooled samples in the samples group analyzed statistically, although the pool samples have increased the positive results. Conclusion: In this study the use of pooled stool is an effective strategy in parasitological microscopy, reducing processing time and improving cost-effective, producing more effective and reliable results.
Keywords
Parasitological analysis; Feces; Parasites; Routine diagnostic tests
REFERÊNCIAS
- Moura EC, Bragazza L, Coelho MF, Aun SM. Prevalence of intestinal parasitosis in schoolchildren. J Pediatr (Rio J). 1997;73(6): 406-10. [Article in Portuguese]
- Chieffi PP, Amato Neto V. Vermes, verminoses e a saúde pública. Cienc. Cult. 2003; 55(1):41-3.
- Halabe Cherem J, Than Gómez MT, Cortés Lawrenz J, Laredo Sánchez F, Wacher Rodarte N, Lifshitz Guinzberg A, et al. An approach to re-evaluating fecal parasitological examinations. Gac Med Mex. 1992;128(2):134-7. [Article in Spanish]
- Menezes RAO, Gomes MSM, Barbos FHF, Machado RLD, Andrade RF, Couto AARD. Sensibilidade de Métodos Parasitológicos para o Diagnóstico das Enteroparasitoses em Macapá – Amapá, Brasil. Rev. Biol. Ciências da Terra. 2013;13(2):66-73.
- Tibiriça SHC, Abramo C, Simões AS, Pinheiro IO, Ribeiro LC, Coimbra ES. Validação do número de lâminas para realização do método de sedimentação espontânea das fezes. Hu Revista. 2009;35(2):105-10.
- Navone GT, Gamboa MI, Kozubsky LE, Costas ME, Cardozo MS, Sisliauskas MN, Gonzalez M. Estudio comparativo de recuperación de formas parasitarias por tres diferentes métodos de enriquecimiento coproparasitológico. Parasitol. latinoam., Santiago. 2005;60(3-4):178-181.
- Koontz F, Weinstock JV. The approach to stool examination for parasites. Gastroenterol Clin North Am. 1996;25(3):435-49.
- Wahlquist SP, Williams RM, Bishop H, Addiss DG, Stewart JM, Finton RJ, et al. Use of pooled formalin-preserved fecal specimens to detect Giardia lamblia. J Clin Microbiol. 1991;29(8):1725-6.
- Hiatt RA, Markell EK, Ng E. How many stool examinations are necessary to detect pathogenic intestinal protozoa? Am J Trop Med Hyg. 1995;53(1):36-9.
- Fernandes S, Beorlegui M, Brito MJ, Rocha G. Protocolo de parasitoses intestinais. Acta Pediatr. Port. 2012;43(1):34-40.
- Aldeen WE, Shisenant J, Hale D, Matsen J, Carroll K. Comparison of pooled formalin-preserved fecal specimens with three individual samples for detection of intestinal parasites. J Clin Microbiol. 1993;31(1):144-5.
- Andrews J. The diagnosis of intestinal protozoa from purged and normally passed stools. J Parasitol 1934;20:253-4.
- Sawitz WG, Faust EC. The probability of detecting intestinal protozoa by successive stool examinations. Am J Trop Med. 1942;22(2):131-6.
- Cartwright CP. Utility of multiple-stool-specimen ova and parasite examinations in a high-prevalence setting. J Clin Microbiol. 1999;37(8):2408-11.
- Peters CS, Hernandez L, Sheffield N, Chittom-Swiatlo AL, Kocka FE. Cost containment of formalin-preserved stool specimens for ova and parasites from outpatients. J Clin Microbiol. 1988;26 (8):1584-5.
- Libman MD, Gyorkos TW, Kokoskin E, Maclean JD. Detection of pathogenic protozoa in the diagnostic laboratory: result reproducibility, specimen pooling, and competency assessment. J Clin Microbiol. 2008;46(7):2200-5.
- Mekonnen Z, Meka S, Ayana M, Bogers J, Vercruysse J, Levecke B. Comparison of individual and pooled stool samples for the assessment of soil-transmitted helminth infection intensity and drug efficacy. PLoS Negl Trop Dis. 2013;7(5):e2189.
- Kure A, Mekonnen Z, Dana D, Bajiro M, Ayana M, Vercruysse J, et al. Comparison of individual and pooled stool samples for the assessment of intensity of Schistosoma mansoni and soil-transmitted helminth infections using the Kato-Katz technique. Parasites & Vectors. 2015;8(1):489.
- Lutz A. Schistosomum mansoni and Schistosomatosis observed in Brazil. Mem. Inst. Oswaldo Cruz. 1919;11(1):121-55.
- Ritchie LS. Ritchie LS. An ether sedimentation technique for routine stool examination. Bull U S Army Med Dep. 1948; 8(4):326.
- Young HK, Bullock SL, Melvin DM, Spruill CL. Ethyl acetate as a substitute for diethyl ether in the formalin-ether sedimentation technique. J. Clin. Microbiol. 1979;10(6):852-3.
- Faust EC, D’Antoni JS, Odon V, Miller MJ, Perez C, Sawitz W, et al. A critical study of clinical laboratory technics of the diagnosis of protozoan cysts and helminth eggs in feces. I – Preliminary communication. Amer. J. trop. Med. 1938;18:169-83
- Gonçalves AL, Belizário TL, Pimentel Jde B, Penatti MP, Pedroso Rdos S. Prevalence of intestinal parasites in preschool children in the region of Uberlândia, State of Minas Gerais, Brazil. Rev Soc Bras Med Trop. 2011;44(2):191-3.
- Araujo AJUS, Kanamura HY, Dias LCS, Gomes JF, Araújo SM. Coprotest® quantitativo: quantificação de ovos de helmintos em amostras fecais utilizando-se sistema de diagnóstico comercial. J. Bras. Patol. Med. Lab., Rio de Janeiro. 2003;39(2):115-24.
- Hira PR, Al-ali F, Shweiki HM, Abdella NA, Johny M, Francis I, et al. Strongyloidiasis: challenges in diagnosis and management in non-endemic Kuwait. Ann Trop Med Parasitol. 2004;98(3):261-70.
- Tsuchiya H. A study on variabilities in dimensions and numbers of discharged cysts of Giardia lamblia (Stiles, 1915) from day to day under normal conditions. Am J Epidemiol.1931;13(2):544-67.
- Vennila GD, Suresh Kumar G, Khairul Anuar A, Rajah S, Saminathan R, Sivanandan S, et al. Irregular shedding of Blastocystis hominis. Parasitol Res. 1999;85(2):162-4.
- Landis JR, Koch GG. The measurement of observer agreement for categorical data. Biometrics. 1977;33(1):159-74.
- Branda JA, Lin TY, Rosenberg ES, Halpern EF, Ferraro MJ. A rational approach to the stool ova and parasite examination. Clin Infect Dis. 2006;42(7):972-8.
- Morris AJ, Wilson ML, Reller LB. Application of rejection criteria for stool ovum and parasite examinations. J Clin Microbiol. 1992; 30(12):3213-6.
- Senay H, MacPherson D. Parasitology: diagnostic yield of stool examination. CMAJ. 1989;140(11):1329-31.
Correspondência
Claudia Maria Antunes Uchôa
Laboratório de Bioagentes Ambientais
Departamento de Microbiologia e Parasitologia (MIP)
Instituto Biomédico (CMB)
Universidade Federal Fluminense (UFF/RJ)
Rua Prof. Hernani Pires de Melo, n° 101
24210 -130 – Niterói – RJ, Brasil
tel: (21) 2629-2426
