Uso de biomarcadores sanguíneos no diagnóstico da doença de Alzheimer: um futuro próximo?
Use of blood biomarkers in the diagnosis of Alzheimer’s disease: a near future?
Moacir Palheta Cereja1
Nágila Martins Carvalho1
Simone Suelen Rodrigues Amparado2
Symara Rodrigues-Antunes3
Danielle Cristinne Azevedo Feio3
1Biomédico. Centro Universitário Metropolitano da Amazônia (UNIFAMAZ). Belém-PA, Brasil.
2Enfermeira. Universidade Estadual de Minas Gerais – Belo Horizonte-MG, Brasil.
33Biomédica. Doutora em Neurociências e Biologia Celular pela Universidade Federal do Pará. Professora – Centro Universitário Metropolitano da Amazônia (UNIFAMAZ). Belém-PA, Brasil.
Instituição: Centro Universitário Metropolitano da Amazônia (UNIFAMAZ). Belém-PA, Brasil.
Conflitos de interesse: não há conflito de interesses
Recebido em 20/07/2019
Artigo aprovado em 12/12/2019
DOI: 10.21877/2448-3877.201900880
INTRODUÇÃO
A doença de Alzheimer (DA) é considerada uma demência neurodegenerativa, e sua principal característica é o acúmulo de placas amiloides extraneurais, além de emaranhados neurofibrilares intraneurais localizados em regiões do cérebro como o lobo temporal; os acúmulos dessas placas já estão descritos por cooperarem para um declínio cognitivo progressivo.(1,2) No início da patologia, o paciente apresenta um comprometimento da memória episódica, e com a evolução da mesma ocorre uma irregularidade da memória semântica, seguida de prejuízos em habilidades visuoespaciais e funções executivas.(3)
O declínio cognitivo da memória em pacientes portadores da doença de Alzheimer pode ser apontado como um elemento de extrema importância para o diagnóstico diferencial entre o envelhecimento normal e o patológico.(4) A DA é a forma mais comum de demência, sendo uma das quatro primeiras causas mais frequentes de morte em países desenvolvidos. A doença de Alzheimer é tida como tardia e identificada pelos seus sintomas, que iniciam a partir dos 65 anos de idade ou mais, tendo uma correspondência de 95% dos casos já registrados.(5)
O envelhecimento da população em decorrência do aumento da expectativa de vida é um fenômeno mundial, que apresenta consequência direta no sistema de saúde pública, tendo como uma das principais consequências do aumento desta parcela da população o crescimento da prevalência de demências, especialmente da DA.(6) Dessa maneira, é de extrema importância a identificação de indivíduos que apresentem potenciais riscos de desenvolver demência. Apesar de gerar discussões, o diagnóstico precoce das demências possibilita uma possível intervenção terapêutica, melhorando dessa forma não só a vida do portador como também dos familiares, por meio, por exemplo, da redução de riscos de acidente, prolongando autonomia e, em alguns casos, retardando o início do processo demencial.(7)
Desta forma, o presente estudo reconhece a necessidade de uma revisão sobre o tema para avaliar e identificar diferentes técnicas que utilizem biomarcadores sanguíneos para o diagnóstico da doença de Alzheimer, com a finalidade de estabelecer precocemente o diagnóstico utilizando-se de métodos menos invasivos.
Material e Métodos
Foi realizada uma pesquisa bibliográfica do tipo integrativa, norteada pela seguinte questão: “existem biomarcadores sanguíneos viáveis para diagnóstico da doença de Alzheimer?” O estudo tem um caráter retrospectivo e temporal, devido ao levantamento de dados ter sido realizado no mês de agosto de 2019 e ser referente aos anos de 2013 a 2019. A pesquisa foi efetivada a partir das bases de dados PubMed e Scielo, utilizando os descritores: “Biomarcadores, Sangue, Diagnóstico e Alzheimer”, em português e em inglês combinados da seguinte forma: “blood-based biomarkers, alzheimer’s, disease“. A busca e a seleção dos artigos incluídos nesta revisão foram realizadas por três revisores de forma independente, com a participação do quarto e quinto revisor quando não houve consenso.
Os critérios de inclusão adotados incluíram os seguintes parâmetros: artigos que avaliaram os biomarcadores sanguíneos na doença de Alzheimer e/ou em estudos comparativos de declínio cognitivo com Alzheimer, artigos publicados nos anos de 2013 a 2019, artigos do tipo estudo clínico e escritos em português ou inglês. Já os critérios de exclusão incluíram: artigos que utilizaram os biomarcadores sanguíneos somente em pacientes com declínio cognitivo; artigos publicados há mais de sete anos; artigos em outras línguas; artigos que abordavam biomarcadores em outros fluídos corporais, material obtido através de autópsia dos pacientes; artigos que avaliaram biomarcadores somente com técnicas de diagnóstico por imagem, artigos com número amostral de pacientes com DA menor que dez e artigos do tipo revisão, relato de caso e carta ao editor.
RESULTADOS
A pesquisa resultou em um total de 186 artigos utilizando os descritores “Blood-based biomarker’s Alzheimer’s disease“, com uso do filtro para ensaio clínico e artigos dos últimos sete anos, na base de dados PubMed. Contudo, na base de dados Scielo, utilizando-se dos mesmos descritores, não resultou em nenhum artigo encontrado.
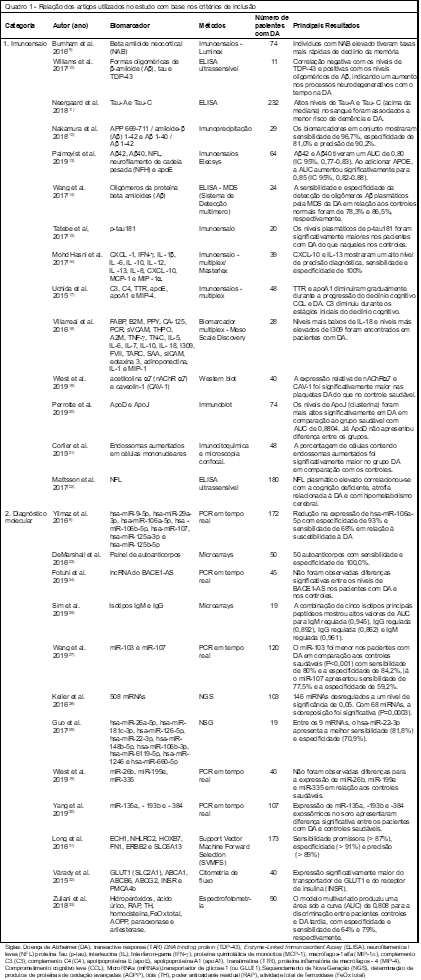
Dos 186 artigos, 161 foram excluídos por não se enquadrarem nos critérios pré-estabelecidos. Desta forma, foram selecionados 25 que se encontravam dentro dos critérios de inclusão estabelecidos. Os artigos foram então classificados com base no método dos testes nas seguintes categorias: imunoensaios, com 13 artigos (52%); diagnóstico molecular, com oito artigos (32%), diagnóstico molecular e imunoensaios associados com um artigo (4%); e outros métodos com apenas três artigos (12%). No Quadro 1 os dados encontram-se resumidos para melhor visualização.
Todos os artigos selecionados são do tipo estudo clínico, sendo, destes, 12% publicados em 2015, 24% em 2016, 24% em 2017, 12% em 2018 e 28% em 2019. A maioria dos estudos utilizou proteínas como biomarcadores sanguíneos, já os demais utilizaram o ácido ribonucleico – RNA, endossoma, marcadores relacionados ao estresse oxidativo e anticorpos.
Na avaliação dos estudos, observamos que todas as técnicas utilizadas se mostraram relevantes para uso no diagnóstico de DA e na diferenciação de outras patologias neurodegenerativas. Entretanto, nem todos os artigos atribuíram a especificidade e sensibilidade dos biomarcadores utilizados.
DISCUSSÃO
Os métodos de diagnósticos de DA utilizados atualmente na prática clínica apresentam baixa especificidade ou alto custo financeiro, o que dificulta o diagnóstico precoce e diferencial em relação a outras patologias neurológicas. Desta forma, avaliar e/ou validar possíveis biomarcadores sanguíneos para o diagnóstico da doença de Alzheimer, utilizando como base proteínas, microRNA ou autoanticorpos, pode proporcionar um excelente custo benefício.(8) Neste artigo foram feitas considerações clínico-laboratoriais sobre a viabilidade dos biomarcadores relacionados ao sangue e métodos diagnósticos nas seções seguintes do presente artigo.
Categoria 1: Imunoensaios
Burnham et al.(9) avaliaram o perfil proteico do sangue em indivíduos que já apresentavam identificação para alta ou baixa carga beta-amiloide neocortical, com objetivo de quantificar esses marcadores por um período correspondente a 54 meses para facilitar a identificação de progressão para a DA. Para isso foi necessário gerar o perfil sanguíneo de um total de 585 pessoas saudáveis, para o controle, com a participação de 74 pacientes com comprometimento cognitivo leve. Esse perfil não apenas forneceu uma aproximação do aumento da carga beta-amiloide neocortical (NAB) como se associou a um declínio cognitivo e provável progressão da doença. Além disso, os autores também identificaram indivíduos com riscos de progressão da DA no período prodrômico e estágios pré-clínicos. Tais resultados colaboraram com a possibilidade de NAB ser utilizado como um biomarcador em futuro próximo.
Além da carga de NAB, as formas oligoméricas de b-amiloide (Ab), tau e TDP-43 desempenham papéis importantes na doença de Alzheimer e, portanto, são considerados biomarcadores promissores. Desta forma, verificou-se que todas as amostras apresentaram níveis elevados de proteína variante no plasma em relação ao controle, embora com diferentes perfis de biomarcadores individuais. Em seguida, ao ser analisado um conjunto de amostras longitudinais, foi observado que as amostras pré-CCL foram caracterizadas por altos níveis de TDP-43; já as amostras de pacientes com comprometimento cognitivo leve (CCL) apresentavam altos níveis de Ab e amostras de pacientes com DA por altos níveis de Ab e tau. Correlações bivariadas mostraram uma correlação negativa com os níveis de TDP-43 e correlações positivas com os níveis cumulativos de Ab, indicando um aumento nos processos neurodegenerativos com o tempo na DA. A detecção de variantes proteicas relacionadas à doença não apenas pode selecionar prontamente casos de DA, mas também acompanhar a sua progressão e tornar-se um promissor biomarcador na fase pré-sintomática.(10)
A utilidade prognóstica de Tau-A e Tau-C foi avaliada em um grande estudo prospectivo, que demonstrou que ambos os biomarcadores, em particular o Tau-C, foram associados à demência, onde os seus altos níveis apresentavam menor risco incidente de demência e DA.(11) Já outro estudo verificou a capacidade da proteína precursora de b-amiloide (APP669-711) e suas formas oligoméricas b-amiloide (Ab1-42, Ab1-40 e Ab1-42) de prever um status positivo individual de cérebro com deposição amiloide, nos quais estes biomarcadores em conjunto mostraram alto desempenho com elevada área sob a curva (AUC) no conjunto de dados (96,7%). Esses resultados demonstram o seu potencial de utilização clínica na previsão do nível de carga cerebral de b-amiloide individual.(12)
O estudo de Palmqvist et al.(13) também analisou o status Ab, especificamente os subtipos Ab42 e Ab40, onde obteve um valor de AUC de 0,80. Entretanto, ao adicionar na análise a apolipoproteína E (apo E), a AUC aumentou significativamente para 0,85. A análise realizada por Wang et al.(14) também observou índices maiores dos níveis plasmáticos de oligômeros Ab em pacientes com DA do que em indivíduos controle normais, através do sistema de detecção multímero (SDM). A sensibilidade e especificidade da detecção plasmática de oligômeros Ab da DA em relação ao controle foi de 78,3% e 86,5%, respectivamente. Já a AUC dos oligômeros Ab foi de 0,844, o que não foi significativamente diferente da AUC de outros biomarcadores (p=0,250). Desta forma, os níveis plasmáticos de oligômeros Ab podem, por meio de diferentes técnicas, ser um biomarcador simples, não invasivo e acessível para avaliar a deposição amiloide cerebral relacionada à DA.
A quantificação da tau plasmática fosforilada na treonina 181 (p-tau181) foi investigada para um possível papel no diagnóstico da DA, o qual se verificou, no primeiro coorte composto, que os níveis plasmáticos de p-tau181 foram significativamente maiores nos pacientes com DA (0,171 ± 0,166 pg/mL) do que aqueles nos controles (0,0405 ± 0,0756 pg/mL, p=0,0039). A porcentagem dos indivíduos cujos níveis de plasma p-tau181 excederam o valor de coorte foi significativamente maior no grupo DA (60%) em comparação com o grupo controle (16,7%). No segundo coorte composto por vinte pacientes com síndrome de Down (SD) e 22 controles pareados por idade, as concentrações plasmáticas de p-tau181 foram significativamente maiores no grupo SD (0,767 ± 1,26 pg/mL, p = 0,0313). No terceiro coorte composto por oito pacientes com DA e três com outras doenças neurológicas, os níveis plasmáticos de p-tau181 correlacionaram-se significativamente com os do p-tau181 no líquido cefalorraquidiano (LCR). Tais dados sugerem que o nível plasmático de p-tau181 é um biomarcador sanguíneo promissor para o diagnóstico da patologia cerebral da DA.(15)
Os mediadores inflamatórios têm apresentado grande potencial como biomarcadores em relação à detecção e monitoração da DA, uma vez que, no início da inflamação, as células da glia (micróglia e astrócitos) servem como primeira linha de defesa em lesões do cérebro, acumulando-se durante a neuroinflamação, fortemente associada à excessiva agregação de beta-amiloide. Na DA, essa ativação da microglia e astrócitos pode levar à liberação de mediadores pró-inflamatórios, incluindo citocinas, fatores de complemento, espécies reativas de oxigênio e produtos neurotóxicos, que podem potencialmente aumentar os danos neuronais e acelerar a progressão da patologia.(16)
Por esse motivo, tem-se a hipótese de que proteínas sequestradoras possuem potencial clínico para a avaliação de riscos do CCL e para o diagnóstico precoce de DA. Sendo assim, foram analisados biomarcadores através de proteínas envolvidas no sequestro de b-amiloide, sendo estas Apo A1, C3 e TTR, onde se verificou, através de um coorte longitudinal e transversal, uma combinação da Apo A1, C3 e TTR, alcançando uma AUC de 0,89, com sensibilidade de 91% e especificidade de 80% na CCL em relação a controles saudáveis. Nos resultados obtidos na comparação da DA versus controle, foi revelado que a apo A1 teve a AUC de 0,76, com sensibilidade de 74%, especificidade de 71% (p< 0,0001) e TTR com um AUC de 0,76, com sensibilidade 74%, especificidade de 69% (p<0,0001), demonstrando-se como uma importante ferramenta para a avaliação dos estágios precoces do comprometimento cognitivo e DA.(17)
Além do exposto, pesquisadores da Malásia avaliaram, a partir das características dos mediadores associados à neuroinflamação, um perfil de 12 citocinas classificadas como clássicas (IL-1b, IL-6, IL-12, IFN-g, TNF-a e IL-10) e não clássicas (Cxcl-1, IL-8, CXCL-10, MCP-1, MIP-1a e IL-13). Foi constatado um aumento significativo nas concentrações de IL-1b, IL-6, IL-12 e IFN-g nos pacientes com DA em relação ao controle, assim como das citocinas pró-inflamatórias CXCL-10, MCP-1 e MIP-1a. Além disso, foi demonstrado uma correlação significativa entre a pontuação do MMSE com o aumento da CXCL-10 e diminuição da IL-13, associados com a progressão da DA, com 100% de sensibilidade e especificidade para DA, o que demonstra sua capacidade como um promissor biomarcador sanguíneo da doença de Alzheimer.(16)
A interleucina 18 (IL18) vem sendo descrita como provável mediador de processos patogênicos cerebrais e ativador da micróglia envolvida em funções neuroendócrinas e neuroimunes. A I309, por sua vez, apresenta um aumento de tauopatia em modelos experimentais, além de esta glicoproteína ser encontrada elevada no LCR de indivíduos portadores de DA. Um estudo propôs examinar tais substâncias como prováveis marcadores individuais no sangue, sendo revelado que as proteínas IL-18, no grupo com DA, apresentaram níveis baixos (p=0,001) quando comparados aos controles (p=0,009) e ao CCL (p=0,014); entretanto, a I309 apresentou níveis mais elevados em pacientes com DA e no CCL do que os apresentados no grupo controle.(18)
Desta maneira observa-se que muitos marcadores plasmáticos de inflamação foram identificados para apoiar o diagnóstico de DA. Com base nessa característica, Wiest et al.(19) resolveram avaliar as particularidades das plaquetas como modelo de biomarcador. Os pesquisadores observaram que os níveis de expressão proteica de nAChRa7 e CAV-1, em relação ao controle saudável, foram significativamente maiores nas plaquetas de pacientes com DA. Tal resultado apresenta destaque pois ambas as proteínas são expressas em células neuronais e nas plaquetas. A análise morfométrica, por sua vez, revelou que, no grupo de pacientes com DA, as plaquetas eram maiores e tinham um contorno mais uniforme do que em controles saudáveis.
Do ponto de vista metabólico, o estresse oxidativo desempenha um papel fundamental na fisiopatologia da doença de Alzheimer (DA). Neste aspecto surge então a necessidade de se observarem alguns marcadores redox periféricos e suas relações com os escores de testes cognitivos complementares. Os resultados observados, em um estudo com esse objetivo, demostraram que a proteína plasmática carbonila e os níveis de ApoJ foram negativamente associados aos escores clínicos de pacientes com DA, apesar de não terem sido observadas alterações nos níveis de ApoD entre os grupos estudados.(20)
Estudos post-mortem de cérebros com a DA revelaram o aumento de endossomos. A partir desse fato, investigadores resolveram analisar o aumento dessa organela nas células mononucleares do sangue periférico, como um possível biomarcador. No estudo foram verificados 71 indivíduos, sendo 48 com DA e 23 controles saudáveis. Constataram-se variações morfológicas no compartimento endossomal de fibroblastos, um aumento importante no percentual celular de indivíduos com DA em relação ao controle, ainda que no estágio inicial da patologia. Entretanto, mais estudos são necessários para relacionar as quantidades de placas amiloides, com curso de tempo da doença e as alterações endossomais, para poder verificar sua possibilidade de utilização como um biomarcador sanguíneo.(21)
Os neurofilamentos leves (NFL) plasmáticos estão associados ao diagnóstico de DA e às características cognitivas, bioquímicas e de imagem da doença. Este achado pode implicar uma potencial utilidade para o NFL plasmático como um biomarcador não invasivo na DA. Uma pesquisa em 193 controles cognitivamente saudáveis, 197 pacientes com comprometimento cognitivo leve e 180 pacientes com DA, obteve o NFL plasmático aumentado em pacientes com CCL (média de 42,8 ng/L), DA (média de 51,0 ng/L) e em comparação com o controle (média de 34,7 ng/L), (p<0,001), soma-se a este fato a alta acurácia diagnóstica observada para pacientes com DA versus controles (área sob a curva de 0,87). O NFL plasmático elevado correlacionou-se também com a baixa cognição e atrofia relacionada à DA (no início e longitudinalmente) e com hipometabolismo cerebral (longitudinalmente).(22)
Categoria 2: Diagnóstico molecular
DeMarshall et al.(23) afirmam que é necessário urgentemente definir biomarcadores com capacidade de identificar de maneira precisa, e a partir daí realizar o diagnóstico da doença de Alzheimer. Os autoanticorpos estão presentes em abundância no soro humano, tendo sido anteriormente demonstrado que são biomarcadores da doença de maneira específica, com capacidade em diagnosticar com precisão estágios leve a moderado da DA e também da doença de Parkinson.
Nos resultados obtidos através de microarrays, na utilização de um pequeno painel de biomarcadores de autoanticorpos (Ab42, tau e tau fosforilado), verificou-se que este pode ser usado para distinguir portadores de CCL associado a DA, de controles por idade e com correspondência de gênero com precisão de 100%. Tal perfil de autoanticorpos individuais foi resultante para o training set, pois os pacientes com CCL foram comparados com os controles usando-se software de análise prospector e reverificados com preditores significativos usando-se random forest, Além disso os indivíduos com CCL foram diferenciados daqueles com DA moderada com alta exatidão.(23)
Os peptídeos Ab são produzidos via clivagem proteolítica da proteína precursora de Ab (APP) pela enzima de clivagem beta-amiloide 1 (BACE1). Com base nessa característica, pesquisadores resolveram analisar os níveis de circulação de RNAs não codificadores longos (lncRNAs) do BACE1-AS como possíveis biomarcadores para DA. Os resultados demostraram que o nível de BACE1-AS era mais baixo no subgrupo pré-DA (sensibilidade de 75% e 100% de especificidade), mas era alto em pessoas com DA em comparação com os controles saudáveis (sensibilidade de 68% e especificidade de 100%), destacando seu potencial como biomarcador para o desenvolvimento de DA.(24)
Embora os autoanticorpos tenham sido estudados como potenciais novos marcadores plasmáticos da DA, a maioria dos estudos se concentrou em anticorpos específicos como marcadores Ab e proteína tau. Entretanto, um estudo resolveu avaliar por microarray 29.240 peptídeos aleatórios para identificar epítopos de ligação associados aos anticorpos isotípicos IgG e IgM. Os achados mais satisfatórios deram-se pela combinação de cinco principais peptídeos que demonstraram altos valores de AUC para IgM regulada (0,945), IgG regulada (0,892), IgG regulada (0,862) e IgM regulada (0,961). Além disso, análises posteriores revelaram que apenas dez peptídeos estavam regulados positivamente à DA (p £ 0,001). Estes resultados sugerem que os peptídeos selecionados podem ser utilizados como biomarcadores da progressão da DA.(25)
Os micros RNA’s são moléculas abundantes no sangue, por isso são fortes candidatos como biomarcadores não só para DA, mas também para outras patologias.(26) Yilmaz et al.(8) avaliaram a expressão de microRNA em sangue total por uma reação em cadeia da polimerase em tempo real (qPCR), com amostras de 281 pessoas, sendo, destas, 172 portadores de DA e 109 controles saudáveis. Descobriram que houve uma diminuição na expressão de sangue: hsa-miR-9-5p, hsa-miR-106a-5p, hsa-miR-106b-5p e hsa-miR-107 foram significativamente relacionados a um aumento do risco de DA (p < 0,05). Já Wang et al.(27) observaram que o miR-103 foi mais adequado que o miR-107 para servir como um biomarcador para a susceptibilidade diminuída à DA, assim como foram correlacionados negativamente com comprometimento cognitivo em pacientes com DA.
Em contrapartida, a expressão de Hsa-miR-125b-5p não obteve diferença significativa entre pacientes e controles (P > 0,05). Dos sete miRNAs cuja expressão foi analisada em sangue total, quatro foram significativamente associados com a DA. A Hsa-miR-106a-5p apresentou uma variável preditora de 93% especificidade e 68% de sensibilidade.(8)
Keller et al.(28) realizaram a validação de 49 casos de DA e 55 controles, além de vinte pacientes com comprometimento cognitivo leve (CCL) e noventa com esclerose múltipla (EM) incluídos como controle, e foram utilizados para os perfis de miRNA associados à bioestatística, através de ensaio de coorte por reação em RT-qPCR, nos quais ocorreu a detecção de 580 miRNA’s no sangue; na validação desses miRNA’s, 146 encontraram-se desregulados em auto nível, com 0,05 de significância em comparação com os controles. Os autores acreditam que os miRNA’s descobertos são específicos para DA.
Foi relatado uma nova assinatura de 9-miRNA (hsa-miR-26a-5p, hsa-miR-181c-3p, hsa-miR-126-5p, hsa-miR-22-3p, hsa-miR-148b-5p, hsa-miR-106b-3p, hsa-miR-6119-5p, hsa-miR-1246 e hsa-miR-660-5p), que podem ser utilizados como biomarcadores para a detecção de DA, usando o sequenciamento de nova geração (NGS) e sendo validados por reação em cadeia da polimerase quantitativa em tempo real (qRT-PCR). Todos os pacientes com DA foram divididos em três grupos (leve, moderado e severo) baseados no MEEM. Essa pesquisa indica que a expressão anormal de miRNAs séricos ocorre em diferentes estágios da DA. Entre os 9-miRNAs analisados, o hsa-miR-22-3p apresentou a melhor sensibilidade (81,8%) e especificidade (70,9%).(29) Em contrapartida, Wiest et al.,(19) ao analisarem a expressão dos miRNA (miR-26b, miR-199a e miR-335) em plaquetas, não observaram diferenças na expressão em relação a pacientes controle saudáveis.
Yang et al.(30) avaliaram os níveis de expressão dos miR-135a, -193b e -384 exossômicos usando RT-qPCR. Os resultados indicaram que o nível exossômico de miR-135a aumentou significativamente no grupo DA em comparação com o grupo controle (p <0,05). Além disso, a expressão do miR-193b foi reduzida no grupo DA (DA versus controle, p<0,01). Esses resultados demonstraram que os níveis de expressão de miR-135a e -193b exossômicos apresentaram diferença significativa entre os pacientes com DA e controles saudáveis.
Os estudos anteriormente citados apresentaram boa especificidade e sensibilidade e são de fácil reprodução. Os dados sugerem que os miRNAs séricos poderiam ser usados como biomarcadores para melhorar o diagnóstico da DA, particularmente no estágio inicial, e para classificar seus estágios clínicos.
Categoria 3: Outros métodos
A identificação do perfil de 18 proteínas plasmáticas demonstrou uma grande possibilidade na sua utilização para classificar pacientes com DA com alta especificidade m relação a indivíduos saudáveis. Através da utilização da bioinformática foi descoberto que a maioria dessas 18 proteínas era relevante para os níveis de proteína tau e LCR. Para estabelecer uma linearidade entre as amostras, o painel utilizado incluiu as proteínas ECH1, NHLRC2, HOXB7, FN1, ERBB2, e SLC6A13, sendo utilizado o método SVM (Support Vector Machine). Os resultados encontraram uma promissora sensibilidade (>87%), especificidade (>91%) e acurácia (>89%) para tais proteínas.(31)
Várady et al.(32) desenvolveram um método rápido e confiável – baseado em análise por citometria de fluxo – de anticorpos para medição de várias proteínas de membrana de eritrócitos (RBC) a partir de uma gota de sangue. Foi documentada que a expressão em proteínas de membrana de RBC, especialmente as transportadoras de GLUT 1 e o receptor de insulina (INSR), são significativamente mais elevados em pessoas doentes, como gota e diabetes, em idades emparelhadas com indivíduos saudáveis. As diferenças observadas podem refletir alterações metabólicas a longo prazo, relevantes para o desenvolvimento da doença de Alzheimer. Apesar dos biomarcadores baseados no sangue serem uma boa opção para o diagnóstico precoce e mais acessíveis, este, em específico, ainda necessita de estudos para geração de protocolos de maior sensibilidade e especificidade.
Zuliani et al.(33) buscaram identificar uma combinação de marcadores de status redox que pudessem auxiliar no diagnóstico da DA. Para alcançar tal objetivo, utilizaram um painel que incluiu índices de danos oxidativos (hidroperóxidos) e de defesa antioxidante, não enzimáticos (ácido úrico, tióis e aqueles que contribuem para o poder antioxidante residual-RAP) e enzimáticos (arilesterase). Os resultados demostraram que RAP e arilesterase foram menores em DA em comparação aos controles, os tióis também mostraram uma tendência semelhante (p <0,05), enquanto que os níveis de ácido úrico e homocisteína aumentaram na DA em comparação aos controles (p <0,01). O modelo de painel produziu uma área de 0,808 para a discriminação entre pacientes controles e DA, com especificidade e sensibilidade de 64% e 79%, respectivamente.
CONCLUSÃO
Os estudos aqui compilados demonstram que, muito em breve, biomarcadores sanguíneos poderão ser utilizados no diagnóstico diferencial da doença de Alzheimer, uma vez que os resultados obtidos têm sido de grande relevância quando se trata de diferenciação entre a DA de outros tipos de doenças neurodegenerativas. Todavia, apesar dos resultados positivos encontrados nos artigos analisados, são necessários novos estudos que busquem elevar ainda mais o grau de sensibilidade e especificidade para fornecer de maneira precoce um diagnóstico diferenciado e mais preciso, para posteriormente estabelecer o tratamento mais adequado visando uma melhor qualidade de vida ao paciente.
Abstract
Alzheimer’s disease (AD) is one of the most common forms of dementia, being a neurodegenerative disorder that irreversibly affects older people. Early diagnosis would enable the realization of treatments presenting better results on reducing the severity of symptoms. However, this is a major problem, since the already consolidated methods of diagnosis are invasive, such as CSF analysis and brain biopsy. This study aimed to analyze blood biomarkers capable of identifying AD even in its initial stage. An integrative review of the literature was carried out by searching indexed articles in electronic data platforms PubMed and Scielo with the descriptor in English and Portuguese “Biomarker, blood, alzheimer”: Articles from 2013 to 2019 were analyzed, where the main types of biomarkers were the ones that carried out the analysis of specific proteins, microRNAs and autoantibodies. Thus providing good results not only in the diagnosis, but also in the cost benefit, since they confer the differentiation of the other pathologies to the initial state of Alzheimer’s disease. It has concluded that although the results obtained were positive, further studies are needed in order to increase sensitivity and specificity in the differentiation of AD from other types of dementia.
Keywords
Alzheimer disease; biomarkers; blood
REFERÊNCIAS
- Serrano-Pozo A, Frosch MP, Masliah E, Hyman BT. Neuropathological alterations in Alzheimer disease. Cold Spring Harb Perspect Med. 2011 Sep;1(1):a006189. doi: 10.1101/cshperspect.a006189.
- Singh SK, Srivastav S, Yadav AK, Srikrishna S, Perry G. Overview of Alzheimer’s Disease and Some Therapeutic Approaches Targeting A? by Using Several Synthetic and Herbal Compounds. Oxid Med Cell Longev. 2016;2016:7361613. doi: 10.1155/2016/7361613.
- Defina PA, Moser RS, Glenn M, Lichtenstein JD, Fellus J. Alzheimer’s disease clinical and research update for health care practitioners. J Aging Res. 2013;2013:207178. doi: 10.1155/2013/207178.
- Spaan PEJ, Walla P. Cognitive decline in normal aging and early Alzheimer’s disease: A continuous or discontinuous transition? A historical review and future research proposal, Cogent Psychology. 2016; 3:1, doi: 10.1080/23311908.2016.1185226
- Apostolova LG. Alzheimer Disease Continuum (Minneap Minn). 2016 Apr;22(2 Dementia): 419-434. doi: 10.1212/CON.000000000 0000307
- Prince M, Ali GC, Guerchet M, Prina AM, Albanese E, Wu YT. Recent global trends in the prevalence and incidence of dementia, and survival with dementia. Alzheimers Res Ther. 2016 Jul 30;8 (1):23. doi: 10.1186/s13195-016-0188-8.
- Dubois B, Padovani A, Scheltens P, Rossi A, Dell’Agnello G. Timely Diagnosis for Alzheimer’s Disease: A Literature Review on Benefits and Challenges. J Alzheimers Dis. 2016;49(3):617-31. doi: 10.3233/JAD-150692.
- Yilmaz SG, Erdal ME, Özge AA, Sungur MA. Can Peripheral MicroRNA Expression Data Serve as Epigenomic (Upstream) Biomarkers of Alzheimer’s Disease? OMICS. 2016 Aug;20(8):456-61. doi: 10.1089/omi.2016.0099.
- Burnham SC, Rowe CC, Baker D, Bush AI, Doecke JD, Faux NG, et al. Predicting Alzheimer disease from a blood-based biomarker profile: A 54-month follow-up. Neurology. 2016 Sep 13;87(11):1093-101. doi: 10.1212/WNL.0000000000003094.
- Williams SM, Schulz P, Rosenberry TL, Caselli RJ, Sierks MR. Blood-Based Oligomeric and Other Protein Variant Biomarkers to Facilitate Pre-Symptomatic Diagnosis and Staging of Alzheimer’s Disease. J Alzheimers Dis. 2017;58(1):23-35. doi: 10.3233/JAD-161116.
- Neergaard JS, Dragsbaek K, Christiansen C, Karsdal MA, Brix S, Henriksen K. Two novel blood-based biomarker candidates measuring degradation of tau are associated with dementia: A prospective study. PLoS One. 2018 Apr 11;13(4):e0194802. doi: 10.1371/journal.pone.0194802.
- Nakamura A, Kaneko N, Villemagne VL, Kato T, Doecke J, Doré V, et al. High performance plasma amyloid-b biomarkers for Alzheimer’s disease. Nature. 2018 Feb 8;554(7691):249-254. doi: 10.1038/nature25456.
- Palmqvist S, Janelidze S, Stomrud E, Zetterberg H, Karl J, Zink K, et al. Performance of Fully Automated Plasma Assays as Screening Tests for Alzheimer Disease-Related b-Amyloid Status. JAMA Neurol. 2019 Jun 24. doi: 10.1001/jamaneurol. 2019.1632.
- Wang MJ, Yi S, Han JY, Park SY, Jang JW, Chun IK, et al. Oligomeric forms of amyloid-b protein in plasma as a potential blood-based biomarker for Alzheimer’s disease. Alzheimers Res Ther. 2017 Dec 15;9(1):98. doi: 10.1186/s13195-017-0324-0.
- Tatebe H, Kasai T, Ohmichi T, Kishi Y, Kakeya T, Waragai M, et al. Quantification of plasma phosphorylated tau to use as a biomarker for brain Alzheimer pathology: pilot case-control studies including patients with Alzheimer’s disease and down syndrome. Mol Neurodegener. 2017 Sep 4;12(1):63. doi: 10.1186/s13024-017-0206-8.
- Mohd Hasni DS, Lim SM, Chin AV, Tan MP, Poi PJH, Kamaruzzaman SB, et al. Peripheral cytokines, C-X-C motif ligand10 and interleukin-13, are associated with Malaysian Alzheimer’s disease. Geriatr Gerontol Int. 2017 May;17(5):839-846. doi: 10.1111/ggi.12783.
- Uchida K, Shan L, Suzuki H, Tabuse Y, Nishimura Y, Hirokawa Y, et al. Amyloid-b sequester proteins as blood-based biomarkers of cognitive decline. Alzheimers Dement (Amst). 2015 Jun 15;1(2):270-80. doi: 10.1016/j.dadm.2015.04.003.
- Villarreal AE, O’Bryant SE, Edwards M, Grajales S, Britton GB; Panama Aging Research Initiative. Serum-based protein profiles of Alzheimer’s disease and mild cognitive impairment in elderly Hispanics. Neurodegener Dis Manag. 2016 Jun;6(3):203-13. doi: 10.2217/nmt-2015-0009.
- Wiest I, Wiemers T, Kraus MJ, Neeb H, Strasser EF, Hausner L, et al. Multivariate Platelet Analysis Differentiates Between Patients with Alzheimer’s Disease and Healthy Controls at First Clinical Diagnosis. J Alzheimers Dis. 2019 Aug 23. doi: 10.3233/JAD-190574.
- Perrotte M, Le Page A, Fournet M, Le Sayec M, Rassart É, Fulop T, et al. Blood-based redox-signature and their association to the cognitive scores in MCI and Alzheimer’s disease patients. Free Radic Biol Med. 2019;130:499-511. doi: 10.1016/j. freerad biomed. 2018.10. 452.
- Corlier F, Rivals I, Lagarde J, Hamelin L, Corne H, Dauphinot L, et al. Modifications of the endosomal compartment in peripheral blood mononuclear cells and fibroblasts from Alzheimer’s disease patients. Transl Psychiatry. 2015 Jul 7;5:e595. doi: 10.1038/tp.2015.87.
- Mattsson N, Andreasson U, Zetterberg H, Blennow K; Alzheimer’s Disease Neuroimaging Initiative. Association of Plasma Neurofilament Light With Neurodegeneration in Patients With Alzheimer Disease. JAMA Neurol. 2017 May 1;74(5):557-566. doi: 10.1001/jamaneurol.2016.6117.
- DeMarshall CA, Nagele EP, Sarkar A, Acharya NK, Godsey G, Goldwaser EL, et al. Alzheimer’s Disease Neuroimaging Initiative. Detection of Alzheimer’s disease at mild cognitive impairment and disease progression using autoantibodies as blood-based biomarkers. Alzheimers Dement (Amst). 2016 Apr 12;3:51-62. doi: 10.1016/j.dadm.2016.03.002.
- Fotuhi SN, Khalaj-Kondori M, Hoseinpour Feizi MA, Talebi M. Long Non-coding RNA BACE1-AS May Serve as an Alzheimer’s Disease Blood-Based Biomarker. J Mol Neurosci. 2019 Jul 1. doi: 10.1007/s12031-019-01364-2.
- Sim KY, Park SH, Choi KY, Park JE, Lee JS, Kim BC, Gwak J, Song WK, Lee KH, Park SG. High-throughput epitope profiling of antibodies in the plasma of Alzheimer’s disease patients using random peptide microarrays. Sci Rep. 2019 Mar 14;9(1):4587. doi: 10.1038/s41598-019-40976-x.
- Leidinger P, Backes C, Deutscher S, Schmitt K, Mueller SC, Frese K, et al. A blood based 12-miRNA signature of Alzheimer disease patients. Genome Biol. 2013 Jul 29;14(7):R78. doi: 10.1186/gb-2013-14-7-r78.
- Wang J, Chen C, Zhang Y. An investigation of microRNA-103 and microRNA-107 as potential blood-based biomarkers for disease risk and progression of Alzheimer’s disease. J Clin Lab Anal. 2019 Aug 16:e23006. doi: 10.1002/jcla.23006.
- Keller A, Backes C, Haas J, Leidinger P, Maetzler W, Deuschle C, et al. Validating Alzheimer’s disease micro RNAs using next-generation sequencing. Alzheimers Dement. 2016 May;12(5):565-76. doi: 10.1016/j.jalz.2015.12.012.
- Guo R, Fan G, Zhang J, Wu C, Du Y, Ye H, et al. A 9-microRNA Signature in Serum Serves as a Noninvasive Biomarker in Early Diagnosis of Alzheimer’s Disease. J Alzheimers Dis. 2017;60(4):1365-1377. doi: 10.3233/JAD-170343.
- Yang TT, Liu CG, Gao SC, Zhang Y, Wang PC. The Serum Exosome Derived MicroRNA-135a, -193b, and -384 Were Potential Alzheimer’s Disease Biomarkers. Biomed Environ Sci. 2018 Feb;31(2):87-96. doi: 10.3967/bes2018.011.
- Long J, Pan G, Ifeachor E, Belshaw R, Li X. Discovery of Novel Biomarkers for Alzheimer’s Disease from Blood. Dis Markers. 2016;2016:4250480. doi: 10.1155/2016/4250480.
- Várady G, Szabó E, Fehér Á, Németh A, Zámbó B, Pákáski M, et al. Alterations of membrane protein expression in red blood cells of Alzheimer’s disease patients. Alzheimers Dement (Amst). 2015 Jul 21;1(3):334-8. doi: 10.1016/j.dadm.2015.06.007.
- Zuliani G, Passaro A, Bosi C, Sanz JM, Trentini A, Bergamini CM, et al. Testing a Combination of Markers of Systemic Redox Status as a Possible Tool for the Diagnosis of Late Onset Alzheimer’s Disease. Dis Markers. 2018 Sep 9;2018:2576026. doi: 10.1155/2018/2576026.
Correspondência
Danielle Cristinne Azevedo Feio
Avenida Visconde de Sousa Franco, N° 660
66053-000 – Belém-PA, Brasil
