Uso etnofarmacológico do óleo de côco: inibição de Candida sp., Escherichia coli e Pseudomonas aeruginosa
Ethnopharmacological use of coconut oil: inhibition of Candida sp., Escherichia coli and Pseudomonas aeruginosa
Rafaela Andreola1, Vitória Couto da Cruz1, Geórgia Muccillo Dexheimer2
1Acadêmica de Biomedicina, Universidade do Vale do Taquari – Univates, Lajeado –RS, Brasil.
2Doutora em Biotecnologia. Professora na Universidade do Vale do Taquari – Univates, Lajeado – RS, Brasil.
Recebido em 28/01/2021
Aprovado em 04/03/2022
DOI: 10.21877/2448-3877.202202102
INTRODUÇÃO
Durante o processo de evolução, o homem aprendeu a fazer uso de plantas como fonte nutritiva e como fonte farmacológica, no alívio de dores e doenças. A consequência dessas ações resultou em conhecimento e domínio dos povos sobre a utilização de plantas e ervas medicinais, durante vários anos e diferentes grupos étnicos. Ao mesmo tempo em que medicamentos normalmente demonstram só um princípio ativo, encarregado pelo seu propósito farmacológico, os extratos vegetais são compostos por multicomponentes de diversas substâncias (ativas, parcialmente ativas e inativas), atuando em alvos farmacológicos diferentes, na maioria dos casos.(1)
A Candida sp. faz parte da nossa microbiota normal. Em pacientes saudáveis, ela pode estar presente na boca, na orofaringe, no intestino, na vagina e em algumas secreções, como no escarro. Na medida em que ocorre um desequilíbrio entre hospedeiro e microrganismo, a Candida pode se tornar patogênica, causando infecções. Em relação a algumas espécies de Candida, Candida albicans é a micose mais prevalente, principalmente causando candidíase vulvovaginal. É também a espécie com maior conhecimento patogênico. A Candida krusei é conhecida como o patógeno fúngico que apresenta maior resistência a diversos antifúngicos, principalmente a sua resistência intrínseca ao fluconazol. Já em relação à Candida parapsilosis, são muito frequentes em micoses das unhas das mãos.(2)
A candidíase é considerada um problema de saúde pública, pois o aumento da sua prevalência deve-se ao elevado número de imunodeprimidos, principalmente infectados pelo HIV, ou indivíduos que utilizam por longos períodos medicamentos antimicrobianos, desencadeando um desequilíbrio na microbiota. A ocorrência de infecções fúngicas vem aumentando progressivamente. Os antifúngicos usados para tratamento contra essas infecções são bastante limitados e a resistência a esses fármacos vem se tornando cada vez mais comum, dificultando o manejo terapêutico.(3)
Entre os principais patógenos relacionados com as infecções do trato urinário, pode-se destacar as bactérias Gram-negativas, incluindo a Escherichia coli como o microrganismo mais frequentemente encontrado, em aproximadamente 70% a 80% dos casos, seguida de outras bactérias Gram-negativas e Gram-positivas como Pseudomonas aeruginosa, Klebsiella sp., Enterobacter sp., Enterococcus faecalis, Proteus sp., Streptococcus sp. e Staphylococcus aureus.(4)
É notável a ocorrência de automedicação, pois muitos medicamentos são comercialmente vendidos mesmo com a ausência de prescrição, o que acaba contribuindo para o aumento da resistência aos antifúngicos.(5) Sendo assim, é necessária a busca de novas estratégias de tratamentos alternativos para tratar essas infecções. Atualmente, a medicina popular acredita que o óleo de coco (cocos nucifera) possui componentes em sua constituição capazes de curar ou contribuir no tratamento de diversas patologias. Como conhecimento popular, sugere-se o uso de óleo de coco na região íntima a fim de prevenir e/ou tratar infecções fúngicas, especialmente a candidíase.(6)
Portanto, é importante avaliar o real impacto deste produto no crescimento de tais microrganismos para testar seu potencial antifúngico neste modo de apresentação comercial. O objetivo desse estudo é avaliar in vitro o potencial antifúngico do óleo de coco extravirgem sobre o crescimento de espécies de Candida, Escherichia coli e Pseudomonas aeruginosa.
METODOLOGIA
As cepas utilizadas foram:Candida albicans ATCC 10231; Candida albicans 0051-L; Candida krusei 0037-L; Candida krusei ATCC 6258, Candida parapsilosis DH35; Candida parapsilosis DH83; Escherichia coli (ATCC 25922) e Pseudomonas aeruginosa (ATCC27853).
O ágar Mueller-Hinton (Oxoid) é um meio utilizado para teste de suscetibilidade antimicrobiana, ou seja, teste de avaliação da resistência aos antimicrobianos. Para prepará-lo, foram adicionados 38g do produto a um litro de água destilada e a solução foi então fervida para dissolver completamente o pó. Em seguida, a solução foi esterilizada em autoclave a 121ºC por 15 minutos. Após, o meio foi distribuído em placas de petri estéreis e levado para a geladeira para solidificar. As placas foram embaladas em sacos plásticos e acondicionadas em posição invertida (tampa voltada para baixo), de modo a evitar a desidratação do meio e garantir, portanto, boas condições de armazenamento. A manipulação das placas sempre foi realizada próximo ao bico de Bunsen para evitar possíveis contaminações. As placas foram deixadas em estufa bacteriológica por 24 horas a 37ºC, servindo como controle de esterilidade. Após este período foram estocadas em geladeira (15ºC) até o momento de uso, não ultrapassando o período de duas semanas.
As leveduras estavam congeladas em freezer a -20°C em meio skim milk. Para a sua ativação, estas foram descongeladas, homogeneizadas, e inoculadas em meio de cultura Mueller-Hinton com o auxílio de um swab estéril. As placas foram incubadas em estufa micológica a 37ºC por 24 horas. Após o crescimento das cepas, a ação antifúngica do óleo de coco comercial foi testada através de duas técnicas de difusão em ágar: disco-difusão(7) e difusão em meio sólido.(8) Foi preparada uma alíquota com solução fisiológica conforme escala de 0,5 de McFarland (1,0 x 108 UFC/mL). Essa alíquota foi semeada no meio de cultura Mueller-Hinton em triplicata. Em seguida, discos de papel filtro devidamente esterilizados foram colocados com o auxílio de uma pinça flambada nas placas. Com o auxílio de uma micropipeta foi impregnado 20µL do óleo de coco comercial nos discos.
Já para o teste de difusão em meio sólido, após a semeadura foi aplicada a técnica de perfuração feita através de cânulas, obtendo poços de 6mm de diâmetro. Utilizou-se alíquotas de 50µL de óleo de coco comercial em temperatura ambiente em cada poço. As placas foram igualmente incubadas a 37ºC por 24 horas. Como controle positivo, foi utilizado o antifúngico fluconazol para verificar o controle de crescimento da levedura e viabilidade da cepa. As placas foram incubadas a 37ºC por 24 horas. Após a incubação foi realizada a medição dos halos que apresentaram diâmetro maior que 10mm.
RESULTADOS
Após a ativação das cepas foi realizado primeiramente o teste de difusão em discos (Figura 1A). Após a análise dos resultados, foi utilizada uma segunda técnica, de difusão em meio sólido para verificação e confirmação dos resultados obtidos (Figura 1B). Ainda, foi realizada uma inoculação em placa de cada microrganismo na escala 0,5 de MacFarland misturada com 100µL/mL de solução fisiológica de óleo de coco comercial (Figura 1C).
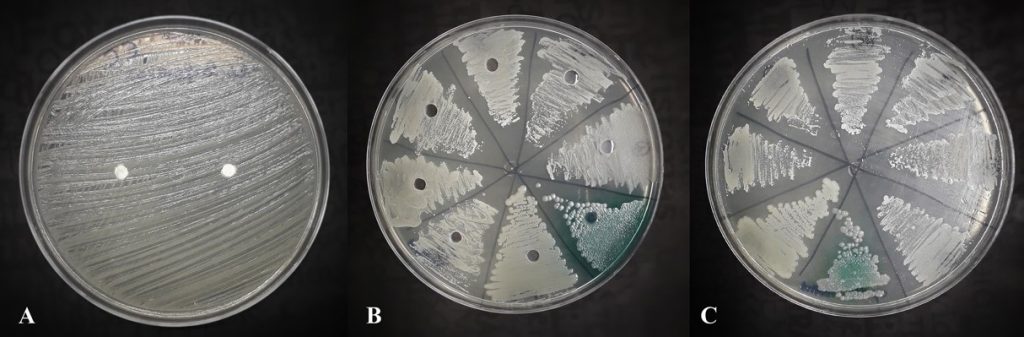
Figura 1
Testes em ágar Mueller-Hinton pela técnica de difusão em disco embebido com óleo de coco. B. Teste em ágar Mueller-Hinton com a técnica de perfuração do ágar. C. Semeadura em escala 0,5 de MacFarland homogeneizada com 100µL/mL de solução fisiológica de óleo de coco comercial.
DISCUSSÃO
A partir da realização dos testes de difusão em disco e difusão em meio sólido com as cepas de diferentes espécies de Candida sp., Escherichia coli e Pseudomonas aeruginosa, observou-se que não houve formação de halos de inibição, indicando que o óleo de coco comercial não apresenta potencial de inibição do crescimento destes microrganismos. A busca por novas fontes de substâncias fitoterápicas que possuam atividade antimicrobiana e antifúngica é incentivada pelo baixo custo maior disponibilidade. As plantas apresentam, em seu metabolismo, compostos de ampla atividade biológica com diferentes efeitos terapêuticos.(9)
Devido ao aumento da resistência em relação a diversos antimicrobianos, o uso de plantas medicinais mostrou-se como uma alternativa no tratamento dessas infecções. Nessa esfera, surge o óleo de coco, muito utilizado popularmente não só para fins culinários mas também para uso em tratamentos alternativos de lesões causadas por fungos. O principal objetivo desse estudo foi testar e buscar o potencial antifúngico do óleo de coco, que já vinha sendo abordado em sites populares da Internet para seu uso etnofarmacológico, indicando que o uso tópico do óleo nas regiões afetadas ou, ainda, utilizando absorventes internos embebidos com o óleo pudessem ser úteis para tratar candidíases. Alguns estudos relataram o potencial antifúngico do óleo, sendo que o uso tópico em animais já foi testado, bem como o potencial inibitório de crescimento in vitro.(10,11)
O resultado do presente estudo demonstrou ausência de inibição de crescimento fúngico com o óleo de coco comercial. Já para Santos et al.,(12) onde foram preparadas nanocápsulas com óleo de coco e clotrimazol, apresentaram atividade antifúngica contra a Candida spp. Assim, foi possível concluir que essas nanocápsulas com núcleo de óleo de coco preenchidas com clotrimazol são estratégia relevante como tratamento da candidíase vulvovaginal, todavia faz pensar que a atividade antifúngica se deve ao clotrimazol e não ao óleo de coco, já que o clotrimazol é um conhecido antifúngico com eficácia já bem estabelecida em diversos estudos, utilizado em larga escala comercialmente.
Segundo Ogbolu et al.,(11) foi possível concluir que o óleo de coco apresentou potencial antifúngico contra algumas espécies de Candida, como a Candida albicans, Candida glabrata, Candida tropicalis, Candida krusei e Candida parapsilosis, relacionando com o uso do antifúngico fluconazol através do método de difusão em ágar. Com o estudo foi possível observar a importância do óleo de coco frente a sua utilização no tratamento de infecções causadas por fungos, devido à resistência que várias espécies Candida apresentam com o uso de fármacos antifúngicos comuns. Em outro estudo realizado por Seleem et al.,(13) identificou que a monolaurina, um constituinte importante do óleo de coco, apresentou potenciais atividades antifúngicas contra Candida albicans in vitro, quando avaliado tanto em testes de suscetibilidade quanto em ensaios de biofilme.
O óleo de coco apresenta em sua composição 92% de ácidos graxos saturados, na forma de triglicerídeos, sendo que cerca de 70% são de ácidos graxos de cadeia média. Entre os ácidos graxos, 45% a 50% é ácido láurico, apresentando também 7% de ácido caprílico e 6% de ácido cáprico. O ácido caprílico apresenta ação contra bactérias patogênicas, incluindo a Escherichia coli.(14) O ácido láurico, ácido graxo primário do óleo de coco, possui atividade antimicrobiana comprovada de forma significativa contra algumas bactérias Gram-positivas, vírus e fungos. O óleo de coco possui ativos com atividade microbicida em microrganismos, entre eles a Pseudomonas aeruginosa e Escherichia coli, através da formulação de cremes que utilizam o extrato do óleo de coco e a realização de testes de inoculação na pele, porém estabelece a necessidade de padronização da qualidade e quantidade de óleo de coco, usada nos testes com fins terapêuticos.(15)
O óleo de coco virgem é tradicionalmente utilizado como hidratante há muitos anos por indivíduos que vivem em regiões tropicais, com a finalidade de tratar problemas/doenças da pele. Estudos clínicos demonstram que ele garante uma melhora da função da barreira cutânea, conferindo proteção contra a radiação UVB. Seu uso de forma tópica possui ação anti-inflamatória capaz de inibir níveis de citocinas, incluindo TNF-α, IFNγ, IL-6, IL-5 e IL-8.(16) Em estudo realizado por Kim et al.,(17) constata-se que a citotoxicidade do extrato de óleo de coco cultivado demonstra efeitos anti-inflamatórios e melhora da barreira epitelial contra alterações acometidas pela radiação UVB na pele humana. Deduz-se que o aumento de polifenóis e ácidos graxos são os responsáveis pela ação da atividade anti-inflamatória.
A monolaurina, monoglicerídeo derivado do ácido láurico, presente no óleo de coco, apresenta atividade antimicrobiana, que se processa por meio de mecanismos que desintegram a membrana lipídica de bactérias envolvidas por lipídios, incluindo Staphylococcus aureus e Staphylococcus epidermidis.(18)
Podem-se verificar os efeitos promissores de óleos e manteigas vegetais na cura de feridas na pele por conta do seu potencial antimicrobiano, anti-inflamatório e antioxidante, promovendo a proliferação celular, aumentando a síntese de colágeno e estimulando a reconstrução da pele. Dentre os óleos apresentados no estudo está o óleo de coco. Deve-se avaliar quais componentes presentes no óleo conferem este potencial farmacológico importante e qual a concentração necessária para este efeito. Logo, sugere-se que o óleo de coco comercial utilizado de modo tópico em regiões com infecções microbianas pode promover o alívio de sintomas como dor e coceira, por promover o reparo do tecido, porém não necessariamente eliminando o microrganismo completamente. Portanto, salienta-se a importância de uma avaliação microbiológica para a correta escolha terapêutica, não sendo o óleo de coco o único meio utilizado por não conhecer as concentrações e efeitos das diversas marcas comercializadas.(19,20)
CONCLUSÃO
A partir dos resultados obtidos na presente pesquisa, percebeu-se que o óleo de coco comercial não apresentou potencial antimicrobiano mínimo para promover inibição do crescimento microbiano. Como discutido, o óleo de coco pode apresentar funções importantes no processo anti-inflamatório e no reparo de tecidos. Sendo assim, o uso etnofarmacológico do óleo pode permitir o alívio de sintomas provocados por infecções como irritação local, prurido, ardência, porém sem controlar o agente etiológico, necessariamente. Portanto, salienta-se a importância de avaliar corretamente cada processo patológico e fazer uso da terapêutica adequada a fim de evitar recidivas da infecção mal curada. Desta forma, percebe-se a necessidade de realizar outros testes de sensibilidade antimicrobiana do extrato de óleo de coco, que demonstrem em qual concentração ou fração deste extrato situa-se o elemento responsável pela ação inibitória do crescimento de patógenos. Por fim, cabe salientar que tratamentos não convencionais devem apresentar efetividade e segurança para uso.
SUPORTE FINANCEIRO
Os custos para a realização da presente pesquisa foram arcados pela instituição de ensino Universidade do Vale do Taquari – Univates.
REFERÊNCIAS
- Ferreira VF, Pinto AC. A fitoterapia no mundo atual. Revista Quim Nova. 2010; 33(9).
- Barbedo LS, Sgarbi D. Candidiasis. DST – J Bras Doenças Sex Transm. 2010; 22(1), 22-38.
- Wang Y. Looking into Candida albicans infection, host response, and antifungal strategies. Virulence. 2015; 6(4), 307-308.
- Schenkel D, Dalle J, Antonello VS. Prevalência de uropatógenos e sensibilidade antimicrobiana em uroculturas de gestantes do Sul do Brasil. Rev Bras Ginecol Obstet. 2014; 36(3), 102-106.
- Leal MR, Lima MC, Klein SD, Garboggi PV. Tratamento da candidíase vulvovaginal e novas perspectivas terapêuticas: uma revisão narrativa. Revista Pesquisa em Fisioterapia. 2016 Nov 25;6(4).
- DebMandal M, Mandal S. Coconut (Cocos nucifera L.: Arecaceae): in health promotion and disease prevention. Asian Pacific Journal of Tropical Medicine. 2011 Mar 1;4(3):241-7.
- Trajano VN, Lima ED, Souza EL, Travassos AE. Propriedade antibacteriana de óleos essenciais de especiarias sobre bactérias contaminantes de alimentos. Food Science and Technology. 2009 Sep;29(3):542-5.
- Lima ID, Oliveira RD, Lima ED, Farias NM, Souza EL. Atividade antifúngica de óleos essenciais sobre espécies de Candida. Revista Brasileira de Farmacognosia. 2006 Jun;16(2):197-201.
- Eller CB, Lima AL, Oliveira RS. Cloud forest trees with higher foliar water uptake capacity and anisohydric behavior are more vulnerable to drought and climate change. New Phytologist. 2016 Jul;211(2):489-501.
- Nardoni S, Mugnaini L, Pistelli L, Leonardi M, Sanna V, Perrucci S, Pisseri F, Mancianti F. Clinical and mycological evaluation of an herbal antifungal formulation in canine Malassezia dermatitis. Journal de Mycologie Medicale. 2014 Sep 1;24(3):234-40.
- Ogbolu DO, Oni AA, Daini OA, Oloko AP. In vitro antimicrobial properties of coconut oil on Candida species in Ibadan, Nigeria. Journal of Medicinal Food. 2007 Jun 1;10(2):384-7.
- Santos SS, Lorenzoni A, Pegoraro NS, Denardi LB, Alves SH, Schaffazick SR, Cruz L. Formulation and in vitro evaluation of coconut oil-core cationic nanocapsules intended for vaginal delivery of clotrimazole. Colloids and Surfaces B: Biointerfaces. 2014 Apr 1;116:270-6.
- Seleem D, Chen E, Benso B, Pardi V, Murata RM. In vitro evaluation of antifungal activity of monolaurin against Candida albicans biofilms. Peer J. 2016 Jun 22;4:e2148.
- Annamalai T, Nair MK, Marek P, Vasudevan P, Schreiber D, Knight R, Hoagland T, Venkitanarayanan K. In vitro inactivation of Escherichia coli O157: H7 in bovine rumen fluid by caprylic acid. Journal of Food Protection. 2004 May;67(5):884-8.
- Oyi AR, Onaolapo JA, Obi RC. Formulation and antimicrobial studies of coconut (Cocos nucifera Linne) oil. Research Journal of Applied Sciences, Engineering and Technology. 2010 Mar 10;2(2):133-7.
- Varma SR, Sivaprakasam TO, Arumugam I, Dilip N, Raghuraman M, Pavan KB, Rafiq M, Paramesh R. In vitro anti-inflammatory and skin protective properties of Virgin coconut oil. Journal of Traditional and Complementary Medicine. 2019 Jan 1;9(1):5-14.
- Kim S, Jang JE, Kim J, Lee YI, Lee DW, Song SY, Lee JH. Enhanced barrier functions and anti-inflammatory effect of cultured coconut extract on human skin. Food and chemical toxicology. 2017 Aug 1;106:367-75.
- Lin TK, Zhong L, Santiago JL. Anti-inflammatory and skin barrier repair effects of topical application of some plant oils. International Journal of Molecular Sciences. 2018 Jan;19(1):70.
- Poljšak N, Kreft S, Kočevar Glavač N. Vegetable butters and oils in skin wound healing: Scientific evidence for new opportunities in dermatology. Phytotherapy Research. 2020 Feb;34(2):254-69.
- Vaughn AR, Clark AK, Sivamani RK, Shi VY. Natural oils for skin-barrier repair: ancient compounds now backed by modern science. American Journal of Clinical Dermatology. 2018 Feb;1
Correspondência
Geórgia Muccillo Dexheimer
E-mail: [email protected]
