Vaginose bacteriana diagnosticada em exames citológicos de rotina: prevalência e características dos esfregaços de Papanicolaou
Bacterial vaginosis diagnosed in routine cytology tests: prevalence and characteristics of Papanicolaou smears
Luiz Guilherme Dittert Toninato1
Mary Mayumi Taguti Irie2
Marcia Edilaine Lopes Consolaro3
Jorge Juarez Vieira Teixeira3
Cinthia Gandolfi Boer3
1Aluno do Curso de Especialização em Análises Clínicas, Universidade Estadual de Maringá, PR, Brasil.
2Farmacêutica-Bioquímica do Laboratório de Citologia Clínica do Departamento de Análises Clínicas e Biomedicina, Universidade Estadual de Maringá, PR, Brasil.
3Docente do Departamento de Análises Clínicas e Biomedicina, Universidade Estadual de Maringá, PR, Brasil.
Trabalho desenvolvido no Laboratório de Citologia Clínica do Departamento de Análises Clínicas e Biomedicina da Universidade Estadual de Maringá, PR, Brasil.
Artigo recebido em 07/10/2011
Artigo aprovado em 17/05/2016
Resumo
Vaginose bacteriana (VB) é uma síndrome polimicrobiana não inflamatória que acomete o trato genital feminino inferior, sendo caracterizada pelo crescimento exacerbado de uma variedade de bactérias anaeróbicas, especialmente Gardnerella vaginalis e Mobiluncus spp., substituindo ou reduzindo acentuadamente a microbiota vaginal normal, constituída pelos lactobacilos. A possibilidade da utilização dos esfregaços de Papanicolaou como método auxiliar no diagnóstico da VB parece altamente atrativa, uma vez que o exame é realizado rotineiramente, tanto em mulheres sintomáticas quanto assintomáticas, e apresenta baixo custo. O objetivo deste trabalho foi determinar a prevalência de vaginose bacteriana nos exames citológicos de rotina, bem como avaliar as características dos esfregaços positivos. Uma análise retrospectiva dos resultados citológicos foi conduzida no período de janeiro de 2002 a dezembro de 2006. A prevalência de VB na população estudada foi de 5,03% e a média de idade de 40,91 anos. Gardnerella vaginalis e Mobiluncus spp. foram detectados em 61,04% e 20,78% dos esfregaços, respectivamente. Em 18,18% dos casos foram encontrados ambos os microrganismos. Inflamação foi diagnosticada em 59,74% das pacientes. Pesquisas adicionais são necessárias para um melhor entendimento sobre a associação entre VB e processo inflamatório.
Palavras-chave
Esfregaço de Papanicolaou; Vaginose bacteriana; Gardnerella vaginalis; Mobiluncus
INTRODUÇÃO
A vaginose bacteriana (VB) é a infecção vaginal mais frequente e a principal causa de corrimento vaginal anormal em mulheres em idade reprodutiva.(1-3) Esta síndrome acomete o trato genital feminino inferior, sendo caracterizada por uma acentuada redução na microbiota vaginal normal, constituída predominantemente pelos lactobacilos, e um crescimento exacerbado de uma variedade de bactérias anaeróbicas.(4,5) As bactérias mais comumente associadas à VB são Gardnerella vaginalis, Mobiluncus spp., Bacteroides spp. e Mycoplasma hominis.(3,6,7)
O principal sintoma associado à VB é uma intensa secreção vaginal homogênea, de coloração branca ou acinzentada, com odor desagradável. Entretanto, metade das pacientes apresenta-se assintomática.(8-10) Trata-se de um problema de saúde pública, uma vez que a VB está associada a complicações ginecológicas e obstétricas, incluindo doença inflamatória pélvica, endometrite, infecção pós-cirurgia ginecológica, nascimento prematuro, podendo ainda aumentar o risco de aquisição e transmissão do vírus da imunodeficiência humana (HIV).(7,9,11)
O diagnóstico clínico da VB é feito com base nos critérios estabelecidos por Amsel et al.,(12) por meio da identificação de pelo menos três destas características: secreção vaginal fluida e homogênea; pH vaginal acima de 4,5; teste das aminas positivo e presença de clue-cells (células-chave) na avaliação microscópica de secreção vaginal a fresco.(3,7,11) A avaliação microscópica dos esfregaços vaginais corados pela coloração de Gram é atualmente o método mais utilizado para o diagnóstico da VB, devido à sua alta sensibilidade e reprodutibilidade.(7,10,11) O esfregaço corado por Gram é tradicionalmente avaliado pelo sistema de Nugent,(13) que consiste em atribuir valores quantitativos por campo microscópico de três diferentes morfotipos bacterianos: grandes bacilos Gram positivos, pequenos cocobacilos Gram variáveis, e bacilos curvos Gram negativos. Um escore maior ou igual a 7 caracteriza a vaginose bacteriana.(3,14) A cultura para G. vaginalis é um método bastante sensível; entretanto, apresenta baixa especificidade, uma vez que este microrganismo pode ser encontrado na microbiota vaginal normal de um grande número de mulheres.(3,6) Abordagens moleculares têm identificado várias espécies anaeróbicas nos casos de VB, revelando microrganismos não detectados anteriormente em culturas.(15)
O diagnóstico citológico através dos esfregaços de Papanicolaou é amplamente aceito como método de rastreamento para a detecção das lesões pré-cancerosas e do câncer inicial do colo uterino. Entretanto, há um crescente interesse em sua utilização como auxiliar no diagnóstico de algumas infecções cérvico-vaginais, por ser um exame rápido e de baixo custo.(16,17) Além disso, como exame de rotina para a prevenção do câncer de colo uterino, um grande número de mulheres é submetido periodicamente a ele, permitindo assim uma maior cobertura, tanto de pacientes sintomáticas quanto assintomáticas.(2,18)
Diversos trabalhos têm demonstrado a importância do método de Papanicolaou para o diagnóstico de vaginose bacteriana.(2,6,8,11,19) Assim, os objetivos deste trabalho foram avaliar a prevalência de vaginose bacteriana nos exames citológicos de rotina, as características dos esfregaços positivos para VB, bem como a idade das pacientes e os sintomas relatados.
MATERIAL E MÉTODOS
Um estudo retrospectivo foi realizado no Setor de Citologia Clínica do Laboratório de Ensino e Pesquisa em Análises Clínicas (LEPAC) da Universidade Estadual de Maringá (UEM), com base na análise dos resultados de exames citológicos cérvico-vaginais (teste de Papanicolaou) coletados de pacientes atendidas pelo referido setor, no período de janeiro de 2002 a dezembro de 2006. Pacientes da comunidade universitária (estudantes, docentes e funcionárias) foram incluídas neste estudo. Pacientes não pertencentes à comunidade universitária, pacientes cujas fichas apresentavam dados incompletos e menores de 18 anos foram excluídas.
As amostras citológicas foram obtidas por meio da coleta de material cérvico-vaginal realizada com auxílio de espátula de Ayre e cytobrush, ou somente vaginal para pacientes histerectomizadas. Após fixação do material, os esfregaços foram corados pelo método de Papanicolaou e analisados ao microscópio óptico em aumentos de 100X e 400X, e eventualmente 1000X para confirmação dos microrganismos. Os resultados foram expressos segundo o Sistema Bethesda.(20) Os critérios morfológicos utilizados para observação dos microrganismos foram os descritos por Gupta,(21) Silva Filho e Longatto Filho.(22)
Neste estudo, os casos classificados como vaginose bacteriana eram aqueles nos quais microrganismos com morfologia sugestiva de Gardnerella vaginalis e/ou Mobiluncus spp. eram observados, na presença eventual de microbiota mista. Os esfregaços apresentavam células escamosas individuais revestidas por uma camada de bactérias obscurecendo as margens das membranas celulares, formando as denominadas clue cells, e ausência de lactobacilos. Esfregaços citológicos que apresentavam associação do quadro de vaginose bacteriana com outros patógenos e lesões intraepiteliais escamosas foram excluídos (5 casos).
Dados como idade e sintomatologia cérvico-vaginal foram extraídos das fichas das pacientes com resultado citológico de vaginose bacteriana através de revisão retrospectiva. Os resultados foram correlacionados com presença ou não de corrimento e/ou prurido, faixa etária das pacientes acometidas, microrganismos envolvidos e associação ou não com processo inflamatório.
Os dados foram tabulados no software Microsoft® Excel 2007 e a análise estatística foi realizada no software OpenEpi 2.3, pelo teste do qui-quadrado de Pearson, considerando o nível de significância para p<0,05.
Este estudo foi aprovado pelo Comitê Permanente de Ética em Pesquisa com Seres Humanos (COPEP) da UEM (Parecer n° 106/2007).
RESULTADOS
Durante o período estudado, foram avaliados 1.531 exames citológicos. A análise dos resultados mostrou que a média de idade das pacientes com vaginose bacteriana foi de 40,91 anos, com uma variação de 22 a 61 anos.
Um total de 77 (5,03%) casos foi positivo para vaginose bacteriana. As características clínicas e a faixa etária das pacientes com VB avaliadas neste estudo estão apresentadas na Tabela 1. A maior frequência de VB foi observada no grupo de idade de 40 a 49 anos (38,96%), seguido pelo grupo de 30 a 39 anos (32,47%). A maioria das pacientes era assintomática (59,74%). Dentre os sintomas relatados, corrimento vaginal foi o mais frequente, e estava presente em 38,96% dos casos. Os dados mostram ainda que não houve associação estatisticamente significante entre as variáveis estudadas.
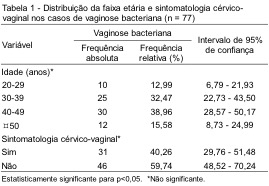
A distribuição dos diferentes microrganismos observados nos casos de vaginose bacteriana é mostrada na Tabela 2. Gardnerella vaginalis foi encontrada em 79,22% dos casos, sendo que em 18,18% havia associação com Mobiluncus spp.

A Tabela 3 mostra a relação entre os microrganismos mais frequentemente encontrados nos casos de VB e a presença de processo inflamatório. Em 46 (59,74%) casos de VB foi possível observar características inflamatórias no esfregaço citológico. Entretanto, infecção por G. vaginalis e/ou Mobiluncus spp. e o desenvolvimento de processo inflamatório não se mostraram estatisticamente associados.
A Figura 1 mostra a diferenciação do padrão lactobacilar (1A) do anaeróbico (1B a 1F), quadros com ou sem processo inflamatório associado (1D e 1C, respectivamente), e a identificação das clue cells (1B, 1E e 1F). Como pode ser observado, infecção por Gardnerella vaginalis é caracterizada por células escamosas individuais cobertas por uma camada uniforme de cocobacilos, particularmente ao longo da margem da membrana celular, formando as chamadas clue cells (Figura 1E). Na figura 1F, observamos a presença de bacilos curvos em forma de vírgula sobre as células escamosas (comma cells), dando aspecto de “tapete de pêlo”, sugerindo infecção por Mobiluncus spp.
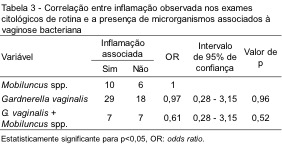
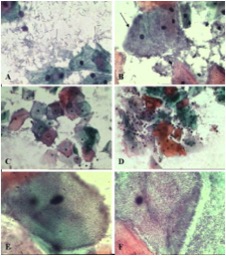
Figura 1. Esfregaços cérvico-vaginais são mostrados. Lactobacilos e citólise secundária (A). Vaginose bacteriana (B-F). A seta indica uma típica clue cell (B). Presença de numerosas clue cells e ausência de características inflamatórias (C). Reação inflamatória com degeneração das células epiteliais e numerosos leucócitos polimorfonucleares (D). Clue cell: presença de cocobacilos cobrindo toda a célula escamosa, com marginalização das bactérias, sugerindo infecção por Gardnerella vaginalis (E) e célula escamosa coberta com bacilos curvos com características morfológicas sugestivas de Mobiluncus spp., dando aspecto de tapete de pêlo (F). (A, B, 400X; C, D, 200X; E, F, 1000X; Coloração de Papanicolaou).
DISCUSSÃO
Vaginose bacteriana é uma síndrome polimicrobiana na qual os lactobacilos vaginais normais, particularmente os produtores de peróxido de hidrogênio, são substituídos por uma variedade de bactérias anaeróbicas, especialmente Gardnerella vaginalis e espécies de Mobiluncus.(10,23,24) Os lactobacilos desempenham um papel crítico na manutenção do ecossistema vaginal normal por prevenir o crescimento exacerbado de microrganismos potencialmente patogênicos através da produção de ácido lático, peróxido de hidrogênio, bacteriocinas e outras substâncias antimicrobianas.(9,15,25) Além disso, alguns lactobacilos podem aderir ao epitélio vaginal e dessa forma interferir com a capacidade de adesão de determinados patógenos.(1,9,15)
A frequência de VB na população estudada foi de 5,03%. Storti-Filho et al.(18) descreveram prevalência de clue cells sugestivas de Gardnerella vaginalis entre 3,53% e 6,57%, dependendo da população estudada. Outros autores encontraram frequências de VB entre 8,3% e 31,9% nos esfregaços de Papanicolaou.(10,11,26,27) Diversos trabalhos relatam que a prevalência da VB é influenciada pelas características da população estudada e pela variação no método utilizado para o diagnóstico, podendo ocorrer desde 4% na população feminina em geral até mais de 40% entre mulheres atendidas em clínicas ginecológicas e especializadas em doenças sexualmente transmissíveis.(4,7,8,28) É provável que a baixa prevalência observada neste estudo seja resultado das características da população estudada, bem como da metodologia utilizada, uma vez que as pacientes, independentemente de apresentar algum sinal ou sintoma de infecção genital, procuraram atendimento para realizar o exame periódico de Papanicolaou para prevenção do câncer de colo uterino.
Embora o exame de Papanicolaou não seja o teste de escolha para detecção de infecções cérvico-vaginais, este método apresenta especificidade entre 93%-98% para detecção de VB.(2,4,6) Assim, o referido exame poderia atuar como uma importante ferramenta no diagnóstico da vaginose bacteriana, particularmente em mulheres assintomáticas, uma vez que possui boa cobertura populacional.(2,7,18) Apesar de não ser o foco principal do exame de Papanicolaou, o relato da presença de microrganismos é essencial para a completa avaliação diagnóstica das amostras cérvico-vaginais, auxiliando no diagnóstico clínico, importante também para o tratamento.(17,18)
O esfregaço citológico permite a detecção de Gardnerella vaginalis em amostras cérvico-vaginais, a identificação das clue cells, a diferenciação do padrão lactobacilar do anaeróbico, sendo também altamente específico para identificar a presença de bacilos curvos sugestivos de Mobiluncus spp.(22,23) Schnadig et al.(29) sugerem o termo padrão anaeróbico para todas as variedades de pequenas bactérias vistas nos esfregaços de Papanicolaou onde não há predomínio de grandes bacilos (isto é, lactobacilos ou bacilos de Doderlein). Gardnerella vaginalis é a bactéria mais comumente encontrada nos casos de VB.(15,18,19) Neste trabalho, esta bactéria foi encontrada em 79,22% dos casos, sendo que, em 18,18%, havia associação com Mobiluncus spp. Clinicamente, Mobiluncus spp. comporta-se de forma muito parecida à G. vaginalis. Microscopicamente, ambas as bactérias têm aspecto semelhante com a coloração de Papanicolaou em aumentos pequenos, sendo que a diferenciação necessita da observação sob imersão.(22,23) Esta diferenciação é importante devido à resistência de alguns Mobiluncus spp. ao metronidazol.(14,30)
A vaginose bacteriana não tem sido associada com sinais óbvios de inflamação como eritema, edema ou a presença de leucócitos vaginais.(25,30) Entretanto, estudos têm demonstrado a presença de processo inflamatório nos esfregaços cérvico-vaginais de mulheres que apresentam esta infecção.(16,27) Eleutério Júnior e Cavalcante(24) relataram que, na presença de bacilos curvos sugestivos de Mobiluncus spp., um maior número de leucócitos foi observado no esfregaço de Papanicolaou. Maeda et al.(23) classificaram os esfregaços citológicos com presença de Mobiluncus spp. como citologia inflamatória, com resposta epitelial reativa de leve a moderada. Neste trabalho, inflamação estava presente em 59,74% dos casos. Entretanto, não houve diferença significativa entre inflamação observada nos exames citológicos e a presença de G. vaginalis e/ou Mobiluncus spp. É possível que a microbiota vaginal presente na VB possa induzir uma resposta inflamatória; alternativamente, a inflamação vaginal encontrada nos casos de VB pode ser decorrente de infecções cérvico-vaginais concomitantes. O uso de técnicas mais sensíveis para detecção de patógenos cérvico-vaginais poderia contribuir para um melhor entendimento da relação entre processo inflamatório e vaginose bacteriana.(5,25)
CONCLUSÃO
Neste trabalho observamos que a prevalência de vaginose bacteriana na população estudada foi de 5,03%, predominando em pacientes de 40 a 49 anos. A maioria das pacientes era assintomática. Gardnerella vaginalis foi o microrganismo mais encontrado. Embora a vaginose bacteriana seja considerada uma síndrome não inflamatória, neste estudo inflamação estava presente em 59,74% dos casos. Estudos adicionais utilizando métodos mais sensíveis para detecção de microrganismos em amostras cérvico-vaginais, bem como a avaliação de um número maior de pacientes, seriam interessantes para auxiliar no entendimento da associação entre vaginose bacteriana e processo inflamatório.
Abstract
Bacterial vaginosis (BV) is a polymicrobial, noninflamatory syndrome involving the lower genital tract that is characterized by an overgrowth of several anaerobic bacteria, specially Gardnerella vaginalis and Mobiluncus spp., and a reduction in or absence of lactobacillus colonization. The possibility of using the Papanicolaou smear as an auxiliary method for bacterial vaginosis is attractive, given its widespread use and low cost. The purpose of this study was to determine the prevalence of bacterial vaginosis detected by routine cytology tests, and to evaluate the characteristics of Papanicolaou smears. A retrospective analysis of cytology results was conducted from January 2002 to December 2006. The prevalence of BV in our study population was 5,03%. Of 77 women with BV studied, the median age was 40,91 years. Gardnerella vaginalis and Mobiluncus spp. were detected in 61,04% and 20,78% of the smears, respectively. In 18,18% of the cases were found both microorganisms. Although BV has traditionally been considered a non-inflammatory syndrome, inflammation was diagnosed in 59,74% of women. Further research is needed to assess the association between BV and inflammation.
Keywords
Papanicolaou smear; Bacterial vaginosis; Gardnerella vaginalis; Mobiluncus.
Referências
1.Turovskiy Y, Sutyak Noll K, Chikindas ML. The aetiology of bacterial vaginosis. J Appl Microbiol. 2011 May;110(5):1105-28.
- Discacciati MG, Simoes JA, Amaral RG, Brolazo E, Rabelo-Santos SH, Westin MCA, Montemor EBL. Presence of 20% or more clue cells: an accurate criterion for the diagnosis of bacterial vaginosis in Papanicoalou smears. Diagn Cytopathol. 2006 Apr; 34(4):272-6.
- Sha BE, Chen HY, Wang QJ, Zariffard MR, Cohen MH, Spear GT. Utility of Amsel criteria, Nugent score, and quantitative PCR for Gardnerella vaginalis, Mycoplasma hominis, and Lactobacillus spp. for diagnosis of bacterial vaginosis in human immunodeficiency virus-infected women. J Clin Microbiol. 2005 Sep;43(9):4607-12.
- Hasenack BS, Miquelão AKMB, Marquez AS, Pinheiro EHT, Urnau AP. Estudo comparativo dos diagnósticos de vaginose bacteriana pelas técnicas de Papanicolaou e Gram. RBAC 2008;40(2):159-62.
- Geisler WM, Yu S, Venglarik M, Schwebke JR. Vaginal leucocyte counts in women with bacterial vaginosis: relation to vaginal and cervical infections. Sex Transm Infect. 2004 Oct;80(5):401-5.
- Tokyol C, Aktepe OC, Cevrioglu AS, Altindis M, Dilek FH. Bacterial vaginosis: comparison of Pap smear and microbiological test results. Mod Pathol. 2004 Jul;17(7):857-60.
- Yen S, Shafer MA, Moncada J, Campbell CJ, Flinn SD, Boyer CB. Bacterial vaginosis in sexually experienced and non-sexually experienced young women entering the military. Obstet Gynecol. 2003 Nov;102(5 Pt1):927-33.
- Eriksson K, Adolfsson A, Forsum U, Larsson PG. The prevalence of BV in the population on the Aland Islands during a 15-year period. APMIS. 2010 Nov;118(11):903-8.
- Bradshaw CS, Brotman RM. Making inroads into improving treatment of bacterial vaginosis – striving for long-term cure. BMC Infect Dis. 2015 Jul;15:292.
- Brooks-Smith-Lowe K, Rodrigo S. Prevalence of bacterial vaginosis in Grenadian women of reproductive age. West Indian Med J. 2013 Sep;62(7):599-603.
- Karani A, Vuyst H, Luchters S, Othigo J, Mandaliya K, Chersich MF, et al. The Pap smear for detection of bacterial vaginosis. Int J Gynecol Obstet. 2007 Jul;98(1):20-3.
- Amsel R, Totten PA, Spiegel CA, Chen KCS, Eschenbach D, Holmes KK. Nonspecific vaginitis. Diagnostic criteria and microbial and epidemiologic associations. Am J Med. 1983 Jan;74(1):14-22.
- Nugent RP, Krohn MA, Hillier Sl. Reliability of diagnosing bacterial vaginosis is improved by a standardized method of Gram stain interpretation. J Clin Microbiol. 1991 Feb; 29(2):297-301.
- Livengood CH. Bacterial vaginosis: an overview for 2009. Rev Obstet Gynecol. 2009;2(1):28-37.
- Africa CW, Nel J, Stemmet M. Anaerobes and bacterial vaginosis in pregnancy: virulence factors contributing to vaginal colonisation. Int J Environ Res Public Health. 2014 Jul;11 (7):6979-7000.
- Baka S, Tsirmpa I, Chasiakou A, Tsouma I, Politi E, Gennimata V, et al. Inflammation on the cervical Papanicolaou smear: evidence for infection in asymptomatic women. Infect Dis Obstet Gynecol. 2013;2013:184302.
- Arora BB, Maheshwari M, Devgan N, Arora DR. Prevalence of trichomoniasis, vaginal candidiasis, genital herpes, chlamydiasis, and actinomycosis among urban and rural women of Haryana, India. J Sex Transm Dis. 2014;2014:963812.
- Storti-Filho A, Souza PC, Souza RJS, Pereira MW, Mello ICJ, Svidzinski TIE, Lopes-Consolaro ME. Prevalence of clue cells suggestive for Gardnerella vaginalis in population-based cervical screening in the public versus private health care in Maringá, Paraná, Brazil. Arch Gynecol Obstet. 2011 Apr;283(4):781-5.
- Demirezen S. Review of cytologic criteria of bacterial vaginosis: examination of 2,841 Papanicolaou-stained vaginal smears. Diagn Cytopathol. 2003 Sep;29(3):156-9.
- Solomon D. The Bethesda System for cervicovaginal cytopathology. In: Bibbo M. Comprehensive Cytopathology. 2. ed. Philadelphia: Saunders; 1997. p.93-100.
- Gupta PK. Microbiology, inflammation, and viral infections. In: Bibbo M. Comprehensive Cytopathology. 2. ed. Philadelphia: Saunders; 1997. p.125-160.
- Silva Filho AM, Longatto Filho A. Colo Uterino e Vagina: Processos Inflamatórios – Aspectos Histológicos, Citológicos e Colposcópicos. Rio de Janeiro: Revinter; 2000. p.85-165.
- Maeda MYS, Shirata NK, Pereira GMC, Pereira SMM, Yamamoto LSU. Identificação diferencial do Mobiluncus sp nas vaginoses bacterianas através do diagnóstico morfológico e sua importância na rede de Saúde Pública. Rev Bras Med. 1994 Mar;51(3):361-8.
- Eleutério Júnior J, Cavalcante DIM. Contagem de morfotipos de Mobiluncus sp e concentração de leucócitos em esfregaços vaginais de pacientes com vaginose bacteriana. Rev Bras Ginecol Obstet. 2004 Abr;26(3):221-5.
- Donders GGG. Definition and classification of abnormal vaginal flora. Best Pract Res Clin Obstet Gynaecol. 2007 Jun;21(3):355-73.
- Karabulut A, Alan T, Ekiz MA, Iritas A, Kesen Z, Yahsi S. Evaluation of cervical screening results in a population at normal risk. Int J Gynecol Obstet. 2010 Jul;110(1):40-2.
- Barouti E, Farzaneh F, Sene AA, Tajik Z, Jafari B. The pathogenic microorganisms in Papanicolaou vaginal smears and correlation with inflammation. J Family Reprod Health. 2013 Mar;7(1):23-7.
- Kenyon C, Colebunders R, Crucitti, T. The global epidemiology of bacterial vaginosis: a systematic review. Am J Obstet Gynecol. 2013 Dec;209(6):505-23.
- Schnadig VJ, Davie KD, Shafer SK, Yandell RB, Islam MZ, Hannigan EV. The cytologist and bacterioses of the vaginal-ectocervical area. Clues, commas and confusion. Acta Cytol. 1989 May-Jun;33 (3):287-97.
- Culhane JF, Nyirjesy P, McCollum K, Goldenberg RL, Gelber SE, Cauci S. Variation in vaginal immune parameters and microbial hydrolytic enzymes in bacterial vaginosis positive pregnant women with and without Mobiluncus species. Am J Obstet Gynecol. 2006 Aug;195(2):516-21.
Correspondência
Cinthia Gandolfi Boer
Departamento de Análises Clínicas e Biomedicina
Universidade Estadual de Maringá
Avenida Colombo, 5790 – Campus Universitário
87020-900 – Maringá, Paraná, Brasil.
E-mail: [email protected]
