Marcadores moleculares para diferenciação diagnóstica do carcinoma urotelial
Molecular markers for diagnostic differentiation of urothelial carcinoma
Guibyson Silva Ferreira1
Danilo Pontes de Oliveira Barros2
1Estudante. Centro Universitário Maurício de Nassau – Uninassau. Recife-PE, Brasil.
2Especialista em Citologia Clínica. Centro Universitário Maurício de Nassau – Uninassau. Recife-PE, Brasil.
Instituição: Centro Universitário Maurício de Nassau – Uninassau. Recife-PE, Brasil.
Recebido em 23/01/2019
Artigo aprovado em 24/03/2020
DOI: 10.21877/2448-3877.202000819
INTRODUÇÃO
A maioria das neoplasias na bexiga tem início no urotélio, diferenciam-se de acordo com os tipos de células nas quais se darão origem e são: carcinoma de células transicionais (uroteliais), carcinoma de células escamosas, adenocarcinoma, carcinoma de pequenas células e sarcoma. Na bexiga, o carcinoma das células de transição é o mais comum. Então, é importante entender que o tumor pode denominar-se de não invasivo e invasivo.(1,2)
Até chegar à forma invasiva, o câncer na bexiga passa pelos estágios 0, que inclui o carcinoma papilífero e o plano não invasivo; 0a, para tumores papilares não invasivos de baixo e alto grau; 0is, para plano não invasivo; I, os que cresceram na camada do tecido conjuntivo da parede da bexiga; II, tumores que invadiram a camada muscular da parede da bexiga; III, os que atingiram a parte externa da bexiga; IV, estes cânceres atingem a parede abdominal ou pélvica, e recidivos são aqueles que acometem outras partes do corpo e são de difícil remoção por método cirúrgico.(3)
No mundo, a incidência anual apontou que o câncer na bexiga é o 11º mais comum e sua incidência é de 3,1% (429.793) casos e a mortalidade de 2% (165.084). Diante dessas evidências, o carcinoma urotelial, também conhecido como carcinoma das células de transição ou transicionais, destaca- se como o mais comum.(4) No Brasil, as estimativas para 2016 apontaram a ocorrência de 9.670 novos casos de câncer na bexiga (sexo masculino – 7.200 e feminino – 2.470) e a mortalidade totalizou 3.642 casos (homens – 2.452 e mulheres – 1.099). Nas regiões brasileiras, as incidências foram: 5.440 casos de neoplasia na bexiga registrados no Sudeste, 1.860 no Sul, 1.390 no Nordeste, 600 no Centro-oeste e 470 no Norte.(5)
Para diagnosticar o câncer na bexiga, a citologia urinária, juntamente com a cistoscopia, permanece como ferramentas de diagnóstico e monitoração desse câncer. Todavia, existe uma variação dependendo do quadro clínico e do grau de lesões uroteliais detectadas através do exame. Observa-se uma evolução significativa na via molecular, onde o gene p53 sofre mutações que garantem a detecção e tratamento. Contudo, a citologia urinária tem uma grande vantagem utilizada pelos clínicos por possuir uma sensibilidade maior para detectar carcinoma urotelial de alto grau.(6)
Embora a sensibilidade da citopatologia urinária seja baixa para carcinoma urotelial de baixo grau, ela continua sendo um método de extrema importância. Em grande parte, os tumores uroteliais dependem da morfologia da lesão. Nisso, podem-se encontrar muitos desafios e armadilhas para um diagnóstico preciso, pois este está ligado ao processo atípico.(7) Mas, devido às suas características histomorfológicas, a avaliação patológica das neoplasias uroteliais pode ser auxiliada por meio de análises imuno-histoquímicas, sendo esta metodologia usada para fins diagnósticos e diferenciação nas distinções de lesões planas versus papilares, de baixo grau versus de alto grau e também determinar a presença ou ausência de tumor invasivo.(8)
Levando-se em conta o valor de sensibilidade da citologia urinária e de sua menor eficiência para a detecção de carcinoma urotelial de baixo grau, a busca por biomarcadores pode melhorar o acompanhamento de pacientes acometidos de neoplasia na bexiga. Alguns marcadores moleculares potenciais foram reconhecidos em espécimes de citologia urinária, incluindo a proteína p53, ki-67, Urovysion™ FISH. O biomarcador mais promissor é o p16INK4a devido à sua aplicabilidade acerca dos resultados da citologia de células escamosas atípicas de significado indeterminado (ASC-US) e lesão intraepitelial escamosa de baixo grau (LSIL). Além disso, é um marcador interessante em outras malignidades. O p16INK4a está ligado funcionalmente ao gene p53, e sua eficácia nas amostras de citologia urinária com carcinomas uroteliais de alto grau está em 97,2%.(9)
Devido à grande dificuldade para um diagnóstico neoplásico positivo de malignidade no epitélio de transição, as células que sofrem alterações morfológicas tumorais descamam na urina, fazendo com que a identificação de sua origem não seja notada, tornando-as semelhantes às células de outro epitélio que compõe o sistema urinário. Desta forma, é importante a realização de estudos sobre marcadores moleculares para a diferenciação diagnóstica dos diversos tipos de neoplasias acometidas na bexiga, visto que tais biomarcadores podem ser capazes de ajudar a identificar o grau cancerígeno do urotelioma.
Sendo assim, o objetivo desta pesquisa foi descrever os marcadores moleculares utilizados para diferenciação diagnóstica do carcinoma urotelial.
MATERIAL E MÉTODOS
Foi realizado um estudo de revisão de literatura que teve por finalidade desempenhar uma pesquisa aplicada. Utilizou-se busca eletrônica de artigos nas bases de dados: Scientific Eletronic Library Online (SciELO), US National Library of Medicine (PubMed) e do Centro Latino-americano e do Caribe de Informações em Ciências da Saúde (LILACS), além dos sites do Instituto Nacional de Câncer José de Alencar Gomes da Silva (Inca) e da Organização Mundial da Saúde (OMS). Foram originados a partir das palavras-chaves relacionadas ao tema proposto: “carcinoma urotelial”, “marcadores moleculares”, “imuno-histoquímica”, “imunocitoquímica”, “citologia urinária”, “urotelial”, “câncer na bexiga”, “biomarcadores”.
Foram utilizados, para critério de inclusão, os artigos publicados nos últimos seis anos (2012-2017) nos idiomas Português, Inglês e Espanhol, além dos considerados clássicos. A abordagem do tratamento da coleta de dados da pesquisa bibliográfica ocorreu a partir de uma leitura prévia dos resumos anexados de acordo com o tema proposto. Para uma melhor compreensão das principais ideias, métodos e conclusão dos artigos lidos, a pesquisa implicou que todos os dados e informações necessárias realizaram-se a partir do apuramento de autores especializados através de artigos científicos e revistas especializadas, entre outras fontes.
REFERENCIAL TEÓRICO
Aspectos clínicopatológicos do carcinoma urotelial
A maioria das neoplasias intituladas ao trato urinário são carcinomas uroteliais.(10) Cada condição de risco tem um impacto discrepante quanto à incidência e fisiopatologia do urotelioma. Entretanto, a diligência de agentes cancerígenos, como a fumaça dos cigarros, pode diminuir consideravelmente sua incidência. Provavelmente, a relevância do tumor entre homens e mulheres retrata em parte quando se fala dos carcinógenos.(11) Os fumantes são três vezes mais propensos a contrair a neoplasia quando comparados com não fumantes, pois foi observado que aproximadamente 50% dos tumores encontrados na bexiga têm relação ao consumo do tabaco.(12)
Sabendo-se que o tabagismo é um fator de risco importante, há uma correlação fisiopatológica direta entre tabaco e câncer na bexiga porque em sua composição química contém aminas aromáticas, como a beta-naftilamina, e também os hidrocarbonetos aromáticos policíclicos que exercem um efeito cancerígeno em todo o trato urinário.(11) Alguns produtos químicos industriais também estão associados com tumor na bexiga por conter benzidina e beta-naftilamina. Logo, fumantes que trabalham com esses tipos de agentes cancerígenos têm um risco, sobretudo proeminente, para desenvolver o câncer.(12)
Quando observamos o carcinoma urotelial, notamos que há dissensões resultantes em variantes histológicas que não se retêm apenas à bexiga. Consequentemente, consideramos uma metástase de outros órgãos, e, sendo assim, utilizamos a imuno-histoquímica para confirmar sua origem urotelial.(10)
Nisso, a estrutura micropapilar arranja-se em ninhos invasivos de câncer clinicamente agressivos. A escamosa aparece histologicamente como queratina ou ligações intercelulares na forma invasiva vista em até 40% dos carcinomas uroteliais. A morfologia plasmocitoide apresenta-se de forma nodal, possui células tumorais infiltrativas e individuais agressivas e se estendem para fora da bexiga. A glandular aparenta-se com adenocarcinoma glandular, considerado como puro e chamado de urotelioma com diferenciação glandular (Figura 1).(13)
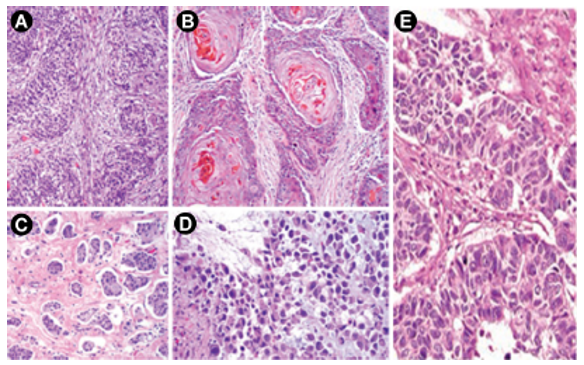
Figura 1. Variantes histológicas do carcinoma urotelial. (A) Carcinoma urotelial invasivo convencional; magnificação x100. (B) Carcinoma urotelial com diferenciação escamosa; magnificação x100. (C) Variante micropapilar; magnificação x100. (D) Variante plasmocitoide; magnitude x 200. (E) A morfologia glandular (x400) aparece como a formação de estruturas glandulares verdadeiras dentro do câncer invasivo. Fonte: Kamat AM et al.(11); Warrick JI (13).
O urotelioma apresenta microhematúria, macrohematúria indolor, além de apresentar sintomas de micção irritante, fazendo com que a investigação para o grau da doença seja mais intensificada.(14) Há pouco tempo, uma grande população de pacientes foi submetida à análise de urina microscópica durante dois anos em que a preponderância da neoplasia foi muito menor, pois a hematúria microscópica sintomática é considerada algo comum no conceito populacional geral, e os baixos graus são ponderados como um coeficiente de risco para neoplasmas maligno do trato urinário.(15)
Estudos revelam que o diagnóstico inicial para neoplasia na bexiga é mais difícil em mulheres do que em homens.(16) A disparidade entre os sexos não tem sido bem compreendida quando se fala em hematúria como fator de risco para carcinoma urotelial, mesmo que exames como a nefrouretectomia radial demonstrem qual categoria está mais propensa a ter tumor maligno. Então, para elucidar essa diferença, os pacientes do sexo feminino apresentam um atraso bem maior relatado à hematúria para diagnóstico de câncer na bexiga. Mas, se o paciente apresentar carcinoma urotelial do trato superior, o atraso será semelhante na categoria sexual.(15,17)
O principal aspecto clinicopatológico metastático são as células tumorais circulantes encontradas no sangue periférico, gradativamente importante no acompanhamento de pacientes com tumores malignos. Através da citologia urinária conseguimos identificar por meio de biomarcadores utilizados para sua detecção.(18) Embora possa apresentar formas atípicas, a Associação Americana de Urologia recomenda a citologia urinária como uma diretriz gerencial no caso de pacientes sob monitoramento para câncer urotelial anteriormente tratado e de pacientes de alto risco, como, por exemplo, os que apresentam hematúria bruta, sintomas irritantes de micção ou histórias do uso irrestrito de tabaco.(19)
Técnicas morfológicas (citopatológica e histopatológica) no diagnóstico do carcinoma urotelial
Novas técnicas para a identificação de lesões malignas na bexiga foram desenvolvidas: o diagnóstico fotodinâmico (cistoscopia de luz azul), que é feito com cloridrato de hexaminolevulinato, que tem uma alta taxa significativa na detecção de tumores não invasivos e também a imagem de banda estreita (apêndice), que auxilia na visibilidade dos vasos e outras estruturas na mucosa da bexiga.(10) Em um acompanhamento para identificação de metástase são comparadas através de manchas de imuno-histoquímica para citoqueratina de alto peso molecular, são elas: CK5/6, CK7, CK20. Também a p53 e a trombomodulina.(20)
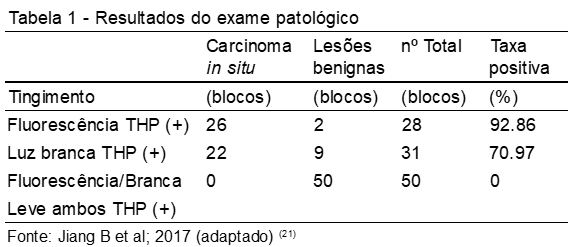
Estudos foram realizados em relação à pirarubicina (THP), criada no Japão em 1979. Estudiosos especularam a agregação de THP e cistoscopia de fluorescência e sua fotossensibilidade, pois o diagnóstico fotodinâmico induzido pelo ácido 5-aminolevulínico é mais eficaz quando comparado com outros métodos. Observou-se que o tecido tumoral após absorver THP emite vermelho sob cistoscopia de fluorescência quando combinado com THP. Exames patológicos revelaram que, em 26 casos, o carcinoma urotelial teve positividade de 92,86% e duas lesões não neoplásicas. Em outros 31 casos, o THP (+) de luz branca mostrou positividade de 70,97% e nove lesões não neoplásicas. De acordo com os resultados, em cinquenta membranas mucosas da veia sem absorção não houve carcinoma urotelial (Tabela 1).(21)
As células do urotelioma apresentam ocasionalmente um arranjo “semelhante a janela” raramente observado entre as células, aumento da relação N/C, núcleos ampliados, membrana nuclear irregular, cromatina nuclear hipercromática e um a três nucléolos. Em outros casos podem apresentar bi ou multinucleação (Figura 2).(22)
Algumas pesquisas relataram atipias celulares quando se fala em carcinoma urotelial. Observa-se que existe uma divisão em “células uroteliais atípicas de significância incerta (AUC-US)” ou “células uroteliais atípicas não excluindo carcinoma urotelial de alto grau (AUC-H)”. É necessária a presença de uma relação núcleo/citoplasma entre 0,5, e 0,5 e/ou hipercromática leve a moderada, membranas nucleares irregulares e cromatina irregular (Figura 3).(23)
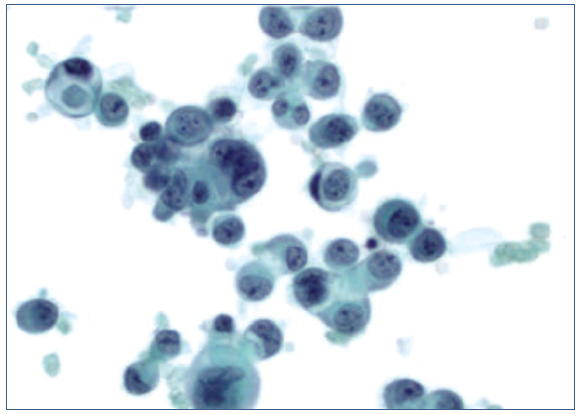
Figura 2. Células do carcinoma urotelial apresentando “Windows”, aumento da relação N/C, núcleos ampliados, membrana nuclear irregular, cromatina nuclear hipercromática e um a três nucléolos.
Fonte: Cheng Huang C, et al. 2012 (22)
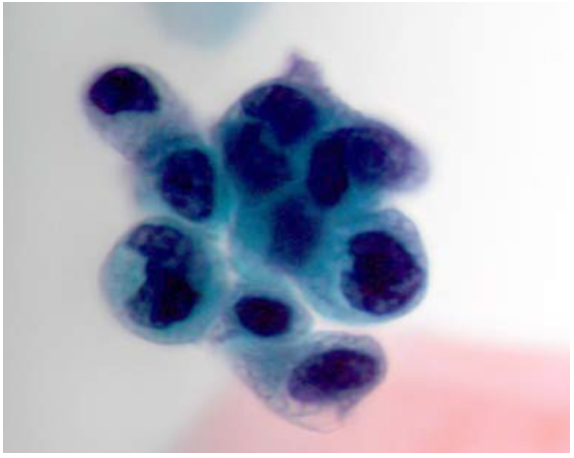
Figura 3. Um grupo de células uroteliais atípicas com aumento da relação N / C (> 0,5), hipercromasia e forma nuclear irregular.
Fonte: Granados R, et al. 2016 (23)
A característica mais comum de AUC-H são células individuais com hipercromasia, fronteiras nucleares irregulares, anisonucleose e aumento de núcleo à citoplasmação, também são pequenas e sua hipercromasia obscurece os detalhes nucleares. A morfologia menos comum são núcleos alongados e a presença de aglomerados de célula (Figura 4).(24)
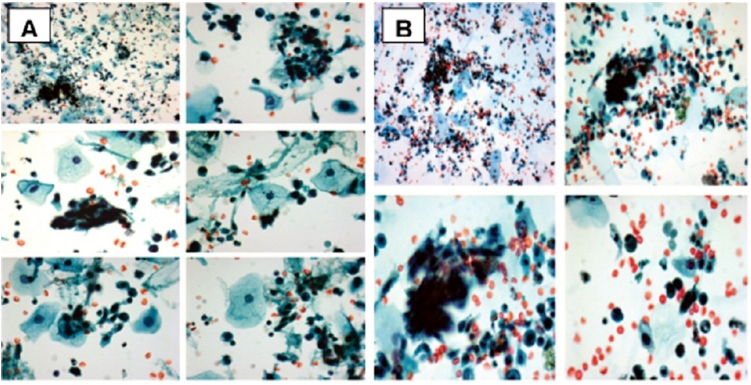
Figura 4. (A) essas fotomicrografias de uma amostra de urina que foi diagnosticada como células uroteliais atípicas não excluindo o carcinoma urotelial (AUC-H) demonstram as 4 características mais comumente observadas: hipercromasia, fronteiras nucleares irregulares, aumento da relação núcleo/citoplasma e anisonucleose. A anisonucleose é particularmente marcante neste espécime, em que muitas células atípicas várias em uma proporção maior que 3:1. As células atípicas são hipercromáticas, resultando na população dupla de núcleos comumente observados em espécimes com AUC-H. (B) trata-se de fotomicrografias de uma amostra de urina que foi diagnosticada como células uroteliais atípicas de significância desconhecida (AUC-US), embora o espécime demonstre as 4 características mais comumente observadas em espécimes com células uroteliais atípicas, não excluindo carcinoma alto grau (AUC-H): hipercromasia, fronteiras nucleares irregulares, aumento da relação núcleo/citoplasma e anisonucleose. Embora essas características também sejam observadas frequentemente em células atípicas individuais, um fragmento de células atípicas é identificado neste espécime. As células atípicas também possuem as 4 características mais comuns. Fonte: Rosenthal DL et al; 2013(24)
Através do exame de Papanicolaou SurePathTM, estudos de pesquisa indicaram que o carcinoma urotelial de alto grau apresenta, em sua morfologia, células solteiras alongadas com citoplasma liso, denso e núcleos angulares e hipercromáticos com uma alta relação N/C (Figura 5). Todavia, essas características são do carcinoma urotelial de alto grau metastático, e geralmente o diagnóstico diferencial vai incluir carcinoma de células escamosas de qualquer tipo primário.(25)
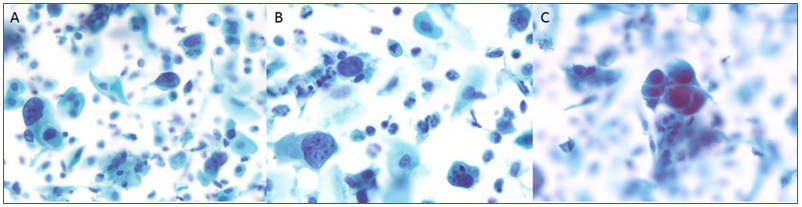 Figura 5. Teste de Papanicolaou, carcinoma urotelial de alto grau. (A, B): células atípicas predominantemente únicas com núcleos grandes, angulares e hipercromáticos e citoplasma denso (Papanicolaou, 400x). (C) Pequeno fragmento de células malignas com núcleos grandes, angulares e hipercromáticos e citoplasma denso. (Papanicolaou, 400x). Fonte: Kapur U, et al. 2007(25)
Figura 5. Teste de Papanicolaou, carcinoma urotelial de alto grau. (A, B): células atípicas predominantemente únicas com núcleos grandes, angulares e hipercromáticos e citoplasma denso (Papanicolaou, 400x). (C) Pequeno fragmento de células malignas com núcleos grandes, angulares e hipercromáticos e citoplasma denso. (Papanicolaou, 400x). Fonte: Kapur U, et al. 2007(25)
Marcadores moleculares no diagnóstico diferencial do carcinoma urotelial
Sabe-se que AUC-US envolve uma distinção difícil quando observamos o urotélio benigno, reativo ou displásico, porque, histologicamente, o pleomorfismo e a hipercromasia inflamatória são divergentes quando comparados com atipia reativa ou carcinoma in situ. Em uma pesquisa, foram observados os casos discordantes, na qual as análises de espécimes com atipia equívocas refletiram na coorte de pacientes. Atualmente evidências escassas têm mostrado resultado negativo. Então, é necessário uma cooperação e colaboração entre urologistas, oncologistas, radiologistas e patologistas para melhor gerenciar pacientes com neoplasia da bexiga.(26)
Entretanto, análises utilizando a imuno-histoquímica de citoqueratina 20 (CK20), p53 e Ki-67 têm sido avaliadas em amostras duvidosas para confirmar a natureza de atipias reativas.(9) Exames realizados com a CK20 observaram que 29% das amostras apresentaram positividade, 16% apresentaram coloração divergente e 55% rotularam-se negativo das células “umbrela”. O p53 apresentou positividade em 23% das amostras, 60% apresentaram irregularidade e 17% negativo apenas para as células localizadas. Todavia, quando combinamos CK20 e p53, 13% apresentaram coloração positiva do carcinoma in situ, 26% discordantes, 45% indeterminados e 16% expressaram coloração benigna (Figura 6) (Tabela 2).(26)
 Figura 6. Cenários desafiadores com coloração imuno-histoquímica p53 com citoqueratina 20 (CK20) e p53 na atipia urotelial. Neste caso de atipia urotelial com infiltrado inflamatório proeminente (A), a atitude atípica reativa foi uma consideração; no entanto, a imuno-histoquímica demonstra positividade de CK20 de espessura total (B) e p53 nuclear forte em quase todas as camadas (C). Em outro caso, com linfócitos intraepiteliais misturados que favorecem mudanças reativas (D), CK20 demonstra positividade anormal de grande parte do epitélio (E), mas há apenas variáveis de p53 nuclear fraco a moderado (F, resultados discordantes). Este exemplo de atipia urotelial com grandes células atípicas que minam uma camada celular superficial benigna foi suspeito para o carcinoma in situ (G). No entanto, a imuno-histoquímica demonstrou CK20 (H) negativo, mas moderado a forte p53 (I, resultados discordantes). Em outro caso de atipia urotelial com desnudamento e contornos nucleares irregulares, a histologia era suspeita de carcinoma in situ (J); no entanto, ambos CK20 (K) e p53 (L) demonstraram resultados negativos (hematoxilina-eosina, ampliações originais x100 [A e G] e x200 [D e J]; ampliações originais x100 [B, C, H e I] e x200 [E, F, K e L]). Fonte: Arias-Stella JA, et al. 2017 (26)
Figura 6. Cenários desafiadores com coloração imuno-histoquímica p53 com citoqueratina 20 (CK20) e p53 na atipia urotelial. Neste caso de atipia urotelial com infiltrado inflamatório proeminente (A), a atitude atípica reativa foi uma consideração; no entanto, a imuno-histoquímica demonstra positividade de CK20 de espessura total (B) e p53 nuclear forte em quase todas as camadas (C). Em outro caso, com linfócitos intraepiteliais misturados que favorecem mudanças reativas (D), CK20 demonstra positividade anormal de grande parte do epitélio (E), mas há apenas variáveis de p53 nuclear fraco a moderado (F, resultados discordantes). Este exemplo de atipia urotelial com grandes células atípicas que minam uma camada celular superficial benigna foi suspeito para o carcinoma in situ (G). No entanto, a imuno-histoquímica demonstrou CK20 (H) negativo, mas moderado a forte p53 (I, resultados discordantes). Em outro caso de atipia urotelial com desnudamento e contornos nucleares irregulares, a histologia era suspeita de carcinoma in situ (J); no entanto, ambos CK20 (K) e p53 (L) demonstraram resultados negativos (hematoxilina-eosina, ampliações originais x100 [A e G] e x200 [D e J]; ampliações originais x100 [B, C, H e I] e x200 [E, F, K e L]). Fonte: Arias-Stella JA, et al. 2017 (26)
Alguns casos relataram a positividade de 79,2% para p16INK4a, onde 93,9% positivaram casos de alto grau embora sobrexpresso em 80,4% dos casos como negativo para neoplasia urotelial papilar de baixo potencial maligno ou baixo grau. Então, a dupla marcação de p16INK4a e Ki-67 foram observadas em 82,9% dos casos para AUC-H, sendo que a citologia positiva para a marcação dupla positivou 93,9% dos casos estudados, resultando uma sensibilidade maior quando comparada à citologia urinária (82,5% vs 80,8%). Nesse mesmo grupo, a sensibilidade de p16INK4a foi de 93,3% e sua especificidade 69,2% (Tabela 3) (Figura 7).(27)
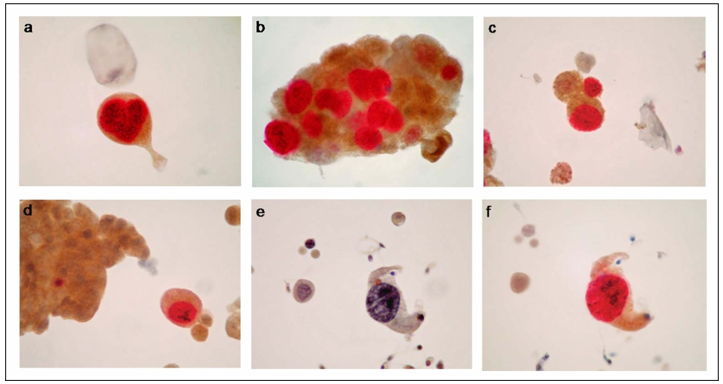
Figura 7. A rotulação dupla p16INK4a e Ki-67 é mostrada em vários casos. (A) A rotulação dupla de uma célula atípica isolada é mostrada em um homem de 66 anos que foi previamente tratado para carcinoma in situ da bexiga e que apresentou cistoscopia negativa. O relatório de citologia foi células uroteliais atípicas, não pode excluir alto grau. A ressecção transuretral (TUR) realizada 7 meses depois revelou um tumor de grau médio, pTa, grau 1. O seguimento após um atraso de 28 meses foi negativo. (B e C) A marcação dupla em numerosas células de câncer em um homem de 83 anos sem história prévia que apresentou hematúria e cistoscopia positiva é mostrada. A citologia urinária foi positiva e de alto grau. TUR revelou um carcinoma de bexiga invasivo, pT3, grau 3. (D) Uma célula de rotulação dupla de um homem com 61 anos de idade sem histórico prévio e que apresentou cistoscopia positiva é mostrada. A citologia sugeriu tumor de baixo grau e TUR revelou uma hiperplasia urotelial polipoide. (E e F) Uma célula marcada dupla de um homem de 83 anos que foi previamente tratada para carcinoma de bexiga superficial de alto grau (pTa grau 3) e que apresentou cistoscopia suspeita é mostrada. A citologia urinária foi positiva e de alto grau. A TUR da bexiga realizada 6 meses depois revelou um carcinoma in situ (e: Papanicolaou mancha, x40; a-d e f: CINtec PLUS double immunostain, x40). Fonte: Piaton E et al; 2014 (27)
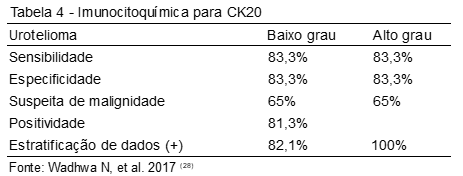
Em uma análise de imunocitoquímica para CK20, observaram-se pacientes que apresentaram carcinoma urotelial de baixo e alto grau.
Sua expressão na sensibilidade e especificidade da citologia urinária foi de 83,3% e na suspeita de malignidade foi de 65%. CK20 foi positivo em 81,3% dos casos que envolveram carcinoma urotelial de baixo grau, e a estratificação de dados resultou em 100% para carcinoma urotelial de alto grau e 82,1% para carcinoma urotelial de baixo grau (Tabela 4).(28)
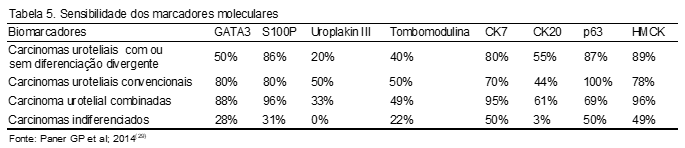
A partir da utilização de marcadores moleculares, as taxas gerais de positividade para carcinomas uroteliais com ou sem diferenciação divergente foram as seguintes: GATA3 (50%), S100P (86%), uroplakin III (20%), trombomodulina (40%), CK7 (80%), CK20 (55%), p63 (87%) e HMCK (89%). As taxas para carcinomas uroteliais convencionais foram as seguintes: GATA3 (80%), S100P (80%), uroplakin III (50%), trombomodulina (50%), CK7 (70%), CK20 (44%), p63 (100%) e HMCK (78%).
Para variantes de carcinoma urotelial combinadas (micropapilares, plasmocitoide, aninhadas, células claras e microcísticas) foram as seguintes: GATA3 (88%), S100P (96%), uroplakin III (33%), trombomodulina (49%), CK7 (95%), CK20 (61%), p63 (69%) e HMCK (96%). Para carcinomas indiferenciados foram as seguintes: GATA3 (28%), S100P (31%), uroplakin III (0%), trombomodulina (22%), CK7 (50%), CK20 (3%), p63 (50%) e HMCK (49%) (Tabela 5).(29)
Importância das técnicas moleculares na descrição de lesões uroteliais
Eventualmente, 80% dos tumores da bexiga sofrem mutação do promotor transcriptase reversa da telomerase, independentemente do grau e do estágio. Nisso, alguns tipos de marcadores moleculares são importantes para a detecção do grau e do estágio em que a lesão se encontra. Os biomarcadores baseiam-se na expressão diferencial das proteínas, DNA, RNA ou marcadores relacionados ao câncer. Na literatura, observou-se que a citologia apresenta uma baixa sensibilidade (34%-55%), porém, em concentrações mais altas, a sua especificidade é >90%. A sensibilidade combinada da maioria dos marcadores variou de 50% a 80% e a especificidade da maioria variou de 70% a 90%, menor que a citologia urinária.(10,30)A cistoscopia continua como o padrão ouro e nenhum marcador molecular possui uma sensibilidade altamente suficiente para que possa substituí-la, e se houver essa necessidade ela ainda não foi devidamente estudada. Existem alguns ensaios moleculares que são importantes para achados atípicos em citologia ou cistoscopia, como o teste de hibridação in situ de florescência UROVysion. Nisso, os marcadores passam por estudos constantes para melhorar as tecnologias atuais.(10)
Nas técnicas que utilizam a CK20, podemos observar a suma importância na identificação de carcinoma urotelial in situ, pois é extremamente positivo em todas as camadas celulares. O p53 apresenta positividade forte, intensa e difusa nos núcleos das células atípicas. Mas outros marcadores adicionais foram avaliados para identificar o carcinoma urotelial in situ, entre eles está o Ki-67, que é considerado o terceiro marcador positivo para carcinoma urotelial in situ. Contudo, a atipia urotelial pode ter uma oscilação intraobservador e interobservador.(26)
Ao se observarem lesões de alto grau, a citologia urinária atinge valores de sensibilidade >80% e especificidade de 90% a 95%. Neste caso, ao se observar a utilização da imunomarcação pelo p16INK4a, que intimamente está ligado à p53 e pRb, notou-se superexpressão relatada em 11% a 100% dos carcinomas uroteliais, 80% das lesões de alto grau e cerca de 100% nos casos de carcinoma urotelial in situ. Em outros estudos realizados recentemente, a proteína p16INK4a teve uma expressão de 81,3% e 64,6% para carcinomas uroteliais de baixo grau. Em cerca de 97,2% de amostras de citologia urinária com carcinomas uroteliais de alto grau encontramos a expressão de p16INK4a.(27)
Observando a lesão de baixo grau, os pacientes que apresentam negatividade devem ser submetidos a cistoscopia. Mas, se um biomarcador auxiliar o diagnóstico de citologia de urina, os pacientes não necessitam de cistoscopia. Logo, a combinação de CK20 aumenta o rendimento diagnóstico da citologia urinária. Sua dilatação em células mais profundas, intermediárias e basais, é anormal e relatada em displasia (89%), carcinoma in situ (81%) e tumores uroteliais (100%). A expressão de CK20 permanece inalterada, tornando-a um biomarcador útil de malignidade urotelial e especialmente útil com citologia inconclusiva.(28)
A técnica do anticorpo monoclonal para GATA3 mostrou-se expresso em 67%-91% de carcinoma urotelial. Mas nesse estudo observou-se que ele foi expresso em 88% das variantes do carcinoma urotelial. A proteína uroplakin III constitui a membrana unitária assimétrica de células em “Windows” e é considerada a mais específica na diferenciação urotelial. Ela é relativamente sensível para o carcinoma urotelial, pois apresentou 55% de expressão na maioria dos casos estudados. O S100P é considerado o menos específico, mas pode ser expresso em outros tumores. O p63 tem menor positividade e as expressões CK7, CK20 e HMCK expressam-se em carcinomas uroteliais com ou sem diferenciação divergente. Contudo, as variantes expressam marcadores de suporte para diferenciação urotelial de acordo com seu grau.(29)
CONSIDERAÇÕES FINAIS
Consideramos que a utilização dos marcadores moleculares no prognóstico do carcinoma urotelial melhorou a sensibilidade para percepção dos diversos tipos existentes. Embora a técnica seja de alto custo, a utilização e combinação de biomarcadores juntamente com a citologia urinária tem resultado na alta sensibilidade e especificidade quando observamos os aspectos clinicopatológicos e suas manifestações.
Pode-se observar também que nenhum marcador molecular é tão excitável quando comparamos com a cistoscopia, pois a cistoscopia continua como padrão ouro na detecção da lesão tumoral da bexiga. Mas isso não tira a importância da utilização de ambas as técnicas citadas para um diagnóstico de qualidade.
Abstract
The majority of neoplasms in the bladder have no onset urothelium. Transitional cell carcinoma is the most common. A urinary cytology together with cystoscopy remain as a diagnostic and monitoring toll. Some potential molecular markers were recognized in urinary cytology specimens, including the p53 protein. The objective of this research was to describe the molecular markers for diagnostic differentiation of urothelial carcinoma. A review of the literature was performed. When we observe the urothelial carcinoma, we notice that there are dissensions resulting in histological variants, and, therefore, it uses immunohistochemistry to confirm your origin. Urotelioma presents microhematúria, painless macrohematúria. As cells do not urotelioma occasionally transformed a “window-like” arrangement. The biomarkers are based on the differential expression of proteins, DNA, RNA or cancer-related markers. It was observed that cytology has a low sensitivity, but at higher concentrations its specificity (>90%). A combined sensitivity of most markers ranged and the specificity of the majority varied from 70% to 90%, lower than urinary cytology. In this, the markers go through constant studies to improve it as current technologies. Although a high-cost technique, a use and combination of biomarkers with urinary cytology results in high sensitivity and specificity.
Keywords
Immunohistochemistry; biomarkers, tumor; urinary bladder neoplasms
REFERÊNCIAS
- 1. American Cancer Society. What is bladder cancer?; disponível em https://www.cancer.org/cancer/bladder-cancer/about/whal-is-bladder-cancer.htm . Acesso em 23 jan 2019.
- Instituto oncoguia. Quimioterapia para câncer de bexiga. Disponível em http://www.oncoguia.org.br/conteudo/quimioterapia-para-cancer-de-bexiga/1911/203/ .Acesso em 23 jan 2019.
- Oncoguia E. Instituto Oncoguia Tratamento do Câncer de Bexiga por Estágio. 2015;
- Oliveira RPCM, Abrantes CFC, Silva EMCT, Marinho CA, Sousa VML, Castro LRCOAP, et al. Invasive bladder urothelial carcinoma, plasmacytoid variant: case report. J Bras Patol e Med Lab [Internet]. 2016;52(4):262-5. Available from: http://www.gnresearch. org/doi/10.5935/1676-2444.20160043.
- Instituto Nacional de Cancer José Alencar Gomes da Silva. INCA – Instituto Nacional de Câncer – Estimativa 2016 [Internet]. Ministério da Saúde Instituto Nacional de Cancer José Alencar Gomes da Silva. 2016. 124 p. Available from: http://www.inca.gov.br/estimativa/ 2014/ sintese-de-resultados-comentarios.asp.
- Ton Nu TN, Kassouf W, Ahmadi-Kaliji B, Charbonneau M, Auger M, Brimo F. The value of the “suspicious for urothelial carcinoma” cytology category: a correlative study of 4 years including 337 patients. Cancer Cytopathol. 2014;122(11):796-803. doi: 10.1002/cncy.21449.
- Onur I, Rosenthal DL, VandenBussche CJ. Benign-appearing urothelial tissue fragments in noninstrumented voided urine specimens are associated with low rates of urothelial neoplasia. Cancer Cytopathol. 2015;123(3):180-185. doi:10.1002/cncy.215018.
- Solomon JP, Hansel DE. Morphologic and Molecular Characteristics of Bladder Cancer. Surg Pathol Clin. 2015;8(4): 663-676. doi: 10.1016/j.path.2015.07.003.
- Alameda F, Juanpere N, Pijuan L, Lloveras B, Gimeno J, Baró T, et al. Value of p16INK4a in the diagnosis of low-grade urothelial carcinoma of the urinary bladder in urinary cytology. Cancer Cytopathol. 2012;120(4):276-82. doi:10.1002/cncy.21193.
- Kamat AM, Hahn NM, Efstathiou JA, Lerner SP, Malmström PU, Choi W, et al. Bladder cancer [published correction appears in Lancet. 2016 Dec 3;388(10061):2742]. Lancet. 2016; 388 (10061): 2796-2810. doi:10.1016/S0140-6736(16)30512-8.
- Burger M, Catto JWF, Dalbagni G, Grossman HB, Herr H, Karakiewicz P, et al. Epidemiology and risk factors of urothelial bladder cancer. Eur Urol [Internet]. 2013;63(2):234-41. Available from: https://doi.org/10.1016/j.eururo.2012.07.033.
- Boehme AK, Esenwa C, Elkind MS. Stroke Risk Factors, Genetics, and Prevention. Circ Res. 2017;120(3):472-495. doi: 10.1161/ CIRCRESAHA.116.308398.
- Warrick JI. Clinical Significance of Histologic Variants of Bladder Cancer. J Natl Compr Cancer Netw [Internet]. 2017;15(10):1268-1274. Available from: http://www.jnccn.org/lookup/doi/10.6004/jnccn.2017.7027.
- Burger M, Oosterlinck W, Konety B, Chang S, Gudjonsson S, Pruthi R, et al. ICUD-EAU International Consultation on Bladder Cancer 2012 : Non-muscle-invasive urothelial carcinoma of the bladder. Eur Urol. 2013;63(1):36-44. doi:10.1016/j.eururo. 2012. 08.061.
- Loo RK, Lieberman SF, Slezak JM, Landa HM, Mariani AJ, Nicolaisen G, et al. Stratifying risk of urinary tract malignant tumors in patients with asymptomatic microscopic hematuria. Mayo Clin Proc [Internet]. 2013;88(2):129-38. Available from: DOI: https://doi.org/ 10.1016/ j.mayocp.2012.10.004.
- Richards KA, Ham S, Cohn JA, Steinberg GD. Urinary tract infection-like symptom is associated with worse bladder cancer outcomes in the Medicare population: Implications for sex disparities. Int J Urol. 2016;23(1):42-7. doi:10.1111/iju.12959.
- Abdullah E, Idris A, Saparon A. Papr reduction using scs-slm technique in stfbc mimo-ofdm. ARPN J Eng Appl Sci. 2017; 12(10):3218-21.
- Zhang Z, Fan W, Deng Q, Tang S, Wang P, Xu P, et al. The prognostic and diagnostic value of circulating tumor cells in bladder cancer and upper tract urothelial carcinoma: a meta- analysis of 30 published studies. 2017;8(35):59527-38. doi:10.18632/oncotarget.18521.
- Glass R, Cocker R, Rosen L, Coutsouvelis C, Chau K, Slim F, et al. The impact of subdividing the “atypical” category for urinary cytology on patient management. Diagn Cytopathol. 2016;44 (6): 477-482. doi:10.1002/dc.23468.
- Zhu B, Rohan SM, Lin X. Urine Cytomorphology of Micropapillary Urothelial Carcinoma. Diagn Cytopathol. 2013;41(6):485-491. doi: 10.1002/dc.22866.
- Jiang B, Dong Y, He H, Han C. Application of pirarubicin photosensitizer fluorescence cystoscopy in early detection of bladder cancer. Oncol Lett. 2017;14(3):3309-12. doi:10.3892/ol.2017.6570.
- Cheng Huang C, Attele A, Michael CW. Cytomorphologic features of metastatic urothelial carcinoma in serous effusions. Diagn Cytopathol. 2013;41(7):569-574. doi:10.1002/dc.22896.
- Granados R, Butrón M, Santonja C, Rodríguez JM, Martín A, Duarte J, et al. Increased risk of malignancy for non-atypical urothelial cell groups compared to negative cytology in voided urine. Morphological changes with LBC. Diagn Cytopathol. 2016; 44(7): 582-590. doi: 10.1002/dc.23489.
- VandenBussche CJ, Sathiyamoorthy S, Owens CL, Burroughs FH, Rosenthal DL, Guan H. The Johns Hopkins Hospital template for urologic cytology samples: parts II and III: improving the predictability of indeterminate results in urinary cytologic samples: an outcomes and cytomorphologic study. Cancer Cytopathol. 2013;121(1):21-28. doi:10.1002/cncy.21254.
25 . Allison DB, Olson MT, Maleki Z, Ali SZ. Metastatic urinary tract cancers in pap test: Cytomorphologic findings and differential diagnosis. Diagn Cytopathol. 2016;44(12):1078-1081. doi:10.1002/dc.23543.
- Arias-Stella JA 3rd, Shah AB, Gupta NS, Williamson SR. CK20 and p53 Immunohistochemical Staining Patterns in Urinary Bladder Specimens With Equivocal Atypia. Arch Pathol Lab Med. 2018;142(1):64-69. Available from: http://www.Archivesofpathology.org/ doi/10.5858/arpa.2016-0411-OA.
- Piaton E, Carré C, Advenier AS, Decaussin-Petrucci M, Mège-Lechevallier F, Lantier P, et al. P16INK4a overexpression and p16/Ki-67 dual labeling versus conventional urinary cytology in the evaluation of urothelial carcinoma. Cancer Cytopathol. 2014;122 (3):211-220. doi:10.1002/cncy.21376.
- Wadhwa N, Diwaker P, Lotha N, Arora VK, Singh N. Cytokeratin 20 immunocytochemistry on urine sediments: A potential low-cost adjunct to cytology in the diagnosis of low-grade urothelial carcinoma. Cytopathology. 2017;28(6):531-535. doi:10.1111/cyt.12463.
- Paner GP, Annaiah C, Gulmann C, Rao P, Ro JY, Hansel DE, et al. Immunohistochemical evaluation of novel and traditional markers associated with urothelial differentiation in a spectrum of variants of urothelial carcinoma of the urinary bladder. Hum Pathol. 2014; 45 (7):1473-82. doi:10.1016/j.humpath.2014.02.024.
- Knowles MA, Hurst CD. Molecular biology of bladder cancer: new insights into pathogenesis and clinical diversity. Nat Rev Cancer. 2015;15(1):25-41. doi:10.1038/nrc3817.
Correspondência
Guibyson Silva Ferreira
Centro Universitário Maurício de Nassau – Uninassau
Rua Guilherme Pinto, número 114 – Graças
52011-210 – Recife – PE, Brasil
